表1 实验各组小鼠饲料配方
Table 1 Diet formulations

李汉荣1,黄淑君1,2,曾本华3,方 祥1,王 丽1,钟青萍1,童贻刚4,魏 泓3,*,廖振林1,*
(1.华南农业大学食品学院,广东 广州 510642;2.广东省妇幼保健院,广东 广州 511400;3.第三军医大学基础部实验动物学教研室,重庆 400038;4.军事医学科学院微生物流行病学研究所,北京 100071)
摘 要:目的:研究不同剂量香蕉抗性淀粉(resistant starch,RS)对高脂饮食诱导的C57BL/6J肥胖小鼠肠道放线菌群多样性的影响。方法:将40 只C57BL/6J小鼠随机分为5 组,分别采用普通饲料(CONV)、高脂饲料(HF)以及添加5%、10%、15%香蕉抗性淀粉的高脂饲料(5% RS+HF、10% RS+HF、15% RS+HF)进行饮食干预,8 周后采用变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)技术对小鼠粪便样本放线菌菌群组成进行分析,采用实时荧光定量聚合酶链式反应技术对小鼠粪便样本双歧杆菌数量进行比较。结果:DGGE图谱分析显示,HF组聚类与其余4 组彻底分离,抗性淀粉各组趋于成簇但无明显界限。5% RS+HF组与15% RS+HF组放线菌多样性和丰富度方面均显著低于CONV组与HF组(p<0.05),10% RS+HF组多样性和丰富度较另外2 组RS+HF组有所上升。高脂饲料能够极显著降低肠道中双歧杆菌数量(p<0.01),而10%和15%香蕉抗性淀粉的加入均高度显著增加双歧杆菌数量(p<0.001)。结论:香蕉抗性淀粉可恢复肥胖小鼠肠道放线菌群多样性,显著促进双歧杆菌生长,且具有剂量依赖关系。
关键词:香蕉抗性淀粉;肠道放线菌;变性梯度凝胶电泳
抗性淀粉(resistant starch,RS)分为RS1(物理包埋淀粉)、RS2(抗性淀粉)、RS3(老化淀粉)、RS4(化学改性淀粉)4 类。RS2又称生淀粉,存在于生香蕉、马铃薯或玉米淀粉中,香蕉抗性淀粉是青香蕉经物理方法直接提取的天然原料,有低糖高淀粉、对酶有高度抗性、营养成分不流失等优点。香蕉抗性淀粉的冻融稳定性与玉米淀粉相当,黏度热稳定性、凝沉性均高于马铃薯淀粉[1];另外,香蕉粉色泽、香气和口味俱佳,不需烹煮,比豆粉或薯粉更适合食品开发。香蕉作为热带水果代表,由于褐变腐烂造成大量经济损失。香蕉粉在国内仍是一种待开发的保健食品,科学利用产地丰富香蕉资源进行深加工,研发香蕉粉功能性食品将更具有市场前景。
近年来,随着人们饮食习惯的改变,对人类健康带来巨大危害的肥胖症已成为亟待解决的全球性问题[2-3]。尽管人类基因组在决定人体体质量方面起到的主要作用毋庸置疑[4],但在过去25 年里,人们也同样认识到,肥胖症并不是完全由基因组的改变所决定的[5]。值得注意的是,人类肠道中居住着数量高达100万亿的微生物,比人体细胞数量多十几倍,微生物含有的基因数量至少是人类自身基因数量的100 倍[6-7],其功能地位相当于人后天获得的一个重要“器官”[8]。所以研究者们已经把肠道微生物菌群放在了影响人体营养代谢的重要地位。
已有研究证实肠道菌群能够调控宿主基因表达[9]、改变热量利用率[10-11]以及脂肪代谢,而饮食结构可以调节肠道菌群的多样性[12]。抗性淀粉作为一种在健康人体小肠内不能被消化吸收但能在结肠内被微生物发酵利用的淀粉,具有优于膳食纤维的功能。可以通过肠道菌群发酵抗性淀粉产生短链脂肪酸改善肠道环境,调节肠道菌群[13],同时具有改善血糖、血脂代谢[14]等有益作用,达到消脂减肥的功效。除了拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)以外,放线菌(Actinobacteria)作为肠道菌群中的另外一个优势门类,其菌群的结构是否与脂肪代谢有一定的关联、抗性淀粉对肠道放线菌有着何种影响还有待研究。本实验通过变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)技术和荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术探究香蕉抗性淀粉对小鼠肠道放线菌群多样性的影响。
1.1 材料、动物、菌株与试剂
香蕉粉(RS2型抗性淀粉含量52.8%) 广东佛山蕉业生物科技有限公司。
C57BL/6J小鼠40 只,雌雄各20只,由第三军医大学实验动物中心提供(许可证号:SCXK2012-0003;SYXK2012-0002)。
双歧杆菌标准菌株青春双歧杆菌(Bifidobacterium adolescentis)购自中国工业菌种保藏中心。
分别按表1配制5 组饲料:普通饲料(CONV)、高脂饲料(HF)、5%香蕉抗性淀粉+高脂饲料(5% RS+HF,质量分数,下同)、10% RS+HF、15% RS+HF。其中基础饲料的成分为:玉米35%、黄豆粉15%、麦麸15%、面粉15%、鱼粉6%、豆饼3%、酵母粉2%、鸡蛋5%、菜油1%、骨粉2.5%、食盐0.5%;高脂饲料成分为:猪油68%、蛋黄粉23%、蔗糖9%。饲料均由重庆市大坪医院配制。
表1 实验各组小鼠饲料配方
Table 1 Diet formulations

1.2 仪器与设备
Mini-BeadbeaterTM组织研磨器 美国BioSpec公司;ND-1000核酸定量仪 美国NanoDrop公司;PYC-150型PCR仪 美国MJ Research公司;DCode Universal Mutation Detection System变性梯度凝胶电泳仪、GelDOC2000凝胶成像系统 美国Bio-Rad公司;Allegra 64R离心机美国Beckman Coulter公司;Light Cycler 480荧光定量PCR仪 美国Roche公司。
1.3 方法
1.3.1 小鼠分组与饲料配方
40 只健康C57BL/6J小鼠分成5 组,每组雌雄各4 只。分别采用5 组饲料进行喂养。所有小鼠每天自由摄食饮水,昼夜比12 h∶12 h,温度22 ℃和舒适湿度,每周称体质量。
1.3.2 小鼠粪便DNA提取
饮食干预第0周和第8周采用逼迫法取小鼠新鲜粪便,参照李瑞等[15]的方法提取小鼠粪便DNA,去除RNA后以1%凝胶电泳检测,在ND-1000核酸定量仪上测定DNA含量和纯度,DNA质量浓度均调整为100 ng/μL,分管保存备用。
1.3.3 放线菌门巢式PCR扩增
引物参考文献[1 6]:F 2 4 3:5’-GGATGAGCCCGCGGCCTA-3’;R1378:5’-CGGTGTGTACAAGGCCCGGGAACG-3’;R513GC:5’-GC-clamp-CGGCCGCGGCTGCTGGCACGTA-3’,其中GC-clamp序列(GC夹):5’-CGCCCGCCGCGC GCGGCGGGCGGGGCGGGGGCACGGGGGG-3’。第一轮PCR反应25 μL体系:模板1 μL、2×PCR Master Mix 12.5 μL、引物F243和R1378(10 μmol/L)各0.5 μL、ddH2O 10.5 μL。第一轮程序:95 ℃ 7 min;95 ℃ 1 min,62 ℃ 40 s,72 ℃ 1 min,30 个循环;72 ℃ 15 min。第二轮PCR反应25 μL体系:以第一轮反应产物作为模板1 μL、2×PCR Master Mix 12.5 μL、引物F243和R513GC(均为10 μmol/L)各0.5 μL、ddH2O 10.5 μL。第二轮程序:95 ℃ 7 min;95 ℃ 1 min,70 ℃ 40s,72 ℃ 40 s,30 个循环;72 ℃ 7 min。所得PCR产物以1%琼脂糖凝胶电泳检测。
1.3.4 PCR扩增产物DGGE分析
参照Muyzer等[17]的方法对放线菌16S rRNA V6~V8区PCR扩增产物进行DGGE,采用8%的聚丙烯酰胺凝胶,总菌变性梯度为42%~60%,放线菌变性梯度为30%~70%,上样量3 μL。采用DCode DGGE系统,1×TAE缓冲液60 ℃条件下,220 V预电泳10 min,然后85 V电泳16 h,结束后银染法染色,拍照。
1.3.5 DGGE图谱数字化分析
采用Quantity One 4.6.2软件对DGGE指纹图谱进行处理,对小鼠肠道放线菌菌群多样性进行分析。分析DGGE图谱每条泳道的Shannon-Wiener多样性指数(H)和菌群均匀度(E),分别按式(1)、(2)计算,并采用UPGMA聚类方法获得一个各泳道间的聚类分析进化树。

式中:Ni为该泳道中第i条条带亮度;N为该泳道所有条带亮度的总和;S为总条带数。
1.3.6 实时荧光定量PCR检测
扩增双歧杆菌16S rRNA全长基因引物序列[18]如下:F8:5’-AGAGTTTGATCCTGGCTCAG-3’;R1391:5’-GACGGGCGGTGWGTRCA-3’。反应体系(25 μL):DNA 0.5 μL、10×Taq酶0.2 μL、dNTP(10 mmol/L)0.5 μL、Taq缓冲液 2.5 μL、MgCl2(25 mmol/L)2 μL、引物(10 μmol/L)各0.5 μL、ddH2O 10.5 μL。程序:95 ℃ 3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃终延伸8 min。电泳割胶回收1 369 bp目的片段,以试剂盒纯化后的产物与pMD®18-T Vector连接并克隆,抽提克隆质粒作为含16S rRNA标准质粒。测序鉴定确为目的质粒后测定DNA浓度,按式(3)计算拷贝数浓度。
式中:N为标准质粒的拷贝数浓度/(copies/µL);ρ为测得的标准质粒的质量浓度/(ng/µL);M为重组后质粒的碱基对数。
用已知浓度的质粒10 倍稀释法制作得5 个浓度梯度,分别作为模板进行实时荧光定量PCR,并绘制标准曲线。引物序列:Bif-F:5’-TCACAACTGACGCTTAGGCTC-3’;Bif-R:5’-AATGTACTACCCAGGCGGATC-3’。反应体系(20 μL):模板2 μL、2×SybrGreen qPCR Master Mix 10 μL、引物(10 μmol/L)各1 μL、ddH2O 6 μL。反应程序:95 ℃ 3 min;95 ℃ 15 s,57 ℃ 20 s,72 ℃ 30 s,40 个循环。质粒拷贝数为横坐标,Ct值为纵坐标作标准曲线,并拟合回归方程。
将干预8 周后的小鼠粪便DNA进行实时荧光定量PCR,每个样品3 个重复。以Ct平均值代入标准曲线方程,计算每个样本中1g DNA中双歧杆菌的拷贝数,以对数值表示。
1.4 数据统计分析
采用SPSS 16.0软件对实验数据进行统计学分析,采用One-way ANOVA对不同实验组进行差异分析。
2.1 高脂饮食对小鼠体质量的影响
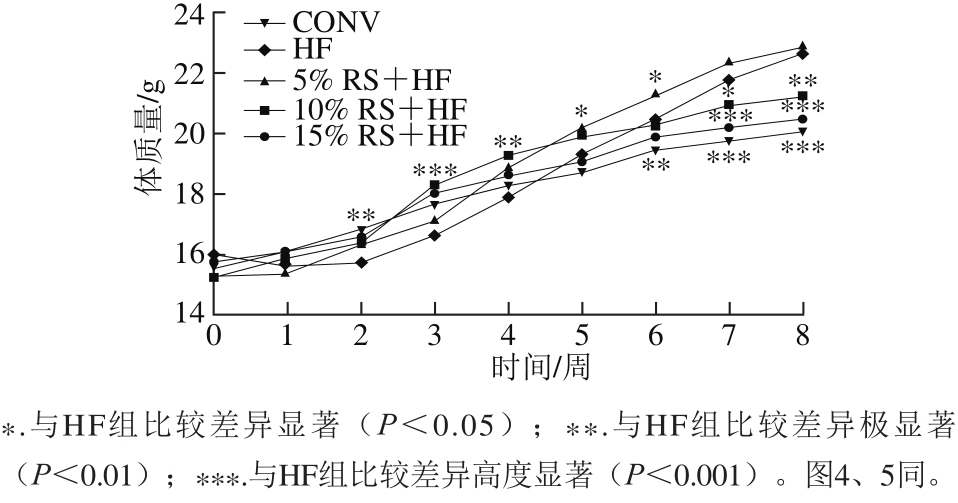
图1 不同饮食干预对小鼠体质量的影响
Fig. 1 Effect of different dietary interventions on body weight in mice
如图1所示,干预前各组小鼠体质量在同一水平,高脂饮食2 周后HF组的体质量保持平稳的增长,第8周时CONV组已经与HF组产生了高度显著的差异(p<0.001),说明高脂饮食对小鼠体质量影响非常明显,肥胖小鼠模型建模成功。
此外,在初期小鼠不适应高脂饮食表现为体质量先小幅下降后升高,而5% RS缓解了高脂饮食的油腻感和适口性,增加了饮食摄入量,使体质量增长较HF组快,但后期增长趋势慢于HF组,若要判断最终效果需延长时间进一步观察。10% RS+HF组和15% RS+HF组第3周后体质量增长减慢,且15% RS+HF组更接近CONV组的体质量。说明RS具有消脂减肥的功效,且其效果与剂量存在依赖关系。
2.2 小鼠肠道放线菌的PCR-DGGE图谱
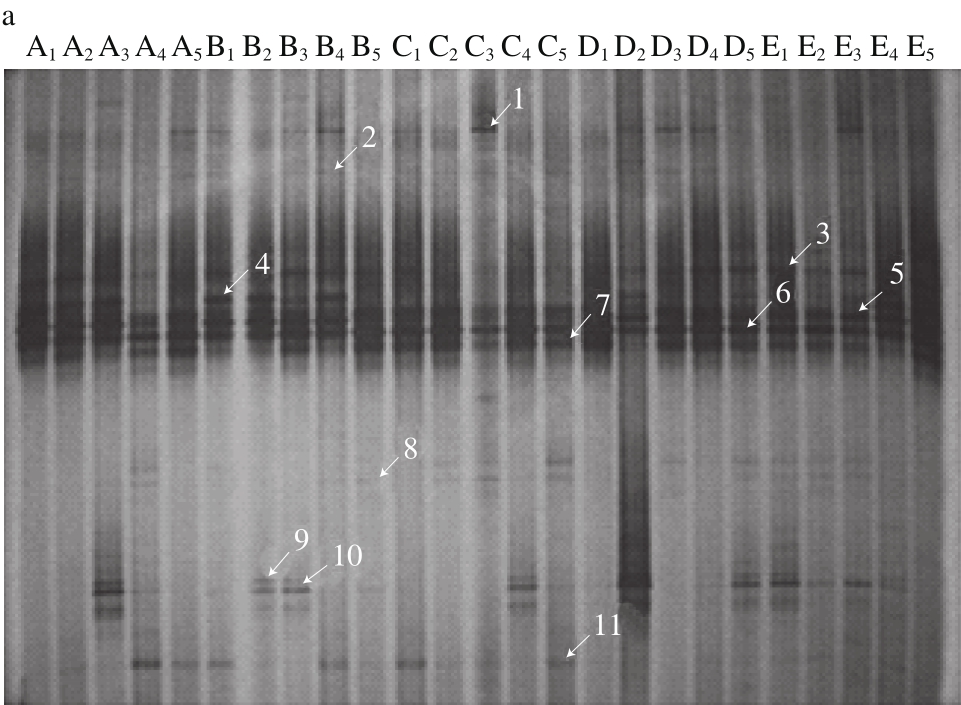
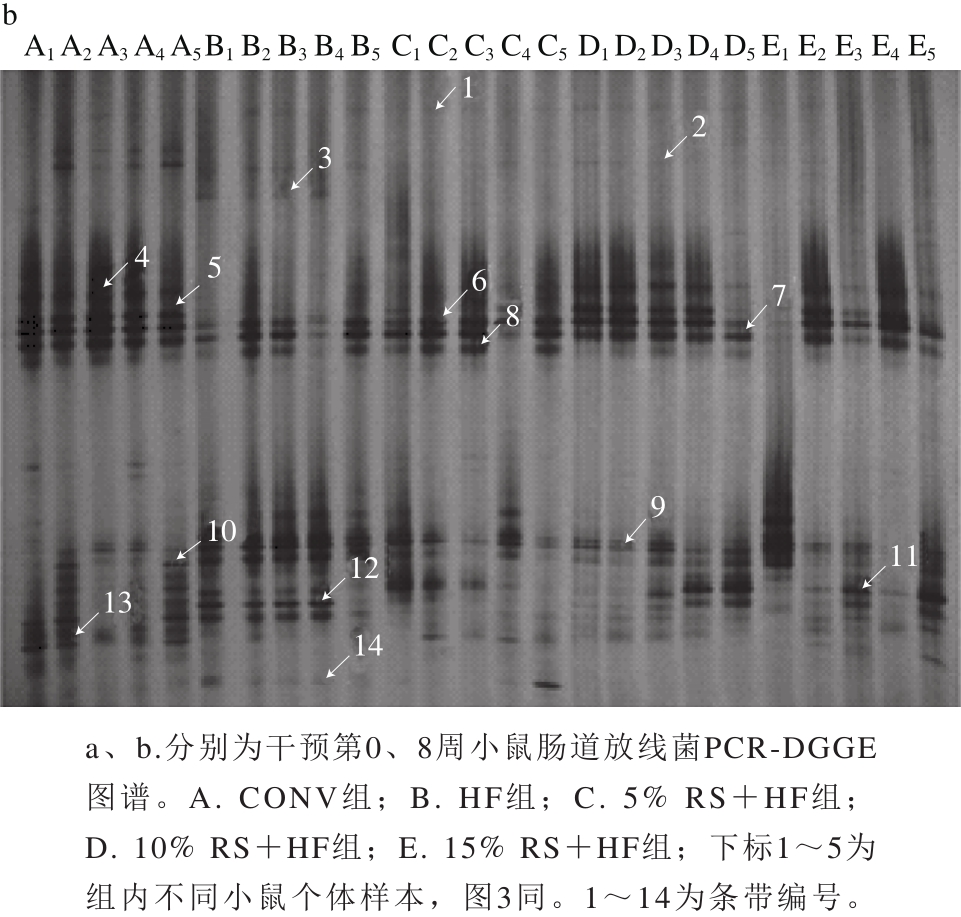
图2 小鼠肠道放线菌的DGGE图谱
Fig. 2 DGGE prof i les of gut Actinobacteria in mice
表2 第0周时放线菌PCR-DGGE条带测序结果
Table 2 Sequence similarity of PCR-DGGE bands of gut Actinobacteria in mice without dietary intervention with GenBank sequences
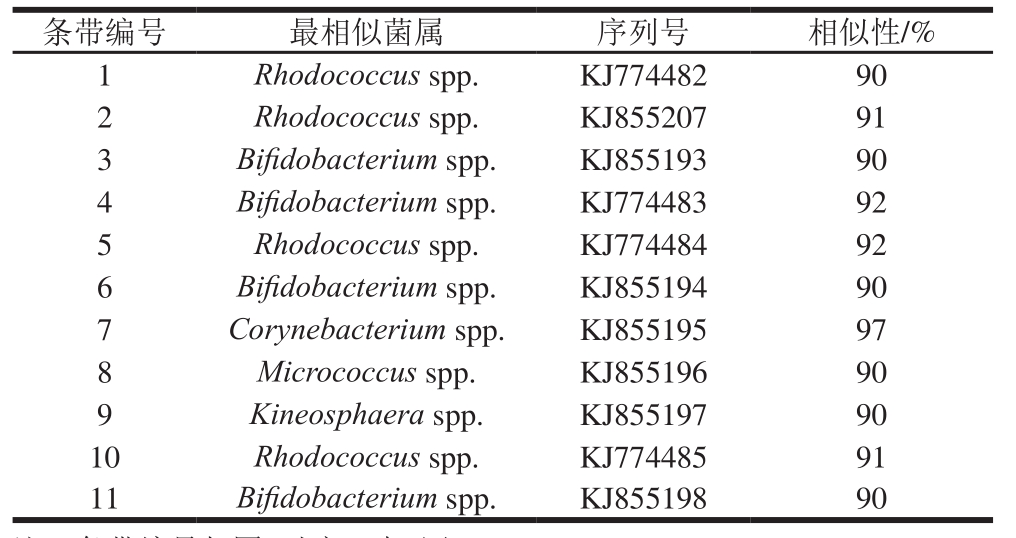
注:条带编号与图2对应,表3同。
表3 干预8周后放线菌PCR-DGGE条带测序结果
Table 3 Sequence similarity of PCR-DGGE bands of gut Actinobacteria in mice subjected to 8-week dietary intervention with GenBank sequences

从图2a可看出,条带3~7其亮度非常高,为0周各组小鼠肠道内的优势放线菌。由表2可知,条带3、4、6被鉴定出最接近的菌种为Bifidobacterium spp.,条带5、7最接近的菌种分别为Rhodococcus spp.、Corynebacterium spp.,其余为非优势菌种。经过8周的饮食干预,各组小鼠与干预前肠道放线菌之间产生了差异。由表3可知,条带4、5最接近的菌种为Bifidobacterium spp.、Kineosphaera spp.,在CONV组亮度相当高,说明为优势条带,而在HF组彻底消失,随着香蕉抗性淀粉剂量增大,条带亮度增强,10% RS+HF组亮度最高,15%RS+HF组亮度减弱,表明香蕉抗性淀粉能削弱高脂饮食对该菌生长的抑制作用,促进其生长,且具有剂量依赖关系。条带11为Microbacterium spp.,在HF组未出现,10% RS+HF组和15% RS+HF组条带11亮度高于CONV组,说明高剂量的香蕉抗性淀粉对该菌生长的促进作用大于高脂饮食对其的抑制作用,且促进效果明显。
2.3 UPGMA聚类和主成分分析
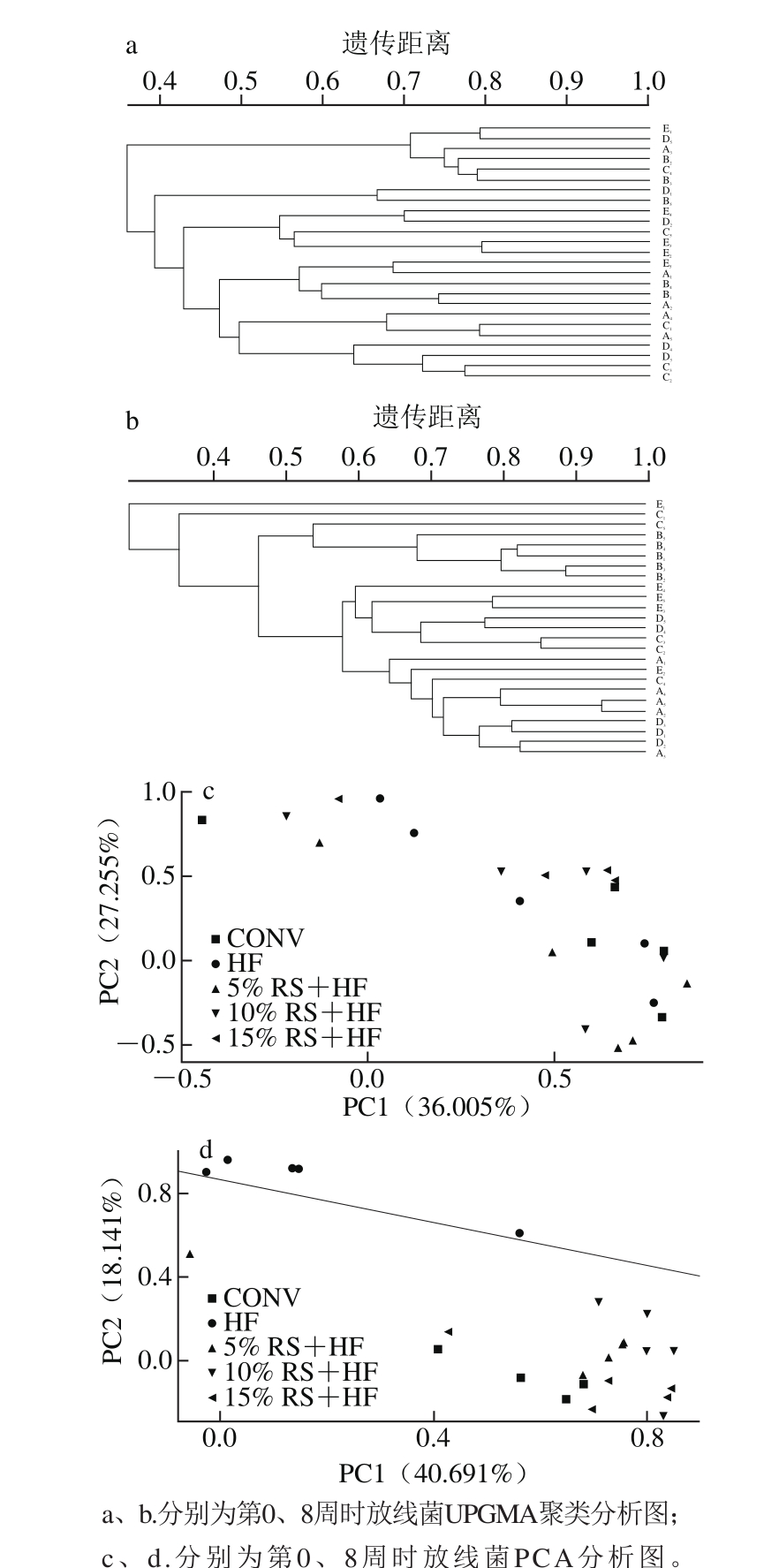
图3 第0、8周放线菌的UPGMA聚类和主成分分析图
Fig. 3 UPGMA cluster and principal component analysis of gut Actinomycetes in mice after 0 and 8 weeks of dietary intervention
从图3a、c来看,各组小鼠之间相互交错,未出现组内聚集现象,说明5 组小鼠肠道放线菌差异不明显,可用于香蕉抗性淀粉对肠道放线菌影响的研究观察。8 周的饮食干预使5 组小鼠之间肠道放线菌发生分离,从图3b、d可看出,高脂饮食诱导的HF组与其余4组彻底分离,说明高脂饮食明显改变了小鼠放线菌群。结合DGGE图谱条带分析与测序,以及后续的实时荧光定量PCR对双歧杆菌的定量分析,可以推测高脂饮食对放线菌群有明显抑制作用;其余4 组之间没有明显的分界线,但不同抗性淀粉组之间有各组内聚成簇的趋势,说明香蕉抗性淀粉能够不同程度调节高脂饮食引起的肠道放线菌的变化,且具有剂量依赖关系。
2.4 小鼠肠道放线菌生物多样性分析
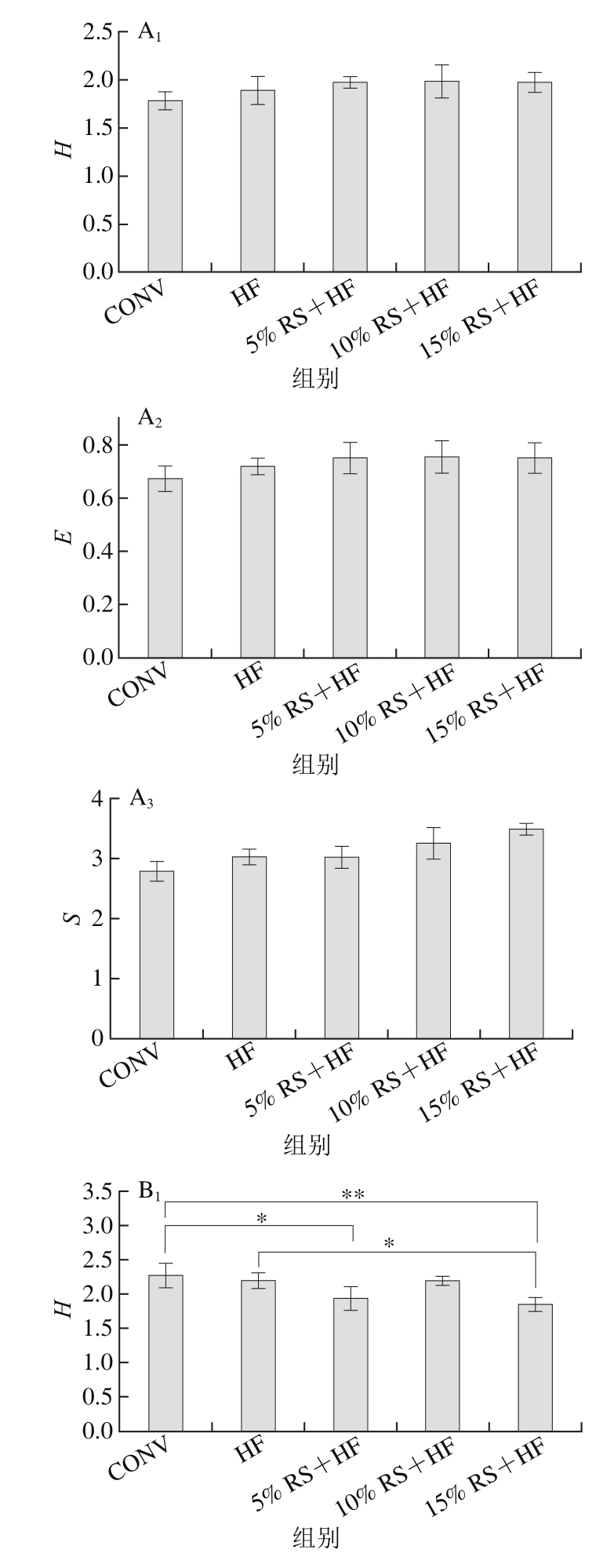
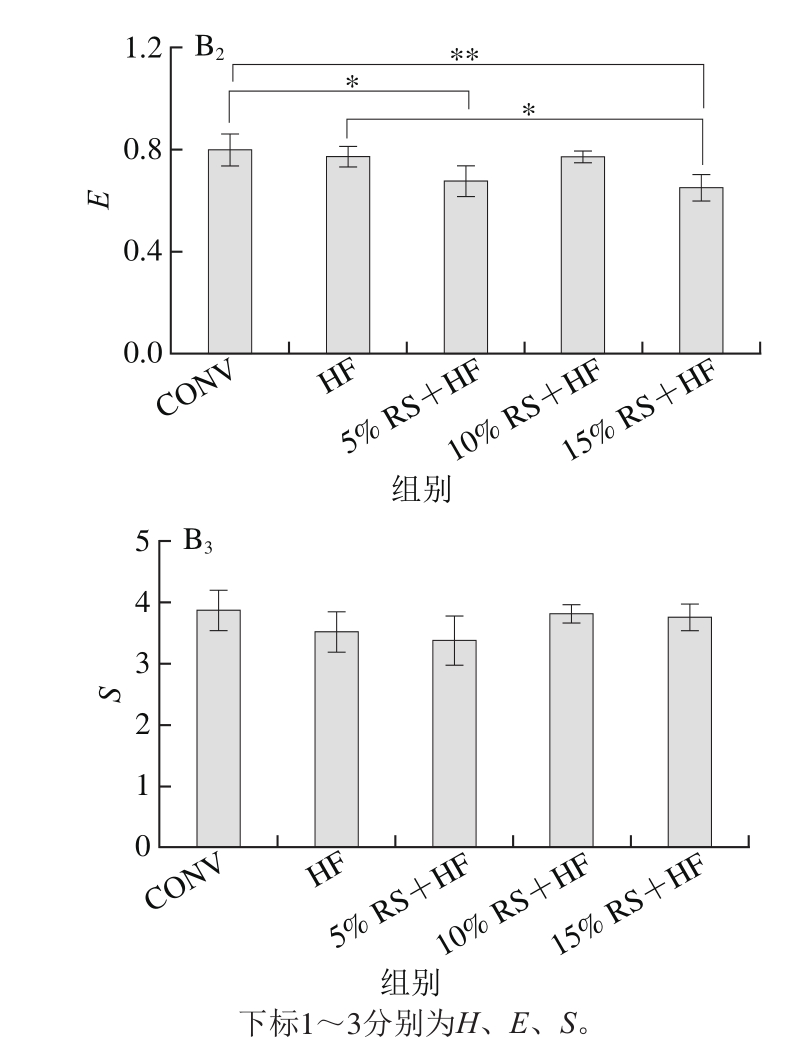
图 4 第0(A)、8(B)周小鼠肠道放线菌群的多样性分析
Fig. 4 Diversity analysis of gut Actinobacteria in mice after 0 (A) and 8 (B)weeks of dietary intervention
由图4A可知,各组多样性指数(H)、均匀度(E)和丰富度(S)之间均无明显差异(P>0.05),说明干预前各组小鼠的肠道放线菌之间无显著差异。8 周的饮食干预使5 组小鼠之间肠道放线菌多样性发生改变。在多样性指数和均匀度2 项指标上,HF组多样性略低于CONV组(P>0.05),5% RS+HF组相对于HF组均有所降低,但差异不明显(P>0.05),10% RS+HF组有所升高(P>0.05),而15% RS+HF组进一步降低,与HF组产生了显著性的差异(p<0.05)。这可能是由于5%香蕉抗性淀粉的加入改善了适口性,使饲料摄入量增加,同时也增加了高脂饲料的摄入,直接影响了肠道菌群的多样性。随着香蕉抗性淀粉的剂量增加到10%,香蕉抗性淀粉的作用抵消甚至超过了高脂饲料的作用,使得菌群多样性升高。当继续加大香蕉抗性淀粉的剂量至15%时,饲料中基础饲料的量进一步减少,香蕉抗性淀粉单一成分可能促进了部分菌的生长,却无法满足另一大部分菌的生长,导致多样性下降。丰富度方面未发现显著性差异(P>0.05)。
2.5 双歧杆菌实时荧光定量PCR分析
双歧杆菌属特异性16S rRNA扩增产物的熔解曲线,峰形单一,峰尖且窄,说明未产生引物二聚体和非特异性产物。标准曲线方程为y=-3.449 lg x+44.30,扩增效率为95.0%,相关系数99.9%。说明标准曲线的拟合度较好,可以覆盖99.9%的数据范围。
实时荧光定量PCR结果由图5可知,HF组的双歧杆菌数量极显著低于CONV组(p<0.01),5%RS+HF组与HF组没有显著差异(P>0.05),而10%RS+HF组和15%RS+HF组高度显著高于HF组(p<0.001)。说明高脂饮食干预8周后,双歧杆菌数量明显下降,香蕉抗性淀粉的加入有利于恢复双歧杆菌的生长,且能使其数量高于正常水平,具有剂量依赖关系,以添加10%香蕉抗性淀粉的效果最佳。

图5 双歧杆菌实时荧光定量PCR结果
Fig. 5 Quantif i cation of Bif i dobacterium in fecal samples from mice by fl uorescence quantitative PCR
本实验发现不同饮食结构对小鼠肠道放线菌群具有显著影响,高脂饲料对肠道放线菌群生长具有抑制作用,香蕉抗性淀粉能够缓解这种抑制作用,同时促进双歧杆菌的生长,并有剂量依赖关系。
大部分肠道放线菌属厌氧共生菌,虽然它们在肠道总菌中占有的比例较小,但是已有研究发现它们的种类和数量与宿主健康有着重要的关系。放线菌中有相当比例的菌属具有产短链脂肪酸的能力,而短链脂肪酸对肠道环境具有有益的调节作用,是益生菌的一个重要功能产物[19],其中受关注最多的是双歧杆菌。双歧杆菌属是一种非常重要的肠道益生菌,对宿主健康具有降胆固醇等重要的促进作用[20-22]。
本研究参照Heuer等[16]的方法对肠道放线菌进行扩增,发现第0周时放线菌在各组中分布均匀,经过8 周的饮食干预,放线菌的种类相对于第0周时有所增加,并且5 组之间产生差异。CONV组与HF组放线菌多样性指数及均匀度较香蕉抗性淀粉各剂量组高,这可能是由于香蕉抗性淀粉主要促进部分菌的繁殖,而对于其他一些菌的生长具有抑制作用。Young[23]用抗性淀粉喂养断奶SD大鼠发现放线菌比例显著增加,其中主要是由双歧杆菌一些种的数量大量增加引起的。
由第8周DGGE图谱可看出,不同的饮食对放线菌的影响存在差异。条带3、9、10、13最接近的菌种均为Corynebacterium spp.,条带3为HF组的独有条带,条带9和10在5 组中均有出现,HF组的亮度高于其他组,如此看来高脂饮食能够促进Corynebacterium中某些菌种的生长。而条带13在HF组中未出现,在其余4 组中出现了且CONV组亮度最高,这又说明高脂饮食对Corynebacterium中某些菌种的生长具有强烈的抑制作用。这两种现象似乎互相矛盾了,其实又是合理的。Corynebacterium是自然界中广泛存在的一个菌属,在土壤、水、植物、动物以及人体都有发现。大部分Corynebacteria不致病,是正常菌群中的一部分。Corynebacterium中也有一部分菌种是致病菌,如Corynebacterium diphtheriae,能导致致命的白喉病[24]。除此之外,一些Corynebacterium spp.能产生有益的次级代谢产物,如Corynebacterium glutamicum产生谷氨酸[25],或具备特殊的生理功能,如Corynebacterium casei用来老化奶酪。由于本研究中相似度不够高,所以不能完全确定条带与菌种的一一对应关系。条带11最接近的菌种为Microbacterium spp.,除HF组之外,其他组均有出现,且随香蕉抗性淀粉剂量的增大数量增多,为好氧的革兰氏阳性菌,过氧化氢酶阳性,氧化酶阴性,不形成吲哚和H2S,可利用乙酸、丙酸作为底物生长[26]。条带4和5在CONV组亮度最高,HF组中未出现,香蕉抗性淀粉各剂量组中10% RS+HF组最高,说明高脂饮食对它们的生长具有抑制作用,而10%的香蕉抗性淀粉的缓解作用最明显。经测序最接近的菌种分别为Bifidobacterium spp.、Kineosphaera spp.,这与抗性淀粉对双歧杆菌生长具有促进作用这一结果一致[26],而后者的相似度只有88%,可能并非该菌。条带6和7为5 组小鼠肠道内的优势菌,但是HF组亮度低于其余4组,且组内分布不均匀,CONV组与10% RS+HF组亮度最高。经鉴定最相似的菌种均为Bifidobacterium spp.,进一步说明高脂饲料对双歧杆菌生长具有抑制作用,香蕉抗性淀粉能够缓解这种抑制,并具有剂量依赖关系。
本研究还通过实时荧光定量PCR技术对香蕉抗性淀粉饮食干预8 周后的肠道双歧杆菌进行绝对定量,发现CONV组、10% RS+HF组以及15% RS+HF组与HF组之间在双歧杆菌数量上产生了统计学差异,其中10% RS+HF组与15% RS+HF组高度显著高于HF组(p<0.001)。这一结果也说明纯高脂饮食对双歧杆菌的生长具有不利影响,而香蕉抗性淀粉的加入能够缓解甚至逆转这种影响,添加10%香蕉抗性淀粉的效果最佳。第8周放线菌DGGE图谱中条带4、6、7经鉴定最接近的菌种均为双歧杆菌,在高脂组亮度较暗甚至完全消失,而在香蕉抗性淀粉组得到加强的这一现象正与实时荧光定量PCR的结果相吻合。
有研究报道香蕉淀粉控制糖尿病小大鼠的体质量,增加短链脂肪酸,促进拟杆菌乳杆菌生长,减少肠球菌数目[27]。邬应龙等[28]发现甘薯制备的3 种RS4抗性淀粉可改善高脂饮食小鼠肠道微生物多样性。方建东[29]、何梅[30]等发现玉米抗性淀粉同样使大鼠后肠双歧杆菌、乳酸菌等有益菌生长,大肠杆菌等有害菌数量减少。熟香蕉糖分超过60%,淀粉含量低于3%,而青香蕉化学成分中天然的抗性淀粉含量达到60%~70%,糖分含量低于3%,还有总膳食纤维含量11%~12%、水分含量8%~9%和少量蛋白质(3%)[27]。所谓抗性淀粉类食品,其抗性淀粉含量应超过18%,本实验材料的香蕉粉中天然抗性淀粉含量超过52%,属于香蕉天然抗性淀粉RS2。另外,香蕉粉中含有少量可溶性的糖、蛋白质,营养物质会在小肠被消化吸收,具有抗性的RS淀粉不被消化到达结肠后才被微生物利用。本实验中香蕉天然抗性淀粉对肥胖小鼠肠道菌群的益生作用与已有文献中甘薯、玉米等其他抗性淀粉的作用类似[27-30],但香蕉和玉米中其余成分的作用均未作单独研究。
目前,已有较多研究证实了香蕉抗性淀粉可作为双歧杆菌增殖因子,促进双歧杆菌的生长繁殖。本实验证实了高脂饮食明显降低C57BL/6J小鼠肠道菌群多样性、抑制双歧杆菌生长。香蕉抗性淀粉恢复肥胖C57BL/6J小鼠肠道放线菌群多样性,显著促进双歧杆菌的生长,且具有剂量依赖关系。
参考文献:
[1] 赵国建, 鲍金勇, 杨公明. 三种香蕉淀粉颗粒性质的研究[J]. 食品科学, 2006, 27(2): 46-49. DOI:10.3321/j.issn:1002-6630.2006.02.004.
[2] PADWAL R S, SHARMA A M. Prevention of cardiovascular disease:obesity, diabetes and the metabolic syndrome[J]. Canadian Journal of Cardiology, 2010, 26: 18-20. DOI:10.1016/S0828-282X(10)71077-1.
[3] BODEN G, SHULMAN G I. Free fatty acids in obesity and type 2 diabetes: def i ning their role in the development of insulin resistance and β-cell dysfunction[J]. European Journal of Clinical Investigation,2002, 32(Suppl 3): 14-23. DOI:10.1046/j.1365-2362.32.s3.3.x.
[4] FAROOQI I S, O’RAHILLY S. Genetics of obesity in humans[J].Endocrine Reviews, 2006, 27(7): 710-718. DOI:10.1210/er.2006-0040.
[5] HILL J O. Understanding and addressing the epidemic of obesity:an energy balance perspective[J]. Endocrine Reviews, 2006, 27(7):750-761. DOI:10.1210/er.2006-0032.
[6] ECKBURG P B, BIK E M, BERNSTEIN C N, et al. Diversity of the human intestinal microbial flora[J]. Science, 2005, 308: 1635-1638.DOI:10.1126/science.1110591.
[7] QIN J, LI R, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464: 59-65.DOI:10.1038/nature08821.
[8] BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004,101(44): 15718-15723. DOI:10.1073/pnas.0407076101.
[9] PREISSLANDL K, ZIMMERMANN R, HAMMERLE G, et al.Lipoprotein lipase: the regulation of tissue specif i c expression and its role in lipid and energy metabolism[J]. Current Opinion in Lipidology,2002, 13(5): 471-481. DOI:10.1097/00041433-200210000-00002.
[10] TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesityassociated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444: 1027-1031. DOI:10.1038/nature05414.
[11] LEY R E, TURNBAUGH P J, KLEIN S, et al. Microbial ecology:human gut microbes associated with obesity[J]. Nature, 2006, 444:1022-1023. DOI:10.1038/4441022a.
[12] ZHANG C, ZHANG M, WANG S, et al. Interactions between gut microbiota, host genetics and diet relevant to development of metabolic syndromes in mice[J]. The ISME Journal, 2010, 4(2):232-241. DOI:10.1038/ismej.2009.112.
[13] READER D, JOHNSON M L, HOLLANDER P, et al. Response of resistant starch in a food bar vs. two commercially available food bars in persons with type Ⅱ diabetes mellitus[J]. Diabetes, 1997, 46(1):254A.
[14] SAJILATA M G, SINGHAL R S, KULKARNI P R. Resistant starch:a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2006, 5(1): 1-17. DOI:10.1111/j.1541-4337.2006.tb00076.x.
[15] 李瑞, 廖振林, 方祥, 等. 抗性淀粉对HFA小鼠肠道菌群的影响[J].中国微生态学杂志, 2013, 25(7): 762-765.
[16] HEUER H, KRSEK M, BAKER P, et al. Analysis of actinomycete communities by specif i c amplif i cation of genes encoding 16S rRNA and gel-electrophoretic separation in denaturing gradients[J]. Applied and Environmental Microbiology, 1997, 63(8): 3233-3241.
[17] MUYZER G, DE WAAL E C, UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplif i ed genes coding for 16S rRNA[J]. Applied and Environmental Microbiology,1993, 59(3): 695-700.
[18] ZOETENDAL E G, BOOIJINK C C G M, WELS M, et al. A metagenomics view on the human microbiota of the small-intestine[J].Microbial Ecology, 2009, 57(3): 587-588.
[19] FUENTES-ZARAGOZA E, RIQUELME-NAVARRETE M J,SÁNCHEZ-ZAPATA E, et al. Resistant starch as functional ingredient: a review[J]. Food Research International, 2010, 43(4):931-942. DOI:10.1016/j.foodres.2010.02.004.
[20] TAHRI K, GRILL J P, SCHNEIDER F. Involvement of trihydroxyconjugated bile salts in cholesterol assimilation by bifidobacteria[J]. Current Microbiology, 1997, 34(2): 79-84.DOI:10.1007/s002849900148.
[21] HONG Z J Y. Progress in the effect of probiotics on cholesterol and its mechanism[J]. Acta Microbiologica Sinica, 2005,2:34 DOI:10.3321/j.issn:0001-6209.2005.02.034.
[22] LIONG M T, SHAH N P. Bile salt deconjugation ability, bile salt hydrolase activity and cholesterol co-precipitation ability of Lactobacilli strains[J]. International Dairy Journal, 2005, 15(4):391-398. DOI:10.1016/j.idairyj.2004.08.007.
[23] YOUNG W, ROY N C, LEE J, et al. Changes in bowel microbiota induced by feeding weanlings resistant starch stimulate transcriptomic and physiological responses[J]. Applied and Environmental Microbiology,2012, 78(18): 6656-6664. DOI:10.1128/AEM.01536-12.
[24] FREEMAN V J. Studies on the virulence of bacteriophage-infected strains of Corynebacterium diphtheriae[J]. Journal of Bacteriology,1951, 61(6): 675.
[25] KALINOWSKI J, BATHE B, BARTELS D, et al. The complete Corynebacterium glutamicum ATCC 13032 genome sequence and its impact on the production of l-aspartate-derived amino acids and vitamins[J]. Journal of Biotechnology, 2003, 104(1): 5-25.DOI:10.1016/S0168-1656(03)00154-8.
[26] WU Y, WU M, WANG C, et al. Microbacterium profundi sp.nov., isolated from deep-sea sediment of polymetallic nodule environments[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(12): 2930-2934. DOI:10.1099/ijs.0.2008/000455-0.
[27] 白永亮, 彭真福, 陈庆发, 等. 香蕉粉干预对糖尿病大鼠肠道菌群调节作用研究[J]. 现代食品科技, 2013, 29(9): 2110-2114.
[28] 邬应龙, 王文婷. RS4型抗性淀粉对高脂饮食C57BL/6J小鼠肠绒毛形态及肠道菌群的影响[J]. 食品科学, 2013, 34(21): 333-338.DOI:10.7506/spkx1002-6630-201321067.
[29] 方建东. 抗性淀粉对小鼠肠道菌群的影响以及作用机制的研究[D].杭州: 浙江工商大学, 2014: 57-59. DOI:10.7666/d.Y2531187.
[30] 何梅, 洪洁, 杨月欣, 等. 抗性淀粉对大鼠肠道菌群的影响[J]. 卫生研究, 2005, 34(1): 85-87. DOI:10.3969/j.issn.1000-8020.2005.01.030.
Regulative Effect of Dietary Banana Resistant Starch on Gut Actinobacteria in Obese C57BL/6J Mice
LI Hanrong1, HUANG Shujun1,2, ZENG Benhua3, FANG Xiang1, WANG Li1, ZHONG Qingping1, TONG Yigang4, WEI Hong3,*, LIAO Zhenlin1,*
(1. College of Food Science, South China Agricultural University, Guangzhou 510642, China;2. Guangdong Maternal and Child Health Hospital, Guangzhou 511400, China; 3. Department of Laboratory Animal Science,College of Basic Medical Sciences, the Third Military Medical University, Chongqing 400038, China; 4. Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Beijing 100071, China)
Abstract:To study the impact of a high-fat diet supplemented with different doses of banana resistant starch (RS) on the diversity of gut Actinobacteria in obese C57BL/6J mice, 40 mice were randomly divided into five groups, which were fed a conventional diet (CONV), a high-fat diet (HF) alone, supplemented with 5% (5% RS + HF), 10% (10% RS +HF), and 15% (15% RS + HF) of RS, respectively. After 8 weeks of dietary intervention, denaturing gradient gel electrophoresis (DGGE) was used to monitor the changes in the composition of gut Actinobacteria in mice. The amounts of fecal Bif i dobacterium were compared among the fi ve groups of animals by real-time fl uorescence quantitative polymerase chain reaction (PCR). Cluster analysis of the DGGE profiles showed that the HF group was significantly different from the other 4 groups. All the RS groups tended to form a cluster without obvious boundaries. In addition, the diversity and abundance of Actinobacteria in the 5% RS + HF and 15% RS + HF groups were signif i cantly lower than in the CONV and HF groups (P < 0.05) and also lower than in the 10% RS + HF group. PCR results suggested that the high-fat diet could highly signif i cantly reduce the number of gut Bif i dobacteria (P < 0.01), which, however, was very signif i cantly increased bysupplementation of 10% and 15% RS (P < 0.001). Hence, we concluded that resistant starch can restore the diversity of gut Actinobacteria in obese mice, and signif i cantly promote the growth of Bif i dobacteria in a dose-dependent manner.
Key words:banana resistant starch; gut Actinobacteria; denaturing gradient gel electrophoresis (DGGE)
收稿日期:2016-10-08
基金项目:国家自然科学基金面上项目(31171673;31071528;31671855;81370906);国家重点实验室开放课题(SKLPBS1518);国家重点基础研究发展计划(973)项目(2013CB532406);国家高技术研究发展计划(863)项目(2014AA022209;2014AA022204)
作者简介:李汉荣(1991—),男,硕士研究生,研究方向为食品微生物与营养调控。E-mail:826261525@qq.com
*通信作者:魏泓(1969—),男,教授,博士,研究方向为遗传工程技术及无菌动物技术。E-mail:weihong63528@163.com
廖振林(1968—),男,副教授,博士,研究方向为食品微生物与营养调控。E-mail:602581821@qq.com
DOI:10.7506/spkx1002-6630-201723024
中图分类号:R151.2
文献标志码:A
文章编号:1002-6630(2017)23-0149-08
引文格式:
李汉荣, 黄淑君, 曾本华, 等. 香蕉抗性淀粉对C57BL/6J肥胖小鼠肠道放线菌群的调控作用[J]. 食品科学, 2017, 38(23):149-156.
DOI:10.7506/spkx1002-6630-201723024. http://www.spkx.net.cn
LI Hanrong, HUANG Shujun, ZENG Benhua, et al. Regulative effect of dietary banana resistant starch on gut Actinobacteria in obese C57BL/6J mice[J]. Food Science, 2017, 38(23): 149-156. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723024. http://www.spkx.net.cn