表1 秀丽隐杆线虫抗氧化基因mRNA表达水平测定用PCR引物
Table 1 PCR primers used for the measurement of antioxidant gene mRNA expression in C. elegans

王 红1,2,张晓寒1,程 静1,王 静1,刁脆茹1,王 浩1,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.天津科技大学生物工程学院,天津 300457)
摘 要:目的:以秀丽隐杆线虫为对象,研究紫薯提取物(purple sweet potato extract,PSPE)抗氧化作用及其可能的作用机制。方法:将秀丽隐杆线虫饲喂于含有不同质量浓度(70、140、280 μg/mL)PSPE的线虫生长培养基,研究PSPE对线虫寿命、抗氧化酶活力以及相关基因表达水平、急性氧化应激的影响。结果:PSPE能明显延长秀丽隐杆线虫的寿命,提高超氧化物歧化酶和过氧化氢酶活力,上调daf-16、ctl-1、sod-3、sir-2.1基因表达水平,下调age-1、daf-2基因表达水平,同时延长在H2O2、胡桃醌及百草枯氧化应激的存活时间。结论:PSPE能够有效延缓秀丽隐杆线虫的衰老、抑制脂褐素累积、提高抗氧化酶活力及抗氧化基因表达水平,增强对H2O2、胡桃醌及百草枯急性氧化应激的抵抗能力。
关键词:秀丽隐杆线虫;紫薯提取物;氧化应激;抗氧化;衰老
紫薯花青素不仅可以作为一种天然着色剂,还可作为功能性食品配料清除机体内多余的自由基[1],具有抗氧化[2-3]、抗肿瘤[4-5]、抗炎[6]和护肝[7]等多种生物学功能。Zhang Zifeng等[3]研究发现紫薯色素可抑制高脂饲料饲喂小鼠体内活性氧自由基的产生,进而减弱肝脏胰岛素抵抗。Hwang等[8]研究发现,紫薯花色苷亦可提高二甲基亚硝胺处理的大鼠肝脏内抗氧化酶活力。
秀丽隐杆线虫生命周期短,易于观察与计数,与人类具有相似的衰老过程,且遗传信息与信号通路相对保守[9],常被作为生物学研究的模式生物[10-11]。有研究表明具有较长寿命的线虫表现出对应激更强的抵抗能力,如氧化应激、热应激、重金属刺激等[12-13]。而能够增强线虫应激抵抗能力的措施,也能延长线虫寿命[14]。
本实验以秀丽隐杆线虫为模式生物,通过测定抗氧化酶活力、基因表达水平,以及急性应激条件下线虫寿命和体内脂褐素的变化,对紫薯提取物(purple sweet potato extract,PSPE)体内抗氧化活性及其作用机制进行研究。
1.1 材料与试剂
野生型秀丽隐杆线虫N2(以下简称线虫)由北京生命科学研究所王晓晨研究员赠送。
PSPE购自天津尖峰有限责任公司。通过高效液相色谱-质谱联用测得其主要活性成分为:矢车菊素3-咖啡酰槐糖苷-5-葡糖苷3.94%(质量分数,下同)、芍药素3-咖啡酰槐糖苷-5-葡糖苷17.68%、矢车菊素3-(6”-咖啡酰-6’’’-阿魏酰槐糖苷)-5-葡糖苷5.32%、芍药素-双咖啡酰槐糖苷-5-葡糖苷9.39%、芍药素3-咖啡酰-对-羟基苯甲酰槐糖苷-5-葡糖苷7.76%、芍药素3-咖啡酰-阿魏酰槐糖苷-5-葡糖苷31.88%[15]。
超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒 南京建成生物工程研究所;Trizol试剂、cDNA合成试剂盒、SYBR Green 宝生物生物工程(大连)有限公司。
1.2 仪器与设备
HWS-850恒温恒湿生化培养箱 宁波海曙赛福实验仪器厂;酶标仪 美国Thermo公司;实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国Bio-Rad公司;UVmini-1240紫外分光光度计 日本岛津仪器公司;倒置荧光显微镜 日本Olympus公司。
1.3 方法
1.3.1 线虫同期化
将5 日龄线虫用M9缓冲液冲洗至EP管,3 000 r/min离心1 min,弃上清液获得虫体。每EP管加入500 μL M9缓冲液及500 μL线虫裂解液,混匀8 min后按上述条件离心,弃上清液。M9缓冲液洗涤5 次后,EP管中加入1 mL M9缓冲液,20 ℃静置过夜后接种至线虫生长培养基(nematode growth medium,NGM),20 ℃培养48 h,即得到L4期线虫。
1.3.2 线虫存活寿命测定
将同期化后线虫随机分为4 组,分别为空白组及不同质量浓度PSPE(70、140、280 μg/mL)的实验组[16],空白组为普通培养基饲养线虫。具体操作为PSPE溶解于二甲基亚砜后,添加至NGM。空白组添加相应量的二甲基亚砜,实验所加二甲基亚砜质量分数低于2‰。每组2 板,每板30 条,于恒温恒湿生化培养箱中培养。每2 d更换新鲜培养基,挑出死亡线虫并记录,至所有线虫死亡,重复3 次。计算线虫的平均寿命及最高寿命,其中平均寿命为全部线虫死亡时间的平均值,最高寿命为每组最后线虫存活数量为10%时的平均寿命。
1.3.3 抗氧化酶活力测定
将同期化2 日龄线虫在不同质量浓度PSPE的NGM中培养5 d后,收集至EP管。生理盐水洗涤并加入200 μL生理盐水于冰上匀浆,取上清液,测定SOD、CAT活力。实验重复3 次。
1.3.4 抗氧化基因表达水平测定
将同期化2 日龄线虫在不同质量浓度PSPE的NGM中培养5 d后,收集至EP管。生理盐水洗涤后放入-80 ℃冰箱备用。依次进行线虫RNA的提取、RNA纯度及完整性的鉴定,合成cDNA,以及实时荧光定量PCR监测线虫体内相关抗氧化基因mRNA表达水平。以gpd-1为持家基因,实验结果以PCR的2-ΔΔCt值表示。实验重复3 次。mRNA表达水平测定用PCR引物(表1)。
表1 秀丽隐杆线虫抗氧化基因mRNA表达水平测定用PCR引物
Table 1 PCR primers used for the measurement of antioxidant gene mRNA expression in C. elegans

1.3.5 线虫急性氧化应激实验
将同期化2 日龄线虫在空白培养基及不同质量浓度PSPE的NGM中培养5 d后,分别转移到含1‰ H2O2的NGM、500 μmol/L胡桃醌NGM和2 μmol/L百草枯NGM,每组2 板,每板30 条。分别间隔30 min、1 h、1 d观察线虫死亡情况并记录,至所有线虫死亡,实验重复3 次。当空白组线虫存活率为20%时,收集各剂量组线虫,NaN3麻醉,挑至1%的琼脂糖载玻片,于激发波长340~380 nm、发射波长430 nm条件下,用倒置荧光显微镜拍摄线虫脂褐素荧光图片,Image J软件分析脂褐素荧光水平。
1.4 数据统计分析
采用GraphPad Prism 5及Image J软件进行数据分析,数据表示为 ±s。通过方差分析进行统计学显著性检验,p<0.05表示差异显著,p<0.01表示差异极显著。
2.1 PSPE对线虫寿命的影响
表2 PSPE对线虫寿命的影响(n=240)
Table 2 Effect of PSPE on lifespan of C. elegans (n= 240)

注:*.与空白组相比差异显著(p<0.05);**.与空白组相比差异极显著(p<0.01)。下同。
由表2可知,PSPE组线虫的平均寿命和最高寿命均高于空白组,且与PSPE质量浓度呈一定的剂量依赖关系,其中280 μg/mL PSPE组的平均寿命和最高寿命分别较空白组延长了32.8%(p<0.05)及19.4%(p<0.01)。
2.2 PSPE对线虫体内主要抗氧化酶活力的影响
表3 PSPE对线虫主要抗氧化酶活力的影响
Table 3 Effect of PSPE on the activity of major antioxidant enzymes in C. elegans

SOD和CAT是线虫体内两类主要的抗氧化酶,分别清除线虫体内多余的超氧化物自由基和H2O2。由表3可知,经PSPE处理线虫SOD和CAT活力均得到提高,且呈现剂量依赖关系。与空白组相比,140 μg/mL PSPE使SOD和CAT活力分别提高了11.7%和38.7%,280 μg/mL PSPE使SOD和CAT活力分别提高了17.7%和47.5%。
2.3 PSPE对线虫抗氧化基因表达水平的影响
表4 PSPE对线虫抗氧化基因表达水平的影响
Table 4 Effect of PSPE on the expression of antioxidant genes in C. elegans
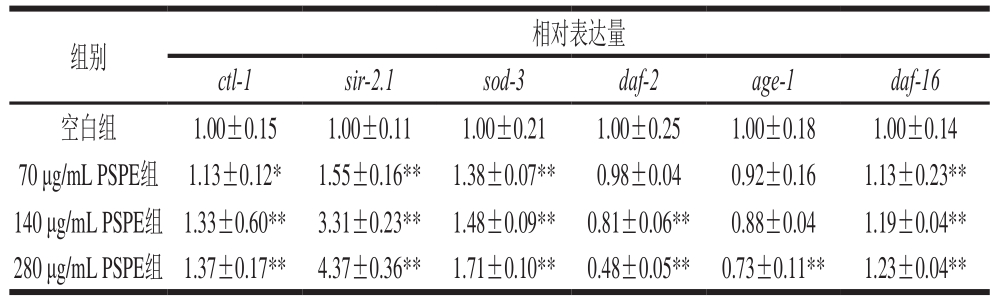
由表4可知,与空白组相比,饲喂PSPE后线虫体内ctl-1、sir-2.1、sod-3和daf-16基因相对表达量均有不同程度的提高,而daf-2和age-1基因表达水平呈下降趋势。其中140 μg/mL PSPE组ctl-1、sir-2.1、sod-3和daf-16基因表达水平比空白组分别升高了33%、231%、48%和19%,daf-2基因表达水平比空白组降低了19%;280 μg/mL PSPE组age-1基因表达水平比空白组降低了27%(p<0.01)。
2.4 PSPE对急性损伤组线虫的保护作用
2.4.1 PSPE对H2O2损伤组线虫的保护作用
表5 PSPE对H2O2损伤组线虫寿命的影响(n=240)
Table 5 Effect of PSPE on lifespan of C. elegans damaged by H2O2(n= 240)

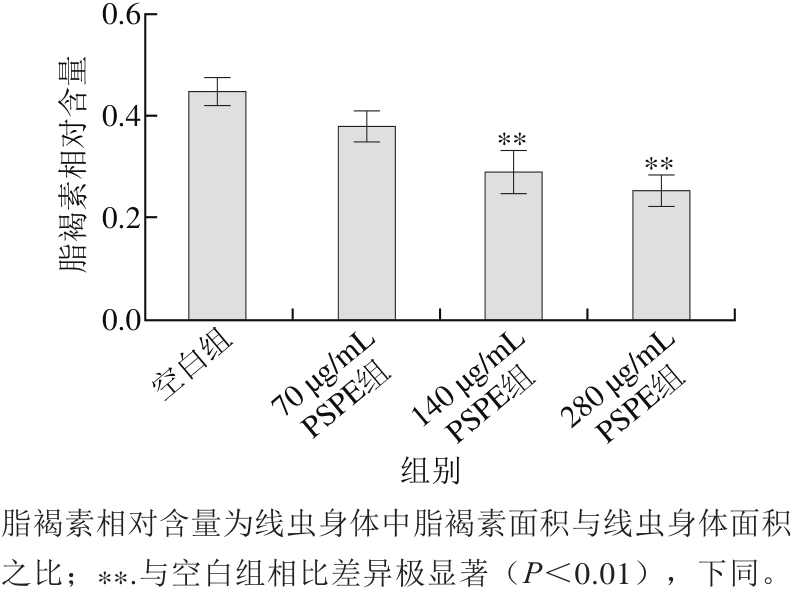
图1 PSPE对H2O2损伤组线虫脂褐素相对含量的影响
Fig. 1 Effect of PSPE on the content of lipofuscin in C. elegans damaged by H2O2
由表5可知,给予H2O2后线虫最高寿命缩短至4 h以内。而经PSPE处理线虫平均寿命较空白组分别延长了13.7%、35.4%及42.9%,表明PSPE对H2O2氧化损伤线虫具有保护作用。由图1可知,与空白组相比,70、140、280 μg/mL PSPE组线虫体内脂褐素的相对含量分别降低了21.7%、41.3%(p<0.01)及47.8%(p<0.01)。
2.4.2 PSPE对胡桃醌损伤组线虫的保护作用
表6 PSPE对胡桃醌损伤组线虫寿命的影响(n=240)
Table 6 Effect of PSPE on lifespan of C. elegans damaged by juglone (n= 240)

胡桃醌在线虫体内的氧化还原反应会诱导产生细胞内的氧化应激[17]。由表6可知,140、280 μg/mL PSPE组线虫平均寿命较空白组分别延长30.1%及48.4%(p<0.05)。由图2可知,脂褐素相对含量较空白组分别下降34.8%(p<0.01)及53.2%(p<0.01)。表明PSPE对胡桃醌氧化损伤线虫具有保护作用,可以一定程度延长线虫的平均存活时间,减少脂褐素积累,由此推断,一定剂量的PSPE能够增强线虫对胡桃醌氧化损伤的耐受能力。

图2 PSPE对胡桃醌损伤组线虫脂褐素相对含量的影响
Fig. 2 Effect of PSPE on the content of lipofuscin in C. elegans damaged by juglone
表7 PSPE对百草枯损伤组线虫寿命的影响(n=240)
Table 7 Effect of PSPE on lifespan of C. elegans damaged by paraquat (n= 240)

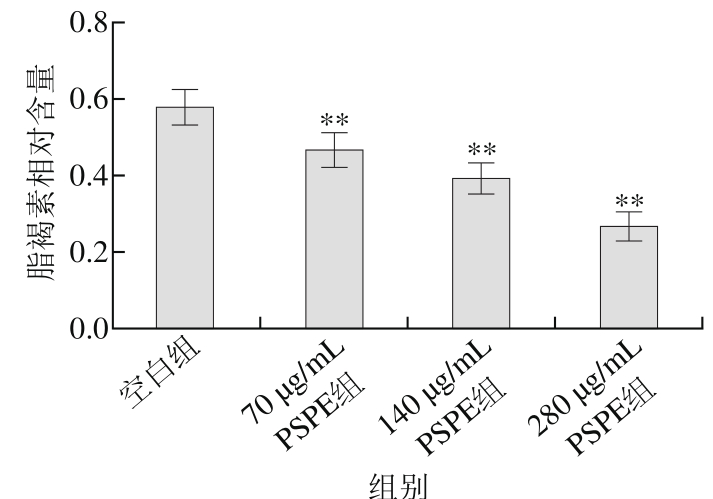
图3 PSPE对百草枯损伤组线虫脂褐素相对含量的影响
Fig. 3 Effect of PSPE on the content of lipofuscin in C. elegans damaged by paraquat
百草枯产生超氧阴离子自由基引起线虫氧化损伤,缩短线虫寿命。由表7可知,280 μg/mL PSPE组线虫较空白组平均寿命延长44.8%(p<0.01)。由图3可知,脂褐素相对含量降低54.9%(p<0.01)。由此推断,PSPE对百草枯导致的氧化损伤线虫有一定的保护作用,可以延长线虫的寿命,呈现剂量依赖关系。
本实验以不同剂量PSPE饲喂线虫,通过寿命实验、抗氧化酶活力及抗氧化基因表达水平的测定,同时辅以氧化应激实验检测PSPE对线虫应激耐受能力的影响,以及测定脂褐素自发荧光水平来研究线虫体内的过氧化水平,初步分析了PSPE调控线虫衰老的分子机制。
SOD和CAT作为线虫体内两类主要的抗氧化酶,分别清除线虫体内多余的超氧化物自由基和H2O2,其酶活力的升高标志着线虫抗氧化能力的增强。实验表明,PSPE能提高两种酶的活力。这与Zhang Zifeng等[3]研究发现紫薯色素能够恢复高脂损伤小鼠肝脏的氧化还原能力,显著性抑制活性氧簇的产生,提高Cu-Zn-SOD及其他抗氧化酶活力的结果一致。Zhang Zifeng等[18]还发现紫薯色素能提高D-半乳糖损伤鼠肝脏中Cu-Zn-SOD及CAT活力。
sir-2.1作为一种长寿基因,不仅可以通过脱乙酰化直接激活daf-16/FOXO,还参与到饮食限制通路下游基因的调控[19-20]。实验测得线虫寿命延长的同时,sir-2.1基因表达水平上调。Berdichevsky等[21]研究发现,线虫体内过表达sir-2.1可增强对热刺激及氧化应激的抵抗,而敲除sir-2.1的突变体线虫对应激表现更敏感。另外,过表达sir-2.1还可提高daf-16靶基因sod-3的转录水平。
胰岛素信号通路在线虫的衰老调控中起重要作用,该通路中与长寿相关的信号因子有daf-2[22-23]、age-1[24-25]等。其中,daf-2是人胰岛素/胰岛素样生长因子受体家族的同族体[23],age-1是哺乳动物磷脂酰激酶-3-羟基激酶的同族体[25]。有研究表明age-1突变体线虫存活时间是野生型的2 倍,即age-1突变体表现出寿命延长的表型[22-24]。而daf-2突变体在氧化应激条件下也表现出比野生型更强的抵抗能力。线虫体内daf-2受体与胰岛素配体结合后可以引发激酶级联反应,daf-2可磷酸化磷脂酰肌醇-3激酶age-1[25],而age-1又可通过AKT-1/AKT-2/SGK-1通路引起叉头转录因子daf-16磷酸化[26]。最终,通过调节daf-16的活性影响该信号通路对寿命的调控。
daf-16通常被认为是对寿命以及热刺激、氧化刺激抵抗的重要监控器,其激活受胰岛素/胰岛素样生长因子信号通路调控。daf-16为叉头转录因子的同族体,其激活为靶基因如sod-3、ctl-1的转录激活创造了条件[27-30]。ctl-1是编码细胞质基质CAT的基因,ctl-1突变体可抑制daf-2、age-1突变体寿命延长[31]。Zhang Jiaolong等[32]研究发现齐墩果酸通过激活daf-16而引起线虫寿命的延长,同时,sod-3、ctl-1基因表达水平也呈现上调趋势。还有研究称,daf-16与daf-18突变体可协同抑制daf-2突变体的寿命延长[22-33]。因此推断,胰岛素/胰岛素样生长因子信号通路可能是通过转录激活指定的目标基因的表达,来有效地维护生命[13]。
有研究称,线虫寿命延长的同时,其对氧化应激的抵抗能力随之增强[34]。H2O2是机体代谢的副产物,过多积累造成机体氧化损伤。百草枯是细胞内超氧阴离子发生器,使组织内高氧而产生急性氧化损伤。胡桃醌在线虫体内的氧化还原反应会诱导产生细胞内的氧化应激[17]。实验测得,给予PSPE后,线虫对氧化应激的抵抗能力有不同程度提高,表现在线虫在应激中存活时间及存活率的提高。有研究发现,4-HBE(对羟基苯甲酸刺激)延长野生型秀丽隐杆线虫寿命的同时还增强其对百草枯的抵抗能力,4-HBE组线虫在60 mmol/L百草枯条件下存活时间较正常组延长[35]。Cong Wenshu等[36]研究发现,富勒醇在延长秀丽隐杆线虫寿命的同时,能够增强其对胡桃醌氧化损伤的应激,表现在给予抗氧化物质富勒醇后,线虫的存活率明显增加,存活时间随之增加。
综上所述,饲喂一定剂量的PSPE后,线虫可通过胰岛素/胰岛素/胰岛素样生长因子信号通路调控相关抗氧化基因的表达水平,提高相关抗氧化酶活力、有效减少线虫体内脂褐素积累、增强对氧化应激的抵抗能力,使得线虫寿命得到有效延长。
参考文献:
[1] OKI T, MASUDA M, FURUTA S, et al. Involvement of anthocyanins and other phenolic compounds in radical-scavenging activity of purplefl eshed sweet potato cultivars[J]. Journal of Food Science, 2002, 67(5):1752-1756. DOI:10.1111/j.1365-2621.2002.tb08718.x.
[2] WU T Y, TSAI C C, HWANG Y T, et al. Effect of antioxidant activity and functional properties of Chingshey purple sweet potato fermented milk by Lactobacillus acidophilus, L. delbrueckii subsp. lactis, and L. gasseri strains[J]. Journal of Food Science, 2012, 77(1): 2-8.DOI:10.1111/j.1750-3841.2011.02507.x.
[3] ZHANG Zifeng, LU Jun, ZHENG Yuanlin, et al. Purple sweet potato color attenuates hepatic insulin resistance via blocking oxidative stress and endoplasmic reticulum stress in high-fat-diet-treated mice[J]. Journal of Nutritional Biochemistry, 2013, 24(6): 1008-1018.DOI:10.1016/j.jnutbio.2012.07.009.
[4] LIM S, XU J, KIM J, et al. Role of anthocyanin-enriched purplefl eshed sweet potato p40 in colorectal cancer prevention[J]. Molecular Nutrition & Food Research, 2013, 57(11): 1908-1917. DOI:10.1002/mnfr.201300040.
[5] YE J L, MENG X J, YAN C L, et al. Effect of purple sweet potato anthocyanins on beta-amyloid-mediated PC-12 cells death by inhibition of oxidative stress[J]. Neurochemical Research, 2010, 35(3):357-365. DOI:10.1007/s11064-009-0063-0.
[6] WANG Y J, ZHENG Y L, LU J, et al. Purple sweet potato color suppresses lipopolysaccharide-induced acute in fl ammatory response in mouse brain[J]. Neurochemistry International, 2010, 56(3): 424-430.DOI:10.1016/j.neuint.2009.11.016.
[7] WANG Wencheng, LI Jinlian, WANG Zhi, et al. Oral hepatoprotective ability evaluation of purple sweet potato anthocyanins on acute and chronic chemical liver injuries[J]. Cell Biochemistry & Biophysics,2014, 69(3): 539-548. DOI:10.1007/s12013-014-9829-3.
[8] HWANG Y P, CHOI J H, YUN H J, et al. Anthocyanins from purple sweet potato attenuate dimethylnitrosamine-induced liver injury in rats by inducing Nrf2-mediated antioxidant enzymes and reducing COX-2 and iNOS expression[J]. Food and Chemical Toxicology, 2011, 49(1):93-99. DOI:10.1016/j.fct.2010.10.002.
[9] COLLINS J J, EVASON K, KORNFELD K. Pharmacology of delayed aging and extended lifespan of Caenorhabditis elegans[J].Experimental Gerontology, 2006, 41(10): 1032-1039. DOI:10.1016/j.exger.2006.06.038.
[10] LEUNG M C K, WILLIAMS P L, BENEDETTO A, et al. Caenorhabditis elegans: an emerging model in biomedical and environmental toxicology[J]. Toxicological Sciences, 2008, 106(1): 5-28. DOI:10.1093/toxsci/kfn121.
[11] BALLA K M, TROEMEL E R. Caenorhabditis elegans: as a model for intracellular pathogen infection[J]. Cellular Microbiology, 2013, 15(8):1313-1322. DOI:10.1111/cmi.12152.
[12] MELOV S, RAVENSCROFT J, MALIK S, et al. Extension of lifespan with superoxide dismutase/catalase mimetics[J]. Science, 2000,289: 1567-1569. DOI:10.1126/science.289.5484.1567.
[13] HONDA Y, HONDA S. Oxidative stress and life span determination in the nematode Caenorhabditis elegans[J]. Annals of the New York Academy of Sciences, 2002, 959(1): 466-474.
[14] LEE E Y, SHIM Y H, CHITWOOD D J, et al. Cholesterol-producing transgenic Caenorhabditis elegans lives longer due to newly acquired enhanced stress resistance[J]. Biochemical and Biophysical Research Communications, 2005, 328(4): 929-936. DOI:10.1016/j.bbrc.2005.01.050.
[15] 陈文, 裴彰明, 刘晓宇, 等. LC-MS/MS分析测定紫薯花色苷方法研究[J]. 中国食品添加剂, 2015(3): 191-194.
[16] PEIXOTO H, ROXO M, KRSTIN S, et al. Anthocyanin-rich extract of Acai (Euterpe precatoria Mart.) mediates neuroprotective activities in Caenorhabditis elegans[J]. Journal of Functional Foods, 2016, 26:385-393.
[17] DE CASTRO E, DE CASTRO S H, JOHNSON T E. Isolation of longlived mutants in Caenorhabditis elegans using selection for resistance to juglone[J]. Free Radical Biology and Medicine, 2004, 37(2): 139-145. DOI:10.1016/j.freeradbiomed.2004.04.021.
[18] ZHANG Zifeng, FAN Shaohua, ZHENG Yuanlin, et al. Purple sweet potato color attenuates oxidative stress and inflammatory response induced by D-galactose in mouse liver[J]. Food and Chemical Toxicology, 2009, 47(2): 496-501. DOI:10.1016/j.fct.2008.12.005.
[19] KENYON C J. The genetics of ageing[J]. Nature, 2010, 464: 504-512.DOI:10.1038/nature08980.
[20] WANG Y M, TISSENBAUM H A. Overlapping and distinct functions for a Caenorhabditis elegans SIR2 and DAF-16/FOXO[J].Mechanisms of Ageing and Development, 2006, 127(1): 48-56.DOI:10.1016/j.mad.2005.09.005.
[21] BERDICHEVSKY A, VISWANATHAN M, HORVITZ H R, et al.C. elegans SIR-2.1 interacts with 14-3-3 proteins to activate DAF-16 and extend life span[J]. Cell, 2006, 125(6): 1165-1177. DOI:10.1016/j.cell.2006.04.036.
[22] KENYON C, CHANG J, GENSCH E, et al. A C. elegans mutant that lives twice as long as wild type[J]. Nature, 1993, 366: 461-464.DOI:10.1038/366461a0.
[23] KIMURA K D, TISSENBAUM H A, LIU Y, et al. daf-2, an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans[J]. Science, 1997, 277: 942-946. DOI:10.1126/science.277.5328.942.
[24] FRIEDMAN D B, JOHNSON T E. A mutation in the age-1 gene in Caenorhabditis elegans lengthens life and reduces hermaphrodite fertility[J]. Genetics, 1988, 118(1): 75-86.
[25] MORRIS J Z, TISSENBAUM H A, RUVKUN G. A phosphatidylinositol-3-OH kinase family member regulating longevity and diapause in Caenorhabditis elegans[J]. Nature, 1996, 382:536-539. DOI:10.1038/382536a0.
[26] PARADIS S, AILION M, TOKER A, et al. A PDK1 homolog is necessary and sufficient to transduce AGE-1 PI3 kinase signals that regulate diapause in Caenorhabditis elegans[J]. Genes &Development, 1999, 13(11): 1438-1452.
[27] MURPHY C T, MCCARROLL S A, BARGMANN C I, et al.Genes that act downstream of DAF-16 to influence the lifespan of Caenorhabditis elegans[J]. Nature, 2003, 424: 277-283. DOI:10.1038/nature01789.
[28] LEE S S, KENNEDY S, TOLONEN A C, et al. DAF-16 target genes that control C. elegans life-span and metabolism[J]. Science, 2003,300: 644-647. DOI:10.1126/science.1083614.
[29] MCELWEE J, BUBB K, THOMAS J H. Transcriptional outputs of the Caenorhabditis elegans forkhead protein DAF-16[J]. Aging Cell,2003, 2(2): 111-121. DOI:10.1046/j.1474-9728.2003.00043.x.
[30] WANG Xue, ZHANG Jiaolong, LU Lulu, et al. The longevity ef f ect of echinacoside in Caenorhabditis elegans mediated through daf-16[J].Bioscience, Biotechnology and Biochemistry, 2015, 79(10): 1676-1683. DOI:10.1080/09168451.2015.1046364.
[31] TAUB J, LAU J F, MA C, et al. A cytosolic catalase is needed to extend adult lifespan in C. elegans daf-C and clk-1 mutants[J]. Nature,1999, 399: 162-166. DOI:10.1038/20208.
[32] ZHANG Jiaolong, LU Lulu, ZHOU Lijun. Oleanolic acid activates daf-16 to increase lifespan in Caenorhabditis elegans[J]. Biochemical and Biophysical Research Communications, 2015, 468(4): 843-849.DOI:10.1016/j.bbrc.2015.11.042.
[33] LARSEN P L, ALBERT P S, RIDDLE D L. Genes that regulate both development and longevity in Caenorhabditis elegans[J]. Genetics,1995, 139(4): 1567-1583.
[34] WIEGANT F A C, SURINOVA S, YTSMA E, et al. Plant adaptogens increase lifespan and stress resistance in C. elegans[J]. Biogerontology,2009, 10(1): 27-42. DOI:10.1007/s10522-008-9151-9.
[35] KIM D K, JEON H, DONG S C. 4-Hydroxybenzoic acid-mediated lifespan extension in Caenorhabditis elegans[J]. Journal of Functional Foods, 2014, 7(2): 630-640. DOI:10.1016/j.jf f.2013.12.022.
[36] CONG Wenshu, PENG Wang, YING Qu, et al. Evaluation of the influence of fullerenol on aging and stress resistance using Caenorhabditis elegans[J]. Biomaterials, 2015, 42: 78-86.DOI:10.1016/j.biomaterials.2014.11.048.
Antioxidant Effect of Purple Sweet Potato Extract in Caenorhabditis elegans
WANG Hong1,2, ZHANG Xiaohan1, CHENG Jing1, WANG Jing1, DIAO Cuiru1, WANG Hao1,*
(1. College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China;2. School of Biological Engineering, Tianjin University of Science and Technology, Tianjin 300457, China)
Abstract:Objective: We used Caenorhabditis elegans as a model organism to study the anti-aging effect of purple sweet potato extract (PSPE) and to elucidate its possible mechanism. Methods: C. elegans were fed with NGM culture medium containing different concentrations (70, 140, 280 μg/mL) of PSPE, and the effect of PSPE on the lifespan, the activity of antioxidant enzymes, the expression of related genes and the resistance to acute oxidative stress were determined.Results: PSPE could markedly prolong the lifespan of C. elegans, increased the activity of antioxidant enzymes such as superoxide dismutase (SOD) and catalase (CAT), up-regulated the gene expression levels of daf-16, ctl-1, sod-3 and sir-2.1, and down-regulated the expression levels of age-1 and daf-2. At the same time, it could extend the survival time under H2O2, juglone and paraquat stress. Conclusion: PSPE could slow down the aging process of C. elegans, increase the activity of antioxidant enzymes, promote the expression of antioxidant genes, and enhanced the resistance to oxidative stress induced by H2O2, juglone or paraquat.
Key words:Caenorhabditis elegans; purple sweet potato extract; oxidative stress; antioxidant; aging
DOI:10.7506/spkx1002-6630-201723026
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)23-0165-06
引文格式:
王红, 张晓寒, 程静, 等. 紫薯提取物对秀丽隐杆线虫抗氧化作用的影响[J]. 食品科学, 2017, 38(23): 165-170.
DOI:10.7506/spkx1002-6630-201723026. http://www.spkx.net.cn
WANG Hong, ZHANG Xiaohan, CHENG Jing, et al. Antioxidant effect of purple sweet potato extract in Caenorhabditis elegans[J]. Food Science, 2017, 38(23): 165-170. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723026. http://www.spkx.net.cn
收稿日期:2016-07-19
基金项目:国家自然科学基金应急管理项目(31540086)
作者简介:王红(1990—),女,硕士,研究方向为食品添加剂与功能配料。E-mail:wanghong514@126.com
*通信作者:王浩(1979—),男,副教授,博士,研究方向为食品添加剂与功能配料。E-mail:wanghao@tust.edu.cn