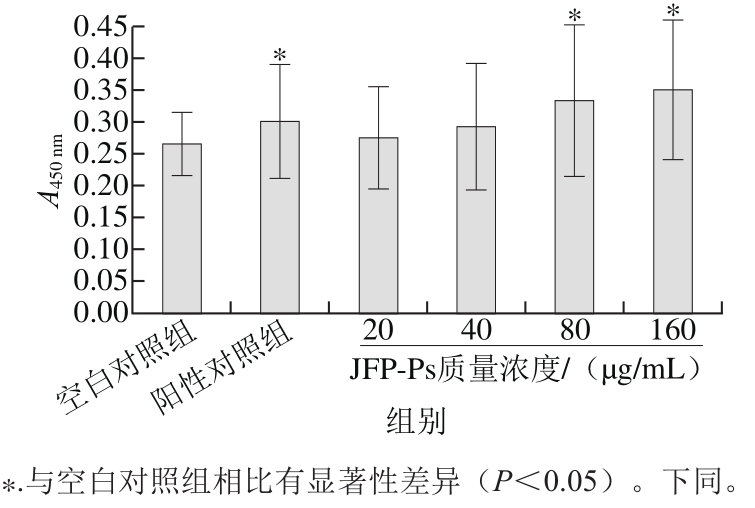
图1 JFP-Ps对脾淋巴细胞增殖的影响
Fig. 1 Effect of JFP-Ps at different concentrations on spleen lymphocyte proliferation in vitro
朱科学1,王颖倩1,2,张彦军1,贺书珍1,徐 飞1,吴 刚1,谭乐和1,*
(1.中国热带农业科学院香料饮料研究所,海南 万宁 571533;2.黑龙江八一农垦大学工程学院,黑龙江 大庆 163319)
摘 要:本研究旨在探明菠萝蜜多糖(polysaccharide from jackfruit pulp,JFP-Ps)对正常小鼠脾淋巴细胞增殖和免疫调节的影响。通过体外小鼠脾淋巴细胞的培养实验,测定不同质量浓度JFP-Ps对正常小鼠脾淋巴细胞增殖、抗氧化能力(总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活力和丙二醛(malonic dialdehyde,MDA)含量)及细胞因子(肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-γ(interferon-γ,IFN-γ)和白细胞介素-1β(interleukin-1β,IL-1β))分泌水平的影响。结果显示,JFP-Ps可促进小鼠脾淋巴细胞增殖,质量浓度为80 μg/mL和160 μg/mL时效果显著(p<0.05);当JFP-Ps质量浓度为40 μg/mL甚至更高时,T-AOC及GSH-Px、SOD和CAT活力显著升高(p<0.05),但MDA含量显著降低(p<0.05);JFP-Ps在质量浓度40~160 μg/mL范围内可显著促进脾淋巴细胞TNF-α、IFN-γ和IL-1β的分泌(p<0.05)。结果表明JFP-Ps的免疫增强活性可能与其促进小鼠脾淋巴细胞增殖、提高抗氧化活性及诱导细胞因子TNF-α、IFN-γ和IL-1β分泌水平有关。
关键词:菠萝蜜多糖;脾淋巴细胞;抗氧化活性;细胞因子;免疫调节
近年来,随着对多糖研究的深入,其生物活性已成为科学研究的热点之一,尤其是多糖的免疫调节作用正受到越来越多的关注。研究发现,许多多糖均能通过调节淋巴细胞亚群的失衡,激活自然杀伤细胞、巨噬细胞和树突状细胞等免疫细胞、诱导细胞因子生成、活化补体等发挥其免疫调节活性[1]。例如,龙眼肉多糖能刺激脾淋巴细胞及B细胞增殖、有效刺激巨噬细胞增殖、增强其吞噬功能和NO生成量[2]。灵芝多糖可促进淋巴细胞增殖和Thl型细胞因子干扰素-γ(interferon-γ,IFN-γ)的分泌,提高T淋巴细胞亚型和诱导Th1型免疫反应,通过诱导NO、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和活性氧(reactive oxygen species,ROS)的生成,激活巨噬细胞的吞噬能力[3-4]。
菠萝蜜(Artocarpus heterophyllus Lam.)作为一种桑科木菠萝属热带果树,素有“热带珍果”、“热带水果皇后”等美誉,具有抗氧化、抗炎、降血糖等多种药理药效活性[5-6]。菠萝蜜果肉中的碳水化合物含量在16.0%~25.4%,邹勇芳等[7]对菠萝蜜水提物中多糖含量进行测定,苯酚-硫酸法测定结果显示菠萝蜜总糖含量为5.53%;Zhu Kexue等[8]研究发现,菠萝蜜多糖(polysaccharide from jackfruit pulp,JFP-Ps)主要由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和半乳糖醛酸组成,并具有显著的体外抗氧化活性。Tan Yinfeng等[9]研究发现菠萝蜜果肉中粗多糖具有免疫增强活性。但有关JFP-Ps对免疫调节机制的报道较少。本实验以菠萝蜜果肉为研究对象,研究JFP-Ps对正常小鼠脾淋巴细胞体外增殖、抗氧化活性和诱导细胞因子分泌的影响,初步研究JFP-Ps对正常小鼠脾淋巴细胞体外免疫活性的影响,为菠萝蜜的深入开发提供实验依据。
1.1 材料、动物与试剂
JFP-Ps由中国热带农业科学院香料饮料研究所产品加工研究室制备[8,10]。
BALB/c纯系雄性小鼠,体质量2~30 g,购自南昌大学医学院实验动物科。
胎牛血清 杭州四季青生物工程材料有限公司;RPMI-1640培养基 美国Gibco公司;刀豆蛋白A(concanavalin A,ConA) 美国Sigma公司;细胞增殖活性检测试剂盒(cell counting kit,CCK)-8、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒、超氧化物歧化酶(total superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、NO检测试剂盒、BCA蛋白浓度测定试剂盒、Western及IP细胞裂解液 上海碧云天生物技术有限公司;小鼠TNF-α酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、小鼠IFN-γ ELISA试剂盒、小鼠IL-1β ELISA试剂盒 武汉博士德生物工程有限公司;其余化学试剂均为分析纯。
1.2 仪器与设备
3110 Series Ⅱ二氧化碳培养箱、Varioskan Flash酶标仪 美国Thermo Fisher公司;CKX41倒置显微镜日本Olympus公司;超净工作台 苏州净化设备厂;3K15高速台式冷冻离心机 美国Sigma公司;微量加样器 德国Eppendorf公司;ZDX-35B高压灭菌锅上海申安医疗器械厂;Milli-Q 50超纯水净化系统 美国Millipore公司。
1.3 方法
1.3.1 小鼠脾淋巴细胞的制备
脱颈椎处死小鼠,无菌取其脾脏,参照文献[11]报道的方法制备脾细胞悬液,将收集到的脾细胞置于培养瓶中,在37 ℃、5% CO2培养箱培养2 h,以除去贴壁细胞,收集未贴壁的细胞悬液即为脾淋巴细胞。台盼蓝染色计数(活细胞数大于95%),备用。
调整小鼠脾淋巴细胞悬液细胞密度为5×106个/mL,按190 μL/孔细胞悬液加入至96 孔细胞培养板。JFP-Ps处理组(各组每孔分别加不同质量浓度JFP-Ps的RPMI-1640培养基10 μL,调节终质量浓度分别为20、40、80、160 μg/mL),空白对照组(每孔加10 μL RPMI-1640培养基),每组4 个复孔,同时设置3 个平行实验,37 ℃、5% CO2条件下培养48 h后,6 000 r/min离心10 min,收集细胞和上清液样品,检测JFP-Ps对脾淋巴细胞抗氧化活性和细胞因子含量的影响。
1.3.2 小鼠脾淋巴细胞增殖的检测
采用CCK-8法检测JFP-Ps对小鼠脾淋巴细胞体外增殖能力的影响,按1.3.1节方法培养小鼠脾淋巴细胞48 h后,ConA(加入10 μL ConA RPMI-1640溶液,使其终质量浓度为5 μg/mL,设3 个复孔)作为阳性对照组[12],根据CCK-8说明书,加入20 μL CCK-8溶液继续培养4 h后用酶标仪检测450 nm波长处吸光度,检测JFP-Ps对小鼠脾淋巴细胞的增殖作用。
1.3.3 抗氧化活性的测定
采用Western及IP细胞裂解液裂解1.3.1节收集的细胞样品:每100万细胞加入200 μL裂解液进行裂解,玻璃匀浆器4 ℃匀浆,6 000 r/min离心10 min,取上清液。
严格按照T-AOC、GSH-Px、SOD、CAT和MDA检测试剂盒说明书进行测定。根据标准曲线和蛋白质量浓度计算抗氧化酶活力和MDA含量。
1.3.4 NO含量的测定
取1.3.3节制备的细胞上清液50 μL,按照NO检测试剂盒说明书方法,每孔分别加Griess Reagent Ⅰ和Griess Reagent Ⅱ各50 μL,酶标仪检测540 nm波长处吸光度,绘制标准曲线,计算脾淋巴细胞NO含量。
1.3.5 细胞因子分泌水平的测定
取1.3.1节制备的细胞培养上清液样品,严格按ELISA试剂盒说明书进行实验操作流程,建立标准曲线,通过绘制标准曲线求出上清液中IFN-γ、IL-1β和TNF-α的质量浓度。
1.4 数据统计分析
采用统计软件SPSS Statistics 17.0进行数据统计,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以x̅±s表示,以p<0.05时,组间差异判断为具有统计学意义。
2.1 JFP-Ps对小鼠脾淋巴细胞增殖的影响

图1 JFP-Ps对脾淋巴细胞增殖的影响
Fig. 1 Effect of JFP-Ps at different concentrations on spleen lymphocyte proliferation in vitro
如图1所示,JFP-Ps在终质量浓度20~160 μg/mL范围内可促进正常小鼠脾淋巴细胞的体外增殖,随JFP-Ps质量浓度的增加,其促进脾脏淋巴细胞体外增殖作用增强。与空白对照组比较,ConA阳性对照组可显著促进正常小鼠脾淋巴细胞增殖(p<0.05),JFP-Ps在80 μg/mL和160 μg/mL时对脾淋巴细胞的增殖作用具有显著性效果(p<0.05)。与阳性对照组相比,80 μg/mL和160 μg/mL的JFP-Ps溶液对小鼠脾淋巴细胞的增殖作用较强,但无显著性差异(P>0.05),表明JFP-Ps可促进正常小鼠脾淋巴细胞的体外增殖。
2.2 JFP-Ps对小鼠脾淋巴细胞抗氧化能力的影响
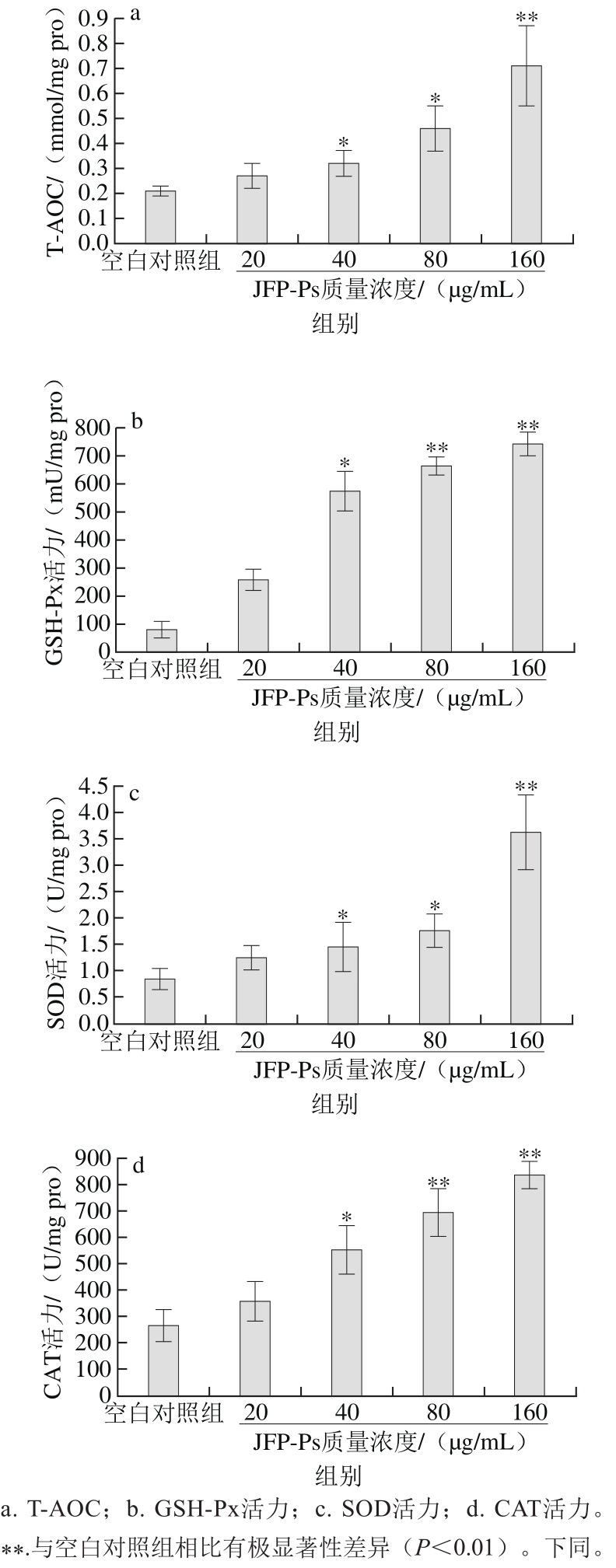
图2 JFP-Ps对脾淋巴细胞抗氧化酶活力的影响
Fig. 2 Effect of JFP-Ps at different concentrations on antioxidant enzyme activities in spleen lymphocytes in vitro
由图2可知,与空白对照组相比,JFP-Ps可提高小鼠脾淋巴细胞中抗氧化酶(T-AOC、GSH-Px、SOD和CAT)活力,并呈现一定的剂量相关性。当JFP-Ps质量浓度在40 μg/mL时,T-AOC、GSH-Px、SOD和CAT活力均显著升高(p<0.05),当质量浓度达到160 μg/mL时,与空白对照组相比,具有极显著升高效果(p<0.01)。

图3 JFP-Ps对脾淋巴细胞抗氧化产物MDA含量的影响
Fig. 3 Effect of JFP-Ps at different concentrations on MDA production in spleen lymphocytes in vitro
由图3可以看出,与空白对照组相比,JFP-Ps在终质量浓度20~160 μg/mL范围内可降低脾淋巴细胞MDA含量,且具有明显的量效关系。当JFP-Ps终质量浓度达到40 μg/mL时,对MDA含量具有显著降低作用(p<0.05),当质量浓度达到80 μg/mL和160 μg/mL时,JFP-Ps作用具有极显著降低效果(p<0.01)。表明JFP-Ps能够通过降低小鼠脾淋巴细胞脂质过氧化,保护自由基介导的氧化损伤。
2.3 JFP-Ps对小鼠脾淋巴细胞NO分泌水平的影响
JFP-Ps对小鼠脾淋巴细胞NO分泌水平的影响结果如图4所示,JFP-Ps能刺激脾淋巴细胞分泌NO,并随着JFP-Ps质量浓度的增加,NO分泌量逐渐升高,呈一定的量效关系。与空白对照组相比,当质量浓度达到80 μg/mL和160 μg/mL时,NO分泌效果极显著增强(p<0.01)。

图 4 JFP-Ps对脾淋巴细胞NO分泌水平的影响
Fig. 4 Effect of JFP-Ps at different concentrations on NO induction in spleen lymphocytes in vitro
2.4 JFP-Ps对小鼠脾淋巴细胞分泌细胞因子的影响
表1 JFP-Ps对脾淋巴细胞分泌细胞因子的影响
Table 1 Effect of JFP-Ps at different concentrations on cytokine secretion in spleen lymphocytes in vitro

注:*.与空白对照组相比差异显著(p<0.05);**.与空白对照组相比差异极显著(p<0.01)。
如表1所示,与空白对照组相比,不同质量浓度JFP-Ps对小鼠脾淋巴细胞内细胞因子分泌水平均有不同程度的促进作用,且呈剂量依赖关系。JFP-Ps在质量浓度20 μg/mL时,细胞因子TNF-α的分泌水平显著增加(p<0.05),对IFN-γ和IL-1β无显著促进作用。在质量浓度40~160 μg/mL范围内可显著促进脾淋巴细胞分泌TNF-α、IFN-γ和IL-1β。结果表明,JFP-Ps可通过促进TNF-α、IFN-γ和IL-1β的分泌发挥免疫增强作用。
脾淋巴细胞是机体获得性免疫系统的重要组成部分,淋巴细胞增殖率是反映细胞免疫能力最直接的指标。常用检测方法有噻唑蓝法和CCK-8法,其中CCK-8法是利用2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐在电子耦合试剂存在的情况下,被活细胞线粒体内的一些脱氢酶还原生成具有高度水溶性黄色甲瓒产物的原理,采用比色法检测450 nm波长处溶液产生的吸收峰,吸光度与活细胞数成线性关系[13]。ConA作为T淋巴细胞有丝分裂原,主要促进T淋巴细胞的增殖[14]。张梦思等[15]采用CCK-8法测定脾淋巴细胞对ConA刺激的增殖能力,发现当归多糖可显著提高D-半乳糖复制的衰老模型大鼠脾淋巴细胞的增值能力。本实验研究结果表明,与ConA阳性对照组相比,较高质量浓度的JFP-Ps能活化小鼠脾淋巴细胞体外增殖,推断JFP-Ps可能是淋巴细胞的致有丝分裂原,通过促进淋巴细胞增殖发挥其免疫增强活性,对增强机体的免疫功能具有重要的意义。
GSH-Px、SOD和CAT等一系列抗氧化酶在维持体内的氧化与抗氧化动态平衡中起着重要作用,保持机体内自由基的动态平衡[16]。其中,T-AOC作为衡量机体抗氧化功能的重要评价指标,其活性大小决定机体抗氧化能力的强弱[17]。GSH-Px是机体内重要的抗脂质过氧化物酶之一,具有清除过氧化氢和脂质过氧化物的能力,保护细胞形态和功能完整[18]。SOD是机体唯一能淬灭自由基的生物酶,主要清除超氧化阴离子自由基等氧自由基,是机体抵抗氧化损伤的主要屏障;CAT与GSH-Px和SOD共同构成机体重要的抗氧化酶系统,可减少ROS的产生,降低脂质过氧化及其中间代谢产物对机体的损害[19-20]。而MDA作为脂质过氧化的代表产物,是衡量机体自由基代谢的敏感指标[21]。本实验发现,JFP-Ps可显著提高正常小鼠脾淋巴细胞内T-AOC,GSH-Px、SOD、CAT活力和显著降低MDA含量(p<0.05),其作用随JFP-Ps质量浓度增加而增强,说明JFP-Ps可通过调节机体氧化-抗氧化平衡发挥其免疫增强活性。
NO作为细胞间信息传递的重要调节分子,其含量高低可评价机体免疫水平的强弱[22]。马玉芳等[23]发现金线莲多糖可促进小鼠脾淋巴细胞分泌NO。刘鹭等[24]研究发现,硒化乳酸菌胞外多糖可促进体外培养小鼠脾淋巴细胞NO的分泌量。本研究结果与前人报道结果相一致,表明JFP-Ps可通过刺激正常小鼠脾淋巴细胞分泌NO,进一步发挥其免疫调节作用。
细胞因子是由活化的免疫细胞和相关细胞分泌的一类具有广泛生物学活性的小分子蛋白质或多肽,可调节细胞的增殖、分化及功能成熟,提高宿主的防御能力[25-26]。TNF-α属于促炎症调节因子,能直接地抑制或杀伤肿瘤细胞,还能激活巨噬细胞和中性粒细胞功能以及促进抗原活化T、B淋巴细胞增殖、分化等作用,发挥重要的免疫调节作用[25]。IFN-γ是Th1型细胞因子,主要由活化的T细胞和自然杀伤细胞产生,是主要的巨噬细胞活化因子,具有强大的免疫调节功能和抗病毒、抗肿瘤作用[27]。IL-1β是一种主要由单核巨噬细胞产生的重要细胞因子和多肽调节因子,它能通过诱导淋巴细胞的分化和增殖进而提高机体细胞免疫应答[28]。从实验结果看,JFP-Ps可促进正常小鼠脾淋巴细胞TNF-α、IFN-γ和IL-1β的分泌,表明JFP-Ps增强正常小鼠免疫功能可能与其诱导细胞因子的分泌有一定关系。
研究表明,未致敏CD4+T细胞在不同条件下功能性分化为Th1或Th2细胞,其中Th1细胞主要分泌IL-2、IFN-γ、TNF-α、TNF-β等细胞因子,Th2细胞主要分泌IL-4、IL-5、IL-10等细胞因子,其中IFN-γ可促进Th1型细胞因子应答[29]。Mishra等[30]研究发现红景天玳瑁根茎水溶性提取物处理的正常人外周血单核细胞能刺激IL-1β、IL-6、TNF-α含量增多,通过刺激先天免疫途径,具有强大的免疫刺激活性。何广胜等[31]发现,巨噬细胞可根据其抗氧化功能状态的变化对Th细胞分化作出调节,免疫细胞自身的抗氧化状态可能会对最终的免疫反应有着重要影响。本研究结果表明,JFP-Ps可能是通过提高小鼠脾淋巴细胞抗氧化能力、调节NO代谢和Th1/Th2细胞因子平衡,发挥其免疫调节活性。
综上所述,JFP-Ps可能促进小鼠脾淋巴细胞增殖,提高T-AOC,GSH-Px、SOD、CAT活力和降低MDA含量,刺激NO分泌和诱导脾淋巴细胞TNF-α、IFN-γ和IL-1β的分泌。表明JFP-Ps的免疫增强活性可能与其促进小鼠脾淋巴细胞增殖、提高抗氧化活性及诱导细胞因子TNF-α、IFN-γ和IL-1β分泌有关。
参考文献:
[1] TZIANABOS A O. Polysaccharide immunomodulators as therapeutic agents: structural aspects and biologic function[J].Clinical Microbiology Reviews, 2000, 13(4): 523-533. DOI:10.1128/CMR.13.4.523-533. 2000.
[2] 易阳, 张名位. 龙眼肉多糖LPII的体外免疫调节活性评价[J].现代食品科技, 2014, 30(4): 63-67; 111. DOI:10.13982/j.mfst.1673-9078.2014.04.016.
[3] PI C C, CHU C L, LU C Y, et al. Polysaccharides from Ganoderma formosanum function as a Th1 adjuvant and stimulate cytotoxic T cell response in vivo[J]. Vaccine, 2014, 32(3): 401-408. DOI:10.1016/j.vaccine.2013.11.027.
[4] YU Q, NIE S P, WANG J Q, et al. Polysaccharide from Ganoderma atrum induces tumor necrosis factor-α secretion via phosphoinositide 3-kinase/Akt, mitogen-activated protein kinase and nuclear factor-κB signaling pathways in RAW264.7 cells[J]. International Immunopharmacology, 2012, 14(4): 362-368. DOI:10.1016/j.intimp.2012.09.005.
[5] SWAMI S B, THAKOR N J, HALDANKAR P M, et al. Jackfruit and its many functional components as related to human health: a review[J]. Comprehensive Reviews in Food Science and Food Safety,2012, 11(6): 565-576. DOI:10.1111/j.1541-4337.2012.00210.x.
[6] ZHANG Y J, ZHU K X, HE S Z, et al. Characterizations of high purity starches isolated from five different jackfruit cultivars[J].Food Hydrocolloids, 2015, 52: 785-794. DOI:10.1016/j.foodhyd.2015.07.037.
[7] 邹勇芳, 苏玉凤, 李清容, 等. 木菠萝水提物中多糖含量的测定[J].右江民族医学院学报, 2009, 31(3): 369-370. DOI:10.3969/j.issn.1001-5817.2009.03.013.
[8] ZHU Kexue, ZHANG Yanjun, NIE Shaoping, et al. Physicochemical properties and in vitro antioxidant activities of polysaccharide from Artocarpus heterophyllus Lam. pulp[J]. Carbohydrate Polymers, 2017,155: 354-361. DOI:10.1016/j.carbpol.2016.08.074.
[9] TAN Yinfeng, LI Hailong, LAI Weiyong, et al. Crude dietary polysaccharide fraction isolated from jackfruit enhances immune system activity in mice[J]. Journal of Medicinal Food, 2013, 16(7):663-668. DOI:10.1089/jmf.2012.2565.
[10] 朱科学, 张彦军, 谭乐和, 等. 菠萝蜜多糖提取工艺优化及初步鉴定[J]. 热带作物学报, 2016, 37(2): 404-410. DOI:10.3969/j.issn.1000-2561.2016.02.030.
[11] 朱科学, 聂少平, 李文娟, 等. 黑灵芝多糖对小鼠脾淋巴细胞增殖及诱生细胞因子的影响[J]. 食品科学, 2010, 31(19): 351-354.
[12] 王园园, 谭小燕, 胡明华, 等. CCK-8法检测小鼠淋巴细胞增殖的条件探讨[J]. 药物评价研究, 2017, 40(2): 206-209. DOI:10.7501/j.issn.1674-6376.2017.02.012.
[13] ZHANG Y C, ZHAI W J, ZHAO M F, et al. Ef f ects of iron overload on the bone marrow microenvironment in mice[J]. PLoS ONE, 2015,10(3): 1-17. DOI:10.1371/journal.pone.0120219.
[14] UCHIDA Y, KE B B, FREITAS M C, et al. The emerging role of T cell immunoglobulin mucin-1 in the mechanism of liver ischemia and reperfusion injury in the mouse[J]. Hepatology, 2010, 51(4): 1363-1372. DOI:10.1002/hep.23442.
[15] 张梦思, 邹婷, 叶渊文, 等. 当归多糖对衰老模型大鼠脾脏结构与功能的影响[J]. 解剖学报, 2015, 46(2): 257-264. DOI:10.16098/j.issn.0529-1356.2015.02.019.
[16] LI L, ZHAO Z Z, XIA J H, et al. A long-term high-fat/high-sucrose diet promotes kidney lipid deposition and causes apoptosis and glomerular hypertrophy in Bama minipigs[J]. PLoS ONE, 2015,10(11): 1-16. DOI:10.1371/journal.pone.0142884.
[17] CHEN Q, ZHANG S Z, YING H Z, et al. Chemical characterization and immunostimulatory effects of a polysaccharide from Polygoni Multiflori Radix Praeparata in cyclophosphamide-induced anemic mice[J]. Carbohydrate Polymers, 2012, 88(4): 1476-1482.DOI:10.1016/j.carbpol.2012.02.055.
[18] LI Y Q, HU Y K, SHI S J, et al. Evaluation of antioxidant and immuno-enhancing activities of Purslane polysaccharides in gastric cancer rats[J]. International Journal of Biological Macromolecules,2014, 68(7): 113-116. DOI:10.1016/j.ijbiomac.2014.04.038.
[19] JIAO L L, BO L, WANG M Z, et al. Antioxidant activities of the oligosaccharides from the roots, fl owers and leaves of Panax ginseng C.A. Meyer[J]. Carbohydrate Polymers, 2014, 106(12): 293-298.DOI:10.1016/j.carbpol.2014.02.035.
[20] CHEN R Z, LIU Z Q, ZHAO J M, et al. Antioxidant and immunobiological activity of water-soluble polysaccharide fractions purified from Acanthopanax senticosu[J]. Food Chemistry, 2011,127(2): 434-440. DOI:10.1016/j.foodchem.2010.12.143.
[21] 王君巧, 聂少平, 余强, 等. 黑灵芝多糖对免疫抑制小鼠的免疫调节和抗氧化作用[J]. 食品科学, 2012, 33(23): 274-277.
[22] GYORGY N, JOANNA M C, EDIT B, et al. Nitric oxide production of T lymphocytes is increased in rheumatoid arthritis[J]. Immunology Letters, 2008, 118(1): 55-58. DOI:10.1016/j.imlet.2008.02.009.
[23] 马玉芳, 郑乃珍, 郑小香, 等. 金线莲多糖对小鼠脾淋巴细胞体外分泌NO的影响[J]. 中国兽医学报, 2017, 37(2): 287-290. DOI:10.16303/j.cnki.1005-4545.2017.02.17.
[24] 刘鹭, 潘道东, 曾小群, 等. 硒化乳酸菌胞外多糖对体外培养小鼠脾淋巴细胞分泌NO、IL-4及IL-12的影响[J]. 中国食品学报, 2014,14(3): 17-21.
[25] KUTTY R K, SAMUEL W, BOYCE K, et al. Proinflammatory cytokines decrease the expression of genes critical for RPE function[J].Molecular Vision, 2016, 22: 1156-1168.
[26] WANG W S, XU L, BRANDSMA J H, et al. Convergent transcription of interferon-stimulated genes by TNF-α and IFN-α augments antiviral activity against HCV and HEV[J]. Scientif i c Reports, 2016, 6(2): 1-14.DOI:10.1038/srep25482.
[27] 夏伦斌, 王新华, 连宏军, 等. γ干扰素及其在动物疾病防控中的应用[J]. 动物医学进展, 2007, 28(5): 74-78. DOI:10.3969/j.issn.1007-5038.2007.05.021.
[28] 李学钊. 山羊白细胞介素-1β与白细胞介素-6的克隆表达及生物学活性研究[D]. 南京: 南京农业大学, 2010: 11-16. DOI:10.7666/d.Y1764649.
[29] DE C M, D’ELIOS M M, ZANCUOGHI G, et al. Human Th1 and Th2 cells: functional properties, regulation of development and role in autoimmunity[J]. Autoimmunity, 1994, 18(4): 301-308.DOI:10.3109/08916939409009532.
[30] MISHRA K P, GANJU L, CHANDA S, et al. Aqueous extract of Rhodiola imbricata rhizome stimulates Toll-like receptor 4,granzyme-B and Th1 cytokines in vitro[J]. Immunobiology, 2009,214(1): 27-31. DOI:10.1016/j.imbio.2008.04.001.
[31] 何广胜, 周玲, 吴德沛. Th1和Th2细胞的分化调节机制[J]. 中华血液学杂志, 2005, 26(2): 125-128. DOI:10.3760/j:issn:0253-2727.2005.02.021.
Antioxidant and Immunoenhancing Activity of Polysaccharide from Artocarpus heterophyllus Lam. on Spleen Lymphocytes
ZHU Kexue1, WANG Yingqian1,2, ZHANG Yanjun1, HE Shuzhen1, XU Fei1, WU Gang1, TAN Lehe1,*
(1. Spice and Beverage Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wanning 571533, China;2. College of Engineering, Heilongjiang Bayi Agricultural University, Daqing 163319, China)
Abstract:The antioxidant and immunomodulatory effects of water-soluble polysaccharide from jackfruit (Artocarpus heterophyllus Lam.) pulp (JFP-Ps) were investigated. The effect of JFP-Ps on the proliferation of normal mouse spleen lymphocytes, antioxidant capacity (total antioxidant capacity (T-AOC), and glutathione peroxidase (GSH-Px), superoxide dismutase (SOD) and catalase (CAT) activity) and malonic dialdehyde (MDA) contents, as well as the secretion of tumor necrosis factor-α (TNF-α), interferon-γ (IFN-γ) and interleukin-1β (IL-1β) were detected by culturing mouse spleen lymphocytes in vitro in the presence of different concentrations of JFP-Ps. The results showed that JFP-Ps at 80 and 160 μg/mL signif i cantly (P < 0.05) increased lymphocyte proliferation, and it at 40 μg/mL and above enhanced T-AOC,GSH-Px, SOD and CAT activities and reduced MDA content. Moreover, JFP-Ps at 40, 80 and 160 μg/mL significantly increased the secretion of TNF-α, IFN-γ and IL-1β in spleen lymphocytes (P < 0.05). These results indicate that JFP-Ps exerts immunomodulatory ef f ect likely by inducing lymphocyte proliferation, enhancing antioxidant activity and increasing the secretion of TNF-α, IFN-γ and IL-1β.
Key words:polysaccharide from jackfruit (Artocarpus heterophyllus Lam.); spleen lymphocyte; antioxidant activity;cytokines; immune modulation
DOI:10.7506/spkx1002-6630-201723033
中图分类号:Q946.3;R392.1
文献标志码:A
文章编号:1002-6630(2017)23-0207-06
引文格式:
朱科学, 王颖倩, 张彦军, 等. 菠萝蜜多糖对脾淋巴细胞抗氧化作用及免疫功能的影响[J]. 食品科学, 2017, 38(23): 207-212.
DOI:10.7506/spkx1002-6630-201723033. http://www.spkx.net.cn
收稿日期:2017-04-12
基金项目:海南省自然科学基金面上项目(317270);南昌大学食品科学与技术国家重点实验室开放基金项目(SKLF-KF-201602)
作者简介:朱科学(1986—),男,助理研究员,博士,研究方向为功能性食品。E-mail:zhukexue163@163.com
*通信作者:谭乐和(1969—),男,研究员,本科,研究方向为热带作物的科研与工程化开发。E-mail:tlh3687@163.com
ZHU Kexue, WANG Yingqian, ZHANG Yanjun, et al. Antioxidant and immunoenhancing activity of polysaccharide from Artocarpus heterophyllus Lam. on spleen lymphocytes[J]. Food Science, 2017, 38(23): 207-212. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723033. http://www.spkx.net.cn