岳晓禹1,陈威风1,邹 健1,李 欣1,杨 娜1,许文涛2
(1.河南牧业经济学院食品工程学院,河南 郑州 450046;2.中国农业大学食品科学与营养工程学院,北京 100083)
摘 要:以储藏玉米中霉菌为研究对象,用修正的Gompertz方程拟合腐败霉菌分别在不同储藏温度、不同时间条件下的生长动力学模型,采用修正的线性Arrhenius-Davey方程建立二级模型,模拟温度对玉米中霉菌生长的比生长速率和迟滞期的影响。对构建模型的有效性分别进行了验证,模型的R2较高,分别为0.959和0.994,偏离因子分别为0.951和0.927,精确因子都小于1.082,均方差值(0.009~0.027)也较小。表明所构建的线性Arrhenius-Davey模型能较好地描述、预测不同温度对玉米中霉菌的比生长速率和迟滞期的影响。
关键词:玉米;霉菌;生长动力学模型;验证
玉米作为主要的粮食作物,其储藏安全影响着国计民生,但是玉米在储藏过程中容易受环境的影响,储藏不当会发生霉变、虫、鼠危害等现象。因此,如何保证玉米储藏安全是全世界人民关注的热点。水分、温度以及霉菌的种类、数量是影响储藏玉米安全的3 个重要因素[1-2]。玉米在常规储藏条件下的水分活度较低,微生物的活动基本处于抑制状态[3]。当粮堆的温度和水分活度适合微生物生长时,微生物会迅速繁殖[4-5]。一旦外界因素变化或者粮堆内部温差产生湿热转移等,均可能出现局部粮食的水分活度增高现象,导致灰绿曲霉(Aspergillusgloucus)、白曲霉(A. candidus)等霉菌生长,有可能使储粮在短期内发生霉腐变质现象,甚至分泌毒素[6-7],其中最常见的毒素类型有黄曲霉毒素、赭曲霉毒素、呕吐毒素、玉米赤霉烯酮和伏马毒素等[8-12],一旦玉米或饲料被这些产毒霉菌污染,将造成严重经济损失,甚至危及人畜安全[13-15]。因此玉米中霉菌的种群状况能基本反映储粮的安全状况[16-17]。
采用微生物预测模型可预测不同环境下食物中微生物的变化情况,防止食物在加工﹑储藏、流通和消费过程中由微生物导致的食品安全问题发生。近年来,针对储藏食物微生物生长动力学模型的研究越来越多[18-22]。Peromingo等[23]研究了温度和水分活度对黄曲霉毒素产生的影响并构建了其生长模型,结果发现在温度25 ℃和水分活度0.95情况下,最适宜黄曲霉毒素的产生。Somjaipeng等[24]研究环境因素(温度和水分活度)对分离自储藏水稻中的真菌和曲霉菌生长速率的影响,并构建了生长模型,结果显示两种影响因素均对真菌和曲霉菌的生长有很大影响,其最佳生长条件均为:温度30 ℃、水分活度0.95。Marin等[25]利用修正的Gompertz模型,在玉米提取液培养基上,研究模拟了水分活度和温度对一些曲霉菌种的迟滞期和代时的影响。Sautour等[26]利用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,对几种霉菌的生长和水分活度之间的关系进行了模型模拟研究,评估了其最低水分活度、最适水分活度和最大水分活度。Pitt[27]整理了一些文献数据,提出了一个有关环境条件影响霉菌生长和毒素产生的模型,对于毒素产生最适温度的变化提供了一种理论解释。岳晓禹等[28]研究了主要生态因子对储藏玉米中黄曲霉生长影响的模拟,构建的二次多项式预测模型可以很好地预测水分活度和温度对黄曲霉生长的比生长速率和迟滞期的组合影响,得出的方程可以用于预测储藏玉米中黄曲霉生长情况。
本实验以粮库储藏玉米中原始霉菌为研究对象,研究不同温度条件下储藏玉米中的霉菌生长情况,进而运用预测微生物学方法,用修正的Gompertz方程和修正的线性Arrhenius-Davey模型,分别构建了对应的初级模型和二级特定储藏玉米中霉菌生长模型,模拟温度对储藏玉米中霉菌生长的影响,为我国储粮领域研究提供一些借鉴和思路,也是粮食储藏可持续性发展的方向。
1.1 材料与试剂
储藏玉米取自河南某粮库,置于冰箱内冷藏备用。抗菌素、PDA培养基(附加抗菌素) 北京陆桥技术股份有限公司。
1.2 仪器与设备
BHC-1100ⅢA/B2超净工作台 哈尔滨东联电子设备有限公司;HVA-85高压灭菌锅 上海精密仪器有限公司;DHG-9031恒温培养箱 上海精宏仪器试验设备有限公司;MA150型红外线水分分析仪、BS21S电子天平 德国Sartorius公司;HBD5ms2100 SMS水分活度仪 北京市北斗星工业化学研究所。
1.3 方法
1.3.1 玉米培养基的配制
玉米培养基:本实验玉米培养基采用的水分活度分别为0.97、0.91、0.85、0.81。具体制备方法如下:每平皿平铺一层玉米,然后于121 ℃下灭菌20 min。取不同量的无菌水加入上述平皿中,然后将其于4 ℃下放置2 d(期间每隔8 h摇动1 次),以便充分吸湿后达到平衡水分含量。然后再于对应下一步实验温度以及不同饱和盐溶液中放置5 d,以达到相应培养温度和相似水分活度。最终的水分活度通过水分活度仪来确定。
1.3.2 霉菌的生长实验
干燥器(直径120 mm)下部有饱和盐溶液,以形成水分活度所需要的相对湿度环境[29-30]。取上述制备好的不同水分活度的玉米培养基平皿,将平皿置于干燥器内,每个干燥器内放置2 个含样品的平皿,然后分别于20、25、30、35 ℃条件下储藏,按GB 4789.15—2010《食品微生物学检验 霉菌和酵母计数》方法[31],测定其不同生长环境、不同生长时间(3、5、7、9、11、13、15、17 d)条件下的霉菌总数(CFU/g)。灭菌玉米样品为对照组。
1.4 数据处理
运用SPSS 16.0软件对数据进行分析,选取适当模型进行拟合和回归处理。使用Excel 2003、Origin 7.5以及Matlab 6.5软件进行相关计算与绘图。
1.4.1 初级模型模拟
分别将在25、30、35 ℃储藏不同时间得到的玉米中霉菌的实验数据,用修正的Gompertz方程描述不同温度条件下霉菌的生长状态[32],如式(1)所示。
式中:A为ln(Nmax/N0);μmax为最大比生长速率/(CFU/(g·d));λ为霉菌生长延滞期/d;N0为霉菌初始数量/(CFU/g);Nmax为最大霉菌数量/(CFU/g)(霉菌稳定期数量);t为储藏时间/d;Nt为储藏时间t时的微生物数量/(CFU/g)。
1.4.2 二级模型模拟
用不同储藏温度作为函数,用修正的线性Arrhenius-Davey模型[33]来模拟储藏温度对菌落生长速率(μ)和迟滞期(λ)的影响,其计算公式如式(2)所示。
式中:B为μ或1/λ;T为储藏温度/℃;C0、C1、C2为系数。
最适温度(Topt/℃)下,比生长速率最快,相应的迟滞期最短。最适温度可以从方程(2)的系数推算出来,如式(3)所示。
方程(2)的模型拟合优度由判定系数R2来确定。
1.4.3 模型的验证和评价
用同样的实验方法,通过重复实验,取得23、33 ℃储藏温度实验条件下检测得到的微生物生长数值,与建立的特定玉米中霉菌的生长动力学模型求得23、33 ℃储藏时的预测值进行比较计算,进行模型有效性和可靠性的验证。
F值可以计算后查F值表来比较。均方差(mean square error,MSE)是基于因变量的预测值和观测值之间的残差变化性的一个值[34],MSE值越小说明模型的精度越好。用偏差因子和精确因子来评价已经建立的特定玉米中霉菌的预测模型的可靠性[35-37]。具体计算公式如(4)~(7)所示。
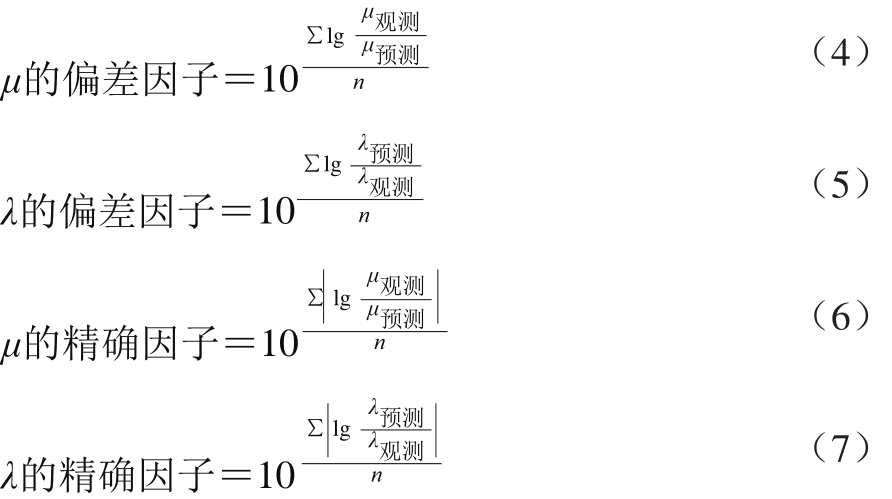
偏差因子用来检查预测值上下波动的幅度。精确因子用来说明预测值与观测值之间的接近程度。精确因子越大,则说明平均估值的精确性越低,意味着预测越不正确。
2.1 一级模型的构建

图1 玉米中霉菌在不同储藏温度下的Gompertz生长动力学模型
Fig. 1 Growth kinetic curves of molds in corn at different storage temperatures fi tted with modif i ed Gompertz equation
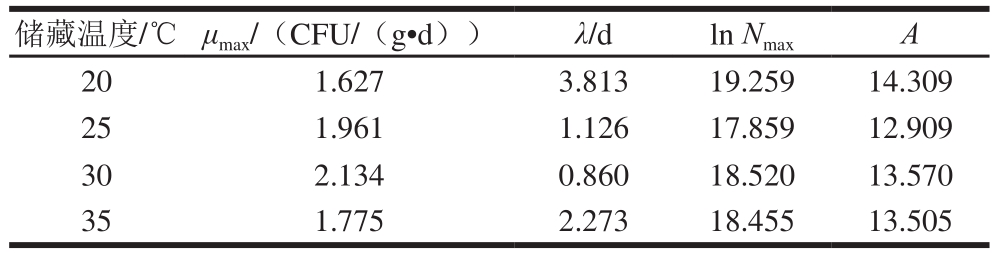
由图1和表1可以看出,20 ℃下,玉米中霉菌生长的迟滞期最长,其比生长速率最小,而30 ℃下的玉米中霉菌生长的迟滞期最短,其比生长速率最大。不同条件下的测量值均与对应模型曲线较好拟合,说明该模型能很好地拟合本实验条件下玉米中霉菌的生长数量曲线。
比生长速率和延滞期是描述特定微生物生长快慢的主要指标,也是影响微生物对储藏粮食质量的主要关注点。由表1可以看出,随着储藏温度的升高,玉米中霉菌的生长数量同比变大,其最大比生长速率μmax总体逐渐升高,延滞期λ总体逐渐降低。相同温度下,随着储藏时间的延长,玉米中霉菌的生长数量逐渐增加。其中在30 ℃下,玉米中霉菌生长最快,其最大比生长速率也最大,为2.134 CFU/(g·d),迟滞期则最短,为0.860 d。此结果证明温度、水分活度的变化都会对其产生影响,这也是影响储藏粮食品质和储藏时间长短的主要原因。
表1 不同储藏温度下玉米中霉菌最大比生长速率、延滞期和最大霉菌数量的Gompertz模型拟合数据
Table 1 Fitting parameters μmax, λ and Nmaxat different storage temperatures of modif i ed Gompertz model
将表1中的拟合数据带入对应动力学模型,即可得出不同温度、不同水分活度下的生长动力学模型。不同储藏条件下玉米中黄曲霉的生长动力学模型参见表2。结果表明,利用Gompertz模型拟合黄曲霉生长曲线的判定系数R2很高,在0.993~0.998之间。
表2 不同储藏温度下玉米中霉菌的生长动力学模型
Table 2 Kinetic models for the growth of mold in corn at different storage temperatures

2.2 二级模型的构建
通过利用Gompertz方程函数拟合实验所得的生长数据,推算出不同条件下菌落的最大比生长速率和迟滞期。利用方程(2),使用温度的一个函数模拟了这些推算出的生长动力学模型的参数。图2、3是描述温度对菌落比生长速率和迟滞期影响的线性Arrhenius-Davey模型图。表3、4中列出了Arrhenius-Davey模型(利用温度的一个函数描述μ或者λ)的系数值和它们的标准误差、95%置信区间、模型相关系数R2。
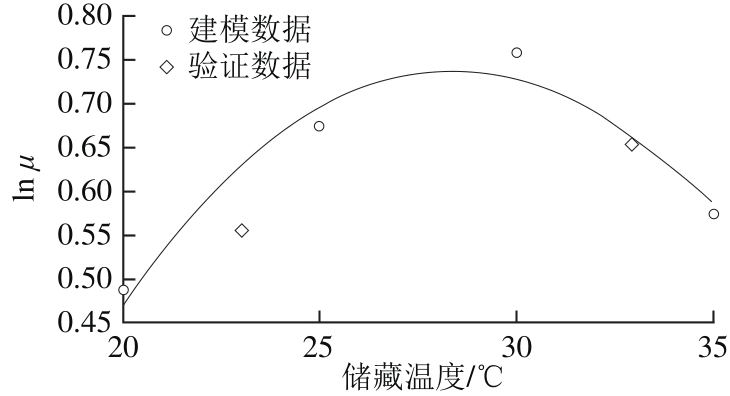
图2 储藏温度与比生长速率关系的Arrhenius-Davey模型
Fig. 2 Plot of linear Arrhenius-Davey model describing the effect of storage temperature on specif i c growth rate

图3 储藏温度与迟滞期关系的Arrhenius-Davey模型
Fig. 3 Plot of linear Arrhenius-Davey model describing the effect of storage temperature on lag phase duration
从图2、3中可以看出,该实验条件下玉米中的霉菌,在20~35 ℃范围内,其菌落比生长速率和迟滞期与温度都呈现较好的线性关系,而且随着温度的增加,霉菌比生长速率也增加,而迟滞期则变短,并且显示出在30 ℃左右时有最适生长温度。
表3 玉米中霉菌Arrhenius-Davey比生长速率及迟滞期模型的系数
Table 3 Coef fi cients of linear Arrhenius-Davey models for the growth rate and lag phase of mold in corn

从表3可以看出,R2值较高(0.959和0.994),证明修正的线性Arrhenius-Davey模型能较好地描述温度对比生长速率和迟滞期的影响。在30 ℃左右时,玉米中霉菌的比生长速率最快且迟滞期最短。利用方程(3)推算出的玉米中霉菌的最适温度(比生长速率最快或者迟滞期最短)在28.11~28.36 ℃之间。根据Arrhenius-Davey模型(式(2)),代入表3中系数C0、C1、C2,得到不同水分活度下比生长速率(μ)和迟滞期(λ)随温度变化的关系,分别如式(8)和(9)所示。
方程(8)、(9)可用于考察储藏玉米中霉菌的生长情况,预测不同温度条件下玉米中霉菌的生长值,从而为研究分析储藏玉米品质与储藏时间提供参考。
2.3 模型验证
在同样的实验条件下重复实验,获得23、33 ℃下玉米中霉菌的生长数据,获得其比生长速率和迟滞期观测值,运用上述构建的修正的线性Arrhenius-Davey模型取得其对应的预测值,进行模型的验证。
表4 描述不同储藏温度对玉米中霉菌生长影响的Arrhenius-Davey模型的验证指标
Table 4 Validation of the linear Arrhenius-Davey model describing the effect of storage temperature on the growth of mold in corn

表4列出了统计学上的指标,用来评价和确定描述温度对菌落比生长速率和迟滞期影响的修正的线性Arrhenius-Davey模型的能力。从表中给出的结果可以观察到,在本研究实验条件下,预测温度对玉米中霉菌的比生长速率的影响的修正的线性Arrhenius-Davey模型的偏差因子为0.951,精确因子为1.052,并且其F分布概率小于0.05,其MSE值较小为0.009,这些说明修正的线性Arrhenius-Davey模型能较好地预测温度对玉米中霉菌的比生长速率的影响。预测温度对玉米中霉菌的迟滞期的影响的修正的线性Arrhenius-Davey模型的偏差因子为0.927,精确因子为1.082,并且其F分布概率也小于0.05,其MSE值也较小,为0.027,这些也说明修正的线性Arrhenius-Davey模型能较好地预测温度对玉米中霉菌的迟滞期的影响。同样的结果也可以在图2、3中得出,其相应数据点均在对应模型图附近。综合分析以上数据分析结果,证明了Arrhenius-Davey模型能较好地描述、预测不同温度对玉米中霉菌的比生长速率和迟滞期的影响。其他有关模型构建的一些类似报道[34-38]中,也用偏差因子、精确因子等指标进行了模型的验证,其验证方法、结果判定与本研究相一致。其中本研究构建模型的MSE值比文献[34]中的小,与文献[35]中的MSE值、偏差因子和精确因子互有大小,精确因子比文献[38]中的更接近1。
通过不同温度(20、25、30、35 ℃)下,对储藏玉米中霉菌生长数量的影响的研究,可以看出随着温度的不同,储藏玉米中霉菌的生长数量随之发生变化,其中在30 ℃下,霉菌生长最为旺盛,增长最快。运用Gompertz方程对不同温度下储藏玉米中霉菌的生长数据进行了拟合,并分别构建了不同温度下的预测生长动力学模型。模型的判定系数R2均较高,在0.993~0.998之间,结合绘图结果也可以看出各温度下的模型与测量值拟合得较好。拟合的模型得到了储藏玉米中霉菌在各温度下的最大比生长速率和迟滞期。
在得到的初级模型基础上,用描述温度对玉米中霉菌生长的比生长速率和迟滞期的影响的修正的线性Arrhenius-Davey 模型,分别构建得到了描述温度对比生长速率和迟滞期的影响的模型,模型的R2较高,分别为0.959和0.994。得到了玉米中霉菌生长的最适温度,在28.11~28.36 ℃之间。
运用同样实验条件获得的23 ℃和33 ℃下玉米霉菌的生长数据,对构建的描述温度对比生长速率和迟滞期的影响的模型有效性和可靠性进行了验证。预测温度对玉米中霉菌的比生长速率的影响的修正的线性Arrhenius-Davey模型的偏离因子为0.951,精确因子为1.052,并且其F分布概率小于0.05,其MSE值也较小,为0.009。预测温度对玉米中霉菌的迟滞期的影响的修正的线性Arrhenius-Davey模型的偏离因子为0.927,精确因子为1.082,并且其F分布概率也小于0.05,其MSE值也较小,为0.027。这些都可以看出,在本研究条件下,构建的线性Arrhenius-Davey模型能较好地描述、预测不同温度对玉米中霉菌的比生长速率和迟滞期的影响。建立的动力学模型有助于快速地了解霉菌的生长特性,为储藏玉米品质的评估和储粮储藏期的预测打下基础,有利于以此为依据优化储粮方法和手段等。对实现“绿色储粮”、“生态储粮”,加强粮食储藏的安全具有理论和应用价值。
参考文献:
[1] PESSU P O, AGODA S, ISONG I U, et al. Fungi and mycotoxins in stored foods[J]. African Journal of Microbiology Research, 2011,5(25): 4373-4382. DOI:10.5897/AJMR11.487.
[2] SULEIMAN R A, ROSENTRATER K A, BERN C J. Effects of deterioration parameters on storage of maize: a review[J].Reviews Journal Natural Sciences Research, 2013, 3(9): 147-165.DOI:10.13031/aim.20131593351.
[3] CASTRO M F P M, BRAGAGNOLO N, VALENTINI S R T. The relationship between fungi growth and aflatoxin production with ergosterol content of corn grains[J]. Brazilian Journal of Microbiology,2002, 33(1): 22-26. DOI:10.1590/S1517-83822002000100004.
[4] ASTORECA A, VAAMONDE G, DALCERO A, et al. Modelling the effect of temperature and water activity of Aspergillus fl avus isolates from corn[J]. International Journal of Food Microbiology, 2012,156(1): 60-67. DOI:10.1016/j.ijfoodmicro.2012.03.002.
[5] BORREANI G, TABACCO E. The relationship of silage temperature with the microbiological status of the face of corn silage bunkers[J].Journal of Dairy Science, 2010, 93(6): 2620-2629. DOI:10.3168/jds.2009-2919.
[6] CHULZE S N. Strategies to reduce mycotoxin levels in maize during storage: a review[J]. Food Additives and Contaminants, 2010, 27(5):651-657. DOI:10.1080/19440040903573032.
[7] LEVASSEUR-GARCIA C. Infrared spectroscopy applied to identif i cation and detection of microorganisms and their metabolites on cereals (corn, wheat, and barley)[M]. Vienna: INTECH Open Access Publisher, 2012: 185-196. DOI:10.5772/34762.
[8] ZHOU G H, CHEN Y J, KONG Q, et al. Detoxif i cation of af l atoxin B1 by Zygosaccharomyces rouxii with solid state fermentation in peanut meal[J]. Toxins, 2017, 9(1): 42-51. DOI:10.3390/TOXINS9010042.
[9] SALATI S, DIMPORZANO G, PANSERI S, et al. Degradation of aflatoxin B1 during anaerobic digestion and its effect on process stability[J]. International Biodeterioration and Biodegradation, 2014,94: 19-23. DOI:10.1016/j.ibiod.2014.06.011.
[10] MARIÑO-REPIZO L, GARGANTINI R, MANZANO H, et al.Assessment of ochratoxin A occurrence in Argentine red wines using a novel sensitive quechers-solid phase extraction approach prior to ultra high performance liquid chromatography-tandem mass spectrometry methodology[J]. Journal of the Science of Food and Agriculture, 2016,97(8): 2487-2497. DOI:10.1002/jsfa.8065.
[11] 程传民, 柏凡, 李云, 等. 2013年玉米赤霉烯酮在饲料原料中的污染分布规律[J]. 中国畜牧杂志, 2014, 50(16): 68-72; 77. DOI:10.3969/J.ISSN.0258-7033.2014.16.014.
[12] 郭聪聪, 朱维芳, 付萌, 等. 甘肃省玉米籽粒中镰孢菌分离频率及伏马毒素含量监测[J]. 植物保护学报, 2015, 42(6): 942-948.DOI:10.13802/J.CNKI.ZWBHXB.2015.06.012.
[13] 岳晓禹, 张恒业, 辛婷, 等. 储粮预测微生物模型的研究进展[J]. 中国粮油学报, 2012, 27(5): 118-123. DOI:10.3969/j.issn.1003-0174.2012.05.024.
[14] 石岩, 翁善钢. 霉菌毒素的预防对策[J]. 河南畜牧兽医(综合版),2016, 37(9): 39-40. DOI:10.3969/J.ISSN.1004-5090.2016.09.019.
[15] 常敬华, 何志明, 戴四基, 等. 脱氧雪腐镰刀菌烯醇在食品加工中的变化研究进展[J]. 食品与发酵工业, 2016, 42(5): 283-288.
[16] FIRRAO G, TORELLI E, GOBBI E, et al. Prediction of milled maize fumonisin contamination by multispectral image analysis[J]. Journal of Cereal Science, 2010, 52(2): 327-330. DOI:10.1016/j.jcs.2010.06.017.
[17] 胡元森, 陈静, 李翠香, 等. 几种储粮霉菌脱氢酶活性测定方法的建立[J]. 食品科学, 2012, 33(13): 207-211.
[18] 朱彦祺, 郭全友, 李保国, 等. 不同温度下腐败希瓦氏菌(Shewanela putrefaciens)生长动力学模型的比较与评价[J]. 食品科学, 2016,37(13): 147-152. DOI:10.7506/spkx1002-6630-201613026.
[19] YOGENDRARAJAH P, VERMEULEN A, JACXSENS L, et al.Mycotoxin production and predictive modelling kinetics on the growth of Aspergillus flavus and Aspergillus parasiticus isolates in whole black peppercorns (Piper nigrum L.)[J]. International Journal of Food Microbiology, 2016, 228: 44-57. DOI:10.1016/j.ijfoodmicro.2016.03.015.
[20] LEE S, YOON Y, KIM D M, et al. Mathematical models to predict kinetic behavior and aflatoxin production of Aspergillus flavus under various temperature and water activity conditions[J]. Food Science and Biotechnology, 2014, 23(3): 975-982. DOI:10.1007/s10068-014-0132-2.
[21] CARLOSE K, NELLY R, EMMA M, et al. Description of Aspergillus fl avus growth under the inf l uence of different factors (water activity,incubation temperature, protein and fat concentration, pH, and cinnamon essential oil concentration) by kinetic, probability of growth, and time-to-detection models[J]. International Journal of Food Microbiology, 2017, 240: 115-123. DOI:10.1016/j.ijfoodmicro.2016.04.024.
[22] LAILA A, ANTONIO J R, VICENTE S. An attempt to model the probability of growth and aflatoxin B1 production of Aspergillus flavus under non-isothermal conditions in pistachio nuts[J]. Food Microbiology, 2015, 51: 117-129. DOI:10.1016/j.fm.2015.05.013.
[23] PEROMINGO B, RODRÍGUEZ A, BERNÁLDEZ V, et al. Effect of temperature and water activity on growth and af l atoxin production by Aspergillus flavus and Aspergillus parasiticus on cured meat model systems[J]. Meat Science, 2016, 122: 76-83. DOI:10.1016/j.meatsci.2016.07.024.
[24] SOMJAIPENG S, TA-UEA P. Evaluation of the effect of water activity and temperature on lag phase and growth rate of af l atoxigenic Aspergillus section Flavi strains isolated from stored rice grain[J].Agriculture and Agricultural Science Procedia, 2016, 11: 38-45.DOI:10.1016/j.aaspro.2016.12.007.
[25] MARIN S, SANCHIS V, SÁENZ R, et al. Ecological determinants for germination and growth of some Aspergillus and Penicillium spp. from maize grain[J]. Journal of Applied Microbiology, 1998, 84(1): 25-36.DOI:10.1046/j.1365-2672.1997.00297.x.
[26] SAUTOUR M, DANTIGNY P, DIVIES C, et al. A temperature-type model for describing the relationship between fungal growth and water activity[J]. International Journal of Food Microbiology, 2001, 67(1):63-69. DOI:10.1016/S0168-1605(01)00471-8.
[27] PITT R E. A descriptive model of mold growth and af l atoxin formation as affected by environmental conditions[J]. Journal of Food Protection,1993, 56(2): 139-146. DOI:10.4315/0362-028X-56.2.139.
[28] 岳晓禹, 李自刚, 郝修振, 等. 主要生态因子对储藏玉米中黄曲霉生长影响的模拟[J]. 农业工程学报, 2013, 29(18): 269-276.DOI:10.3969/j.issn.1002-6819.2013.18.032.
[29] GREENSPAN L. Humidity fi xed points of binary saturated aqueous solutions[J]. Journal of Research of the National Bureau of Standards,1977, 81A(1): 89-96. DOI:10.6028/jres.081A.011.
[30] 国家技术监督局. 船舶货舱温湿度仪技术要求及试验方法: GB/T 15309—1994[S]. 北京: 中国标准出版社, 1994: 1-6.
[31] 卫生部. 食品微生物学检验 霉菌和酵母计数: GB 4789.15—2010[S]. 北京: 中国标准出版社, 2010: 1-5.
[32] ZWIETERING M H, ROMBOUTS F M, VAN’T RIET K.Comparison of def i nitions of the lag phase and the exponential phase in bacterial growth[J]. Journal of Applied Bacteriology, 1992, 72(2):139-145. DOI:10.1111/j.1365-2672.1992.tb01815.x
[33] DAVEY K R. A predictive model for combined temperature and water activity on microbial growth during the growth phase[J]. Journal of Application Bacteriology, 1989, 67(5): 483-488. DOI:10.1111/j.1365-2672.1989.tb02519.x
[34] SUTHERLAND J P, BAYLISS A J, BRAXTON D S. Predictive modelling of growth of Escherichia coli O157:H7: the effects of temperature, pH and sodium chloride[J]. International Journal of Food Microbiology, 1995, 25: 29-49. DOI:10.1016/0168-1605(94)00082-H.
[35] TE GIFFEL M C, ZWIETERING M H. Validation of predictive models describing the growth of Listeria monocytogenes[J].International Journal of Food Microbiology, 1999, 46(2): 135-149.DOI:10.1016/S0168-1605 (98)00189-5.
[36] LIAO H M, KONG X Z, ZHANG Z Y, et al. Modeling the inactivation of Salmonella typhimurium by dense phase carbon dioxide in carrot juice[J]. Food Microbiology, 2010, 27(1): 94-100. DOI:10.1016/j.fm.2009.09.012.
[37] ROSS T. Indices for performance evaluation of predictive models in food microbiology[J]. Journal of Applied Microbiology, 1996, 81(5):501-508. DOI:10.1111/j.1365-2672.1996.tb03539.x.
[38] SAMAPUNDOA S, DEVLIEGHEREA F, DE MEULENAERA B,et al. Predictive modelling of the individual and combined effect of water activity and temperature on the radial growth of Fusarium verticilliodes and F. proliferatum on corn[J]. International Journal of Food Microbiology, 2005, 105(1): 35-52. DOI:10.1016/j.ijfoodmicro.2005.06.007.
Kinetic Modeling of the Effect of Storage Temperature on the Growth of Mold in Corn
YUE Xiaoyu1, CHEN Weifeng1, ZOU Jian1, LI Xin1, YANG Na1, XU Wentao2
(1. College of Food Engineering, Henan University of Animal Husbandry and Economy, Zhengzhou 450046, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract:The modif i ed Gompertz equation was applied to fi t a kinetic model for mold growth in corn stored at different temperatures. Further, a second-order model using the modified linear Arrhenius-Davey equation was established to describe the inf l uence of temperature on the specif i c growth rate and lag phase of molds in corn. The model was validated by additional experimental data. The results showed that the model had a high coeff i cient of determination (R2), of 0.959 and 0.994 for specif i c growth rate and lag phase, respectively. The obtained bias factors of the model were 0.951 and 0.927,respectively, and its accuracy factors were less than 1.082. Furthermore, its mean square errors (MSEs) (0.009–0.027) were low. The current study proved that the Arrhenius-Davey model can better describe and predict the influence of storage temperature on the growth rate and lag phase of molds in corn.
Key words:corn; mold; growth kinetic model; validation
DOI:10.7506/spkx1002-6630-201723037
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)23-0231-06
引文格式:
岳晓禹, 陈威风, 邹健, 等. 温度对储藏玉米中霉菌生长影响的动力学模型构建[J]. 食品科学, 2017, 38(23): 231-236.
DOI:10.7506/spkx1002-6630-201723037. http://www.spkx.net.cn
YUE Xiaoyu, CHEN Weifeng, ZOU Jian, et al. Kinetic modeling of the effect of storage temperature on the growth of mold in corn[J]. Food Science, 2017, 38(23): 231-236. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723037. http://www.spkx.net.cn
收稿日期:2017-05-21
基金项目:国家自然科学基金联合基金项目(U1404332);河南省科技创新人才支持计划项目(16HASTIT017);河南牧业经济学院校科技创新团队项目(HUAHE2015015)
作者简介:岳晓禹(1974—),男,副教授,博士,研究方向为食品安全。E-mail:yuerain@163.com