
图1 茶树中L-茶氨酸的生物合成[24]
Fig. 1 Biosynthesis of L-theanine in the tea plant[24]
李 元,刘 珊,祝 俊*
(中国科学院天津工业生物技术研究所,天津 300308)
摘 要:L-茶氨酸是茶叶中的特征氨基酸,具有改善食品风味、放松减压、增强抗肿瘤药物疗效等多种功能。本文介绍了L-茶氨酸的生理功能及其在食品、保健品和医药领域中的应用,并重点对L-茶氨酸的酶法合成进行了综述,在此基础上探讨了工业化生产L-茶氨酸的未来可能的研究方向,以期为利用酶法实现L-茶氨酸的工业化生产提供参考依据。
关键词:茶叶;L-茶氨酸;生物合成;酶
L-茶氨酸(L-theanine)属于酰胺类化合物,分子式为C7H14N2O3,是茶叶中含量最丰富的游离氨基酸,占总游离氨基酸含量的50%以上。它是茶叶香味和口感的主要成分,因此它的含量多少对茶叶的风味和品质起到关键性的作用。大量研究结果表明L-茶氨酸具有多种重要的生理功能[1],因而被广泛应用于食品、保健品及医药行业中。
L-茶氨酸可从茶叶中提取分离[2-3],但其仅占茶叶干质量的1%~2%[4];另外,由于缺乏简便、特异和高效的分离方法,高纯度L-茶氨酸的提取分离通常涉及耗时、高成本和复杂的操作过程,不利于工业化生产。与此相反,化学法[5-6]合成L-茶氨酸具有方法简单、成本低、产率高等优点,但是合成的茶氨酸为L-和D-形式的外消旋混合物,通常被认为是“非天然”产物,其安全性评价亟待研究。
近年来,随着生物工程技术的发展,L-茶氨酸的生物合成[7-11]备受关注。目前应用于L-茶氨酸合成的生物酶主要有L-谷氨酰胺酶、γ-谷氨酰转肽酶(γ-glutamyltranspeptidase,GGT)、L-谷氨酰胺合成酶(L-glutamine synthetase,GS)、γ-谷氨酰甲胺合成酶(γ-glutamylmethylamide synthetase,GMAS)和γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)。本文结合本课题组的前期工作,参考近年来国内外有关文献对L-茶氨酸的生理功能及应用现状进行了概述,并着重综述了L-茶氨酸酶催化合成方法的研究进展,探讨了未来可能的研究方向和方法,以期为L-茶氨酸的研究开发和综合利用提供理论依据,并为其生物合成的工业化生产提供参考依据。
L-茶氨酸具有多种重要的生理功能,如:通过调节脑中神经传达物质的浓度降低血压[12];与抗肿瘤药物并用时,增强抗肿瘤药物的抗癌效果,并减少抗肿瘤药物的副作用[13];抑制短暂脑缺血引起的神经细胞死亡,对神经细胞有保护作用[14-15];影响脑中多巴胺等神经传达物质的代谢和释放,从而改善认知能力和提高学习能力[16]、放松减压并缓解焦虑[17];提高免疫力[18];减肥作用[19]等。
L-茶氨酸作为一种安全、集多种生理功能于一体的功能性活性因子,被广泛应用于食品、保健品和医药行业。在食品行业,由于具有优良的加工特性和稳定性,L-茶氨酸主要用作茶饮料、食品的风味改良剂和功能性食品的添加剂[20],如美国达拉斯VIB Holdings LLC公司生产的以L-茶氨酸为添加剂的安神饮料Vacation in a Bottle。在保健品行业,L-茶氨酸作为天然镇静剂、抗抑郁剂在国外市场上大受欢迎,日本、美国市场上已有多种不同品牌的茶氨酸保健产品[21],如美国保健品牌Doctor’s Best的L-茶氨酸胶囊;然而,在国内L-茶氨酸主要是销往国外,国内基本没有茶氨酸类的保健品上市。在医药行业,L-茶氨酸可开发为治疗肿瘤的辅助药物、降压药物或可用于安神镇静药物中等,目前日本已经把L-茶氨酸作为有效成分用于镇静剂中。近年来,L-茶氨酸生理功能和药理药效实验的研究表明其在保健品和医药领域中具有巨大的应用价值和广阔的开发前景。
在茶树中,L-茶氨酸合成酶(theanine synthetase,TS)在ATP供能的条件下,催化L-谷氨酸和乙胺合成L-茶氨酸[22],如图1所示。Sasaoka等[23]对TS的性质进行了研究,结果表明该酶为茶树特有的合成酶,对乙胺具有高亲合力,然而其非常不稳定并且难以分离,不适宜体外合成L-茶氨酸,因此限制了其在L-茶氨酸体外合成中的应用。

图1 茶树中L-茶氨酸的生物合成[24]
Fig. 1 Biosynthesis of L-theanine in the tea plant[24]
随着基因工程技术的深入开展,研究人员对酶促体外合成L-茶氨酸进行了不断地探索和技术创新。目前,用于L-茶氨酸体外合成的酶如图2所示,主要包括:1)以L-谷氨酰胺为底物、基于γ-谷氨酰转移反应的酶:L-谷氨酰胺酶和GGT;2)以L-谷氨酸为底物、需ATP供能的合成酶:GS、GMAS和γ-谷氨酰半胱氨酸合成酶γ-GCS。L-谷氨酰胺酶和GGT催化L-谷氨酰胺和乙胺合成L-茶氨酸;GS、GMAS和γ-GCS在ATP存在条件下催化L-谷氨酸和乙胺合成L-茶氨酸。

图2 酶催化合成L-茶氨酸
Fig. 2 Biosynthesis of L-theanine by various enzymes
3.1 L-谷氨酰胺酶催化L-茶氨酸合成
L-谷氨酰胺酶是一种酰胺基水解酶[25],催化L-谷氨酰胺的γ-酰胺键水解为L-谷氨酸和游离氨(图3A),在原核和真核生物中广泛分布。此外,一些L-谷氨酰胺酶还可催化L-谷氨酰胺的γ-谷氨酰基的转移反应,例如来自硝基还原假单胞菌Pseudomonas nitroreducens的L-谷氨酰胺酶[26],其可催化羟胺、甲胺和乙胺作为受体分子的转移反应,如图3B所示,其中当乙胺作为受体分子时形成L-茶氨酸。Tachiki[27]和Pu Hefang[28]等分别对天然形式的来自菌株P. nitroreducensIFO 12694的L-谷氨酰胺酶和重组形式的来自菌株P. nitroreducensDSM14399的L-谷氨酰胺酶进行了深入研究,其催化合成L-茶氨酸的反应条件如表1所示。

图3 L-谷氨酰胺酶催化的反应[25]
Fig. 3 Reactions catalyzed by L-glutaminase[25]
为了增强L-谷氨酰胺酶的稳定性和可复用性,Yokoyama等[29]使用介孔二氧化硅(mesoporous silica,MPS)作为固定化载体对菌株IFO 12694的L-谷氨酰胺酶进行了固定化,并通过用氧化锆表面修饰提高MPS在高pH值下的稳定性,从而改善固定化酶对于L-茶氨酸生产的可复用性。Itoh等[30]使用碳包覆MPS的孔表面也获得了类似的效果。此外,Matsuura等[31]开发了包含L-谷氨酰胺酶-MPS组合物的流动型微反应器,可用于连续合成L-茶氨酸。
表1 各种来源L-谷氨酰胺酶催化合成L-茶氨酸方法的比较
Table 1 Comparative analysis of the methods available for enzymatic synthesis of L-theanine using L-glutaminase from various sources
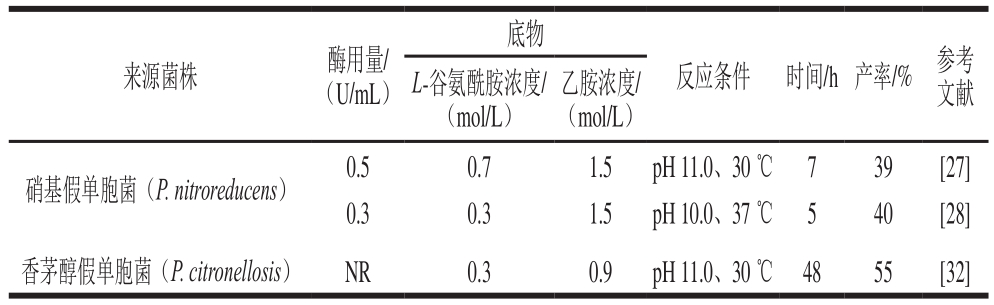
注:NR.未报道。下同。
除了P. nitroreducens外,来自香茅醇假单胞菌P. citronellosis GEA FERM BP-8353所衍生的L-谷氨酰胺酶也可合成L-茶氨酸[32]。该菌株为日本太阳化学株式会社研究人员从土壤中分离出的一种新细菌。使用P. citronellosis GEA的无细胞提取物合成L-茶氨酸时,在0.3 mol/L L-谷氨酰胺和0.9 mol/L乙胺时反应最佳,30 ℃、pH 11.0孵育48 h后,转化率达到约55%。
3.2 GGT催化L-茶氨酸合成

图 4 GGT催化的反应[33]
Fig. 4 Reactions catalyzed by GGT[33]
GGT催化γ-谷氨酰化合物的γ-谷氨酰基部分转移到其他氨基酸和短肽上[33](图4A),当水作为γ-谷氨酰基受体时,其催化γ-谷氨酰化合物的水解(图4B)。
GGT广泛存在于从细菌到哺乳动物的一系列生物体中。相比哺乳动物,细菌GGT具有更广泛的底物特异性,目前用于L-茶氨酸合成的GGT均来自于细菌。2002年,Suzuki等[34]首次发现来自大肠杆菌Escherichia coli K-12的GGT可催化γ-谷氨酰胺和乙胺生成L-茶氨酸,转化率为60%。随后研究者们对使用来自E. coli[35-39]、枯草芽孢杆菌Bacillus subtilis[40-43]和地衣芽孢杆菌B. licheniformis[44]的GGT催化合成L-茶氨酸进行了深入研究,如表2所示。
理论上,GGT催化合成L-茶氨酸可使用各种γ-谷氨酰基供体,其转肽活性随γ-谷氨酰基供体而变化。例如,来自B. licheniformis的GGT以L-谷氨酰胺作为γ-谷氨酰基供体时,相对活力是以GAME作为供体的4.4 倍[45];相反地,当使用GMAE代替L-谷氨酰胺作为供体时,来自E. coli K-12的GGT的相对活力增加1.2 倍[36]。当以GAME为γ-谷氨酰基供体时,使用含有GGT的E. coli全细胞催化L-茶氨酸合成转化率可达95%[36];使用固定化的含有GGT的E. coli全细胞催化L-茶氨酸合成,在使用6 次后,平均转化率可达87.2%[37]。2013年,Zhang Hongjuan等[39]报道了利用各种取代的γ-谷氨酰基苯胺为γ-谷氨酰基供体,使用来自E. coli的GGT催化合成L-茶氨酸。
与L-谷氨酰胺酶相似,通过GGT催化合成L-茶氨酸时,无需ATP参与;然而通常需要使用较高浓度的乙胺和优化反应pH值以抑制底物L-谷氨酰胺的水解和因自转肽作用形成γ-谷氨酰-谷氨酰胺副产物。为了减少通过GGT生物合成L-茶氨酸期间的底物水解和自转肽副反应,Wang Haoqi等[41]使用其中游离α-氨基和羧基被Zn封闭的L-谷氨酰胺-Zn(Ⅱ)络合物代替L-谷氨酰胺作为底物,其L-茶氨酸产率增加了16.9%。
表2 各种来源GGT催化合成L-茶氨酸方法的比较
Table 2 Comparative analysis of the methods available for enzymatic synthesis of L-theanine using GGT from various sources

注: GAME.谷氨酸γ-甲酯(L-glutamic acid γ-methyl ester);#.使用6 次后;γ-GpNA. L-γ-谷氨酰对硝基苯胺(L-γ-glutamyl-p-nitroanilide)。
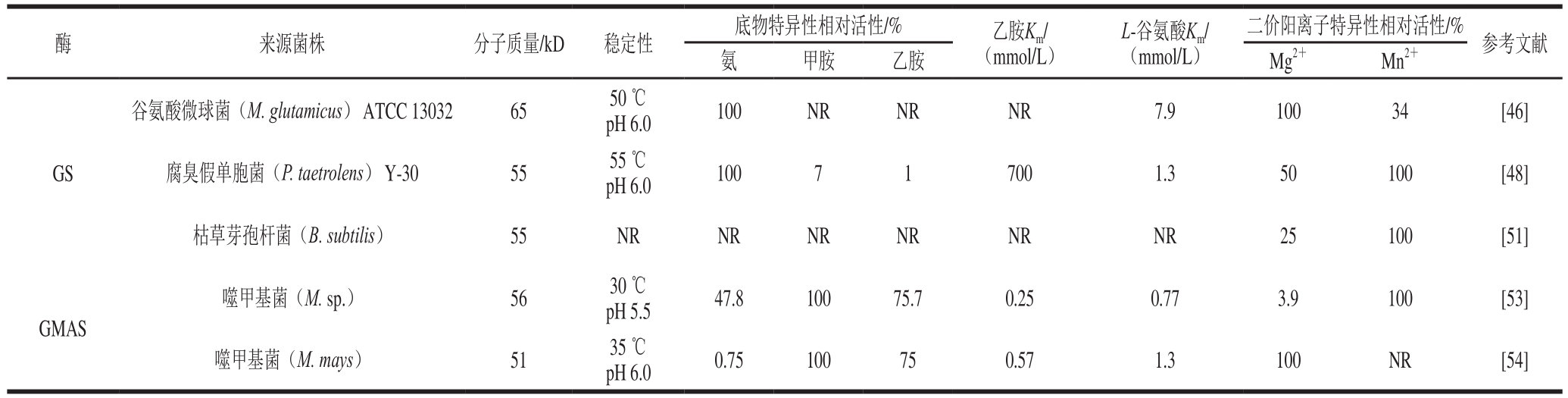
表3 各种来源GS和GMAS酶学性质的比较
Table 3 Comparative enzymatic characterization of GS and GMAS from various sources
3.3 GS催化L-茶氨酸合成
GS在ATP存在条件下,催化L-谷氨酸盐和游离氨转化为L-谷氨酰胺。Tachiki等[46-47]首次对来自谷氨酸微球菌Micrococcus glutamicus ATCC 13032的GS催化L-谷氨酸和乙胺合成L-茶氨酸进行了报道。随后,Yamamoto等[48]对来自腐臭假单胞菌Pseudomonas taetrolens Y-30菌株的GS进行了纯化及酶学性质研究,经表征其具有生产L-茶氨酸的能力;该来源编码GS的基因已在E. coli中成功表达,重组的GS显示与天然GS具有相同的性质,且该酶在表达系统中的生产能力比在原始细菌P. taetrolens Y-30中高约30 倍[49]。在GS催化L-茶氨酸合成时,需要ATP参与,因此该课题组将“偶联发酵与能量转移”的酵母糖酵解ATP再生系统应用于GS生物合成L-茶氨酸中,反应体系经过优化后,200 mmol/L L-谷氨酸可产生170 mmol/L L-茶氨酸[50]。此外,Zhou Xin等[51]研究表明来自B. subtilis的GS能在E. coli BL21(DE3)/pET28a-glnA细胞中作为可溶性蛋白高效表达(约占总蛋白的86%);在pH 7.5和Mn2+浓度为10 mmol/L条件下,重组GS具有最大的L-茶氨酸合成活力(6.4 U/mg)。
3.4 GMAS催化L-茶氨酸合成
GMAS在ATP供能的条件下催化L-谷氨酸和甲胺合成γ-谷氨酰甲胺(γ-glutamylmethylamide,γ-GMA);对于依赖甲胺作为单独的碳源和氮源的细菌,GMAS在甲胺代谢中间体γ-GMA的生物合成中发挥着重要作用[52]。相比GS,其对乙胺显示出更高的活性,各种来源的GMAS和GS酶学性质的比较如表3所示。
1 9 9 2年,K i m u r a等[53]首次从噬甲基菌株Methylophaga sp. AA-30中纯化出GMAS,该酶在pH 7.5 和40 ℃条件下有最大活性,表现出较宽的底物特异性范围,并能以乙胺和L-谷氨酸为底物催化合成L-茶氨酸,但未进行深入研究。2007年,Yamamoto等[54]从200多种甲胺和/或甲醇同化细菌中筛选出M. mays No. 9作为L-茶氨酸生产菌,并从中分离出GMAS,该酶在中性pH值范围对乙胺具有较高的活性;同时在较低底物浓度条件下,该酶催化的L-茶氨酸产量高于P. taetrolens Y-30 GS大约20 倍。随后该课题组将M. mays No. 9中编码GMAS的基因在E. coli中进行了重组表达,结果表明重组菌的产酶能力可比原始M. mays No. 9高23 倍,而重组GMAS的酶学性质与天然GMAS无明显不同[55],这使得大量生产GMAS用于工业L-茶氨酸生产成为可能;以重组GMAS作为催化剂,研究了偶联酵母糖酵解ATP再生的L-茶氨酸生物合成,结果表明含600 mmol/L L-谷氨酸钠、600 mmol/L盐酸乙胺、300 mmol/L葡萄糖、200 mmol/L磷酸钾缓冲液(pH 7.0)、30 mmol/L MgCl2、5 mmol/L MnCl2、5 mmol/L单磷酸腺苷(adenosine monophosphate,AMP)、30 U/mL GMAS 和40 g/L 酵母细胞的1 mL混合体系中,在48 h内可催化合成约110 g/L L-茶氨酸[56]。另外,该课题组将GMAS和酵母干细胞封闭于透析膜管中,该膜封闭酶制备法可实现600 mmol/L L-谷氨酸和乙胺100%转化为L-茶氨酸,且在含NAD+混合反应液中经6 次连续反应仍能保持较高的L-茶氨酸生产能力[57]。
与L-谷氨酰胺酶和GGT相比,GMAS在催化L-茶氨酸合成时,以廉价的L-谷氨酸盐为原料,只需要添加等当量的乙胺,而无需考虑L-谷氨酰胺为底物时由于其水解及自转肽反应带来的副产物问题。然而,与GS相似,GMAS在催化L-茶氨酸的合成中是需要ATP参与的,ATP再生是关系到GMAS用于工业化生产L-茶氨酸的关键。鉴于重组GMAS在L-茶氨酸合成中所表现出的优势,本课题组开发了偶联基于磷酸激酶(polyphosphate kinase,PPK)的ATP再生系统的酶法L-茶氨酸合成路线[58],如图5所示,通过PPK催化,以廉价易得的多聚磷酸盐(polyphosphate,polyP)为底物实现ATP再生,在200 mL反应体系中,添加催化量的ATP,以400 mmol/L L-谷氨酸和乙胺为底物,实现了L-茶氨酸84%的产率。该反应体系基于酶法ATP再生,相比酵母糖酵解ATP再生,体系简单易控,有利于工业化生产L-茶氨酸,相关反应体系比较如表4所示。
表4 各种来源GS和GMAS催化合成L-茶氨酸方法的比较
Table 4 Comparative analysis of the methods available for enzymatic synthesis of L-theanine using GS and GMAS from various sources

注:FDP.果糖-1,6-二磷酸(fructose-1,6-diphosphate)。
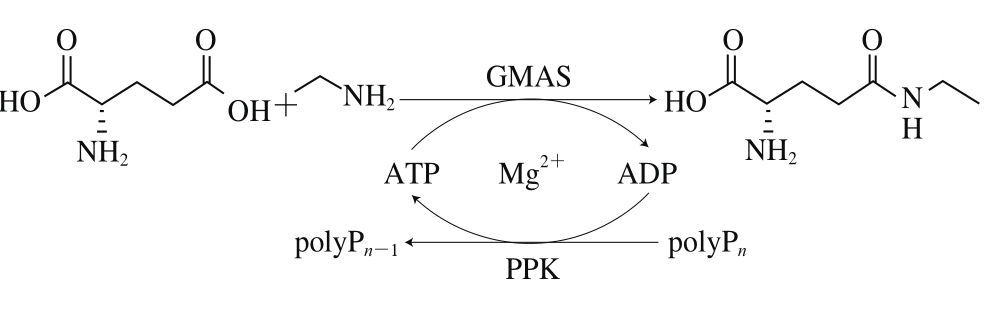
图5 偶联基于PPK ATP再生酶法合成L-茶氨酸[58]
Fig. 5 Enzymatic synthesis of L-theanine by GMAS coupled with an ATP regeneration system based on PPK[58]
3.5 GCS合成酶催化L-茶氨酸合成
γ-GCS在ATP供能条件下,以L-谷氨酸和L-半胱氨酸为底物催化合成γ-谷氨酰半胱氨酸,是生物体内合成谷胱甘肽的重要用酶[59]。Miyake等[60]报道了来自E. coli的γ-GCS具有催化L-谷氨酸和脂肪胺类生成γ-谷氨酰胺类化合物的能力,且反应速度与亚甲基长度有关(正丙胺>丁胺>乙胺>>甲胺);利用重组E. coli DH5α/pGSK1表达的γ-GCS催化,并偶联E. coli自身ATP再生系统,18 h后能以429 mmol/L乙胺合成12.1 mmol/L L-茶氨酸。然而,该酶对乙胺的底物特异性较差,需要对其进行进一步改造,以提高其底物特异性。
L-茶氨酸因其独特的生物学功能,在食品、保健品、医药等领域必将有着巨大的应用价值和广阔的开发前景,所以实现L-茶氨酸的工业化生产尤为重要。由于高效、节能、环境友好等优点,酶催化合成L-茶氨酸日益受到青睐。目前L-茶氨酸的酶法合成已经取得一定进展,但仍存在一些问题:1)使用L-谷氨酰胺酶和GGT催化L-谷氨酰胺及衍生物与乙胺合成L-茶氨酸,反应过程中不需要ATP参与,然而需要使用过量乙胺并在碱性条件下反应,以抑制底物L-谷氨酰胺水解及自转肽作用;另外,还存在底物浓度偏低和转化效率不高的问题。2)使用GS、GMAS及γ-GCS催化L-谷氨酸与乙胺合成L-茶氨酸,不存在底物水解及自转肽等副反应,然而反应过程需要ATP参与,使得ATP再生成为此类酶,特别是GMAS,应用于L-茶氨酸工业生产的关键问题。因此,可从以下几个方面进行深入研究:1)进一步表征这些酶的晶体结构,从而更完善地阐明乙胺结合以及通过γ-谷氨酰基的转移或L-谷氨酸的连接生物合成L-茶氨酸的分子机制,以更好地利用定向进化技术提高酶对乙胺的底物特异性、催化活性和稳定性,进一步提高合成L-茶氨酸的效率。2)利用生物信息学中的基因挖掘技术从自然界中筛查和表征更多具有催化L-茶氨酸合成功能的酶,并比较其酶性质和合成L-茶氨酸的能力,以开发更有效的酶用于L-茶氨酸的工业生产。3)开发更高效的ATP再生系统,以解决GMAS等酶在工业化生产应用中的瓶颈问题。
参考文献:
[1] LIANG Y R, LIU C, XIANG L P, et al. Health benef i ts of theanine in green tea: a review[J]. Tropical Journal of Pharmaceutical Research,2015, 14(10): 1943-1949. DOI:10.4314/tjpr.v14i10.29.
[2] VUONG Q V, STATHOPOULOS C E, GOLDING J B, et al.Optimum conditions for the water extraction of L-theanine from green tea[J]. Journal of Separation Science, 2011, 34(18): 2468-2474.DOI:10.1002/jssc.201100401.
[3] YE J H, JIN J, LUO Y W, et al. Isolation of L-theanine from tea solution by cation exchange resin in batch and fi xed bed column[J].Biotechnology and Bioprocess Engineering, 2011, 16(2): 256-263.DOI:10.1007/s12257-010-0223-8.
[4] CARTWRIGHT R A, ROBERTS E A H, WOOD D J. Theanine, an amino-acid N-ethyl amide present in tea[J]. Journal of the Science of Food and Agriculture, 1954, 5(12): 597-599. DOI:10.1002/jsfa.2740051208.
[5] GU H N, JIANG Y X, WANG J. A practical synthesis of ethyl L-glutamine (L-theanine)[J]. Organic Preparations and Procedures International, 2004, 36(2): 182-185.DOI:10.1080/00304940409355394.
[6] ZHANG Z Z, YAN S H, LI D X, et al. Chemical synthesis and the stability of theanine[J]. Advanced Materials Research, 2012,396/397/398: 1273-1277. DOI:10.4028/www.scientif i c.net/AMR.396-398.1273.
[7] VUONG Q V, BOWYER M C, ROACH P D. L-Theanine: properties,synthesis and isolation from tea[J]. Journal of the Science of Food and Agriculture, 2011, 91(11): 1931-1939. DOI:10.1002/Jsfa.4373.
[8] MU W M, ZHANG T, JIANG B. An overview of biological production of L-theanine[J]. Biotechnology Advances, 2015, 33(3/4):335-342. DOI:10.1016/j.biotechadv.2015.04.004.
[9] 陈林, 张正竹, 陈键, 等. 茶氨酸酶促生物合成研究进展[J]. 茶叶科学, 2011, 31(1): 1-10.
[10] 罗晶晶, 张灵枝, 王登良. 生物技术在茶氨酸合成上的应用进展[J]. 广东茶业, 2013(增刊1): 13-15. DOI:10.3969/j.issn.1672-7398.2013.01.005.
[11] 贲培玲, 朱岩岩, 殷志敏. L-茶氨酸生物制备技术和生物功能研究进展[J]. 中国茶叶加工, 2015(4): 19-25.
[12] YOTO A, MOTOKI M, MURAO S, et al. Effects of L-theanine or caffeine intake on changes in blood pressure under physical and psychological stresses[J]. Journal of Physiological Anthropology,2012, 31: 1-9. DOI:10.1186/1880-6805-31-28.
[13] LI L, WANG X R, XIONG Y, et al. L-Theanine: a promising substance in tumor research[J]. Journal of Food Agriculture and Environment, 2013, 11(1): 25-27.
[14] THANGARAJAN S, DEIVASIGAMANI A, NATARAJAN S S, et al.Neuroprotective activity of L-theanine on 3-nitropropionic acid-induced neurotoxicity in rat striatum[J]. International Journal of Neuroscience,2014, 124(9): 673-684. DOI:10.3109/00207454.2013.872642.
[15] ZHAO Y, ZHAO B L. The neuroprotective effect of L-theanine and its inhibition on nicotine dependence[J]. Chinese Science Bulletin, 2014,59(31): 4014-4019. DOI:10.1007/s11434-014-0529-6.
[16] TAMANO H, FUKURA K, SUZUKI M, et al. Advantageous effect of theanine intake on cognition[J]. Nutritional Neuroscience, 2014, 17(6):279-283. DOI:10.1179/1476830513Y.0000000094.
[17] UNNO K, TANIDA N, ISHII N, et al. Anti-stress effect of theanine on students during pharmacy practice: positive correlation among salivary alpha-amylase activity, trait anxiety and subjective stress[J].Pharmacology Biochemistry and Behavior, 2013, 111: 128-135.DOI:10.1016/j.pbb.2013.09.004.
[18] LI C J, TONG H O, YAN Q X, et al. L-Theanine improves immunity by altering TH2/TH1 cytokine balance, brain neurotransmitters,and expression of phospholipase C in rat hearts[J]. Medical Science Monitor, 2016, 22: 662-669. DOI:10.12659/MSM.897077.
[19] ZHENG G D, SAYAMA K, OKUBO T, et al. Anti-obesity effects of three major components of green tea, catechins, caffeine and theanine,in mice[J]. In Vivo, 2004, 18(1): 55-62.
[20] 朱松, 王洪新. 茶氨酸的生理功能及在食品中的应用[J]. 食品研究与开发, 2005, 26(3): 18-20. DOI:10.3969/j.issn.1005-6521.2005.03.006.
[21] 帅玉英, 沈宇峰, 黄海娟, 等. 功能性配料L-茶氨酸的生产应用与法规情况简介[J]. 中国食品添加剂, 2013, 117(2): 181-185.DOI:10.3969/j.issn.1006-2513.2013.02.021.
[22] ASHIHARA H. Occurrence, biosynthesis and metabolism of theanine(gamma-glutamyl-L-ethylamide) in plants: a comprehensive review[J].Natural Product Communications, 2015, 10(5): 803-810.
[23] SASAOKA K, KITO M, ONISHI Y. Some properties of theanine synthesizing enzyme in tea seedlings[J]. Agricultural and Biological Chemistry, 1965, 29(11): 984-988. DOI:10.1080/00021369.1965.10858501.
[24] DENG W W, OGITA S, ASHIHARA H. Biosynthesis of theanine(gamma-ethylamino-L-glutamic acid) in seedlings of Camellia sinensis[J]. Phytochemistry Letters, 2008, 1(2): 115-119.DOI:10.1016/j.phytol.2008.06.002.
[25] NANDAKUMARA R, YOSHIMUNE K, WAKAYAMAC M, et al.Microbial glutaminase: biochemistry, molecular approaches and applications in the food industry[J]. Journal of Molecular Catalysis B: Enzymatic, 2003, 23(2/3/4/5/6): 87-100. DOI:10.1016/S1381-1177(03)00075-4.
[26] TACHIKI T, YAMADA T, UEDA M, et al. Purification and some properties of glutaminase from Pseudomonas nitroreducens IFO 12694[J]. Bioscience Biotechnology and Biochemistry, 1996, 60(7):1160-1164. DOI:10.1271/bbb.60.1160.
[27] TACHIKI T, YAMADA T, MIZUNO K, et al. Gamma-glutamyl transfer reactions by glutaminase from Pseudomonas nitroreducens IFO12694 and their application for the syntheses of theanine and gamma-glutamylmethylamide[J]. Bioscience Biotechnology and Biochemistry, 1998, 62(7): 1279-1283. DOI:10.1271/Bbb.62.1279.
[28] PU Hefang, WANG Qi, ZHU Fenfen, et al. Cloning, expression of glutaminase from Pseudomonas nitroreducens and application to theanine synthesis[J]. Biocatalysis and Biotransformation, 2013, 31(1):1-7. DOI:10.3109/10242422.2012.749462.
[29] YOKOYAMA T, ISHII R, ITOH T, et al. Synthesis of L-theanine using enzyme/mesoporous silica conjugates under high pH conditions[J].Materials Letters, 2011, 65(1): 67-69. DOI:10.1016/j.matlet.2010.09.016.
[30] ITOH T, HOSHIKAWA Y, MATSUURA S, et al. Production of L-theanine using glutaminase encapsulated in carbon-coated mesoporous silica with high pH stability[J]. Biochemical Engineering Journal, 2012, 68: 207-214. DOI:10.1016/j.bej.2012.07.012.
[31] MATSUURA S, YOKOYAMA T, ISHII R, et al. An enzymeencapsulated microreactor for efficient theanine synthesis[J].Chemical Communications, 2012, 48(56): 7058-7060. DOI:10.1039/C2cc32271d.
[32] TACHIKI T, OKADA Y, OZEKI M, et al. Process for producing theanine: US7335497[P]. (2008-02-16)[2016-08-20].
[33] CASTELLANO I, MERLINO A. γ-Glutamyltranspeptidases:sequence, structure, biochemical properties, and biotechnological applications[J]. Cellular and Molecular Life Sciences, 2012, 69(20):3381-3394. DOI:10.1007/s00018-012-0988-3.
[34] SUZUKI H, IZUKA S, MIYAKAWA N, et al. Enzymatic production of theanine, an “umami” component of tea, from glutamine and ethylamine with bacterial gamma-glutamyltranspeptidase[J]. Enzyme and Microbial Technology, 2002, 31(6): 884-889. DOI:10.1016/S0141-0229(02)00213-2.
[35] YAO Y F, WENG Y M, HU H Y, et al. Expression optimization and biochemical characterization of a recombinant gammaglutamyltranspeptidase from Escherichia coli Novablue[J]. Protein Journal, 2006, 25(6): 431-441. DOI:10.1007/s10930-006-9037-0.
[36] ZHANG F, ZHENG Q Z, JIAO Q C, et al. Synthesis of theanine from glutamic acid gamma-methyl ester and ethylamine catalyzed by Escherichia coli having gamma-glutamyltranspeptidase activity[J].Biotechnology Letters, 2010, 32(8): 1147-1150. DOI:10.1007/s10529-010-0273-1.
[37] ZHANG F, ZHENG Q Z, JIAO Q C, et al. Enzymatic synthesis of theanine from glutamic acid gamma-methyl ester and ethylamine by immobilized Escherichia coli cells with gamma-glutamyltranspeptidase activity[J]. Amino Acids, 2010, 39(5): 1177-1182. DOI:10.1007/s00726-010-0553-z.
[38] WANG Q, MIN C, ZHU F F, et al. Production of bioactive gammaglutamyl transpeptidase in Escherichia coli using sumo fusion partner and application of the recombinant enzyme to L-theanine synthesis[J].Current Microbiology, 2011, 62(5): 1535-1541. DOI:10.1007/s00284-011-9891-7.
[39] ZHANG Hongjuan, ZHANG Weiguo, WANG Zhiyuan, et al.Enzymatic synthesis of theanine with Escherichia coli gammaglutamyltranspeptidase from a series of gamma-glutamyl anilide substrate analogues[J]. Biotechnology and Bioprocess Engineering,2013, 18(2): 358-364. DOI:10.1007/s12257-012-0644-7.
[40] SHUAI Y Y, ZHANG T, JIANG B, et al. Development of efficient enzymatic production of theanine by gamma-glutamyltranspeptidase from a newly isolated strain of Bacillus subtilis, SK11.004[J]. Journal of the Science of Food and Agriculture, 2010, 90(15): 2563-2567.DOI:10.1002/jsfa.4120.
[41] WANG Haoqi, YAO Zhong, ZHOU Zhi, et al. Enzymatic synthesis of theanine with L-glutamine-Zn(Ⅱ) complexes[J]. Biotechnology and Bioprocess Engineering, 2012, 17(6): 1135-1139. DOI:10.1007/s12257-012-0205-0.
[42] CHEN X Y, SU L Q, WU D, et al. Application of recombinant Bacillus subtilis gamma-glutamyltranspeptidase to the production of L-theanine[J]. Process Biochemistry, 2014, 49(9): 1429-1439.DOI:10.1016/j.procbio.2014.05.019.
[43] 傅嘉懿, 陈晟, 吴敬. γ-谷氨酰转肽酶补料法合成L-茶氨酸工艺研究[J]. 生物技术通报, 2016, 32(2): 165-171. DOI:10.13560/j.cnki.biotech.bull.1985.2016.02.022.
[44] BINDAL S, GUPTA R. L-Theanine synthesis using gammaglutamyl transpeptidase from Bacillus licheniformis ER-15[J]. Journal of Agricultural and Food Chemistry, 2014, 62(37): 9151-9159.DOI:10.1021/jf5022913.
[45] LIN L L, CHOU P R, HUA Y W, et al. Overexpression, one-step purification, and biochemical characterization of a recombinant gamma-glutamyltranspeptidase from Bacillus licheniformis[J]. Applied Microbiology and Biotechnology, 2006, 73(1): 103-112. DOI:10.1007/s00253-006-0440-4.
[46] TACHIKI T, WAKISAKA S, KUMAGAI H, et al. Glutamine synthetase from Micrococcus glutamicus: effect of nitrogen sources in culture medium on enzyme formation and some properties of crystalline enzyme[J]. Agricultural and Biological Chemistry, 1981,45(6): 1487-1492. DOI:10.1271/bbb1961.45.1487.
[47] TACHIKI T, SUZUKI H, WAKISAKA S, et al. Production of γ-glutamylmethylamide and γ-glutamylethylamide by coupling of baker’s yeast preparations and bacterial glutamine synthetase[J]. The Journal of General and Applied Microbiology, 1986, 32(6): 545-548.DOI:10.2323/jgam.32.545.
[48] YAMAMOTO S, UCHIMURA K, WAKAYAMA M, et al.Purification and characterization of glutamine synthetase of Pseudomonas taetrolens Y-30: an enzyme usable for production of theanine by coupling with the alcoholic fermentation system of baker’s yeast[J]. Bioscience Biotechnology and Biochemistry, 2004, 68(9):1888-1897. DOI:10.1271/Bbb.68.1888.
[49] YAMAMOTO S, WAKAYAMA M, TACHIKI T. Cloning and expression of Pseudomonas taetrolens Y-30 gene encoding glutamine synthetase: an enzyme available for theanine production by coupled fermentation with energy transfer[J]. Bioscience Biotechnology and Biochemistry, 2006, 70(2): 500-507. DOI:10.1271/Bbb.70.500.
[50] YAMAMOTO S, WAKAYAMA M, TACHIKI T. Theanine production by coupled fermentation with energy transfer employing Pseudomonas taetrolens Y-30 glutamine synthetase and baker’s yeast cells[J]. Bioscience Biotechnology and Biochemistry, 2005, 69(4):784-789. DOI:10.1271/Bbb.69.784.
[51] ZHOU Xin, ZHANG Zhengping, JIA Xiaohe, et al. Mn2+enhances theanine-forming activity of recombinant glutamine synthetase from Bacillus subtilis in Escherichia coli[J]. World Journal of Microbiology and Biotechnology, 2008, 24(8): 1267-1272.DOI:10.1007/s11274-007-9599-9.
[52] KIMURA T, SUGAHARA I, HAYASHI K, et al. Primary metabolic pathway of methylamine in Methylophaga sp. AA-30[J]. Agricultural and Biological Chemistry, 1990, 54(11): 2819-2826. DOI:10.1080/000 21369.1990.10870440.
[53] KIMURA T, SUGAHARA I, HANAI K, et al. Purification and characterization of gamma-glutamylmethylamide synthetase from Methylophaga sp. AA-30[J]. Bioscience Biotechnology and Biochemistry, 1992, 56(5): 708-711. DOI:10.1271/bbb.56.708.
[54] YAMAMOTO S, WAKAYAMA M, TACHIKI T. Characterization of theanine-forming enzyme from Methylovorus mays No. 9 in respect to utilization of theanine production[J]. Bioscience Biotechnology and Biochemistry, 2007, 71(2): 545-552. DOI:10.1271/Bbb.60590.
[55] YAMAMOTO S, WAKAYAMA M, TACHIKI T. Cloning and expression of Methylovorus mays No. 9 gene encoding gammaglutamylmethylamide synthetase: an enzyme usable in theanine formation by coupling with the alcoholic fermentation system of baker’s yeast[J]. Bioscience Biotechnology and Biochemistry, 2008,72(1): 101-109. DOI:10.1271/Bbb.70462.
[56] YAMAMOTO S, MORIHARA Y, WAKAYAMA M, et al. Theanine production by coupled fermentation with energy transfer using gammaglutamylmethylamide synthetase of Methylovorus mays No. 9[J].Bioscience Biotechnology and Biochemistry, 2008, 72(5): 1206-1211.DOI:10.1271/Bbb.70663.
[57] YAMAMOTO S, MORIHARA Y, WAKAYAMA M, et al. Repeated batch production of theanine by coupled fermentation with energy transfer using membrane-enclosed gamma-glutamylmethylamide synthetase and dried yeast cells[J]. Bioscience Biotechnology and Biochemistry, 2009, 73(12): 2800-2802. DOI:10.1271/Bbb.90647.
[58] LIU S, LI Y, ZHU J. Enzymatic production of L-theanine by gammaglutamylmethylamide synthetase coupling with an ATP regeneration system based on polyphosphate kinase[J]. Process Biochemistry, 2016,51(10): 1458-1463. DOI:10.1016/j.procbio.2016.06.006.
[59] KELLY B S, ANTHOLINE W E, GRIFFITH O W. Escherichia coli gamma-glutamylcysteine synthetase - two active site metal ions affect substrate and inhibitor binding[J]. Journal of Biological Chemistry,2002, 277(1): 50-58. DOI:10.1074/jbc.M107961200.
[60] MIYAKE K, KAKITA S. A novel catalytic ability of gammaglutamylcysteine synthetase of Escherichia coli and its application in theanine production[J]. Bioscience Biotechnology and Biochemistry,2009, 73(12): 2677-2683. DOI:10.1271/Bbb.90538.
Process in Enzymatic Synthesis of L-Theanine
LI Yuan, LIU Shan, ZHU Jun*(Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China)
Abstract:L-theanine (γ-glutamylethylamide), a unique non-protein-derived amino acid in tea, has a broad range of bioactivities, such as improving food fl avor, releasing pressure and enhancing the eff i ciency of anticancer agents. Herein,the physiological and pharmacological activities of L-theanine and its applications in food, health and medical industries are summarized with focus on the enzymatic synthesis of L-theanine. Moreover, directions for future research are also discussed in the hope of providing a guideline for the large-scale industrial production of L-theanine.
Key words:tea; L-theanine; biosynthesis; enzyme
DOI:10.7506/spkx1002-6630-201723047
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2017)23-0298-07
引文格式:
李元, 刘珊, 祝俊. 酶催化合成L-茶氨酸的研究进展[J]. 食品科学, 2017, 38(23): 298-304.
DOI:10.7506/spkx1002-6630-201723047. http://www.spkx.net.cn
LI Yuan, LIU Shan, ZHU Jun. Process in enzymatic synthesis of L-theanine[J]. Food Science, 2017, 38(23): 298-304. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723047. http://www.spkx.net.cn
收稿日期:2016-09-09
基金项目:天津市科技计划项目(14ZCZDSY00064)
作者简介:李元(1986—),女,助理研究员,硕士,研究方向为生物催化。E-mail:li_yuan@tib.cas.cn
*通信作者:祝俊(1962—),男,研究员,博士,研究方向为酶工程与生物催化。E-mail:zhu_j@tib.cas.cn