表1 各种抑制剂组合方式
Table 1 Different combinations of protease inhibitors

注:+.添加抑制剂;-.不添加抑制剂。
田元勇,宋 扬,郑 尧,刘慧慧,刘俊荣*
(大连海洋大学食品科学与工程学院,辽宁 大连 116023)
摘 要:鱿鱼肝脏含有丰富的蛋白酶,为利用其内源蛋白酶进行可控的酶解,本研究以鲤鱼肌原纤维蛋白为底物对鱿鱼肝脏内源蛋白酶的种类和性质进行了研究。反应体系中添加E-64、1,10-菲啰啉和苯甲基 磺酰氟(phenylmethylsulfonyl fluoride,PMSF)后,肌球蛋白重链(myosin heavy chain,MHC)的降解得到了显著抑制,确定了鱿鱼肝脏含有金属类、半胱氨酸类、丝氨酸类3 类蛋白酶。半胱氨酸类蛋白酶热稳定性最好,在50 ℃以上仍然具有较大活性,可将肌原纤维蛋白酶解成小分子质量的降解产物。利用特异性底物对半胱氨酸蛋白酶种类进行鉴定发现,该酶只酶解Z-Phe-Arg-MCA,添加亮抑酶肽后相对酶活性为0%,添加E-64相对酶活性仅存0.6%,初步确定鱿鱼肝脏中的半胱氨酸蛋白酶主要为组织蛋白酶L。最后,通过硫酸铵沉淀、离子交换层析、凝胶过滤对组织蛋白酶L进行分离纯化,在电泳上得到了分子质量约为25 kD单一条带。
关键词:鱿鱼肝脏;酶解;抑制剂;荧光底物;组织蛋白酶L
目前,关于水产蛋白利用的研究取得了很多重要的成果。对于功能性较差的蛋白资源,如低值鱼肉[1-3]、水产残渣[4]、鱼的生殖腺[5]等通过添加外源酶[6-7]或者利用内源酶[8]进行酶解,生产具有各种功能性的多肽是提高废弃物有效利用的途径之一。内源酶由于个体差异、季节差异[9]等原因导致酶解的控制比较困难,因而为更有效、可控地利用内源酶,需要对水产品内源酶的性质进行系统研究。
鱿鱼是一个非常重要的水产经济品种,在加工过程中会产生大量的废弃物。主要包括头部、内脏、皮等部位,占鱿鱼总质量的50%左右,其中肝脏占鱿鱼总质量的15%左右。这部分通常被当作废弃物掩埋处理,这不仅造成了巨大的资源浪费,而且污染了环境。鱿鱼肝脏富含多不饱和脂肪酸[10]、蛋白质等营养成分,通过蛋白酶水解后可用作水产饲料[11-12]、调味料[13-14]、ACE活性肽[15-16]。此外,鱿鱼肝脏还含有丰富的蛋白酶。Cardenas-Lopez等[17]从巨型鱿鱼的肝脏中分离得到了组织蛋白酶L,日本研究者[18-20]从日本鱿鱼分离得到了肌球蛋白酶myosinaseⅠ、Ⅱ,Sakai-Suzuki等[21]从鱿鱼外套膜中分离出了酸性半胱氨酸蛋白酶,并分别对分离得到的蛋白酶的酶学性质进行了研究。Funaki等[22]研究了日本传统食品盐辛生产过程中鱿鱼肝脏蛋白酶的作用。为了使鱿鱼肝脏进行可控的自水解或对其他蛋白资源的酶解,Tian等[23]对其内源性蛋白酶的酶学性质及其对鱼肉蛋白的消化特性进行了比较系统的研究,前期的研究中发现半胱氨酸类蛋白酶具有比较好的热稳定性、pH值稳定性和对底物的低选择性。本研究通过各种抑制剂对鱿鱼肝脏中的蛋白酶进行了鉴定,并对3 类蛋白酶的温度特性进行比较,通过特异性底物对半胱氨酸蛋白酶的类型进行了鉴定,进一步对组织蛋白酶L进行了分离纯化。
1.1 材料与试剂
取新鲜鱿鱼肝脏部分,利用丙酮脱脂脱水后得到干燥粉末,-40 ℃冰箱贮存备用。活鲤鱼购买于大连沃尔玛超市;运至实验室立刻速杀,去头、内脏、鳞、鳍、鳃,然后清洗去皮、去骨、采肉、放入斩拌料理机中绞碎成肉泥状,立即使用。
E-64(L-trans-epoxysuccinyl-leucylamido-4-guandimobutane)、抑肽素、亮抑酶肽、N-乙基马来酰亚胺(N-ethylmaleimide,NEM)、对-氯汞基苯甲酸盐(p-chloromercuribenzoate,PCMB)、大豆胰蛋白酶抑制物(soybean trypsin inhibitor,SBIT)美国Sigma公司;苯甲基 磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、1,10-菲啰啉、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA) 日本和光纯药工业株式会社。
1.2 仪器与设备
AB204-N电子分析天平 梅特勒-托利多有限公司;Z-326K冷冻离心机 德国Hermle公司;PB-10 pH计德国赛多利斯集团;UV1800紫外-可见分光光度计日本岛津株式会社;J-715荧光分光光度计 日本分光株式会社;AE-6500电泳仪 日本Atto株式会社。
1.3 方法
1.3.1 鱿鱼肝脏蛋白酶的提取
取2.0 g鱿鱼肝脏脱脂粉末,加入20 mL的0.1 mol/L NaCl、0.02 mol/L Tris-HCl(pH 7.5)缓冲溶液,7 000 r/min均质3 次,每次30 s。然后10 000×g离心20 min,收集上清液,用同一缓冲溶液透析12 h,所得的溶液即为鱿鱼肝脏粗酶液。以上所有操作均在4 ℃进行。
1.3.2 鱿鱼肝脏蛋白酶活性的测定
以鲤鱼肌原纤维蛋白为底物,对鱿鱼肝脏蛋白酶的活性进行测定。肌原纤维蛋白的提取参考Kato等[24]的方法,略有修改。取5.0 g鲤鱼背部白肉,切碎后加入0.1 mol/L NaCl、0.02 mol/L Tris-HCl(pH 7.5)缓冲溶液反复漂洗3 次,在4 ℃、3 000 r/min条件下,离心5 min。取沉淀加入25 mL的同一缓冲溶液,在14 000 r/min均质3 次,每次间隔 30 s。离心得到的沉淀用上述缓冲溶液漂洗后悬浊,用两层纱布过滤,滤液即为鲤鱼肌原纤维蛋白溶液。使用该溶液作为底物检测鱿鱼肝脏蛋白酶的活性。在0.2 mL反应组成液(其中包括肌原纤维蛋白2.5 mg/mL、粗酶液0.2 mg/mL、NaCl 0.5 mol/L、Tris-HCl(pH 7.5)20 mmol/L)中分别加入以下各种抑制剂:E-64(10 mmol/L)、PMSF(1 mmol/L)、EDTA(5 mmol/L)、1,10-菲啰啉(3 mmol/L)、亮抑酶肽(10 mmol/L)、NEM(1 mmol/L)、PCMB(5 mmol/L)、SBIT(100 mg/mL)、抑肽素(10 mg/mL)。在20 ℃条件下反应20 min,反应停止后添加 0.3 mL电泳缓冲溶液(2%巯基乙醇、2%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、0.05%溴酚蓝、20 mmol/L Tris-HCl(pH 7.5)),并立即煮沸5 min。所得到的样品用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gelelectrophoresis,SDSPAGE)进行分析,并通过肌球蛋白重链(myosin heavy chain,MHC)量的变化来评价蛋白酶的活性。
1.3.3 3 种蛋白酶不同温度的酶切特性
在蛋白酶提取液中分别添加E-64和PMSF、1,10-菲啰啉和PMSF、E-64和1,10-菲啰啉制备金属蛋白酶、半胱氨酸蛋白酶、丝氨酸蛋白酶反应体系。3 个反应体系中分别添加10%、2.5%、10%的粗酶,并与肌原纤维蛋白溶液混合,分别在 20、30、35、40、45、50、60、70、80、90 ℃反应30 min,最后加入0.3 mL电泳缓冲溶液煮沸5 min,进行SDS-PAGE分析。
1.3.4 基于特异性荧光多肽底物的蛋白酶活性检测
参考Sherekar等[25]的方法,以荧光多肽为底物,对半胱氨酸蛋白酶活性进行了测定。方法如下:比色皿放置于荧光分光光度计中,3 mL缓冲溶液中加入0.1 mL荧光多肽底物,37 ℃预热2 min后,加入0.02 mL粗酶溶液,立刻测定反应释放的7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)的荧光强度,测定的激发波长为380 nm,发射波长为460 nm。在反应液中分别添加亮抑酶肽、E-64、PMSF、EDTA检测蛋白酶活性的变化。酶活力单位(U)定义为每分钟释放1 nmol AMC需要的酶量。
1.3.5 组织蛋白酶L的分离纯化
鱿鱼肝脏提取的粗酶溶液(0.1 mol/L NaCl、20 mmol/L Tris-HCl(pH 7.5))中加入40%硫酸铵,在冰水中静置30 min后,20 000×g离心20 min取上清液,进一步加入硫酸铵至饱和质量分数60%,收集沉淀。用0.1 mol/L NaCl、20 mmol/L Tris-HCl(pH 7.5)的缓冲溶液透析12 h后,20 000×g离心20 min,取离心后上清液5 mL进行分离纯化。TOYOPRARL DEAE-650M(1.6 cm×20 cm)先用1 mol/L NaCl、20 mmol/L Tris-HCl(pH 7.5)的缓冲溶液洗净,再用0.1 mol/L NaCl、20 mmol/L Tris-HCl(pH 7.5)缓冲溶液平衡。用0.05~0.4 mol/L NaCl溶液进行线性洗脱,流速10 mL/min,3 mL/管进行回收。然后以肌原纤维蛋白为底物对各管的酶活性进行测定,收集半胱氨酸蛋白酶活性高的组分,浓缩后添加到0.1 mol/L NaCl、20 mmol/L Tris-HCl(pH 7.5)平衡的TOYOPEARL HW-55F(1.6 cm×100 cm)色谱柱。5 mL/h的流速,3 mL/管进行收集。使用Z-Phe-Arg-MCA为底物对各组分的活性进行测定,收集高活性组分,浓缩后得到纯化的组织蛋白酶L。
2.1 鱿鱼肝脏粗酶对肌原纤维蛋白的酶解特性
表1 各种抑制剂组合方式
Table 1 Different combinations of protease inhibitors

注:+.添加抑制剂;-.不添加抑制剂。
按照表1所示的组合添加各种抑制剂到鱿鱼肝脏粗酶,分析各种蛋白酶对肌原纤维蛋白的酶解特性,结果如图1所示,在不添加任何抑制剂的条件下(A),MHC和肌动蛋白都呈减少趋势,相应能看到很多新条带的产生。添加各种抑制剂后,MHC的降解不同程度得到抑制,生成的条带也有所不同。其中E-64、1,10-邻菲罗啉、PMSF、NEM、亮抑酶肽、PCMB、EDTA等抑制剂,不管是单独添加到反应体系,还是几种混合后添加到反应体系,都对MHC的降解产生了显著的抑制效果。E-64、1,10-邻菲罗啉、PMSF联合添加到反应体系,几乎可以完全抑制MHC的降解,SBTI和抑肽素的添加几乎没有作用。因此推定鱿鱼肝脏内主要含有金属类、半胱氨酸类和丝氨酸类蛋白酶,而几乎不含有天冬氨酸类蛋白酶。
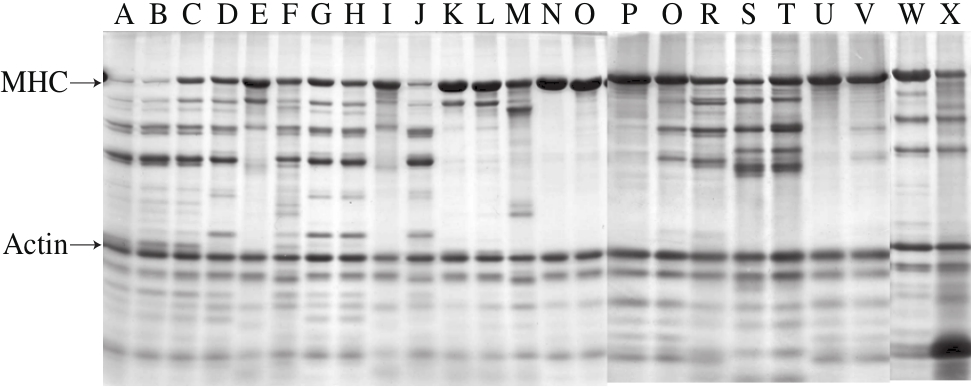
图1 各种抑制剂对鱿鱼肝脏蛋白酶的抑制效果
Fig. 1 SDS-PAGE analysis of inhibition of squid liver proteases by different inhibitor combinations
2.2 3 类蛋白酶对肌原纤维蛋白的酶解特性
根据图1的结果可知,通过添加两类蛋白酶的抑制剂,仅使其中一类蛋白酶起作用,可分析某一类蛋白酶的性质。在反应体系中分别添加E-64和PMSF、1,10-邻菲罗啉和PMSF、E-64和1,10-邻菲罗啉制备金属蛋白酶作用系、半胱氨酸蛋白酶作用系、丝氨酸蛋白酶作用系,根据酶活性大小不同调节了粗酶添加量。图2A显示,在30℃条件下的降解物条带比较固定,包括150、140、110 kD的重酶解肌球蛋白(heavy meromyosin,HMM)和50、60、90 kD的轻酶解肌球蛋白(light meromyosin,LMM),酶切位点比较专一,与Tamori等[19]报道鱿鱼肝脏的金属蛋白酶对肌球蛋白酶解降解的片段类似;40 ℃以上,降解物条带减少,Okamoto等[18]报道鱿鱼金属蛋白酶有myosinaseⅠ和Ⅱ两种类型,本研究的粗酶未进行分离纯化,其中含有多种金属类蛋白酶,每种酶的热稳定性不同引起了降解图谱的改变。图2B显示,在35 ℃以下,半胱氨酸类的降解物条带比较固定;40 ℃以上,MHC量急剧减少,而且条带显著增加,由此推测在40 ℃以上,半胱氨酸类蛋白酶酶切位点增多,其原因可能是在40℃以上肌原纤维蛋白的结构发生了变化导致酶切位点暴露而引起。Tian等[26]报道的肌球蛋白结构的改变可导致胰凝乳蛋白酶酶切位点的增多。图2C显示,在40 ℃以上,丝氨酸类蛋白酶的降解物条带也有所增加。通过以上结果可知半胱氨酸类蛋白酶对温度耐受性最强,活性最高,可把肌原纤维蛋白分解成更小的片段,在多肽生产方面具有更好的应用前景。
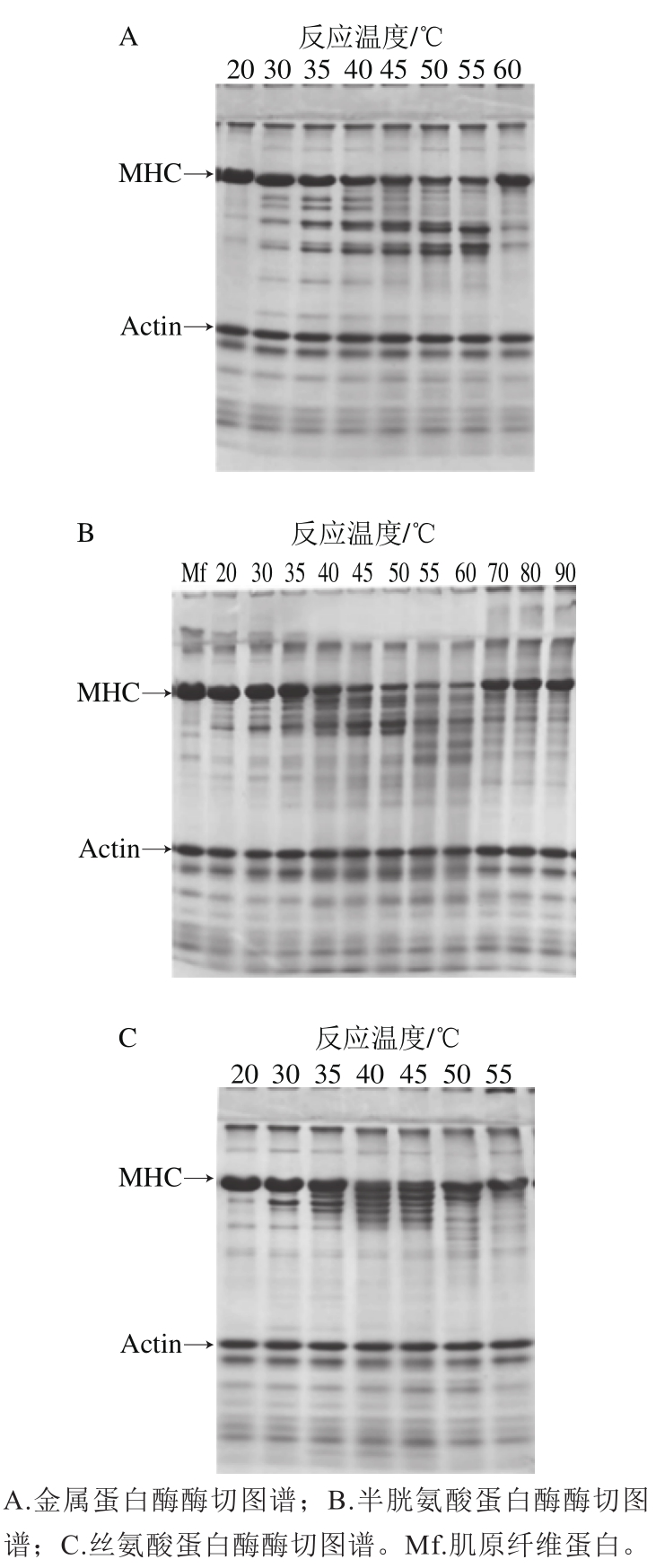
图2 温度对3 种蛋白酶消化图谱的影响
Fig. 2 Effect of temperature on the digestion patterns of the three types of proteinases in squid liver
2.3 基于特异性荧光多肽底物检测半胱氨酸蛋白酶活性
表2 鱿鱼肝脏蛋白酶对不同荧光底物酶切效果
Table 2 Squid liver proteinases activities measured using synthetic substrates
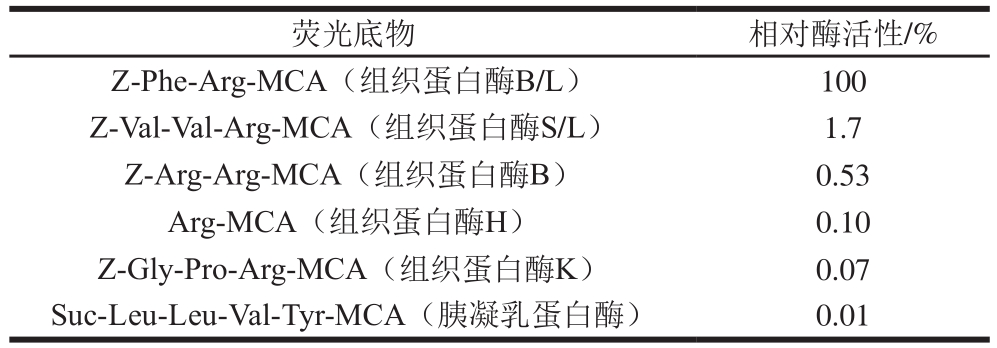
利用各种特异性荧光底物对鱿鱼肝脏蛋白酶的活性进行测定,结果如表2所示,组织蛋白酶B/L的特异性底物Z-Phe-Arg-MCA能检测到较大的酶活性,以该活性作为100%进行比较发现,组织蛋白酶B的特异性底物Z-Arg-Arg-MCA几乎没有检测到粗酶的活性,仅为0.53%,由此推定粗酶中组织蛋白酶B的含量很少。此外组织蛋白酶S/L的特异性底物Z-Val-Val-Arg-MCA也几乎没有检测到粗酶的活性,仅为1.7%。根据Brömme等[27]的报道可知,组织蛋白酶S对Z-Val-Val-Arg-MCA的分解活性为Z-Phe-Arg-MCA的10 倍,所以可推定粗酶中也几乎不含组织蛋白酶S。组织蛋白酶H、K的特异性底物也几乎没有检测到酶活性。所以推定鱿鱼肝脏中半胱氨酸蛋白酶的主要成分是组织蛋白酶L。进一步利用Z-Phe-Arg-MCA为底物,检测各种抑制剂的抑制效果,结果如表3所示,E-64和亮抑酶肽抑制效果最好。
表3 Z-Phe-Arg-MCA为底物检测的抑制剂抑制效果
Table 3 Inhibition of crude proteinase activity with Z-Phe-Arg-MCA as substrate

2.4 组织蛋白酶L的分离纯化
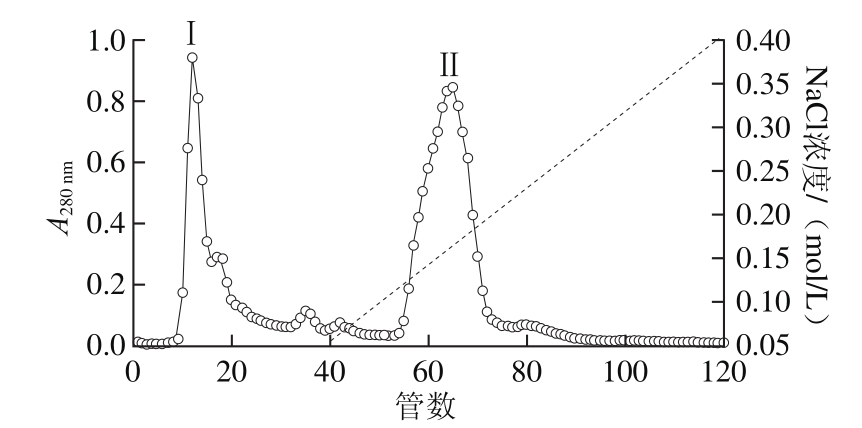
图3 TOYOPEARL DEAE-650M分离半胱氨酸蛋白酶结果
Fig. 3 Chromatography of cystein proteinase on TOYOPEARL DEAE-650M
鱿鱼肝脏粗酶经40%~60%饱和度的硫酸铵沉淀,离心后所得沉淀溶解于0.05 mol/L NaCl、20 mmol/L Tris-HCl(pH 7.5)缓冲溶液中,透析48 h后,上样品到平衡好的TOYOPRARL DEAE-650M离子交换层析柱,0.05~0.4 mol/L NaCl溶液线性洗脱,在280 nm波长处检测吸光度,结果如图3所示,可以得到未吸附组分Ⅰ和被吸附组分Ⅱ。再用鲤鱼肌原纤维蛋白为底物,在pH 7.0、37 ℃检测每管蛋白酶的活性。在未吸附组分Ⅰ中可以检测到金属蛋白酶和丝氨酸蛋白酶活性(图4a、c)。在吸附组分Ⅱ可以检测到金属蛋白酶和半胱氨酸蛋白酶(图4a、b)。在组分Ⅰ和组分Ⅱ中金属蛋白酶对肌球蛋白的酶切图谱并不一致,分析可能是不同种的金属类蛋白酶。Tamori等[19]也报道过鱿鱼肝脏来源的金属蛋白酶包含3 种类型,肌球蛋白Ⅰ、Ⅱ、Ⅲ,其中肌球蛋白Ⅰ可将兔MHC降解成130 kD和90 kD的片段,而肌球蛋白酶Ⅱ酶切的片段分子质量为158 kD和65 kD,肌球蛋白酶Ⅲ酶切的片段为120 kD和100 kD。据此推测组分Ⅰ中含有的金属类蛋白酶可能是肌球蛋白酶Ⅱ,在组分Ⅱ中含有的金属类蛋白酶是肌球蛋白酶Ⅰ和Ⅲ。肌球蛋白酶Ⅰ、Ⅱ和组织蛋白酶L不能通过DEAE-650M分开。收集组分Ⅱ,浓缩后添加到平衡好的TOYOPEARL HW-55F层析柱(1.6 cm×100 cm),所得结果如图5所示,同样可以得到组分Ⅰ和组分Ⅱ,利用Z-Phe-Arg-MCA为底物对各组分活性进行检测发现,组分Ⅱ有较高的活性。收集组分Ⅱ,采用胶质量分数为12%的SDS-PAGE进行分析,结果如图 6所示,所得粗酶经过硫酸铵沉淀、离子交换层析、凝胶过滤后得到的单一条带分子质量为25 kD。其他研究从海参[28]、美国巨型鱿鱼肝脏[17]、蓝圆鰺肌肉[29]、杂色鲍[30]中分离的组织蛋白酶L的分子质量在23~30 kD之间,与本研究结果类似。
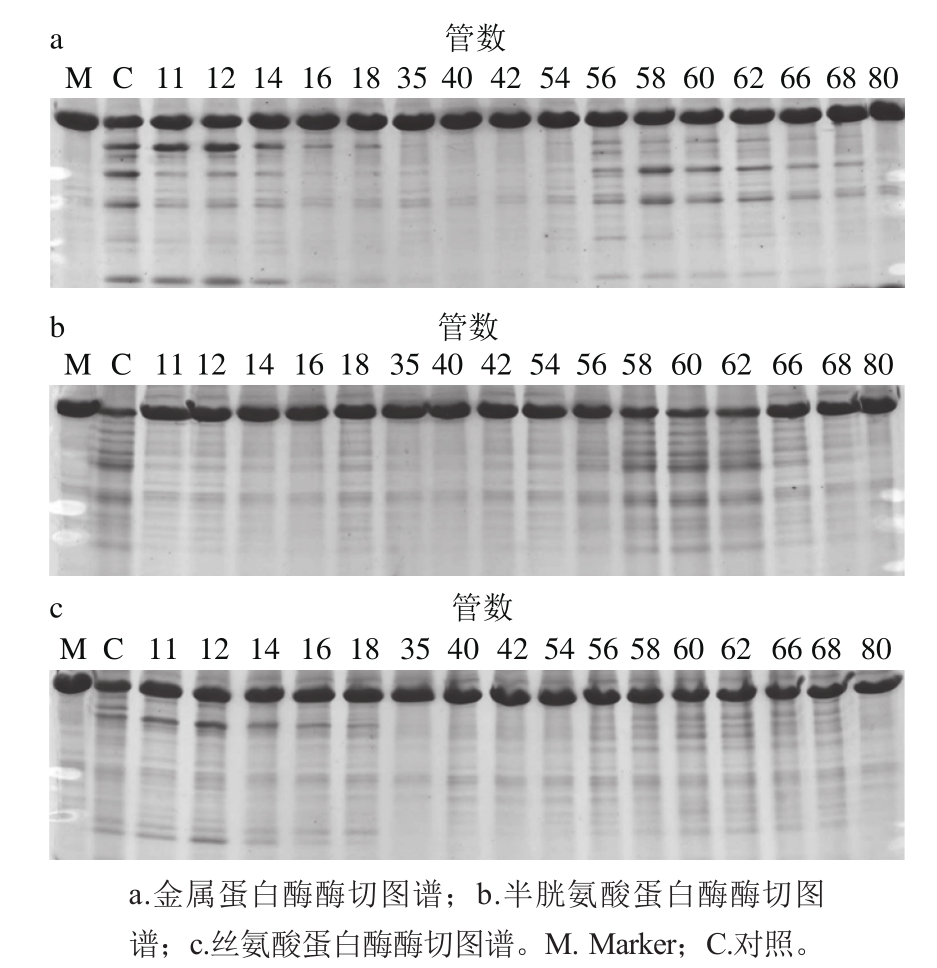
图4 TOYOPEARL DEAE-650M分离蛋白酶的酶解SDS-PAGE图谱
Fig. 4 SDS-PAGE analysis of proteinase in elution peak from TOYOPEARL DEAE-650M
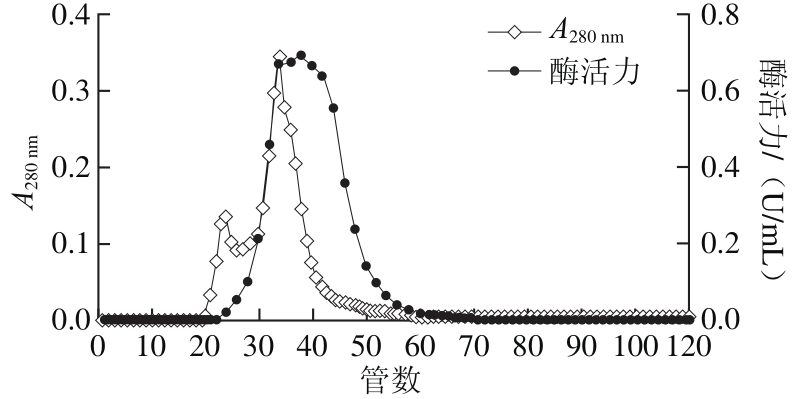
图5 TOYOPEARL HF-55F凝胶过滤纯化组织蛋白酶L
Fig. 5 TOYOPEARL HF-55F chromatographic profile of cathepsin L
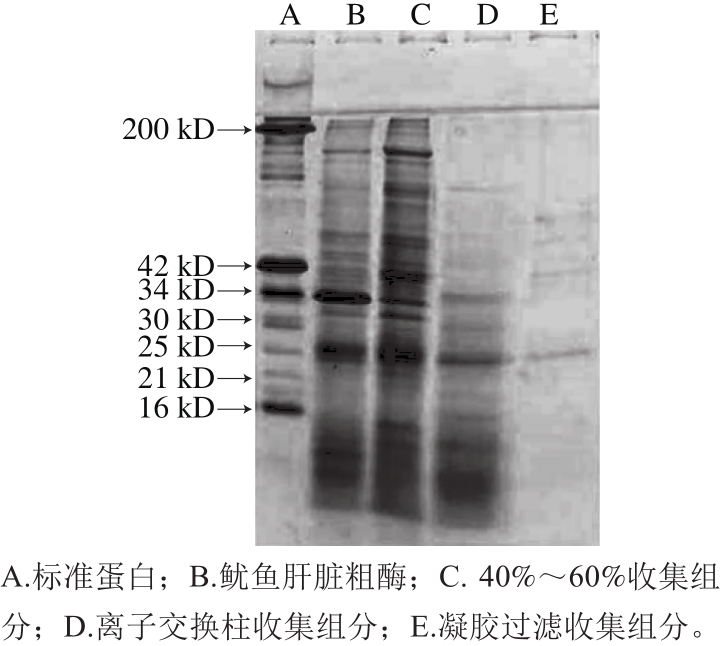
图6 组织蛋白酶L分离过程的SDS-PAGE图谱
Fig. 6 SDS-PAGE analysis of crude and purified cathepsin L
综上所述,鱿鱼肝脏主要含有3 类蛋白酶(金属类、半胱氨酸类、丝氨酸类),对鱼肉的肌原纤维蛋白的酶切性质不同。金属类蛋白酶的酶切位点比较固定,即使肌球蛋白发生变性酶切位点也不会增多,而半胱氨酸类蛋白酶在肌球蛋白发生变性后,酶切位点显著增多,可得到小分子酶切片段,并且半胱氨酸类蛋白酶对温度耐受性最好,在60 ℃依然表现出比较高的活性。通过特应性荧光底物确定半胱氨酸蛋白酶的主成分为组织蛋白酶L,通过分离纯化后,确定其分子质量在25 kD左右,接下来有必要对组织蛋白酶 L进行深入研究。
参考文献:
[1] 丁利君, 张敏玲. 鲤鱼蛋白控制酶解及其酶解产物抗氧化研究[J].食品科学, 2011, 32(8): 70-73.
[2] BORAWSKA J, DAREWICZ M, VEGARUD G E, et al. Antioxidant properties of carp (Cyprinus carpio L.) protein ex vivo, and in vitro,hydrolysates[J]. Food Chemistry, 2016, 194∶ 770-779. DOI∶10.1016/j.foodchem.2015.08.075.
[3] MARMON S K, KRONA A, LANGTON M, et al. Changes in salt solubility and microstructure of proteins from herring (Clupea harengus) after pH-shift processing[J]. Journal of Agricultural & Food Chemistry, 2012, 60(32)∶ 7965-7972. DOI∶10.1021/jf301352s.
[4] SULERIA H A R, MASCI P, GOBE G, et al. Current and potential uses of bioactive molecules from marine processing waste[J]. Journal of the Science of Food & Agriculture, 2016, 96(4)∶ 1064-1067.DOI∶10.1002/jsfa.7444.
[5] 田元勇, 高悦勉. 虾夷扇贝卵巢酶水解产物抗氧化性的研究[J].大连海洋大学学报, 2007, 22(1): 46-48.
[6] GILDBERG A, ESPEJO-HERMES J, MAGNO-OREJANA F.Acceleration of autolysis during fish sauce fermentation by adding acid and reducing the salt content[J]. Journal of the Science of Food &Agriculture, 1984, 35(12): 1363-1369. DOI:10.1002/jsfa.2740351214 .
[7] SHEN Q, GUO R, DAI Z, et al. Investigation of enzymatic hydrolysis conditions on the properties of protein hydrolysate from fish muscle(Collichthys niveatus) and evaluation of its functional properties[J].Journal of Agricultural & Food Chemistry, 2012, 60(20): 5192-5198.DOI:10.1021/jf205258f.
[8] SAMARANAYAKA A G P, LI-CHAN E C Y. Autolysis-assisted production of fish protein hydrolysates with antioxidant properties from Pacific hake (Merluccius productus)[J]. Food Chemistry, 2008,107(2): 768-776. DOI:10.1016/j.foodchem.2007.08.076.
[9] 倪小英, 张永普, 贾守菊, 等. 小荚蛏消化酶活性的季节变化[J]. 江西科学, 2007, 25(3): 288-291. DOI:10.13990/j.issn1001-3679.2007.03.017.
[10] LATYSHEV N A, ERMOLENKO E V, KASYANOV S P.Concentration and purification of polyunsaturated fatty acids from squid liver processing wastes[J]. European Journal of Lipid Science &Technology, 2015, 116(11): 1608-1613. DOI:10.1002/ejlt.201400083.
[11] JANUMA S, MIYAJIMA K, ABE T. Development and comparative test of squid liver artificial bait for tuna longline[J]. Fisheries Science,2003, 69(2): 288-292. DOI:10.1046/j.1444-2906.2003.00619.x.
[12] JANUMA S. The application of processed bait for pelagic tuna longline made by liver of squid (present state and tasks ahead of zero emission on fisheries)[J]. Bulletin of the Japanese Society of Scientific Fisheries, 2001, 67: 313-314. DOI:10.2331/suisan.67.313.
[13] 田爱民, 罗日明, 周小敏, 等. 鱿鱼内脏酶解液美拉德反应致香成分GC-MS分析[J]. 安徽农业科学, 2013, 41(3): 1278-1280.DOI:10.13989/j.cnki.0517-6611.2013.03.014.
[14] 徐伟, 石海英, 朱奇, 等. 鱿鱼加工废弃物鱼酱油发酵过程中的生物胺变化研究[J]. 安徽农业科学, 2010, 38(4): 2055-2057.DOI:10.13989/j.cnki.0517-6611.2010.04.023.
[15] SASAKI T, KOUDOU M, MICHIHATA T, et al. Purification and antihypertensive activity of a novel angiotensin-Ⅰ converting enzyme inhibitory peptide from fish sauce, ishiru[J]. Japanese Journal of Complementary & Alternative Medicine, 2013, 10(1): 45-49.DOI:10.1625/jcam.10.45.
[16] 叶丛林, 李荣, 杨最素, 等. 乌贼内脏酶解多肽的制备和抗氧化活性研究[J]. 安徽农业科学, 2013(14): 6159-6161. DOI:10.13989/j.cnki.0517-6611.2013.14.084.
[17] CARDENAS-LOPEZ J L, HAARD N F. Identification of a cysteine proteinase from jumbo squid (Dosidicus gigas) hepatopancreas as cathepsin L[J]. Food Chemistry, 2009, 112(2): 442-447. DOI:10.1016/j.foodchem.2008.05.100.
[18] OKAMOTO Y, OTSUKAFUCHINO H, HORIUCHI S, et al.Purification and characterization of two metalloproteinases from squid mantle muscle, myosinaseⅠ and myosinase Ⅱ[J]. Biochimica Et Biophysica Acta, 1993, 1161(1): 97-104. DOI:10.1016/0167-4838(93)90202-3.
[19] TAMORI J, KANZAWA N, TAJIMA T, et al. Purification and characterization of a novel isoform of myosinase from spear squid liver[J]. Journal of Biochemistry, 1999, 126(5): 969-974.
[20] EHARA T, TAMIYA T, TSUCHIYA T. Investigation of myosin heavy chain-degrading proteinase in squid muscle[J]. Nsugaf, 1994, 60(4):527-528. DOI:10.2331/suisan.60.527.
[21] SAKAI-SUZUKI J, TOBE M, TSUCHIYA T, et al. Purification and characterization of acid cysteine proteinase from squid mantle muscle[J]. Comparative Biochemistry & Physiology Part B Comparative Biochemistry, 1986, 85(4): 887-893. DOI:10.1016/0305-0491(86)90192-6.
[22] FUNAKI J, TAMURA T, NISHINOAKI M, et al. Utilization of oryzacystatin for regulating the ripening of squid Shiokara, a traditional Japanese salted and fermented seafood[J]. Journal of Food Science,2010, 75(9): S527-S530. DOI:10.1111/j.1750-3841.2010.01840.x.
[23] TIAN Y, UMEZAWA E, DUAN R, et al. Three types of proteinases in Japanese common squid Todarodes pacificus, hepatopancreas as studied by using carp myofibrils as substrate[J]. Fisheries Science,2010, 76(2): 365-373. DOI:10.1007/s12562-009-0206-x.
[24] KATO S, KONNO K. Isolation of carp myosin rod and its structural stability[J]. Nsugaf, 1993, 59(3): 539-544. DOI:10.2331/suisan.59.539.
[25] SHEREKAR S V, GORE M S, NINJOOR V. Purification and characterization of cathepsin B from the skeletal muscle of fresh water fish, Tilapia mossambica[J]. Journal of Food Science, 2010, 53(4):1018-1023. DOI:10.1111/j.1365-2621.1988.tb13521.x.
[26] TIAN Y, WANG W, YUAN C, et al. Nutritional and digestive properties of protein isolates extracted from the muscle of the common carp using pH-shift processing[J]. Journal of Food Processing & Preservation, 2016,41(1): e12847. DOI:10.1111/jfpp.12847.
[27] BRÖMME D, STEINERT A, FRIEBE S, et al. The specificity of bovine spleen cathepsin S. A comparison with rat liver cathepsins L and B[J]. Biochemical Journal, 1989, 264(2): 475-481. DOI:10.1042/bj2640475.
[28] ZHOU D Y, CHANG X N, BAO S S, et al. Purification and partial characterisation of a cathepsin L-like proteinase from sea cucumber (Stichopus japonicus) and its tissue distribution in body wall[J]. Food Chemistry, 2014, 158(8): 192-199. DOI:10.1016/j.foodchem.2014.02.105.
[29] ZHONG C, CAI Q F, LIU G M, et al. Purification and characterisation of cathepsin L from the skeletal muscle of blue scad (Decapterus maruadsi) and comparison of its role with myofibril-bound serine proteinase in the degradation of myofibrillar proteins[J].Food Chemistry, 2012, 133(4): 1560-1568. DOI:10.1016/j.foodchem.2012.02.050.
[30] 董训江, 钟婵, 蔡秋凤, 等. 杂色鲍组织蛋白酶L的分离纯化与性质研究[J]. 食品工业科技, 2011(12): 247-250. DOI:10.13386/j.issn1002-0306.2011.12.080.
Identification of Proteases and Purification of Cathepsin L from Squid Liver
TIAN Yuanyong, SONG Yang, ZHENG Yao, LIU Huihui, LIU Junrong*
(College of Food Science and Engineering, Dalian Ocean University, Dalian 116023, China)
Abstract:In order to understand the applicability of endogenous proteases from squid liver as a rich source of proteases, the endogenous proteases of squid liver were identified and characterized with common carp myofibrillar protein as substrate by adding a variety of protease inhibitors. It was found that the degradation of myosin heavy chain (MHC) was significantly inhibited by addition of E-64, 1,10-phenanthroline and PMSF to the reaction system indicating that squid liver contained three kinds of proteases, metalloprotease, cysteine protease and serine protease. The cysteine protease had the best thermal stability and highest activity, which still maintained a high activity at temperatures higher than 50 ℃, and it could hydrolyze myofibrillar proteins into small molecules. Substrate specificity analysis indicated that the cysteine protease could only hydrolyze Z-phe-Arg-MCA, and was inhibited 100% by leupeptin and 99.4% by E-64, indicating that the enzyme consisted mainly of cathepsin L. At last, cathepsin L was purified to homogeneity by ammonium sulfate precipitation, ion exchange and gel filtration chromatography. The purified enzyme showed a molecular weight of about 25 kD.
Key words:squid liver; enzymatic hydrolysis; inhibitor; fluorogenic substrate; cathepsin L
DOI:10.7506/spkx1002-6630-201724005
中图分类号:TS254
文献标志码:A
文章编号:1002-6630(2017)24-0028-06
引文格式:
田元勇, 宋扬, 郑尧, 等. 鱿鱼肝脏蛋白酶的鉴定及组织蛋白酶L的分离纯化[J]. 食品科学, 2017, 38(24): 28-33.
DOI:10.7506/spkx1002-6630-201724005. http://www.spkx.net.cn
TIAN Yuanyong, SONG Yang, ZHENG Yao, et al. Identification of proteases and purification of cathepsin L from squid liver[J]. Food Science, 2017, 38(24)∶ 28-33. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724005.http∶//www.spkx.net.cn
收稿日期:2016-11-08
基金项目:国家自然科学基金面上项目(31671790);辽宁省教育厅科学研究一般项目(L2015082);
教育部留学回国人员科研启动基金项目(教外司留[2013]693号)
作者简介:田元勇(1978—),男,讲师,博士,研究方向为水产品加工。E-mail:tianyuanyong@foxmail.com
*通信作者:刘俊荣(1963—),女,教授,博士,研究方向为水产品加工与质量安全。E-mail:ljunrong@dlou.edu.cn