房盟盟,刘贵珊*,何建国,冯愈钦,郭红艳,丁佳兴,杨晓玉
(宁夏大学农学院,农产品无损检测实验室,宁夏 银川 750021)
摘 要:将高光谱技术与流化床富集技术相结合,用大孔吸附树脂对干红葡萄酒中的微量白藜芦醇吸附后,采集光谱图像,通过比对多种预处理方法对建模效果的影响进而优选算法。结果表明,采用霍特林T2统计检测方法剔除异常样本,KS算法划分白藜芦醇含量样本集,标准正态变换法预处理光谱数据,建立的标准正态变换-偏最小二乘回归模型预测效果最优,其校正相关系数Rc2为0.813 8,校正均方根误差为0.047 7,预测相关系数R2p为0.782 4,预测均方根误差为0.050 2,为白藜芦醇的高光谱痕量检测提供理论参考。
关键词:高光谱技术;白藜芦醇;流化床;富集;算法优化
白藜芦醇是具有芪类结构的一种不属于黄酮类的多酚化合物,它是一些植物受到各种应激时自身合成的抗毒素[1],已在花生、开心果、葡萄及其衍生物等72 种植物中发现白藜芦醇[2-3],其中葡萄中含量最高,主要存在于葡萄果皮和种子中,可通过饮用红葡萄酒摄入白藜芦醇[4]。红葡萄酒中的白黎芦醇是植物中的天然抗氧化剂,可以缓解人体细胞衰老,具有调节血脂、改善血小板凝集、保持血管弹性正常[5-7]作用,还可以通过降低DNA聚合酶的活性从而有效抑制细胞癌变、诱导基因表达致使癌细胞死亡等[8]。
白藜芦醇在自然界中的含量较低,一般为mg/L数量级。在红葡萄酒中,大约1L含有1 mg的白藜芦醇,干白葡萄酒中白藜芦醇的含量仅为干红葡萄酒的15%左右[9]。常规白黎芦醇的检测方法主要包括分光光度法、气相色谱-质谱联用法、液相色谱-质谱联用技术等,存在检测对象单一、步骤繁琐、耗时长、费用高等缺点[10-11],而光谱检测技术具有快速、无损、高效、成本低的优势,即光波透过待测样品的表面,对待测物无破坏性,几分钟甚至几秒钟内即可完成样品的一次测试,达到检测样品内外品质的目的[12-13]。通常光谱检测技术主要应用在常量组分的无损检测中,针对低含量组分检测灵敏度低,检测上限受到限制等制约因素,本实验提出了先富集再检测的研究思路,借助大孔吸附树脂吸附快、解吸快、吸附容量大、选择性高、易于再生、使用寿命长等特点,使干红葡萄酒中的白藜芦醇分子吸附在树脂的表面,利用“图谱融合”的高光谱信息进行建模,以期突破高光谱技术在微量组分检测上的瓶颈。
本实验搭建流化床富集装置和高光谱采集系统,利用大孔吸附树脂富集干红葡萄酒中的白藜芦醇,采集高光谱信息,运用化学计量学方法建立干红葡萄酒中白藜芦醇含量的快速检测模型,为白藜芦醇的高光谱痕量分析提供理论参考。
1.1 材料与试剂
2014年蛇龙珠干红葡萄酒 宁夏西夏王葡萄酒业有限公司;H103大孔吸附树脂(20~60目) 郑州勤实科技有限公司。
甲醇(色谱纯),无水乙醇、盐酸、氢氧化钠、磷酸(均为分析纯) 天津科密欧化学试剂有限公司;乙腈(色谱纯) 美国ChromaDex公司;白藜芦醇标品 中国食品药品检定研究院。
1.2 仪器与设备
一次性有机滤器(0.45 μm×13 mm)、滤膜(0.45 μm×50 mm)、滤网(80 目)、HY-4型调速振荡仪常州国华电器有限公司;BT-50EA/153YX型蠕动泵重庆杰恒蠕动泵有限公司;SHB-IIIS型循环水式多用真空泵 郑州长城科工贸有限公司;pHS-25型pH计上海仪电科学仪器股份有限公司;AL204型电子天平梅特勒-托利多仪器(上海)有限公司;1100型高效液相色谱仪 美国安捷伦科技公司;N17E-NIR型光谱成像系统(光谱范围900~1 700 nm) 北京卓立汉光仪器有限公司。
光谱成像系统:Imspector N17E型近红外成像光谱仪芬兰奥卢光谱成像有限公司;35 WHSIA-LS-TDIF型卤钨灯线光源(4 个)、N17E-NIR近红外高光谱成像系统、PSA200-11-X型推扫式输送装置 北京卓立汉光仪器有限公司;Zelos-285 GV型CCD相机 德国KappaoptoelectronicsGmbH公司;采集暗箱和信息处理的计算机(CPU为Inter(R) Core i7-2 600,主频为3.40 GHz,内存为4.00 G) 联想(北京)有限公司。
1.3 方法
1.3.1 高效液相色谱法测定白藜芦醇含量
白藜芦醇在波长365 nm处显蓝紫色荧光,在300~310 nm区间存在最大吸收波长,实验中选择检测波长为305 nm[14]。用电子天平分别称取白藜芦醇标品0.005 0、0.010 0、0.015 0、0.020 0 g,然后用1 mL甲醇溶解,定容至5 mL,配制成4 种不同质量浓度的白藜芦醇标准溶液。高效液相色谱仪对葡萄酒中白藜芦醇含量进行分析检测时,采用AQ-C18色谱柱(4.6 mm×250 mm,5 μm),二极管阵列检测器,进样量10 μL,流速1.0 mL/min,其色谱条件设定为:进样量10 μL,流速0.9 mL/min,柱温35 ℃,流动相甲醇与水的体积比为45∶55。梯度洗脱:A为去离子水(磷酸调解pH 2.4),B为纯乙腈,分析前分别通过0.45 μm有机滤膜过滤,超声振荡10 min除去气泡,起始时流动相A、B的体积比为65∶35,0~10 min,保持35% B;10~20 min,35%~100% B;20~30 min,保持100% B;30~35 min,100%~35% B;35~40 min,保持35% B。
1.3.2 大孔吸附树脂对葡萄酒中白藜芦醇的富集
1.3.2.1 大孔吸附树脂预处理
生产出的大孔吸附树脂未经处理时,含有未聚合单体、致孔剂、交联剂等多种残留,为避免因残留物对实验的影响,降低实验误差,使用前需进行预处理[15-16]。处理方法:1)采用质量分数5%盐酸溶液对树脂进行浸泡,同时用玻璃棒搅拌,使盐酸与树脂充分接触4 h后,用蒸馏水清洗溶液,待pH值检测后呈现中性为止;2)酸处理后洗净的树脂用质量分数2%氢氧化钠溶液浸泡,4 h后,蒸馏水冲洗至中性;3)用体积分数95%乙醇溶液对酸碱处理后的树脂浸泡24 h,蒸馏水冲洗,待树脂无醇味且无浑浊现象,取出树脂加热干燥,放入室温条件下的广口瓶中密封保存。
1.3.2.2 白藜芦醇的高效富集
本实验组建流化床吸附装置,主要包括富集容器、蠕动泵、振荡器、料液罐以及废液罐五部分[17]。其中废液罐不密封,避免整套装置压力过大,阻碍料液的流化态形成,影响蠕动泵的工作。
170 个干红葡萄酒样本经0.45 μm滤器过滤除去杂质备用。选取5.0 g预处理过的H103树脂装入富集容器底部,在料液罐中装入400 mL干红葡萄酒,连接好富集装置,开动振荡器,调节其振荡频率为140 次/min,然后开启蠕动泵,调节转速为50 r/min,流量为60 mL/min,开始富集酒样中的白藜芦醇。初次富集结束后,关闭装置,流出液再次装入储液罐中,重复操作,进行二次吸附[18]。结束后,将吸附树脂取出加热烘干,均匀铺在培养皿上。
1.3.3 干红葡萄酒的高光谱数据采集
1.3.3.1 参数确定
选用N17E-NIR近红外高光谱成像系统。图像采集前,需打开高光谱仪器预热30 min。
吸附树脂表面粗糙程度造成光源发生漫发射,影响高光谱信息。同时,在光谱图像信息采集的过程中存在噪声干扰,降低了光谱数据采集的准确性。因此,在采集样本高光谱数据前,需要采集黑、白图像以减弱CCD相机暗电流和高光谱成像系统光源变化对采集样本图像质量的影响。依据下式进行校正[19-21]:
式中:RC为校正后光谱图像强度:IR为原始光谱图像强度;D为黑板图像强度;IW为白板图像强度。
为避免环境光线和噪音的干扰,样品的图像采集过程在暗箱中进行[22]。预先根据光源的照度设定好CCD相机的曝光时间,以保证图像清晰[23]。经反复调整,确定高光谱成像系统的最佳参数值为曝光时间10 ms,图像采集速率13 mm/s,物距2 cm。
1.3.3.2 高光谱数据采集
实验过程中,将样本逐个放于载物台上,关闭暗箱门,连接位移平台控制电机,开始扫描,获取900~1 700 nm波段的高光谱图像信息。为减少背景图像中冗余信息的影响,采用软件ENVI V.4.6(美国Research System公司)进行裁剪[24],选取2×2个像素点为感兴趣区域,将平均光谱信息作为原始光谱进行分析。
2.1 大孔吸附树脂富集效果

图1 吸附前(a)、后(b)的H103大孔吸附树脂
Fig. 1 H103 macroporous resin before (a) and after (b) adsorption of resveratrol
如图1所示,吸附后树脂颜色明显加深,松散度降低。高效液相色谱法分析H103树脂用于富集装置对葡萄酒中白藜芦醇的吸附富集效果,检测的色谱条件同1.3.1节,测定结果显示流出液中基本不含白藜芦醇,即H103树脂对白藜芦醇有很好的吸附效果。
2.2 原始光谱分析
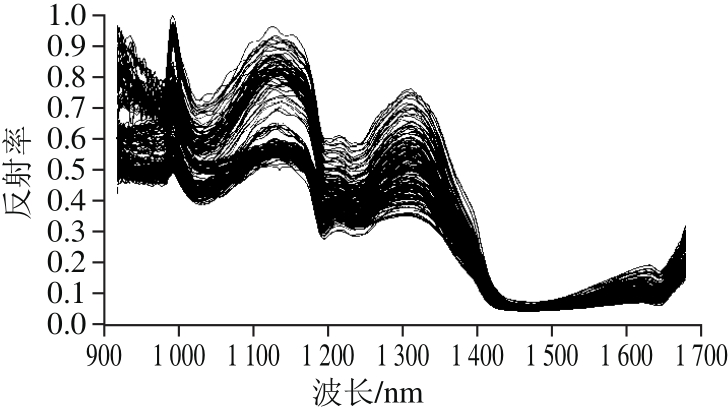
图2 900~1 700 nm检测范围内吸附树脂样品的原始光谱曲线
Fig. 2 Original spectra of resin samples in the range of 900–1 700 nm
由图2可以看出,170 个测试样品的原始光谱曲线共获取256 个波段,在970~1 000 nm之间样本有较强的反射率,在1 000~1 100 nm之间有一个吸收峰,这是O—H的3 倍拉伸振动的合频吸收峰。大部分光谱曲线具有相同的趋势,干红葡萄酒中白藜芦醇含量高的样本反射率高于白藜芦醇含量低的样本。其中波长在1 300~1 450 nm范围内反射率差异有逐渐减小的趋势;噪音明显的波长在975 nm以下和1 630 nm以上,因此,选取975~1 630 nm光谱区域内(220 个波段)进行分析。
2.3 基于霍特林(Hotelling)T2检验的白藜芦醇异常样本检测结果
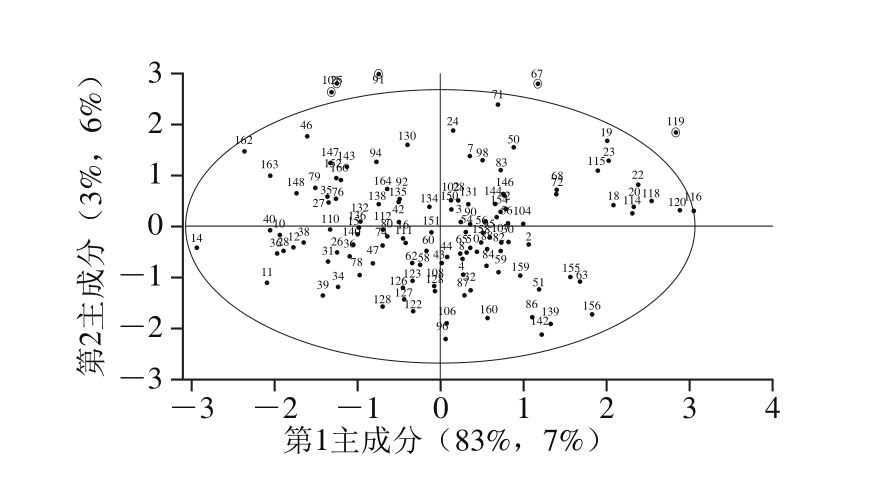
图3 白藜芦醇含量样本分布图
Fig. 3 Distribution of resveratrol content in resin samples
基于霍特林T2异常样本检测方法,检测干红葡萄酒中白藜芦醇含量样本的异常值[25],如图3所示,在选择临界极限5%时,白藜芦醇含量模型中105、75、91、67、119号样品明显偏离圆心较远,超出极限值,这是由于吸附树脂中的成分含量复杂,不仅含有白藜芦醇,也含有极少量葡萄酒中的花色苷等微量成分,光谱中包含了多种元素信息,在测定单一元素时其他元素等各种因素都会对实验结果产生影响。此外,虽然在获取实验数据时采用了一定的误差处理方法,但仍存在一些随机误差,如高频随机噪声、基线漂移、样品表面差异等。因此,结合图3可以得出,5%显著差异时,以上观测值的标号值对应的样本是异常样本。剔除异常样本后,输入样本的光谱数据及化学测定值,利用The Unscrambler X软件建立偏最小二乘回归(partial least squares regression,PLSR)模型,得到葡萄酒中白藜芦醇含量PLSR校正模型和预测模型,其校正集相关系数Rc2为0.731 2,校正均方根误差(root mean square error of the corrections,RMSEC)为0.056 2;预测集相关系数Rp2为0.705 0,预测均方根误差(root mean square error of the predictions,RMSEP)为0.059 1,说明剔除异常样本后的预测含量与真实含量相关性良好。
2.4 白藜芦醇含量样本集划分
剔除异常样本后,分别用选样本(Kennard-Stone,KS)法、X-Y共生距离(Sample set partitioning based on joint X-Y distances,SPXY)法、随机选择(random select,RS)法按照3∶1的比例将165 个白藜芦醇含量样本集划分成校正集(120 个样本)和预测集(45 个样本),如表1所示。
表1 不同方法划分样品集后校正集与预测集中白藜芦醇含量的统计结果
Table 1 Statistical results of resveratrol content in calibration and prediction sets established by different methods

通过对总体均值和标准差的计算,得到总体均值和标准差分别为0.387 mg/L和0.099 mg/L,由表1可以看出,KS法所得校正集和预测集的均值与样本集总体均值相差较小,分别为0.004 mg/L和0.025 5 mg/L;SPXY法所得校正集和预测集的均值与样本集总体均值相差为0.005 8 mg/L和0.029 7 mg/L;RS法所得校正集和预测集的均值与样本集总体均值相差较大,分别为0.015 3 mg/L和0.036 1 mg/L。这说明KS法所得校正集和预测集的数据分布比RS法和SPXY法更均匀。因此,3 种划分方法比较而言,KS法更适于划分干红葡萄酒中白藜芦醇含量样本集。
为进一步对划分方法进行比较,研究3 种样本集划分方法对干红葡萄酒中白藜芦醇含量预测模型性能的影响,比较了由KS法、SPXY法、RS法所得校正集光谱经不同光谱预处理后所建模型的性能参数,如表2所示。
表2 基于3 种样品划分方法的白藜芦醇含量PLSR分析模型结果
Table 2 The results of PLSR analysis of resveratrol content based on three sample partitioning methods

由表2可以看出,由KS法划分干红葡萄酒中白藜芦醇含量样本集,所得的PLSR模型Rp2为0.768 7,RMSEP为0.053 1;由SPXY法划分白藜芦醇含量样本集,所得的PLSR模型R2p为0.736 5,RMSEP为0.053 4;由RS法划分白藜芦醇含量样本集,所得的PLSR模型R2p为0.749 8,RMSEP为0.053 2。KS法划分后建立的模型性能明显优于SPXY法,其Rp2提升0.032 2,RMSEP减小0.000 3,相比于RS法,其Rp2提升0.018 9,RMSEP减小0.000 1。故由表1、2可知,KS法最适于划分干红葡萄酒中白藜芦醇含量样本集。
2.5 光谱预处理方法选择与模型的建立
2.5.1 白藜芦醇含量的PLSR模型建立
为了消除光谱曲线上的噪音与其他无关信息的干扰,提取出有用信号,增强分析信息,需要对原始光谱进行光谱预处理[26-27]。实验中,样本集由霍特林T2统计检验剔除异常样本后,采用KS法按照校正集和预测集3∶1的比例划分,经不同光谱预处理方法处理后,建立PLSR模型,如表3所示。
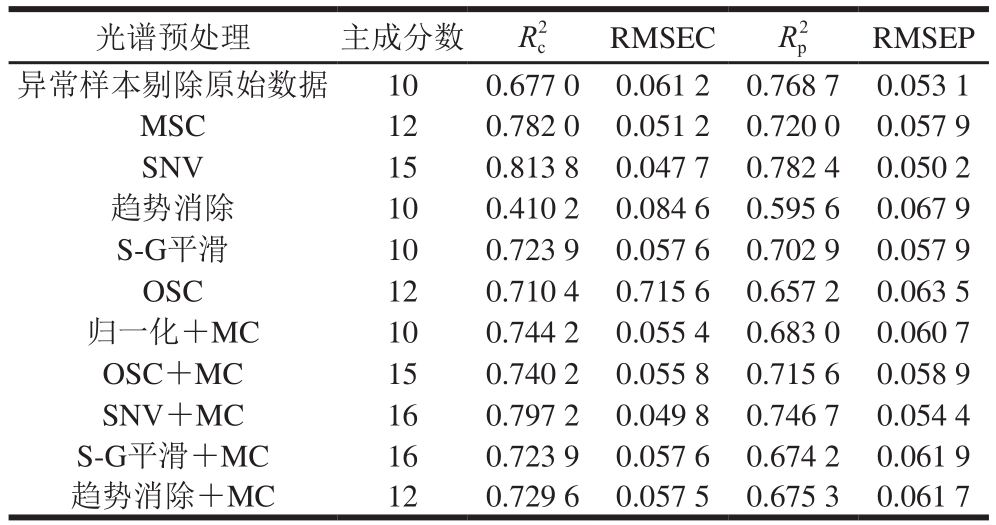
表3 不同光谱预处理后白藜芦醇含量的PLSR模型结果
Table 3 Parameters of PLSR models developed by different spectral pretreatments
注:多元散射校正(multiplicative scatter correction,MSC);卷积(Savitzky-Golay,S-G)平滑法;正交信号校正(orthogonal signal correction,OSC)法;中心化(mean center,MC)法。
由表3可以看出,标准正态变换(standard normal variate,SNV)方法预处理后所建PLSR模型的性能参数最优,其Rp2为0.782 4,RMSEP为0.050 2,较原始数据的预测模型相比,Rp2提高了0.013 7,RMSEP减小0.002 9。经SNV预处理后建立PLSR校正集、预测集模型,如图4所示。因此,选择SNV为建立白藜芦醇含量样本集PLSR模型的最优光谱预处理方法。
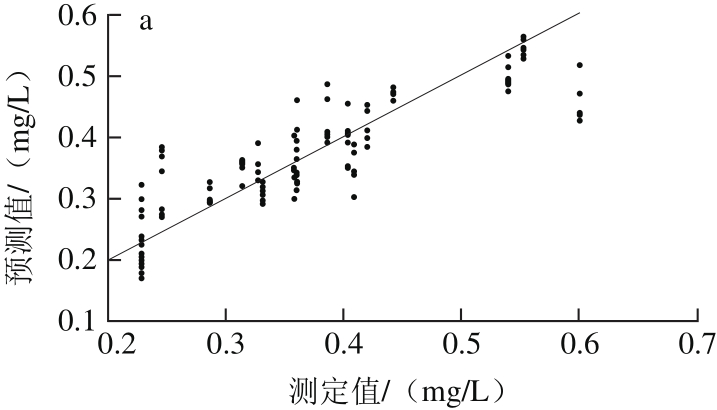

图4 PLSR-SNV模型校正(a)与预测(b)效果图
Fig. 4 Plots for calibration (a) and prediction sets (b) by PLSR-SNV model
2.5.2 白藜芦醇含量主成分回归(principal component regression,PCR)模型建立
与PLSR模型类似,用KS法按照校正集和预测集3∶1的比例划分样本,依照最优光谱预处理快速选择方法,经不同的光谱预处理方法预处理后,建立干红葡萄酒中白藜芦醇含量的PCR模型,如表4所示。
表4 不同光谱预处理后白藜芦醇含量的PCR模型结果
Table 4 Parameters of PCR models developed by different spectral pretreatments

由表4可以看出,经SNV+MC预处理后所建PCR模型的性能参数最优,其R2p为0.716 5、RMSEP为0.058 3,OSC+MC处理后建模效果次之,R2p为0.706 4、RMSEP为0.058 5。因此,依照最优光谱预处理快速选择方法将两者结合,得到SNV+OSC+MC的预处理方法,用组合的预处理方法处理建模,其Rp2为0.585 3、RMSEP为0.068 5,不及SNV+MC方法。经SNV+MC预处理后建立的干红葡萄酒中白藜芦醇含量PCR校正级、预测级模型,如图5所示。因此,选择SNV+MC为建立白藜芦醇含量样本集PCR模型的最优光谱预处理方法。
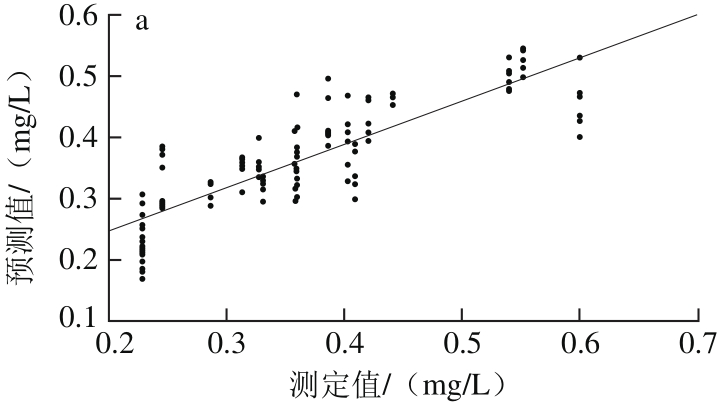
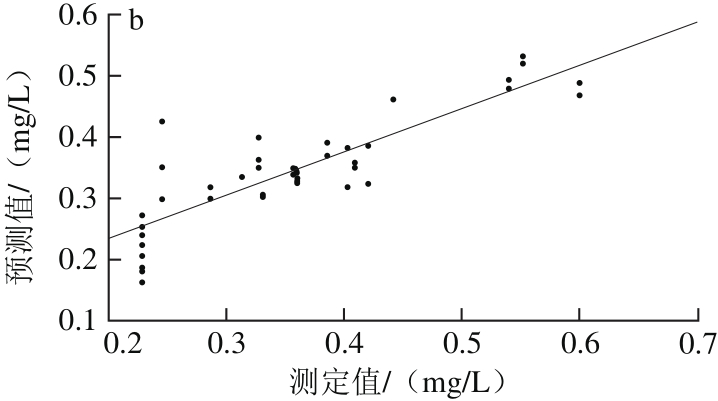
图5 PCR-SNV-MC模型校正(a)与预测(b)效果图
Fig. 5 Plots for calibration (a) and prediction sets (b) by PCR-SNV-MC model
2.5.3 白藜芦醇含量多元线性回归(multiple linear regression,MLR)模型建立
采用多种光谱预处理方法对剔除异常样本后的样本集光谱进行预处理,用KS法按照校正集和预测集3∶1的比例划分样本,建立干红葡萄酒中白藜芦醇含量的MLR模型,如表5所示。
表5 不同光谱预处理后白藜芦醇含量的MLR模型结果
Table 5 Parameters of MLR models developed by different spectral pretreatments
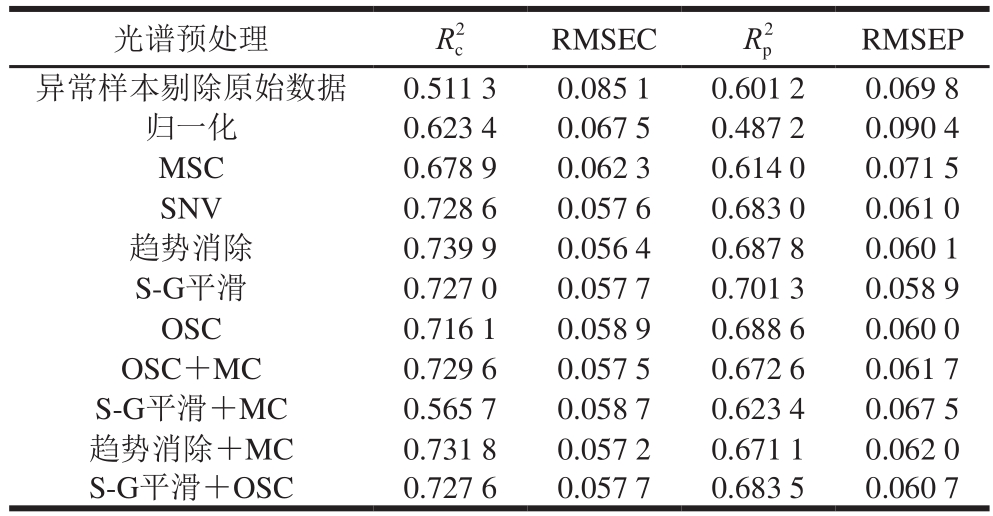
由表5可以看出,采用单独的光谱预处理方法处理后所得白藜芦醇含量MLR模型结果差异很大,其中,经S-G平滑预处理后模型的效果最优,其Rp2为0.701 3、RMSEP为0.058 9;OSC预处理效果次优,R2p为0.688 6、RMSEP为0.060 0;依照最优光谱预处理快速选择方法,将S-G平滑与OSC预处理方法相组合。经S-G平滑+OSC预处理后,得到模型的R2p为0.683 5、RMSEP为0.060 7,模型的性能降低。经S-G平滑预处理后建立干红葡萄酒中白藜芦醇含量MLR校正级、预测级模型,如图6所示。因此,选择S-G平滑为建立白藜芦醇含量样本集MLR模型的最优光谱预处理方法。
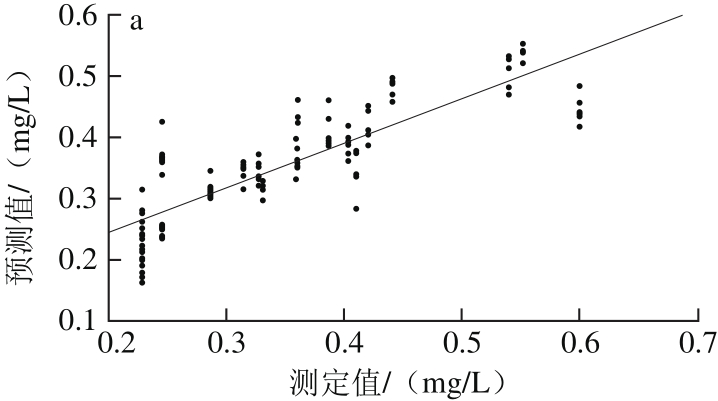
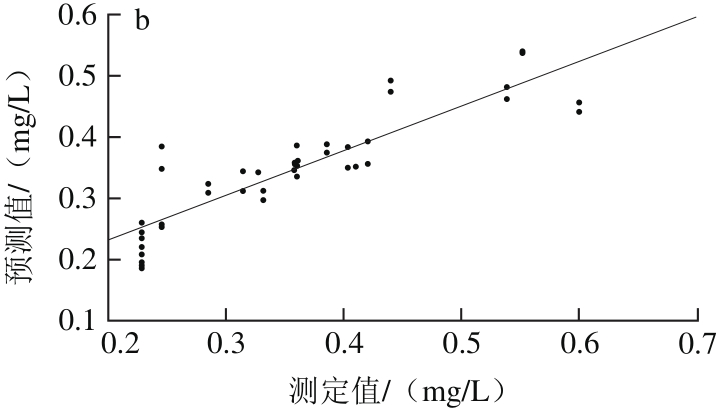
图6 MLR-S-G模型校正(a)与预测(b)效果图
Fig. 6 Plots for calibration (a) and prediction sets (b) by MLR-S-G model
2.5.4 白藜芦醇含量不同模型性能比较
表6 不同建模方法所得的白藜芦醇含量高光谱定量分析模型性能比较
Table 6 Comparison of the performance of different models for the quantitative analysis of resveratrol content
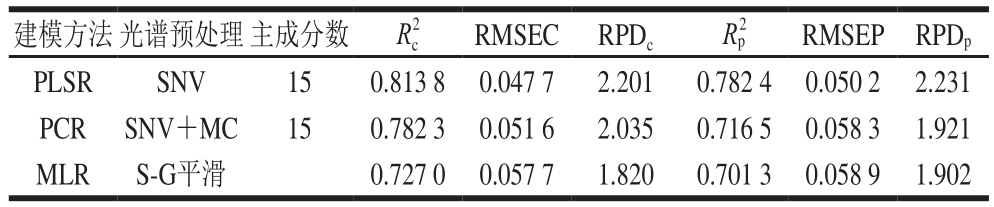
注:RPD为检测样品标准误差与标准偏差的比值[28],RPD值介于1.75~2.5范围内表示所建校正模型基本可用;RPD值介于2.5~5范围内表示所建校正模型基本成功;RPD值介于5~8范围内表示所建校正模型成功;RPD值大于8时,建立的校正模型非常成功[29]。
白藜芦醇含量样本光谱经最优预处理方法处理后,分别采用PLSR、PCR、MLR方法建立模型,如表6所示。白藜芦醇含量的PLSR模型最优,PCR模型次之,MLR模型较差。在白藜芦醇含量的3 种模型中,PLSR模型性能优于MLR模型和PCR模型,这是因为PLSR分析是多元线性回归分析、典型相关分析和主成分分析3 种方法的融合,它集中了这3 种方法的优点。
经SNV光谱预处理后,当主成分因子数为15时,白藜芦醇含量PLSR模型性能参数R2c为0.813 8、RMSEC为0.047 7;R2p为0.782 4、RMSEP为0.050 2,校正分析误差RPDc为2.201,预测分析误差RPDp为2.231。显然,RPDc值和RPDp值均介于1.75~2.5范围内,所以,建立的白藜芦醇含量PLSR模型可用作预测模型计算。
2.6 白藜芦醇含量的高光谱特征波长的比较
表7 全波段与特征波段模型效果比较
Table 7 Comparison of the performance of full band and characteristic band models
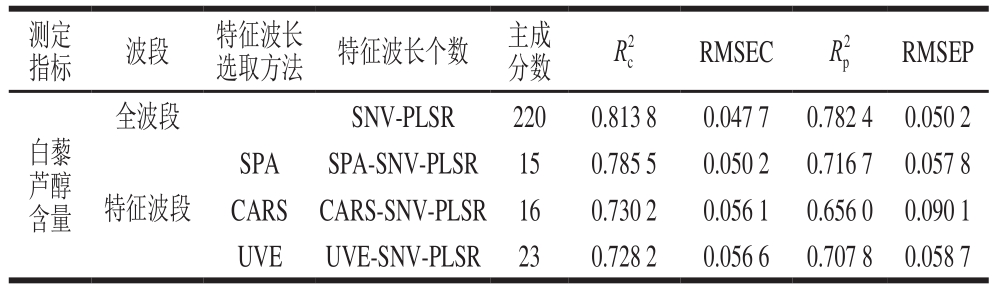
采用连续投影算法(successive projections algorithm,SPA)、竞争性自适应重加权(competitive adaptive reweighted sampling,CARS)法、无信息变量消除(uninformative variables elimination,UVE)法3 种特征波长选择方法选择光谱特征波长[30],并对3 种方法所得的特征波长建模,如表7所示。可以看出,用SPA、CARS法、UVE法提取特征波长建模,虽然均减少了建模波点个数,但其所选出的白藜芦醇含量特征波长建立的SPA-SNV-PLSR模型、CARS-SNV-PLSR模型、UVE-SNV-PLSR模型,3 个模型的各项评价指标均不及全波段模型,未能提高干红葡萄酒中白藜芦醇含量预测模型的性能。这是由于在对光谱信息做综合提取时,虽能减少冗余波长的干扰,但只注重最具概括性的光谱波段信息,忽略了小贡献率光谱波段对白藜芦醇含量的解释性,而全波段建模时能概括全部光谱信息。综上,若要提高干红葡萄酒中白藜芦醇整体品质检测效果,需获得尽量全面的空间光谱信息,这样建立的预测模型效果更好。
本研究针对高光谱技术检测限高、灵敏度低的问题,将高光谱成像技术与大孔吸附树脂、流化床技术融合,搭建富集装置,把干红葡萄酒中的微量白藜芦醇浓缩至H103大孔吸附树脂,采集光谱图像信息并结合化学检测方法,建立干红葡萄酒中白藜芦醇含量的预测模型。采用霍特林T2统计检测方法剔除异常样本,用KS、SPXY、RS 3种方法划分样本集,选取最优样本划分方法,经多种方法预处理后建立PLSR、PCR、MLR模型并优选模型。同时,采用SPA、CARS法、UVE法3种特征波长选择算法提取特征波长并建模,比较全波段与特征波段的建模效果。结果表明,霍特林T2统计检测方法剔除异常样本后,KS算法最适于划分样本集,SNV法处理光谱数据后建立的SNV-PLSR模型预测效果最优,其Rc2为0.813 8,RMSEC为0.047 7;预测相关系数Rp2为0.782 4,RMSEP为0.050 2。应用高光谱图像技术结合富集流化床装置,所得SNV-PLSR模型能够有效预测干红葡萄酒中的白藜芦醇含量,有效解决了高光谱技术在微量成分检测限低的问题,为高光谱成像技术在痕量成分的检测提供了新方法。
参考文献:
[1] 张贵娟, 杨涛, 罗非君, 等. 白藜芦醇的提取与检测方法研究进展[J]. 食品与机械, 2013, 29(2)∶ 234-237. DOI∶10.3969/j.issn.1003-5788.2013.02.057.
[2] 黄卫文, 李忠海, 黎继烈, 等. 白藜芦醇的合成研究进展[J]. 中南林业科技大学学报, 2010, 30(10)∶ 72-77. DOI∶10.14067/j.cnki.1673-923x.2010.10.025.
[3] FERNÁNDEZ-MAR M I, MATEOS R, GARCÍA-PARRILLA M C, el al. Bioactive compounds in wine∶ resveratrol, hydroxytyrosol and melatonin∶ a review[J]. Food Chemistry, 2012, 130∶ 797-813.DOI∶10.1016/j.foodchem.2011.08.023.
[4] 张焕丽, 李凡姝, 马慧, 等. 巨峰葡萄皮中白藜芦醇提取工艺的研究[J]. 农产品加工, 2016(9)∶ 29-33. DOI∶10.16693/j.cnki.1671-9646(X).2016.09.009.
[5] LI H G, XIA N, ULRICH F. Cardiovascular effects and molecular targets of resveratrol[J]. Nitric Oxide, 2012, 26(2)∶ 102-110.DOI∶10.1016/j.niox.2011.12.006.
[6] JUAN M E, ALFARAS I, PLANAS J M. Colorectal cancer chemoprevention by trans-resveratrol[J]. Pharmacological Research,2012, 65∶ 584-591. DOI∶10.1016/j.phrs.2012.03.010.
[7] LEE J G, YON J M, LIN C, et al. Combined treatment with capsaicin and resveratrol enhances neuroprotection against glutamate-induced toxicity in mouse cerebral cortical neurons[J]. Food and Chemical Toxicology, 2012, 50(11)∶ 3877-3885. DOI∶10.1016/j.fct.2012.08.040.
[8] BERTELLI A A, DAS D K. Grapes, wines, resveratrol and heart health[J]. Journal of Cardiovascular Pharmacology, 2009, 7(6)∶ 468-476. DOI∶10.1097/FJC.0b013e3181bfaff3.
[9] 吕中, 李菊, 符悦冠, 等. 抗癌药物白藜芦醇与血红蛋白相互作用研究[J]. 华中师范大学学报(自然科学版), 2011, 45(1)∶ 68-71.
[10] BAUR J A, PEARSON K J, PRICE N L, et al. Resveratrol improves health and survival of mice on a high-calorie diet[J]. Nature, 2006,444∶ 337-342. DOI∶10.1038/nature05354.
[11] 张筱蕾, 刘飞, 聂鹏程, 等. 高光谱成像技术的油菜叶片氮含量及分布快速检测[J]. 光谱学与光谱分析, 2014, 34(9)∶ 2513-2518.DOI∶10.3964/j.issn.1000-0593(2014)09-2513-06.
[12] 李蕾蕾, 王海霞, 黄洁燕, 等. 近红外光谱法快速测定枇杷叶中熊果酸的含量[J]. 中国实验方剂学杂志, 2013, 19(23)∶ 103-106.DOI∶10.11653 /syfj2013230103.
[13] 罗阳, 何建国, 贺晓光, 等. 农产品无损检测中高光谱成像技术的应用研究[J]. 农机化研究, 2013(6)∶ 1-7. DOI∶10.13427/j.cnki.njyi.2013.06.011.
[14] 伍晓春. 高效液相色谱测定不同产地虎杖中白藜芦醇的含量[J]. 生命科学仪器, 2009, 7(8)∶ 40-42. DOI∶10.3969/j.issn.1671-7929.2009.08.010.
[15] 潘丽军, 马道荣, 姜绍通, 等. 茶多酚的膨胀床吸附性能研究[J]. 食品科学, 2003, 24(10)∶ 45-48. DOI∶10.3321/j.issn∶1002-6630.2003.10.008.
[16] 路秀玲, 赵东旭, 金业涛, 等. 膨胀床吸附高效纯化牛血红蛋白[J]. 化工学报, 2003, 21(9)∶ 1257-1263. DOI∶10.3321/j.issn∶0438-1157.2003.09.019.
[17] 冯愈钦, 郭红艳, 刘贵珊, 等. 宁夏葡萄酒中白藜芦醇含量的高效液相色谱快速测定[J]. 食品研究与开发, 2017, 38(5)∶ 156-161.DOI∶10.3969/j.issn.1005-6521.2017.05.033.
[18] 郭红艳. 高光谱结合流化床富集技术对葡萄酒中白藜芦醇的快速检测方法研究[D]. 银川∶ 宁夏大学, 2016.
[19] 张保华, 李江波, 樊书祥, 等. 高光谱成像技术在果蔬品质与安全无损检测中的原理及应用[J]. 光谱学与光谱分析, 2014, 34(10)∶ 2743-2751. DOI∶10.3964/j.issn.1000-0593(2014)10-2743-09.
[20] 高海龙, 李小昱, 徐森淼, 等. 透射和反射高光谱成像的马铃薯损伤检测比较研究[J]. 光谱学与光谱分析, 2013, 33(12)∶ 3366-3371.DOI∶10.3964/j.issn.1000-0593(2013)12-3366-06.
[21] GIOVENZANA V, BEGHI R, CIVELLI R, et al. Optical techniques for rapid quality monitoring along minimally processed fruit and vegetable chain[J]. Trends in Food Science & Technology, 2015,46(2)∶ 331-338. DOI∶10.1016/j.tifs.2015.10.006.
[22] 郭红艳, 刘贵珊, 吴龙国, 等. 基于高光谱成像的马铃薯环腐病无损检测[J]. 食品科学, 2016, 37(12)∶ 203-207. DOI∶10.7506/spkx1002-6630-201612036.
[23] ALEXANDRINO G L, KHORASANI M R, AMIGO J M, et al. Monitoring of multiple solid-state transformations at tablet surfaces using multi-series near-infrared hyperspectral imaging and multivariate curve resolution[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2015, 93∶ 224-230. DOI∶10.1016/j.ejpb.2015.03.034.
[24] 丁佳兴, 吴龙国, 何建国, 等. 高光谱成像技术对灵武长枣果皮强度的无损检测[J]. 食品工业科技, 2016, 37(24)∶ 58-62; 68.DOI∶10.13386/j.issn1002-0306.2016.24.003.
[25] 卢文丽, 王伟, 张亚黎, 等. 霍特林T2检验及多元方差分析在生存质量研究中的应用[J]. 中国医院统计, 2002, 9(4)∶ 222-223.
[26] 冯愈钦, 吴龙国, 何建国, 等. 基于高光谱成像技术的长枣不同保藏温度的可溶性固形物含量检测方法[J]. 发光学报, 2016, 37(8)∶1014-1022. DOI∶10.3788 /fgxb20163708.1014.
[27] 王松磊, 吴龙国, 康宁波, 等. 基于高光谱图谱融合技术的宁夏滩羊肉嫩度检测方法研究[J]. 光电子·激光, 2016, 27(9)∶ 987-995.DOI∶10.16136/j.joel.2016.09.0824.
[28] 丁轻针, 刘玲玲, 武彦文, 等. 基于FTIR的芝麻油真伪鉴别和掺伪定量分析模型[J]. 光谱学与光谱分析, 2014, 34(10)∶ 2690-2695.DOI∶10.3964/j.issn.1000-0593(2014)10-2690-06.
[29] 刘旭华, 闵顺耕, 何雄奎, 等. 近红外光谱逆回归降维定量分析模型[J]. 光谱学与光谱分析, 2011, 31(8)∶ 2098-2101. DOI∶10.3964/j.is sn.1000-0593(2011)08-2098-04.
[30] 郭志明. 基于近红外光谱及成像的苹果品质无损检测方法和装置研究[D]. 北京∶ 中国农业大学, 2015.
Algorithm Optimization for Fast Detection of Resveratrol Content in Wine by Hyperspectral Imaging
FANG Mengmeng, LIU Guishan*, HE Jianguo, FENG Yuqin, GUO Hongyan, DING Jiaxing, YANG Xiaoyu
(Non-Destructive Detection Laboratory of Agricultural Products, School of Agriculture, Ningxia University, Yinchuan 750021, China)
Abstract:In this experiment, fluidized-bed enrichment of trace resveratrol in red wine was carried out by macroporous resin adsorption and hyperspectral images of the resin samples were acquired. The prediction models established using various spectral pretreatments were compared for obtaining the optimal algorithm. The results showed that the partial least squares regression (PLSR) model established by removing abnormal samples using Hotelling T2test method, dividing the sample sets using the KS algorithm, and pretreating the spectral data using standard normal variate (SNV) method exhibited the best prediction performance with correlation coefficient of correction (Rc2), root mean square error of calibration (RMSEC),correlation coefficient of prediction (R2p) and root mean square error of prediction (RMSEP) of 0.813 8, 0.047 7, 0.782 4, and 0.050 2, respectively. Hyperspectral imaging can provide a new method for detecting trace components.
Key words:hyperspectral technology; resveratrol; fluidized bed; enrichment; algorithm optimization
DOI∶10.7506/spkx1002-6630-201724014
中图分类号:S123
文献标志码:A
文章编号:1002-6630(2017)24-0087-07
引文格式:
房盟盟, 刘贵珊, 何建国, 等. 红葡萄酒中白藜芦醇含量的高光谱快速检测算法优化[J]. 食品科学, 2017, 38(24): 87-93.
DOI:10.7506/spkx1002-6630-201724014. http://www.spkx.net.cn
FANG Mengmeng, LIU Guishan, HE Jianguo, et al. Algorithm optimization for fast detection of resveratrol content in wine by hyperspectral imaging[J]. Food Science, 2017, 38(24)∶ 87-93. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724014. http∶//www.spkx.net.cn
收稿日期:2017-05-09
基金项目:国家自然科学基金青年科学基金项目(31401480);中央财政支持地方高校改革发展资金——食品学科建设项目(2017)
作者简介:房盟盟(1993—),女,硕士研究生,研究方向为农产品及食品光学无损检测。E-mail:2543675591@qq.com
*通信作者:刘贵珊(1979—),男,副教授,博士,研究方向为农产品及食品光学无损检测。E-mail:liugs@nxu.edu.cn