表1 梯度洗脱程序
Table 1 Gradient elution procedures

王俐娟1,梁杏秋1,王晓琴1,2,*
(1.华侨大学化工学院,福建 厦门 361021;2.华侨大学 油脂及天然产物研究所,福建 厦门 361021)
摘 要:以茶叶籽油为材料,采用60%甲醇溶液提取酚类化合物,经硅胶柱层析后,选取Sephadex LH-20柱对酚类化合物进行分离纯化,并采用反相高效液相色谱-二极管阵列检测技术分析纯化后酚类化合物的组分。以HepG2细胞为供试细胞,结合主成分分析,初步确定茶叶籽油中具有抑制癌细胞活性的酚类化合物。结果表明,Sephadex LH-20柱分离的3 个组分中,Fr1组分所含5 种化合物主要为儿茶素类或黄酮类,其中儿茶素类占62.60%;Fr2组分主要含酚酸类及黄酮类;Fr3组分中黄酮类占78.70%。Fr1、Fr2、Fr3组分抑制HepG2细胞增殖的IC50值分别为1.76%、16.24%及12.35%。对Fr1、Fr2、Fr3组分中酚类化合物及各组分IC50值进行主成分分析,表明茶叶籽油中儿茶素、芦丁为主要HepG2细胞增殖活性抑制成分。
关键词:茶叶籽油;酚类化合物;分离纯化;HepG2;抗增殖
茶叶籽油来源于山茶属植物茶(Camellia sinensis O.Ktze.)的种子,其油脂包括多种人体必需脂肪酸、生育酚、植物甾醇和酚类化合物等活性组分[1-2],是我国卫生部认定的新资源食品。目前对茶叶籽油酚类化合物的研究资料主要集中在总含量及主要组分的分离,对茶叶籽油中酚类化合物的组成及生物活性研究报道较少。Fazel等[3]采用高效液相色谱技术对伊朗南方地区茶叶籽油酚类化合物进行分析鉴定,共鉴定出8 种酚类化合物。本课题组测定了28 种不同品种茶叶籽毛油中茶多酚含量,得出其含量达16.7~529.3 mg没食子酸/kg,同时对茶叶籽油微量活性物质与抗氧化作用进行相关性分析,发现茶叶籽油酚类化合物具有强抗氧化活性[1,4]。
研究报道表明氧化是产生慢性疾病如癌症、老化的主要原因之一,具有强抗氧化活性的多酚类化合物,通常具有抑制肿瘤作用[5-6]。Raquel等[7]通过橄榄油中酚类化合物对结肠腺癌Caco-2/TC7细胞增殖抑制作用研究,表明橄榄油中酚类化合物可使Caco-2/TC7细胞阻滞在G0/G1和S期,诱导Caco-2/TC7细胞凋亡,并提高对致癌物的解毒作用。Maurya等[8]研究表明槲皮素可诱导人肝癌细胞HepG2中p53因子从而抑制磷脂酰肌醇-3激酶和蛋白激酶C发挥人肝癌HepG2细胞的抑制增殖作用。同时有报道指出酚类化合物可参与表观遗传机制如DNA甲基化、蛋白质组乙酰化、miRNA的调控,具有广泛临床应用价值[9-10]。茶叶提取物含多种天然酚类化合物,其通过干扰相关酶活性及信号转导通路的抑制癌细胞增殖机制已有报道[11-12],而茶叶籽油因与茶叶同源,富含天然多酚,它潜在的生理活性作用仍有待探索。本实验对茶叶籽油酚类化合物进行分离纯化,采用反相高效液相色谱-二极管阵列检测技术分析组成及含量,结合HepG2供试细胞抗增殖实验和主成分分析,对其抗肿瘤细胞增殖活性进行研究。
1.1 材料、试剂与仪器
茶叶籽油自制:采摘成熟茶叶籽自然晾干后冷榨。
没食子酸、羟基酪醇、4-羟基苯乙酸、咖啡酸、苯甲酸、肉桂酸、芦丁标准品 美国阿拉丁生物科技有限公司;表儿茶素没食子酸酯、儿茶素、表儿茶素、表没食子儿茶素、表没食子儿茶素没食子酸酯、槲皮素、山柰酚标准品 美国Sigma公司。
粗孔(ZCX-Ⅱ)硅胶 青岛裕民源硅胶试剂厂;LH-20葡聚糖凝胶 美国GE公司;胎牛血清、DMEM培养基、胰蛋白酶 美国Hyclone公司;3-(4,5-二甲基-2-噻唑基)-2,5-二苯基溴化四唑(methylthiazolyldiphenyltetrazolium bromide,MTT)试剂 上海碧云天生物技术有限公司;人肝癌细胞(HepG2) 中国科学院典型培养物保藏委员会细胞库。
TDL-60B台式低速离心机 上海安亭科学仪器厂;Multlskan酶标仪 美国Thermo公司;HF90型CO2培养箱上海力申科学仪器有限公司;LC-20高效液相色谱仪日本岛津公司。
1.2 方法
1.2.1 标准溶液的配制
准确称取没食子酸、羟基酪醇等14 种标准品各10 mg,分别用10 mL色谱纯甲醇定容,得到各标准溶液。分别移取1.0 mL上述标准溶液,用甲醇定容至50 mL,得多酚混合标准贮备液,绘制标准曲线时将混合标准品用甲醇稀释成不同质量浓度梯度。用0.45 μm微孔滤膜过滤,用于色谱定性和定量分析。
1.2.2 样品前处理
参照橄榄油和山茶油[13-16]的前处理方法,得到茶叶籽油多酚化合物粗提液,再依次用硅胶柱和Sephadex LH-20柱分离纯化其中的多酚化合物。准确称取50 g茶叶籽油,加入50 mL正己烷摇匀,加入50 mL提取液(50%乙醇溶液)于旋涡混合器中充分振荡3 min后,3 500 r/min离心10 min,弃去正己烷萃取层,以除去脂溶性物质。重复提取3 次,合并甲醇粗提液于35 ℃条件下旋蒸浓缩至干后,用石油醚-乙酸乙酯(9∶1,V/V)溶液溶解定容至10 mL,得茶叶籽油多酚化合物粗提液。
多酚化合物粗提液经硅胶柱层析[17-18],用石油醚-乙酸乙酯溶液(9∶1、3∶1、3∶2、1∶1、0∶1,V/V)进行梯度洗脱,以50 mL/份收集洗脱液,以1%三氯化铁与2%铁氰化钾的等体积混合物作为显色剂,环己烷-乙酸乙酯-乙酸(10∶2∶0.5,V/V)溶液为展开系统,在硅胶板上分别点样分析,相同的组分合并,将收集到的组分真空旋蒸浓缩。浓缩液过Sephadex LH-20柱,用氯仿-甲醇(1∶1,V/V)溶液等梯度洗脱,10 mL/份收集洗脱液,得Fr1、Fr2、Fr3组分,经0.45 μm微孔滤膜过滤,置于-20 ℃条件下待测。
1.2.3 色谱条件
色谱柱:WondaSil反相C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇-乙腈-乙酸(5∶5∶0.1,V/V)溶液(A),0.2%乙酸溶液(B),采用表1中多级线性梯度洗脱程序,流速1.0 mL/min,柱温35 ℃,检测波长280 nm,进样量10 μL,每次进样前平衡5 min。
表1 梯度洗脱程序
Table 1 Gradient elution procedures

1.2.4 色谱峰定性、定量
线性关系考察:将配制好的梯度混合标准品溶液,按1.2.3节色谱条件进样分析。每个样重复进样3 次,以对照品的质量浓度(mg/L)对峰面积Y进行线性回归分析。
在相同色谱条件下,首先将14 种单体酚分别进样,确定各单体酚的保留时间和出峰顺序,对混合标准品溶液进样,得混合标准品色谱图,再将茶叶籽油多酚纯化组分Fr1、Fr2、Fr3分别进行测试,得各组分对应色谱图。首先将标准品和各组分中峰的保留时间进行比较,初步定性鉴定出未知物;然后向多酚纯化组分中分别单一加入该初步鉴定的单体酚进行测试,将得到的色谱图与各组分对应色谱图进行比较,根据峰高是否增加来验证各个组分,完成茶叶籽油提取物中酚类化合物的定性。最后根据标准品的线性回归方程计算茶叶籽油多酚纯化组分Fr1、Fr2、Fr3中鉴定出来的酚类化合物含量。
1.2.5 茶叶籽油酚类化合物不同组分对HepG2细胞生长的影响
采用MTT法检测茶叶籽油酚类化合物不同组分对HepG2细胞生长的影响。将HepG2细胞接种于DEME培养基中,37 ℃和5% CO2培养箱培养,以0.25%胰酶消化进行传代。取对数生长期细胞,调整细胞浓度为5×104个/mL,接种于96 孔细胞培养板,每孔100 µL。将流分Fr1、Fr2、Fr3减压蒸干,分别用25 µL甲醇溶解后,加入DEME培养基使终体积为5 mL作为母液,分别配制含不同体积分数的茶叶籽油酚类化合物组分(2.5%、5%、10%、15%、20%、25%)的培养基,甲醇溶液的体积分数不超过0.5%。细胞培养24 h后,每孔加入100 µL上述不同体积分数梯度的Fr1、Fr2、Fr3多酚化合物组分,甲醇溶剂对照组加入分别含0.1%、0.2%、0.5%甲醇的DEME培养基,空白对照组加入DEME培养基,均设6 个平行孔。继续培养48 h后每孔加10 mg/mL MTT 10 µL,继续孵育4 h,弃去培养基,加入与初始体积等量的Formazan溶解液,利用酶标仪在570 nm和630 nm双波长检测各孔吸光度,用Bliss法按下式计算细胞抑制率(IC50值):
2.1 茶叶籽油多酚化合物定性定量分析
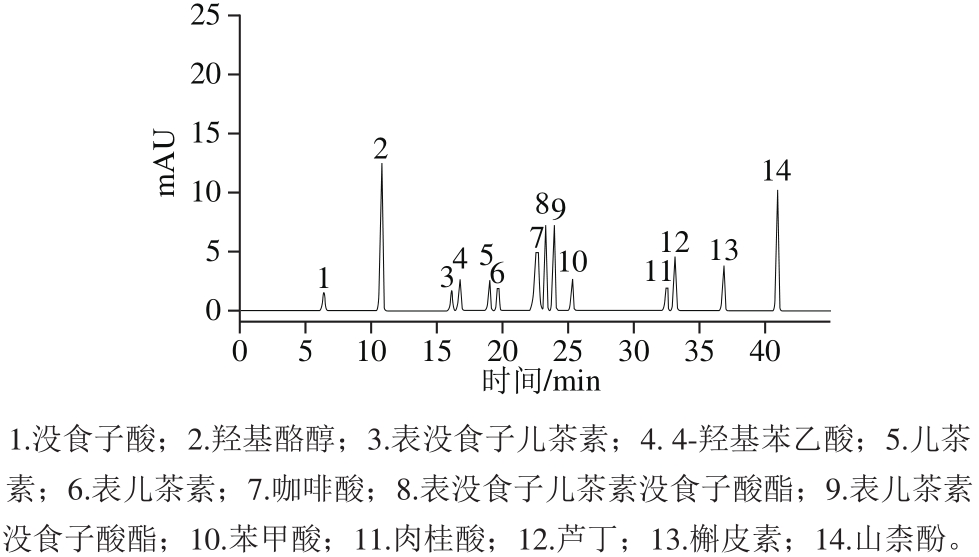
图1 14 种酚类化合物混合标准品的液相色谱图
Fig. 1 Liquid chromatograms of mixture of 14 phenolic standards
根据前人的研究结果[19-21],选定本实验中14 种单体酚作为标准对照品。采用1.2.3节色谱条件,能有效分离14 种标准品,如图1所示。分别以各个混合标准品溶液的质量浓度x(mg/L)为横坐标,相应峰面积y为纵坐标绘制标准曲线,进行线性回归分析,根据信噪比为3时,测得各组分检出限,如表2所示。同一混合标准品溶液平行测定6 次,各峰面积的相对标准偏差(relative standard deviation,RSD)在0.2%~10.8%之间,保留时间的RSD在0.1%~2.1%之间,表明该方法具有较好的精密度(重复性)。
表2 14 种酚类物质的标准曲线、相关系数、线性范围及检出限
Table 2 Regression equations, correlation coefficients, linear ranges and detection limits for 14 phenolics
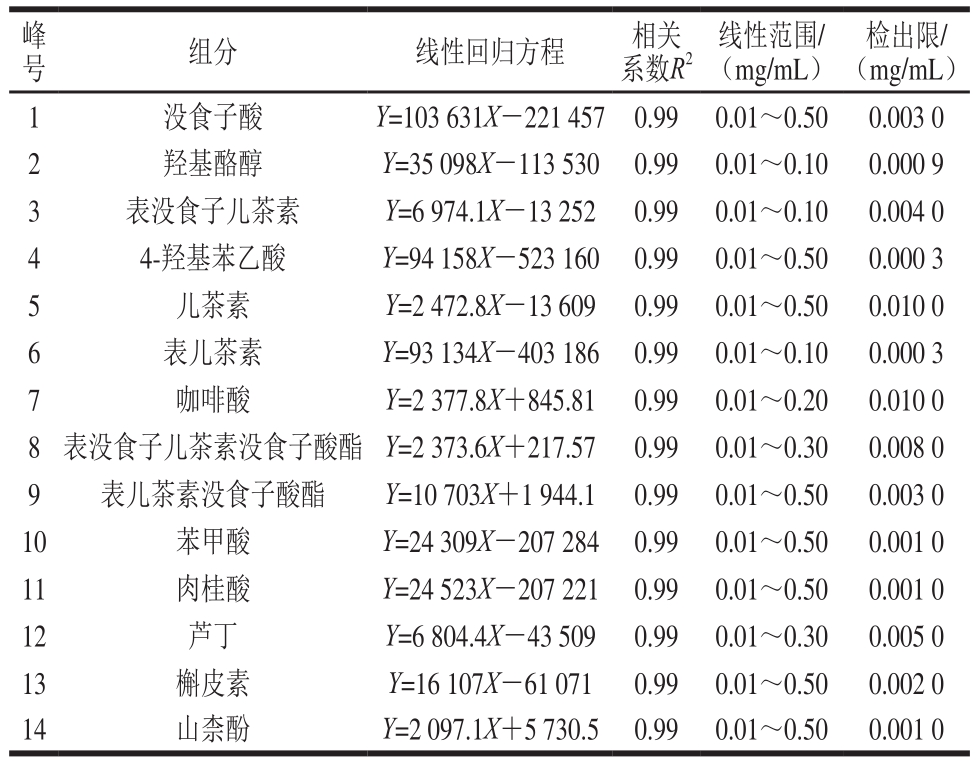
2.2 茶叶籽油多酚化合物纯化组分分析
Fr1、Fr2、Fr3组分分别采用1.2.3节色谱条件进行分析,如图2所示。比较各组分与混合标准品峰的保留时间及加标实验,确定各组分组成,同时根据表2中线性回归方程计算各组分中具体物质相对含量,如表3所示。Fr1组分中含儿茶素、山柰酚、表儿茶素没食子酸酯、肉桂酸、槲皮素,主要分属儿茶素类及黄酮类,其中儿茶素类化合物占62.60%;Fr2组分含山柰酚、肉桂酸、儿茶素、没食子酸、咖啡酸及表儿茶素没食子酸酯,山柰酚占50.70%;Fr3组分含9 种酚类物质,其中黄酮类化合物(芦丁、槲皮素、山柰酚)占78.70%。由于油脂中酚类化合物存形式复杂,所以对于茶叶籽油中单个酚类化合物的分离纯化,有待在后续实验中开发。
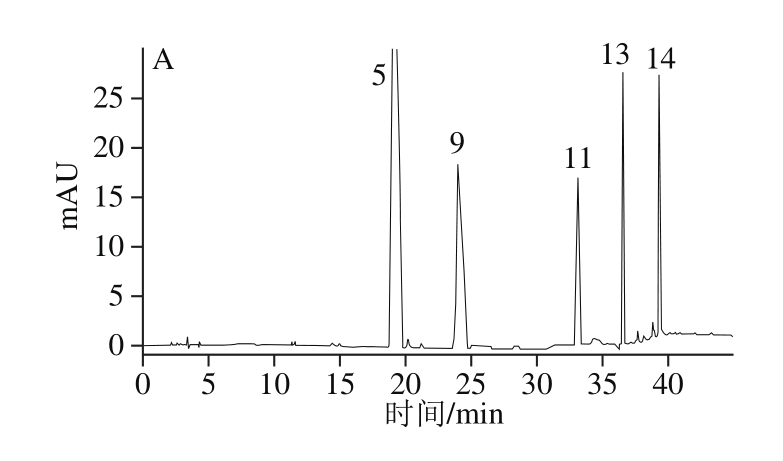
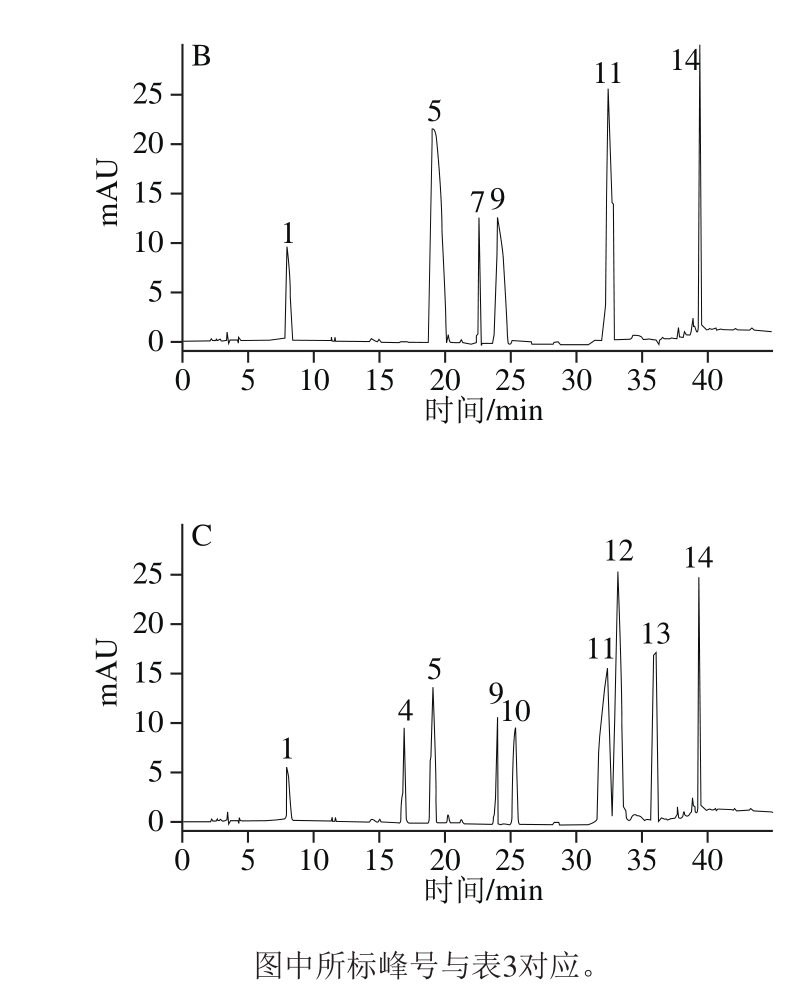
图2 茶叶籽油多酚纯化组分Fr1(A)、Fr2(B)、Fr3(C)的液相色谱图
Fig. 2 Liquid chromatograms of Fr1 (A), Fr2 (B), and Fr3 (C) from tea seed oil
表3 茶叶籽油多酚纯化组分Fr1、Fr2、Fr3中各酚类化合物相对含量
Table 3 Phenolic constituents of Fr1, Fr2 and Fr3
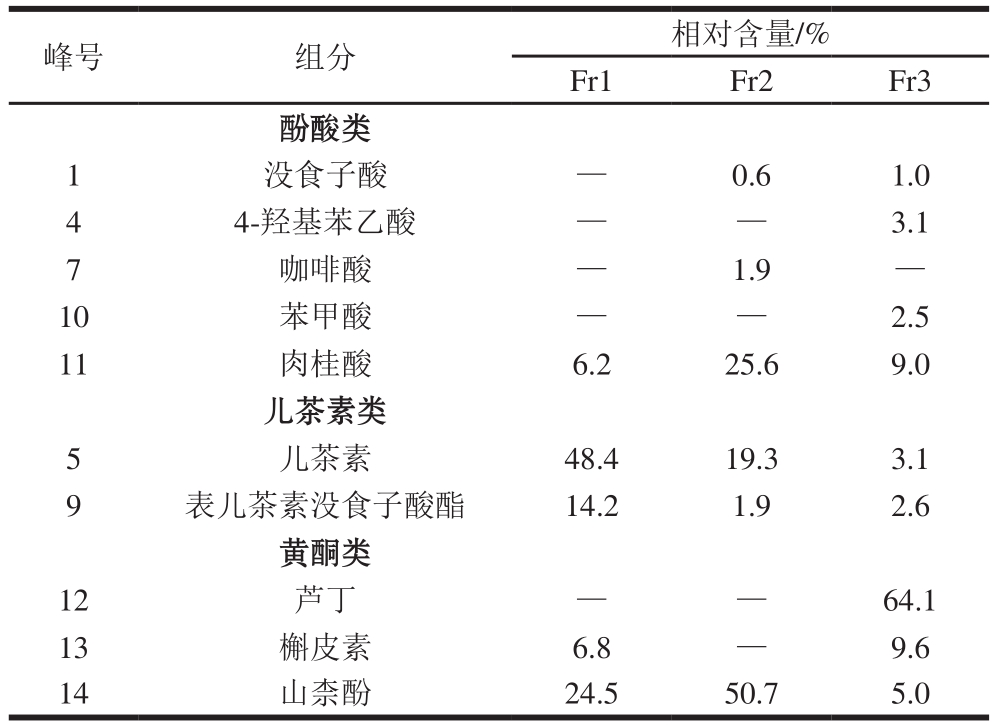
注:—.未检出。
2.3 茶叶籽油酚类化合物对HepG2细胞体外增殖活性抑制效果
体积分数0.1%、0.2%、0.5%甲醇溶剂对照组的细胞相对成活率分别是99.91%、99.76%、99.48%,与各组分实验组的细胞成活率相比,可视为无影响。有关研究也表明,在细胞体外实验中,甲醇溶液的体积分数控制在0.5%以下,可避免其毒性对实验造成假阳性结果[22]。研究表明茶中儿茶素、黄酮类化合物在高质量浓度条件下存在细胞毒性,可能与其在高浓度条件下引起的促氧化作用相关[23-24]。闫敬娜等[25]通过亚甲基蓝染色法检测细胞存活率实验表明茶叶多酚提取物对受试细胞的无毒性剂量范围为0~500 μg/mL,香菇柄多酚主要为儿茶素、没食子酸、咖啡酸、芦丁、阿魏酸和槲皮素,与茶叶籽油分离纯化组分中多酚组成类似,其在质量浓度不小于1.71 mg/mL时对HepG2显示细胞毒性[26],本实验中茶叶籽油酚类化合物组分质量浓度均在上述无毒性范围内。
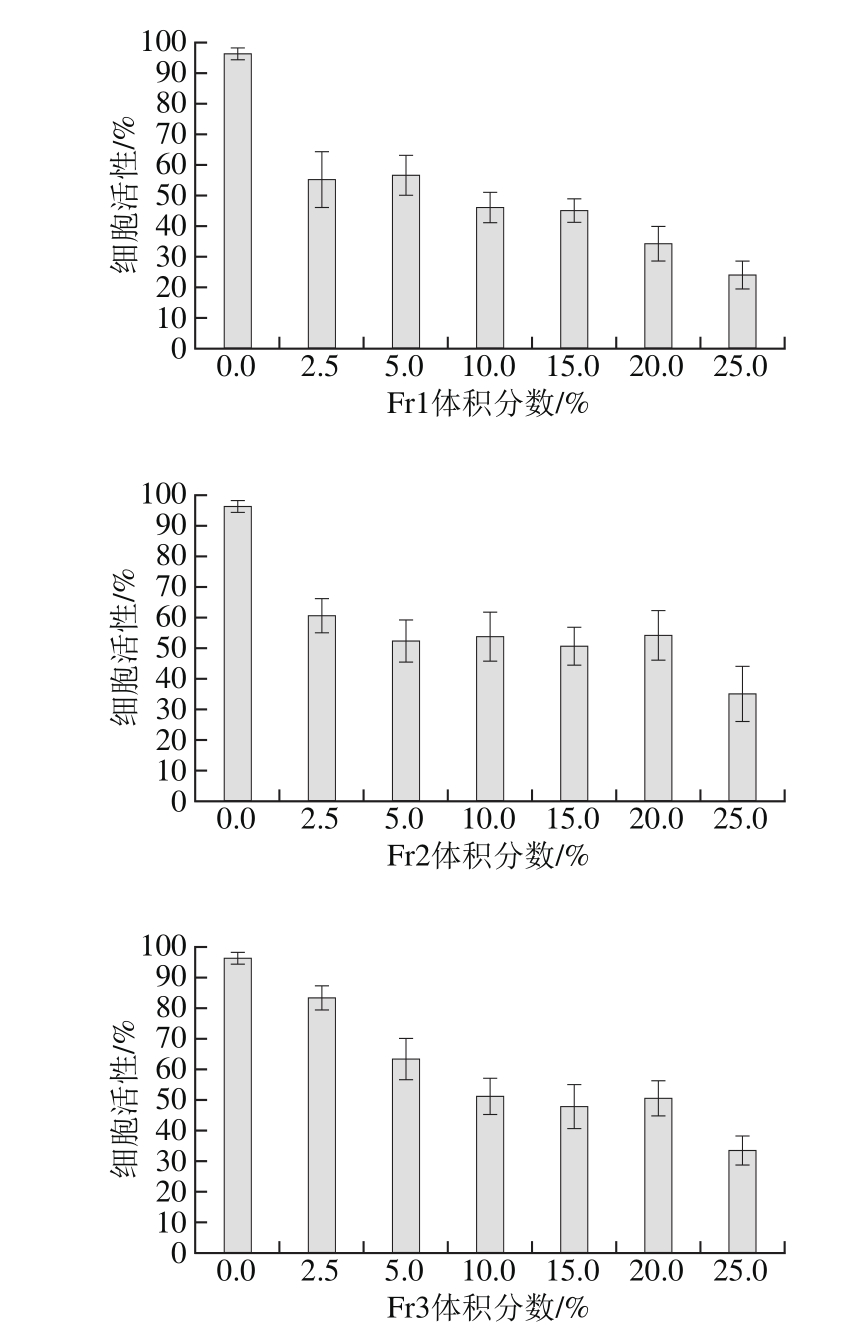
图3 茶叶籽油酚类化合物纯化组分对HepG2细胞增殖的影响
Fig. 3 Effect of purified phenolic constituents from tea seed oil on proliferation of HepG2 cells
采用1.2.5节方法,考察茶叶籽油酚类化合物Fr1、Fr2、Fr3组分分别对HepG2癌细胞增殖活性抑制作用,如图3所示。Fr1、Fr2、Fr3组分对应的抑制癌细胞增殖的IC50值分别为1.76%、16.24%及12.35%,各组分对HepG2癌细胞的抑制活性大小排列顺序为Fr1>Fr3>Fr2,Fr1组分能明显抑制HepG2癌细胞活性。

图4 茶叶籽油酚类化合物主成分分析图
Fig. 4 Principal component analysis for identification of antiproliferative phenols in tea seed oil
结合2.2节中已知的Fr1、Fr2、Fr3组分多酚化合物具体组成,与其对应的IC50值进行主成分分析,比较各酚类化合物对人肝癌HepG2细胞系的体外抑制活性,如图4所示。Fr1~Fr3组分中酚类化合物被分为两大主成分,所提取到特征值能达到90%以上的贡献率,其中第1主成分的贡献率为65.87%,大于第2主成分贡献率(34.13%),对第1主成分贡献最大的化合物是儿茶素、芦丁及槲皮素,对第2主成分贡献较大的化合物为没食子酸、肉桂酸。表明茶叶籽油中的儿茶素类与黄酮类化合物对人肝癌HepG2细胞增殖起主要抑制作用,尤以儿茶素、芦丁、槲皮素为主。茶叶多酚如儿茶素及黄酮类化合物对肿瘤细胞的增殖活性抑制作用已被广泛报道,研究表明,未分离纯化的茶叶多酚提取物对多种肿瘤细胞如HepG2、A549、MGC803细胞均具有诱导细胞凋亡及抑制增殖作用[27-28],此外儿茶素、槲皮素单独作用于肿瘤细胞时,也表现出显著的癌细胞增殖抑制作用[29-30]。本实验初步证实,在茶叶籽油中分离纯化的茶多酚及黄酮类化合物也存在抑制癌细胞增殖作用。
茶叶籽油酚类化合物经硅胶柱、Sephadex LH-20柱分离纯化,得到组分Fr1、Fr2、Fr3。采用反相高效液相色谱-二极管阵列检测技术分析表明:Fr1主要含儿茶素类化合物,占比达62.60%;Fr2除主要的黄酮类,还含有部分酚酸类化合物,如肉桂酸占25.6%;Fr3中主要含黄酮类,其中芦丁相对含量高达64.10%。Fr1~Fr3组分对HepG2细胞的IC50值分别为1.76%、16.24%及12.35%,表明Fr1抑制HepG2细胞活性最显著,其次为组分Fr3,结合主成分分析,得出茶叶籽油中的黄酮类及儿茶素类化合物具有较强的HepG2细胞增殖活性抑制作用,尤以儿茶素、芦丁为主要活性物质。本研究初步证实茶叶籽油酚类化合物具有抗肿瘤作用,可为茶叶籽油酚类化合物及活性研究提供基础资料,同时为茶叶籽资源深度开发提供参考。
参考文献:
[1] 梁杏秋, 王晓琴, 黄兵兵. 茶叶籽油组成分析及其抗氧化机理研究进展[J]. 中国粮油学报, 2013, 28(11): 123-128. DOI∶10.3969/j.issn.1003-0174.2013.11.024.
[2] 朱晋萱, 朱跃进, 刘国艳, 等. 13 个省茶叶籽油脂肪伴随物分析[J].中国油脂, 2013, 38(1): 84-88. DOI∶10.3969/j.issn.1003-7969 .2013.01.022.
[3] FAZEL M, SAHARI M, BARZEGAR M. Determination of main tea seed oil antioxidants and their effects on common Kilka oil[J].International Food Research Journal, 2008, 15(1): 209-217.
[4] WANG X Q, LIANG X Q, ZHAO J, et al. Cultivar characterization of tea seed oils by their active components and antioxidant capacity[J].Journal of Oil & Fat Industries, 2014, 91(4): 629-639. DOI:10.1007/s11746-013-2397-7.
[5] HU T, HE X W, JING J G, et al. Hydroxytyrosol and its potential therapeutic effects[J]. Journal of Agricultural & Food Chemistry, 2014,62(7): 1449-1455. DOI:10.1021/jf405820v.
[6] JOVEN J, MICOL V, SEGURA-CARRETERO A, et al. Polyphenols and the modulation of gene expression pathways: can we eat our way out of the danger of chronic disease?[J]. Critical Reviews in Food Science & Nutrition, 2014, 54(8): 985-1001. DOI∶10.1080/10408 398.2011.621772.
[7] RAQUEL M, GEMA P C, BACON J R, et al. Anticancer activity of olive oil hydroxytyrosyl acetate in human adenocarcinoma Caco-2 cells[J]. Journal of Agricultural & Food Chemistry, 2013, 61(13):3264-3269. DOI∶10.1021/jf305158q.
[8] MAURYA A K, VINAVAK M. Anticarcinogenic action of quercetin by downregulation of phosphatidylinositol 3-kinase (PI3K) and protein kinase C (PKC) via induction of p53 in hepatocellular carcinoma(HepG2) cell line[J]. Molecular Biology Reports, 2015, 42(9): 1-11.DOI∶10.1007/s11033-015-3921-7.
[9] LUCERI C, BIGAGLI E, PITOZZI V, et al. A nutrigenomics approach for the study of anti-aging interventions: olive oil phenols and the modulation of gene and microRNA expression profiles in mouse brain[J]. European Journal of Nutrition, 2017, 56(2): 1-13.DOI∶10.1007/s00394-015-1134-4.
[10] YANG C S, WANG X, LU G, et al. Cancer prevention by tea: animal,studies, molecular mechanisms and, human relevance[J]. Nature Reviews Cancer, 2009, 9(6): 429-439. DOI:10.1038/nrc2641.
[11] HAJIAGHAALIPOUR F, KANTHIMATHI M S, SANUSI J, et al.White tea (Camellia sinensis) inhibits proliferation of the colon cancer cell line, HT-29, activates caspases and protects DNA of normal cells against oxidative damage[J]. Food Chemistry, 2015, 169: 401-410.DOI:10.1016/j.foodchem.2014.07.005.
[12] HIGDON J V, FREI B. Tea catechins and polyphenols: health effects, metabolism, and antioxidant functions[J]. Critical Reviews in Food Science and Nutrition, 2003, 43(1): 89-143.DOI:10.1080/10408690390826464.
[13] GARCIA-VILLALBA R, CARRASCO-PANCORBO A, OLIVERASFERRAROS C, et al. Characterization and quantification of phenolic compounds of extra-virgin olive oils with anticancer properties by a rapid and resolutive LC-ESI-TOF MS method[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(2): 416-429.DOI:10.1016/j.jpba.2009.06.021.
[14] OUNI Y, TAAMALLI A, GOMEZ-CARAVACA A M, et al.Characterisation and quantification of phenolic compounds of extravirgin olive oils according to their geographical origin by a rapid and resolutive LC-ESI-TOF MS method[J]. Food Chemistry, 2011, 127(3):1263-1267. DOI:10.1016/j.foodchem.2011.01.068.
[15] 张志英. 山茶油抗氧化防辐射活性成分及其机理的研究[D]. 杭州:浙江大学, 2006.
[16] 刘雳, 赵正惠. 茶籽毛油中极性抗氧化物质的研究[J]. 中国粮油学报, 2002, 17(3): 4-9. DOI:10.3321/j.issn:1003-0174.2002.03.002.
[17] 李爱群, 蔡葵花, 林励. 薄层扫描法测定利喉乐含片中没食子酸的含量[J]. 分析测试学报, 1999, 18(1): 64-66. DOI:10.3969/j.issn.1004-4957.1999.01.020.
[18] 余婷婷, 鲁晓翔, 连喜军, 等. 玉米须黄酮类化合物的薄层层析及紫外光谱研究[J]. 食品科学, 2008, 29(11): 477-481. DOI:10.3321/j.issn:1002-6630.2008.11.108.
[19] 罗凡, 费学谦, 方学智, 等. 固相萃取/高效液相色谱法测定茶油中的多种天然酚类物质[J]. 分析测试学报, 2011, 30(6): 696-700.DOI:10.3969/j.issn.1004-4957.2011.06.021.
[20] 王进英, 钟海雁. RP-HPLC内标标准曲线法测定茶油中的7 种酚类物质[J]. 中国粮油学报, 2014, 29(9): 107-111.
[21] BALLUS C A, QUIRANTES-PINE R, BAKHOUCHE A, et al.Profile of phenolic compounds of Brazilian virgin olive oils by rapid resolution liquid chromatography coupled to electrospray ionisation time-of-flight mass spectrometry (RRLC-ESI-TOF-MS)[J]. Food Chemistry, 2015, 170: 366-377. DOI:10.1016/j.foodchem.2014.08.054.
[22] 王文娟, 雒向宁, 马晓军, 等. 8 种有机溶剂对人肝癌细胞HePG2及SMMC7721的细胞毒作用[J]. 现代中医药, 2013(4)∶ 85-86.DOI∶10.13424/j.cnki.mtcm.2013.04.036.
[23] 胡秀芳, 杨贤强. 茶儿茶素对癌细胞凋亡作用的研究[J]. 茶叶科学,2001, 21(1)∶ 26-29. DOI∶10.3969/j.issn.1000-369X.2001.01.007.
[24] 龚金炎, 洪辉, 吴晓琴, 等. 黄酮类化合物的促氧化作用及其细胞毒性研究进展[J]. 中草药, 2008, 39(12)∶ 1905-1909. DOI∶10.3321/j.issn∶0253-2670.2008.12.052.
[25] 闫敬娜, 罗理勇, 胡雅琼, 等. 茶提取物和纳米表没食子儿茶素没食子酸酯对6-羟基多巴胺诱导的SH-SY5Y细胞保护作用[J]. 食品科学, 2016, 37(1)∶ 163-170. DOI∶10.7506/spkx1002-6630-201601029.
[26] 李谣, 陈金龙, 夏春燕, 等. 基于HepG2细胞模型的香菇柄粉多酚抗氧化及抗增殖活性[J]. 食品科学, 2016, 37(11)∶ 190-196.DOI∶10.7506/spkx1002-6630-201611033.
[27] HESSIEN M, DONIA T, EI-GENDY S, et al. Unfractionated green tea and ginger polyphenols induce apoptotic, cytotoxic and antioxidant effects in hepatoma cells[J]. Journal of Herbal Medicine, 2013, 3(3)∶87-98. DOI∶10.1016/j.hermed.2013.04.003.
[28] LI H, LI F, YANG F, et al. Size effect of Se-enriched green tea particles on in vitro antioxidant and antitumor activities[J]. Journal of Agricultural & Food Chemistry, 2008, 56(12)∶ 4529-4533.DOI∶10.1021/jf0731200.
[29] LEE S H, LEE E J, MIN K H, et al. Quercetin enhances chemosensitivity to gemcitabine in lung cancer cells by inhibiting heat shock protein 70 expression[J]. Clinical Lung Cancer, 2015, 16(6)∶e235-e243. DOI∶10.1016/j.cllc.2015.05.006.
[30] MANIKANDAN R, BEULAJA M, ARULVASU C, et al. Synergistic anticancer activity of curcumin and catechin: an in vitro study using human cancer cell lines[J]. Microscopy Research and Technique, 2012,75(2): 112-116. DOI:10.1002/jemt.21032.
Isolation and Purification of Phenolic Compounds from Tea Seed Oil and Their Antiproliferative Activity on HepG2 Cells
WANG Lijuan1, LIANG Xingqiu1, WANG Xiaoqin1,2,*
(1. College of Chemical Engineering, Huaqiao University, Xiamen 361021, China;2. Institute of Oil and Natural Product, Huaqiao University, Xiamen 361021, China)
Abstract:Phenolic compounds from tea seed oil were extracted with 60% methanol and purified by sequential chromatography on silica gel and Sephadex LH-20 columns. The composition of purified phenolics was determined by RPHPLC-DAD. Phenolic compounds with antiproliferative effect on HepG2 cells were identified by principal component analysis. The results showed that as one of the three fractions separated by Sephadex LH-20, Fr1 contained 5 phenolic compounds including catechins (accounting for 62.60% of the total amount) and flavonoids. Fr2 mainly included phenolic acids and flavonoids; flavonoids represented 78.70% of Fr3. IC50values of Fr1, Fr2, and Fr3 for the proliferation inhibition of HepG2 cells were 1.76%, 16.24%, and 12.35%, respectively. Principal component analysis showed that rutin and catechin were the major constituents in tea seed oil that had a significantly strong ability to inhibit cell viability.
Key words:tea seed oil; phenolic componds; isolation and purification; HepG2; antitumor activity
DOI∶10.7506/spkx1002-6630-201724016
中图分类号:TS225.1
文献标志码:A
文章编号:1002-6630(2017)24-00101-06
引文格式:
王俐娟, 梁杏秋, 王晓琴. 茶叶籽油酚类化合物分离纯化组分分析及HepG2细胞增殖活性抑制[J]. 食品科学, 2017,38(24): 101-106.
DOI:10.7506/spkx1002-6630-201724016. http://www.spkx.net.cn
WANG Lijuan, LIANG Xingqiu, WANG Xiaoqin. Isolation and purification of phenolic compounds from tea seed oil and their antiproliferative activity on HepG2 cells[J]. Food Science, 2017, 38(24)∶ 101-106. (in Chinese with English abstract)DOI∶10.7506/spkx1002-6630-201724016. http∶//www.spkx.net.cn
收稿日期:2016-11-07
基金项目:国家自然科学基金青年科学基金项目(31601403);福建省科技计划高校产学合作项目(2017N51010055);厦门市科技计划项目(3502220161230);华侨大学中青年教师科研提升资助计划项目(ZQN-PY417);华侨大学研究生科研创新能力培育计划资助项目(1400215009)
作者简介:王俐娟(1993—),女,硕士研究生,研究方向为油脂及天然产物。E-mail:Wang-Lijuan@foxmail.com
*通信作者:王晓琴(1977—),女,副教授,博士,研究方向为油脂及天然产物。E-mail:wangxiaoqin77@sohu.com