黄 卉,杨丽芝,杨贤庆*,李来好,郝淑贤,魏 涯,王锦旭
(中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州 510300)
摘 要:目的:从南海鸢乌贼墨汁中分离纯化多糖,并分析其多糖组分。方法:利用水提醇沉法得粗多糖,通过固相萃取层析法除色素对多糖进行纯化,纯化多糖依次经DEAE-52离子交换柱、Sephacryl HR-300凝胶柱分级纯化,按峰收集得单一组分,采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)衍生化方法,通过超高效液相色谱分析多糖组分。结果:粗多糖经DEAE-52离子交换柱、Sephacryl HR-300凝胶柱后收集得到3 个糖组分,分别为SIP1、SIP2、SIP3;通过PMP衍生化方法分析单糖组成,得:SIP1是由D-甘露糖、D-葡萄糖、D-半乳糖3 种单糖缩合而成;SIP2和SIP3分别是由D-甘露糖、鼠李糖、D-葡萄糖、D-半乳糖及L-(-)-岩藻糖5 种单糖按照不同比例缩合而成。
关键词:墨多糖;分离纯化;组分分析
生物体内的糖类物质已被证明具有诸多生物活性,如抗菌[1]、抗氧化[2]、抗肿瘤[3]及提高机体免疫[4]等生物活性,随着海洋生物医学的发展,对糖类物质的研究逐渐深入,为探索糖类生物学功能及其抗性机理,对其结构分析刻不容缓,但是由于糖类物质极性强,结构相近,缺乏光学吸收基团,所以一直制约整个糖类领域的发展[5]。为改变糖类物质的光学灵敏度检测,衍生化为糖类物质的分析提供了新技术,衍生化是使糖链带上荧光或紫外基团,从而使糖类物质满足光学检测的灵敏度。
1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)在弱碱性条件下发生衍生化反应,糖链还原性末端与1、3取代基发生反应,1 个糖分子的还原端可与2 分子PMP形成稳定的衍生物,与其他酸性条件的衍生化试剂相比,其条件温和、紫外吸收强、衍生物较稳定且无异构体,被广泛用于糖类物质的分析[6]。PMP和其类似物1-(4-异丙基)苯基-3-甲基-5-吡唑啉酮[7]、1-(2-萘基)-3-甲基-5-吡唑啉酮[8-9]、1,3-二苯基-5-吡唑啉酮[10]等对分析痕量糖链也均有明显优势。采用PMP衍生化方法对多糖组分分析时,可使糖类物质在波长24 nm处产生强烈的紫外吸收,且操作方便,重现性好,广泛应用于糖类组分分析中[11-13]。PMP衍生法可对中性糖如甘露糖、木糖,碱性糖如氨基半乳糖、氨基葡萄糖,酸性糖如葡萄糖醛酸、半乳糖醛酸等11 种单糖同时测定,但除单糖中木糖和阿拉伯糖不能完全分离外,均可实现良好分离[11],从而为物质多糖组分分析提供了可能。
1.1 材料与试剂
中国水产科学研究院南海水产研究所“南锋”号调查船于2014年7月,南海海域捕捞鸢乌贼,取墨囊,冻藏于-20 ℃,备用。
DEAE-52纤维素 上海楷阳生物公司;Sephacryl HR-300丙烯葡聚糖凝胶、1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picryl-hydrazyl,DPPH) 美国Sigma公司;PMP 成都西亚试剂有限公司;D-阿拉伯糖(D-(-)-arabinose,D-Ara)、鼠李糖(L-rhamnose monohydrate,Rha)、肌醇、L-(-)-岩藻糖(L-(-)-fucose,L-(-)-Fuc) 上海源叶生物科技有限公司;D-木糖(D-xylose,D-Xyl)、D-甘露糖(D-Mannose,D-Man)、D-葡萄糖(D-glucose,D-Glc)、D-半乳糖(D-galactose,D-Gal)、乳糖(lactose,Lac) 成都植标化纯生物技术有限公司;木瓜蛋白酶(6 000 U/mg) 上海楷阳生物公司;三羟甲基氨基甲烷(tri-hydroxymethyl aminomethane,Tris)、无水葡萄糖、苯酚、浓硫酸、氯仿、正丁醇、氯化钠、无水乙醇、甲醇、三氟乙酸(trifluoroacetic acid,TFA)、磷酸氢二钠、磷酸二氢钠、盐酸、乙酸铵、溴化钾、氢氧化钠均为国产分析纯;乙腈为国产色谱纯。
1.2 仪器与设备
AvantiJ26XP高速离心机 德国Sigma公司;Synergy全功能酶标仪 美国BioTek公司;UV2550紫外-可见分光光度计、IRAffinity-1红外光谱仪 津岛企业管理中国有限公司;EYELAN-1000旋转蒸发仪 日本京理化器械株式会社;AKTApurifierUPC100蛋白纯化仪美国GE公司;CBS-B多功能分部收集器 上海青浦沪西公司;ACQUITY超高效液相色谱 美国Waters公司;Alphal-4冷冻干燥器 德国Christ公司;N-EVAP24氮吹仪 美国Organomation Associate Inc公司。1.3 方法
1.3.1 南海鸢乌贼墨汁粗多糖提取工艺流程
取500 g鸢乌贼墨汁,加入1 kg蒸馏水,调节pH值为5.5,40 ℃热水浸提4 h,4 ℃浸提12 h,10 000 r/min离心40 min(重复2 次),取上清液加2 倍体积Tris-HCl溶液,加1.0%(5 g)木瓜蛋白酶,酶解12 h(pH 6.8,60 ℃水浴振荡),煮沸10 min,灭酶,10 000 r/min离心20 min除去蛋白,取上清液加入1/4体积的氯仿-正丁醇溶液(4∶1,V/V),搅拌器剧烈搅拌30 min,重复操作,直至除去杂质蛋白,离心,取上清液,旋转蒸发浓缩至50 mL加4 倍无水乙醇醇沉过夜。10 000 r/min离心10 min,取沉淀抽滤,无水乙醇、丙酮洗沉淀,得粗多糖,冷冻干燥,备用。
1.3.2 鸢乌贼墨多糖的分离纯化
1.3.2.1 固相萃取小柱层析
取鸢乌贼墨粗多糖1 g,加入超纯水5 mL,80 ℃水浴加热溶解25 min,5 000 r/min离心5 min,不溶物重复上述操作,合并2 次上清液,上已活化的C18固相萃取小柱,以除去部分色素,用超纯水洗柱至3 个柱体积,收集浓缩液,备用,利用苯酚-硫酸法测定多糖含量[14],并根据上柱前后总的糖含量之和,按下式计算损失率:
1.3.2.2 离子交换柱层析
取1 g经过固相萃取小柱的粗多糖浓缩液上DEAE-52纤维素离子交换柱(2.6 cm×50 cm),上样后,依次用0~2 mol/L NaCl溶液分段梯度洗脱,自动部分收集器收集,直至无糖检出,流速1 mL/min,每管5 mL,苯酚-硫酸法检测洗脱液中多糖含量,隔管检测,并绘制洗脱曲线,根据洗脱曲线按峰收集,浓缩各峰收集液,经8 000 D透析袋透析48 h,冷冻干燥[15-22],备用并测量。
1.3.2.3 分子筛层析
分别将经离子交换柱的各个峰值多糖溶于超纯水,再上样于Sephacryl HR-300丙烯葡聚糖凝胶分子筛柱(1.6 cm×100 cm),超纯水洗脱,自动部分收集器收集,流速1 mL/min,苯酚-硫酸法检测洗脱液多糖含量,绘制标准曲线,根据洗脱曲线按峰收集洗脱液,浓缩,冷冻干燥得精品墨多糖[23-24]。
1.3.2.4 红外光谱分析
取约1 mg墨多糖SIP1组分,加入适量干燥KBr粉末,在暖灯加热条件下,放入玛瑙研钵中均匀研细,放入压片机中压成均匀透明薄片。将此透明薄片放入傅里叶变换红外光谱仪内,在400~4 000 cm-1区间进行扫描,采集红外光谱图。
1.3.2.5 单糖组分的分析方法-PMP衍生高效液相法[24-27]
混合单糖标样的衍生:将乳糖及7 种单糖标准品用甲醇配制成0.5 mg/mL,分别取50 µL加入具塞试管中,然后在具塞试管中加入400 µL PMP(甲醇配制0.5 mol/L)和400 μL NaOH(0.3 mol/L)溶液,70 ℃水浴反应100 min,取出10 min冷却至室温,加入400 μL HCl(0.3 mol/L)溶液调节至中性,加入1 mL氯仿充分振荡萃取,静置,吸弃下层,重复此操作3 次,取上清液水相用0.45 μm微孔膜过滤,稀释10 倍,上样分析。
样品制备:取鸢乌贼墨多糖样品2 mg于可耐高温具塞试管中,加入2 mL 2 mol/L TFA,充氮气封管,110 ℃水解8 h,冷却至室温,50 ℃于氮吹仪中挥干TFA,加入1 mL甲醇溶液重复操作,以NaOH溶液调节至中性,取100 μL进行PMP衍生,PMP、NaOH和HCl量均改为100 μL,其他操作相同,以100 μL甲醇代替样品作PMP衍生空白。
色谱条件:Waters ACQUITY超高效液相色谱;ACQUITY UPLC C18色谱柱(2.1 mm×100 mm,1.7 μm);紫外检测器波长250 nm;流动相:A相为乙腈,B相为5 mmol/L的甲酸铵溶液,C相为乙腈-水(1∶9,V/V);梯度洗脱程序:0~6 min,23.0% A、77.0% B、0% C;6~9.5 min,50.0% A、50.0% B、0% C;9.5~10 min,23.0% A、77.0% B、0% C;流速0.30 mL/min;柱温25 ℃。
2.1 固相萃取小柱层析结果
表1 粗多糖经固相萃取小柱后多糖质量分数前后对比
Table 1 Recovery and loss of polysaccharide during solid phase extraction
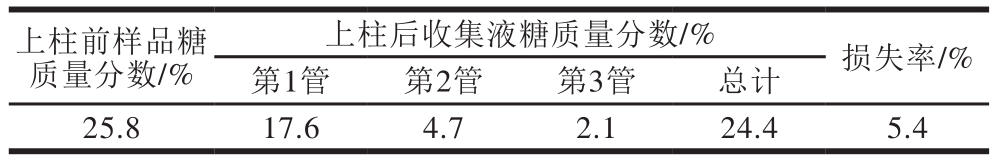
由于鸢乌贼墨多糖粗提物中含有较多色素杂质,如果直接上色谱柱容易堵塞填料,很难继续上样,增加了分离纯化的难度,将墨汁粗多糖先经固相萃取小柱简单分离后可以除去大部分色素,利于后续实验的顺利进行,由表1可得,鸢乌贼墨汁粗多糖经固相萃取小柱后,多糖损失为质量分数1.4%,多糖损失较小,损失率为5.4%。
2.2 离子交换柱层析结果
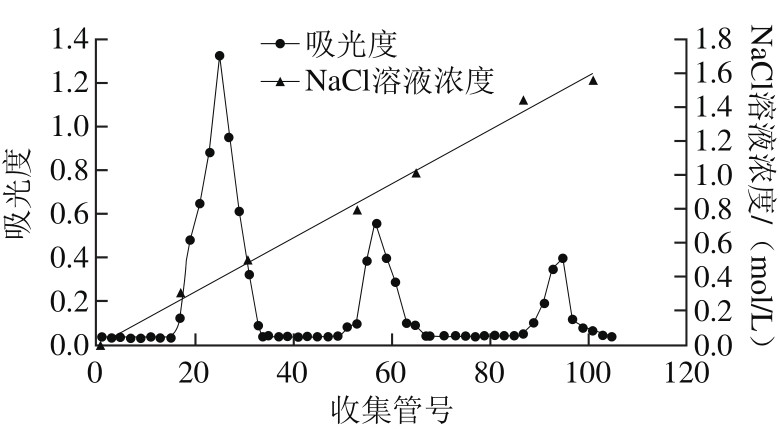
图1 墨汁粗多糖在DEAE-52离子交换柱中的洗脱曲线
Fig. 1 Elution curves of crude polysaccharides on DEAE-52 ion exchange column
取1 g经过固相萃取小柱的粗多糖浓缩液上DEAE-52纤维素离子交换柱,上样后,依次用0~2 mol/L NaCl溶液分段梯度洗脱,自动部分收集器收集,如图1所示。鸢乌贼墨多糖经DEAE-52纤维素离子交换柱后出现3 个糖峰,分别在第17、51管及第87管开始出现糖峰,并且可以看出峰1含量较高,峰2次之,峰3含量最少(已通过检测冷冻干燥产品证实),依次称之为:SIP1、SIP2、SIP3,分别收集3 个糖峰,冷冻干燥,备用。
2.3 分子筛层析结果
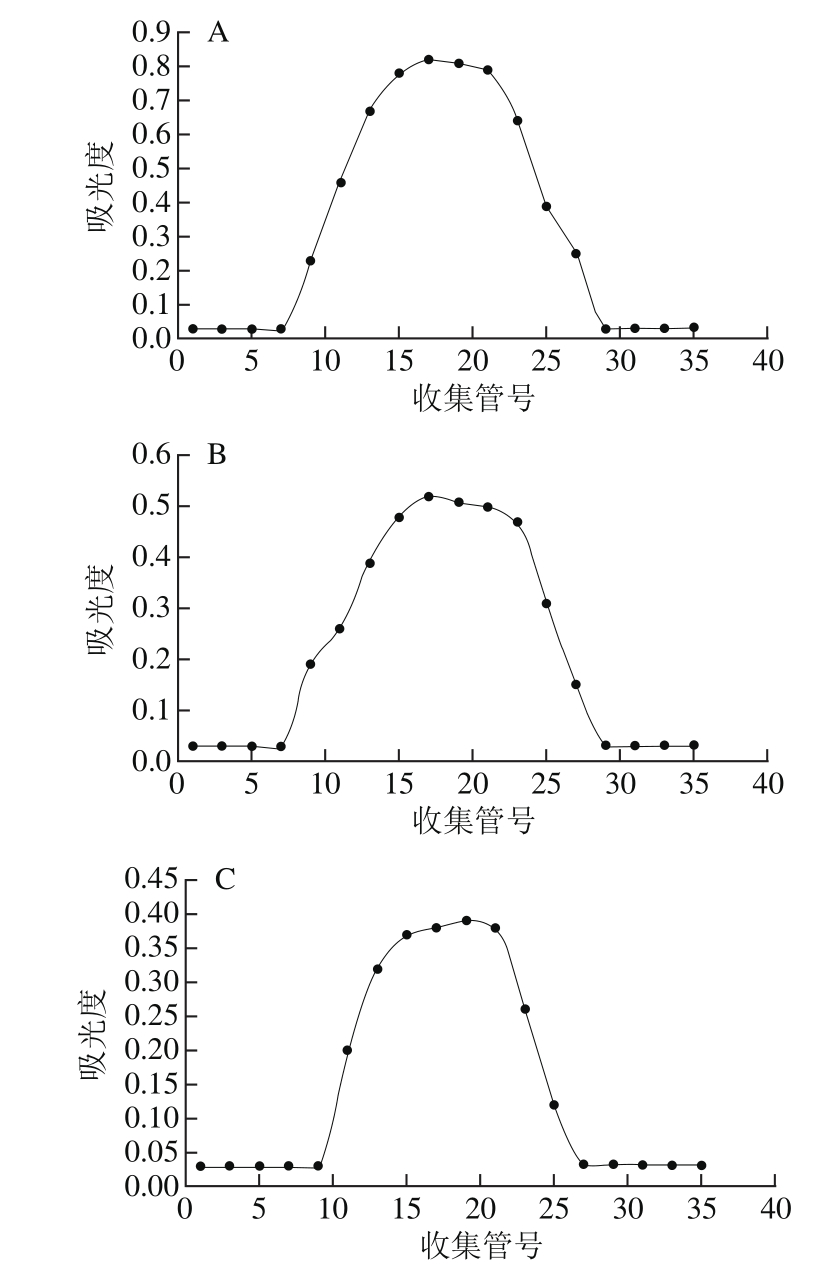
图2 SIP1(A)、SIP2(B)和SIP3(C)在Sephacryl HR-300凝胶柱中的洗脱曲线
Fig. 2 Elution curves of SIP1 (A), SIP2 (B), and SIP3 (C) on Sephacryl HR-300 gel column
分别取样品SIP1、SIP2、SIP3组分上样于Sephacryl HR-300丙烯葡聚糖凝胶分子筛柱,超纯水洗脱,自动部分收集器收集,苯酚-硫酸法检测洗脱液多糖含量,绘制标准曲线,其中样品SIP1收集液第15~25管分别用超纯水稀释5 倍;SIP2收集液第15~17管稀释2 倍,SIP3未进行稀释。由图2可知,SIP1、SIP2、SIP3三组分经Sephacryl HR-300凝胶柱后,各自只有一个糖峰,说明SIP1、SIP2、SIP3是单一组分。由图2A可知,样品SIP1组分经Sephacryl HR-300丙烯葡聚糖凝胶分子筛柱,从第7管开始出现糖峰,且随着管号的增大吸光度增加,多糖含量增加,在第15~23管达到最大,随后降低;而由图2B、C可知,样品SIP2、SIP3分别在第7、9管开始出现糖峰,但与SIP1相比,尽管样品SIP1第15~25管分别用超纯水稀释5 倍,但是吸光度依旧很大,糖含量很高;SIP2与SIP3相比,SIP2吸光度高于SIP3,糖含量高于SIP3,分别按峰收集SIP1、SIP2和SIP3,冷冻干燥,备用。
2.4 红外光谱结果
取经Sephacryl HR-300凝胶柱纯化多糖SIP1,采用傅里叶变换红外光谱仪在4 000~400 cm-1区间进行扫描,采集红外光谱图,如图3所示。
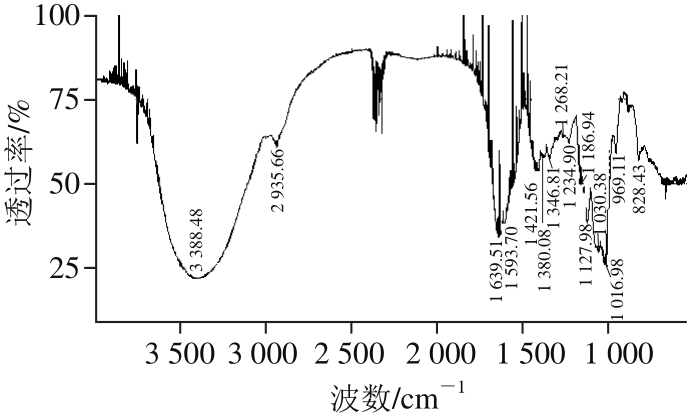
图3 鸢乌贼墨多糖分离组分SIP1的红外吸收光谱图
Fig. 3 FTIR spectrum of SIP1
红外吸收光谱中,4 000~1 333 cm-1区域被称为特征谱带区,该区域吸收峰比较稀疏,容易辨认,有机化合物的分子中一些主要的官能团的特征吸收多发生在此区域。由图3可知,在SIP1的红外吸收光谱图中3 500~3 200 cm-1之间出现一个极强的峰,主要由于—OH基在形成氢键缔合后,O—H键拉长,电偶极矩增大而形成的。此外,2 935.7、1 609.8 cm-1有较强吸收峰,前者是C—H键的伸缩振动,是糖的特征峰,表明多糖中含有—CH2—,后者为—COO—中C=O非对称伸缩振动或为C=C或C=N或结晶水的吸收峰,红外吸收光谱上1 333~400 cm-1区域中的谱带特别密集,通常称为指纹区,反映了化合物在结构上的微小差别,1 400~1 200 cm-1的一些峰是C—H的变角振动[28]。
2.5 单糖组分分析
单糖结构相近,极性较强,且缺乏光学活性,给多糖的分离检测增加了难度,研究者常将多糖水解后采用柱前或柱后衍生化色谱法进行分离和检测,以改善其分离选择性和提高检测灵敏度,其中PMP柱前衍生化高效液相色谱法应用较为广泛,其具有反应条件较温和、分析效率高、分析时间短、检测灵敏度较高等优点。
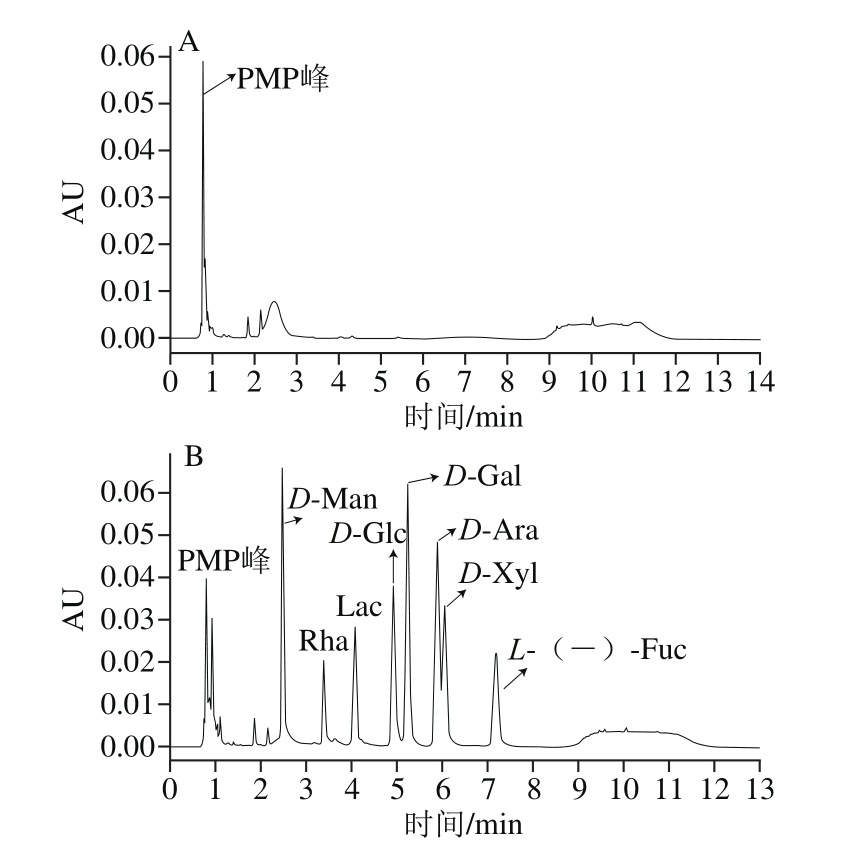
图4 PMP衍生物空白对照(A)和8 种单糖-PMP衍生物(B)色谱图
Fig. 4 Chromatograms of PMP derivatives of eight monosaccharides
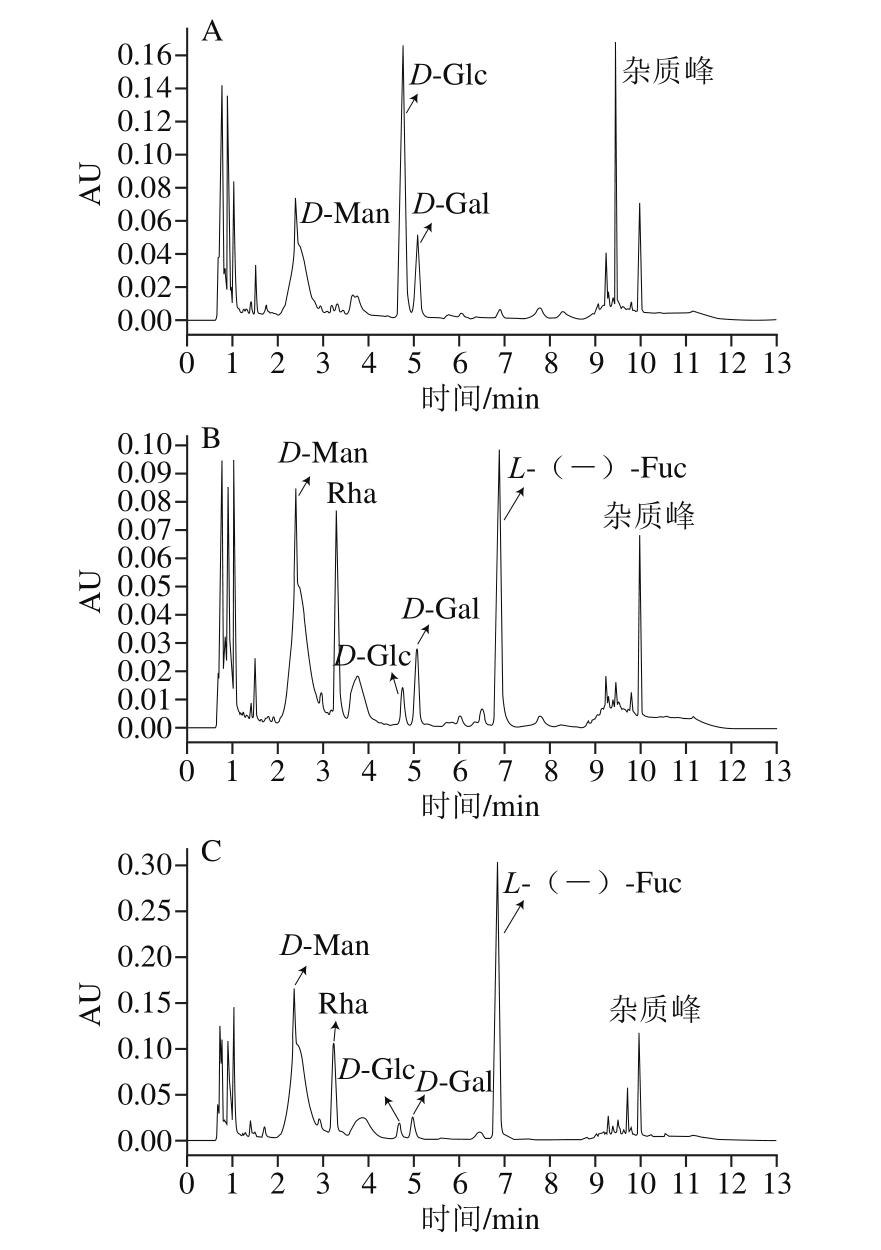
图5 SIP1(A)、SIP2(B)、SIP3(C)水解样品的PMP衍生化产物色谱图
Fig. 5 Chromatograms of PMP derivatives of acid hydrolysates of SIP1 (A), SIP2 (B) and SIP3 (C)
根据上述单糖组分分析方法进行PMP衍生化检测单糖组分,结果如图4A所示,在保留时间0.6~2.8 min之间有一些PMP峰,以此作为空白对照,由图4B可得出,D-Man的保留时间为2.54 min;Rha的保留时间为3.50 min;Lac的保留时间为4.05 min;D-Glc的保留时间为4.92 min;D-Gal的保留时间为5.35 min;D-Ara的保留时间为5.85min;D-Xyl的保留时间为6.00;L-(-)-Fuc的保留时间为6.93 min。
从图5A可得,样品SIP1出峰时间分别为2.54、4.92、5.35 min,分别为D-Man、D-Glc、D-Gal 3种单糖,说明样品SIP1是由D-Man、D-Glc、D-Gal 3 种单糖组成,其中D-Gal是主要组成部分;由图5B可知,样品SIP2单糖组成较为复杂,主要包括:D-Man、Rha、D-Gal、D-Glc及L-(-)-Fuc 5种单糖,出峰时间为别为2.54、3.50、5.35、4.92、6.93 min,其中L-(-)-Fuc含量较高,是主要组成部分,D-Gal、D-Glc含量甚微,猜测应是SIP1中没有收集完全的糖组分,可以忽略不计;而由图5C可得,样品SIP3含有D-Man、Rha、D-Gal、D-Glc及L-(-)-Fuc 5种单糖,说明样品SIP2和SIP3单糖组成相似,但是组成比例不等,其中L-(-)-Fuc也是主要组成成分,而Rha所占比例有所下降,由此可得,SIP1、SIP2、SIP3分别是由不同种类单糖按照不同比例缩合而成。
南海鸢乌贼墨汁粗多糖经分离提取、酶法结合上清液加入1/4氯仿-正丁醇溶液(4∶1,V/V)两步去除杂质蛋白、固相萃取小柱层析除色素后,依次经过DEAE-52离子交换柱、Sephacryl HR-300凝胶柱,苯酚-硫酸法测多糖含量,按峰收集,经DEAE-52柱收集得到3 个峰组分,分别为SIP1、SIP2、SIP3,将SIP1、SIP2、SIP3分别过Sephacryl HR-300凝胶柱,分别得到单一峰组分。然后分别将SIP1、SIP2、SIP3组分进行PMP衍生,上样于超高效液相色谱,通过与混标的色谱图对比,分析单糖组分,得到:SIP1是由D-Man、D-Glc、D-Gal 3 种单糖按照一定比例缩合而成;SIP2和SIP3分别是由D-Man、Rha、D-Gal、D-Glc及L-(-)-Fuc 5 种单糖按照不同比例缩合而成,南海鸢乌贼墨多糖是由D-Man、D-Glc、D-Gal、Rha、L-(-)-Fuc 5 种单糖组成,PMP衍生化方法,除单糖中D-Xyl和D-Ara不能完全分离外,均可实现良好分离。
鸢乌贼生命周期短、繁殖率强、生长率高,广泛分布于印度洋和太平洋的热带、亚热带海域,其中以南海海域数量较大,是一种具有潜力的生物资源[29-34]。随着对鸢乌贼资源的开发利用,其加工副产物墨汁也逐步受到重视,墨汁中富含多糖等活性物质,多糖具有抗菌、抗氧化、抗肿瘤等生物活性,随着海洋生物医学的发展,对糖类物质的研究逐渐深入,为探索糖类生物学功能及其抗性机理,对其结构分析刻不容缓,本实验对鸢乌贼墨多糖进行了分离纯化,得到其单糖组成,但因产品纯度问题未能得到单糖组成的比例,今后应在此方向进行进一步的研究。
参考文献:
[1] 吴金龙, 罗剑秋, 刘华忠, 等. 乌贼墨多糖对冷藏鱿鱼的防腐保鲜作用研究[J]. 食品科学, 2010, 31(10)∶ 304-307.
[2] VATE N K, BENJAKUL S. Antioxidative activity of melanin-free ink from splendid squid (Loligo formosana)[J]. International Aquatic Research, 2013, 9(5)∶ 2-12. DOI∶10.1186/2008-6970-5-9.
[3] SUBO W, YANNA C, FENGSHAN W, et al. Inhibition activity of sulfated polysaccharide of Sepiella maindroni ink on matrix metalloproteinase (MMP)-2[J]. Biomedicine & Pharmacotherapy,2008, 62(5)∶ 297-302. DOI∶10.1016/j.biopha.2008.01.018.
[4] 景奕文, 曾丽, 王加斌, 等. 海洋头足类活性物质的功能特性研究进展[J]. 浙江海洋学院学报(自然科学版), 2013(5)∶ 457-461.DOI∶10.3969/j.issn.1008-830X.2013.05.016.
[5] 王承健, 王仲孚. 糖链的生物质谱分析[J]. 生命科学, 2010, 23(6)∶569-577. DOI∶10.13376/j.cbls/2011.06.008.
[6] 张璐瑶, 赵峡, 陈欢欢. 糖类化合物PMP衍生分析进展[J]. 分析测试学报, 2016, 35(3)∶ 367-372.
[7] ZHANG P, WANG Z, XIE M, et al. Detection of carbohydrates using a pre-column derivatization reagent 1-(4-isopropyl) phenyl-3-methyl-5-pyrazolone by high-performance liquid chromatography coupled with electrospray ionization mass spectrometry[J]. Journal of Chromatography B, 2010, 878(15)∶ 1135-1144. DOI∶10.1016/j.jchromb.2010.03.027.
[8] DING C, WANG L, TIAN C, et al. LC-DAD-ESI-MS characterization of carbohydrates using a new labeling reagent[J]. Chromatographia,2008, 68(11/12)∶ 893-902. DOI∶10.1365/s10337-008-0805-1.
[9] YOU J, SHENG X, DING C, et al. Detection of carbohydrates using new labeling reagent 1-(2-naphthyl)-3-methyl-5-pyrazolone by capillary zone electrophoresis with absorbance (UV)[J]. Analytica Chimica Acta, 2008, 609(1)∶ 66-75. DOI∶10.1016/j.aca.2007.12.022.
[10] 张萍, 王仲孚, 黄琳娟. 糖类物质的衍生化试剂∶ 氘代PMP和类似物的合成及其衍生化性能[J]. 合成化学, 2013, 21(3)∶ 262-266.DOI∶10.15952/j.cnki.cjsc.2013.03.027.
[11] 付海宁, 赵峡, 于广利, 等. 盐藻多糖单糖组成分析的四种色谱方法比较[J]. 中国海洋药物, 2008, 27(4)∶ 30-34. DOI∶10.3969/j.issn.1002-3461.2008.04.006.
[12] ZHANG Y, ZHANG P, WANG Z, et al. An innovative derivatization method for simultaneous determination of uronic acids and neutral and amino sugars in coexisting samples by HPLC-ESI-MS/MS2[J]. Journal of Liquid Chromatography & Related Technologies, 2011, 34(16)∶1754-1771. DOI∶10.1080/10826076.2011.579216.
[13] 赵东豪, 黎智广, 王旭峰, 等. 高效液相色谱-串联质谱法检测水产品中硝基呋喃类代谢物的优化研究[J]. 南方水产科学, 2015, 11(6)∶58-64. DOI∶10.3969/j.issn.2095-0780.2015.06.008.
[14] 陈晋芳. 红枣多糖提取分离纯化及其抗氧化性的研究[D]. 晋中∶ 山西农业大学, 2013.
[15] 王娜. 费菜多糖的提取及分离纯化研究[D]. 厦门∶ 华侨大学, 2013∶4-88.
[16] 李瑞. 翡翠贻贝糖胺聚糖抗肿瘤活性及其免疫调节作用的研究[D].湛江∶ 广东海洋大学, 2010∶ 5-89.
[17] 王忠良, 黄建盛, 张健东, 等. 响应面法分析光照强度与盐度对卤虫休眠卵孵化率的联合效应[J]. 南方水产科学, 2014, 10(3)∶ 80-85.DOI∶10.3969/j.issn.2095-0780.2014.03.012.
[18] 戚勃, 李来好, 杨贤庆, 等. 响应曲面法优化麒麟菜卡拉胶碱处理工艺[J]. 南方水产科学, 2011, 7(6)∶ 26-34. DOI∶10.3969/j.issn.2095-0780.2011.06.005.
[19] XU H, SUN L P, SHI Y Z, et al. Optimization of cultivation conditions for extracellular polysaccharide and mycelium biomass by Morchella esculenta As51620[J]. Biochemical Engineering Journal, 2008, 39(1)∶66-73. DOI∶10.1016/j.bej.2007.08.013.
[20] 魏江洲, 张建鹏, 刘军华, 等. 海螵蛸多糖的提取分离及活性组分CPS-1的纯化[J]. 第二军医大学学报, 2006, 27(1)∶ 17-21.
[21] 王宇. 河蚬多糖的分离提取及抗氧化活性研究[D]. 杭州∶ 浙江大学, 2012.
[22] LIU C, LI X, LI Y, et al. Structural characterisation and antimutagenic activity of a novel polysaccharide isolated from Sepiella maindroni ink[J]. Food Chemistry, 2008, 110(4)∶ 807-813. DOI∶10.1016/j.foodchem.2008.02.026.
[23] CHEN S, WANG J, XUE C, et al. Sulfation of a squid ink polysaccharide and its inhibitory effect on tumor cell metastasis[J].Carbohydrate Polymers, 2010, 81(3)∶ 560-566. DOI∶10.1016/j.carbpol.2010.03.009.
[24] 陈士国. 鱿鱼墨多糖和黑色素的研究[D]. 青岛∶ 中国海洋大学, 2007.
[25] 戴军, 朱松, 汤坚, 等. PMP柱前衍生高效液相色谱法分析杜氏盐藻多糖的单糖组成[J]. 分析测试学报, 2007, 26(2)∶ 206-210.DOI∶10.3969/j.issn.1004-4957.2007.02.015.
[26] 刘晓杰, 焦连庆, 杨利民, 等. 蜜环菌多糖的分离纯化及PMP衍生化HPLC分析[J]. 中国药师, 2012, 15(4)∶ 448-451. DOI∶10.3969/j.issn.1008-049X.2012.04.004.
[27] 郭怀忠, 姜文月, 杜智昊, 等. 1-苯基-3-甲基-5-吡唑啉酮衍生中药寡糖的毛细管区带电泳分离[J]. 色谱, 2011, 29(3)∶ 254-258.DOI∶10.3724/SP.J.1123.2011.00254.
[28] 毛阳. 日本枪乌贼营养分析及多糖提取分离[D]. 青岛∶ 中国海洋大学, 2011.
[29] 袁梦, 汤勇, 徐姗楠, 等. 珠江口南沙海域秋季渔业资源群落结构特征[J]. 南方水产科学, 2017, 13(2)∶ 18-25. DOI∶10.3969/j.issn.2095-0780.2017.02.003.
[30] 张鹏, 张俊, 李渊, 等. 秋季南海中南部海域的一次灯光罩网探捕调查[J]. 南方水产科学, 2016, 12(2)∶ 67-74. DOI∶10.3969/j.issn.2095-0780.2016.02.010.
[31] 韩青鹏, 陆化杰, 陈新军, 等. 南海北部海域中国枪乌贼角质颚的形态学分析[J]. 南方水产科学, 2017, 13(4)∶ 122-130. DOI∶10.3969/j.issn.2095-0780.2017.04.015.
[32] 晏磊, 张鹏, 杨吝, 等. 月相对南海灯光罩网鸢乌贼渔获率的影响分析[J]. 南方水产科学, 2015, 11(3)∶ 16-21. DOI∶10.3969/j.issn.2095-0780.2015.03.003.
[33] 张鹏, 杨吝, 杨炳忠, 等. 春季南沙海域鸢乌贼种群结构特征的研究[J]. 南方水产科学, 2015, 11(5)∶ 11-19. DOI∶10.3969/j.issn.2095-0780.2015.05.002.
[34] 粟丽, 陈作志, 张鹏. 南海中南部海域春秋季鸢乌贼繁殖生物学特征研究[J]. 南方水产科学, 2016, 12(4)∶ 96-102. DOI∶10.3969/j.issn.2095-0780.2016.04.012.
Separation, Purification and Monosaccharide Composition of Polysaccharides from the Ink of Sthenoteuthis oualaniensis in South China Sea
HUANG Hui, YANG Lizhi, YANG Xianqing*, LI Laihao, HAO Shuxian, WEI Ya, WANG Jinxu
(Key Laboratory of Aquatic Product Processing, Ministry of Agriculture, National R&D Center for Aquatic Product Processing,South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China)
Abstract:Objective∶ To isolate and purify polysaccharides from the ink of Sthenoteuthis oualaniensis in the South China Sea, and to analyze the monosaccharide composition of the purified polysaccharides. Methods∶ Crude polysaccharides were isolated through water extraction followed by alcohol precipitation and passed through a solid phase extraction column to remove the pigment. The polysaccharides were fractionated and further purified into homogeneity by sequential chromatographies on DEAE-52 ion exchange and Sephacryl HR-300 columns. The monosaccharide composition was analyzed by ultra performance liquid chromatography (UPLC) after 1-phenyl-3-methyl-5-pyrazolone (PMP) derivatization.Results∶ Three purified polysaccharides designated as SIP1, SIP2, and SIP3 were obtained. SIP1 was composed of D-mannose,D-glucose, and D-galactose while SIP2 and SIP3 were composed of D-mannose, rat sugar, D-glucose, D-galactose and L-(-)-fucose in different ratios.
Key words:sepia ink polysaccharides; separation and purification; monosaccharide analysis
DOI∶10.7506/spkx1002-6630-201724019
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2017)24-0118-06
引文格式:
黄卉, 杨丽芝, 杨贤庆, 等. 南海鸢乌贼墨多糖分离纯化及组分分析[J]. 食品科学, 2017, 38(24): 118-123.
DOI:10.7506/spkx1002-6630-201724019. http://www.spkx.net.cn
HUANG Hui, YANG Lizhi, YANG Xianqing, et al. Separation, purification and monosaccharide composition of polysaccharides from the ink of Sthenoteuthis oualaniensis in South China Sea[J]. Food Science, 2017, 38(24)∶ 118-123. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724019. http∶//www.spkx.net.cn
收稿日期:2016-11-12
基金项目:农业部财政重大专项(NFZX2013);国家重点基础研究发展计划(973计划)项目(2014CB441500)
作者简介:黄卉(1980—),女,副研究员,博士,主要从事水产品加工与质量安全研究。E-mail:huanghuigd@aliyun.com
*通信作者:杨贤庆(1963—),男,研究员,学士,主要从事水产品加工与质量安全研究。E-mail:yxqgd@163.com