常 强1,2,苏明华1,2,*,陈清西1,*,曾碧玉1,2,李惠华2,王 伟1,2
(1.福建农林大学园艺学院,福建 福州 350002;2.福建省亚热带植物研究所,福建省亚热带植物生理生化重点实验室,福建 厦门 361006)
摘 要:目的:定性分析和定量检测橄榄(Canarium album L.)果实提取物中主要酚类物质以及评价其抗氧化活性。方法:采用超高效液相色谱-飞行时间质谱鉴定了橄榄果实中的12 种酚类化学成分;利用多重反应检测模式的超高效液相色谱-串联质谱技术,建立一个快速、稳定可靠检测橄榄果实多酚的方法。该方法可在15 min内完成,其检测范围内线性良好(r>0.98);定量限小于1.436 ng/mL;检出限小于4.786 ng/mL;准确度大于80.19%,精密度大于1.12%;回收率大于80.13%。适用于橄榄果实中多酚物质的定性定量分析。对橄榄果实不同溶剂提取的多酚组分定量分析表明,3-O-没食子酸奎宁酸和老鹳草素同分异构体含量最高,为橄榄果实提取物中主要成分。对不同溶剂提取的橄榄果实多酚及其抗氧化能力的研究表明,80%丙酮溶剂提取具有更高的多酚含量和抗氧化能力。
关键词:多酚;超高效液相色谱-串联质谱;橄榄
多酚是植物体内重要的次生代谢产物,已被证实具有广泛的生物活性,包括抗氧化、抗炎、抗癌、抗肿瘤、抗病毒、抗血栓形成和抗动脉硬化等多种生理功能,因其自身的安全性已成为近年来食品科学的研究热点[1]。橄榄(Canarium album (Lour.) Raeusch)属无患子目橄榄科(Burseraceae)橄榄属(Canarium)植物,为我国特色果树资源,可供鲜食或加工,自古为我国常用中药材。据报道,橄榄果实富含总酚,其含量可达280.46 mg GAE/g(以干质量计),1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为97.11%,在68 种常见中药材中含量属最高,抗氧化能力最强,因此被认为是一种优良天然抗氧化剂的主要来源[2]。现已报道的橄榄果实中酚类物质有酚酸类化合物(没食子酸、没食子酸甲酯、没食子酸乙酯、芥子酸)[3-4]、黄酮类(山柰酚-3-O-β-D-葡萄糖苷、金丝桃苷、穗花衫双黄酮、木犀草素、槲皮素)[4-5]、鞣花单宁类化合物(异柯里拉京、六羟基联苯二甲酸的衍生物)[3-4]。
目前,用于橄榄果实多酚类物质定量分析的方法仅限于福林-酚比色法和高效液相色谱(high performance liquid chromatography,HPLC)法[4]。其中,福林-酚比色法主要用于测定总多酚含量,无法分析多酚单体化合物含量。HPLC法可以测定多酚类组分含量,但其分辨率低、耗时长且难以达到对叠加峰相应化合物进行准确地分离鉴定。超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLCMS/MS)法被认为是一种强大的分析手段,具有高灵敏度、检测时间短以及更高分辨率等特点,主要基于化合物的分子质量和离子碎片的多反应检测(multiple reaction monitoring,MRM)模式进行定量检测,可提供分子离子信息,排除在HPLC中叠加峰的干扰[6],具有同时定量定性检测的特点。近年来该技术已大量应用于多酚类化合物的定量定性分析[7-12]。然而截至目前,国内外较少有利用UPLC-MS/MS检测橄榄果实中多酚类物质的方法报道。
据此,本研究基于超高效液相色谱-飞行时间质谱(ultra performance liquid chromatography-Q time of flight mass spectrometry,UPLC-QTOF-MS)研究橄榄果实中12 种多酚化合物的质谱信息,采用MRM模式的UPLC-MS/MS技术建立一种快速灵敏、准确分析橄榄果实中12 种多酚类成分含量的方法;并采用所建方法研究不同溶剂的橄榄果实提取物中相应化合物的含量,测定橄榄果实提取物总多酚和总黄酮含量以及评价其抗氧化活性,为橄榄果实多酚保健功能的开发利用提供依据,对全面评价橄榄果实营养价值具有重要意义。
1.1 材料与试剂
橄榄为‘檀香’品种,于2013年11月25日到福建省福州市闽清县采集(37°36’N,110°17’E),分别从20 株橄榄树采摘5 kg果实用于实验。果实要求大小均一,成熟一致,无病虫害。
异柯里拉京(分析纯) 上海诗丹德公司;3-O-没食子酰基奎宁酸、鞣花酸-4-O-β-D-吡喃葡萄糖苷、鞣花酸-4-O-D-木糖、柯勒黎酸、老鹳草素以及同分异构体为本实验室从橄榄果实中分离(纯度>93.5%);没食子酸、鞣花酸、短叶苏木酚、穗花双黄酮、金丝桃苷、DPPH、2,4,6-三吡啶基三嗪(2,4,6-tris(2-pyridyl)-S-triazine,TPTZ)、2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-amino-di(3-ethyl-benzothiazoline sulphonic acid-6)ammonium salt,ABTS)、水溶性VE(Trolox)、荧光素钠盐(fluoroscein disodium salt,FL)、2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis(2-amidino-propane)dihydrochloride,AAPH)、福林-酚试剂 美国Sigma-Aldrich公司;甲醇、乙腈(色谱级) 美国Tedia公司。
1.2 仪器与设备
Lambda 35紫外-可见光光谱仪 美国Perkin Elmer公司;Heto PowerDry LL1500真空冷冻干燥机(冷阱仓温度-110 ℃,面板加热温度为25 ℃,真空泵vacuubrand RZ2.5 Pressure 4×10-4mbar) 美国Thermo Electron公司;ACQUITY UPLC-SYNAPT G2-Si超高压液相色谱-飞行时间质谱、ACQUITY UPLC-Xevo TQS超高效液相色谱三重四极杆串联质谱仪 美国Waters公司。
1.3 方法
1.3.1 定性分析
UPLC条件:Waters ACQUITY UPLC超高效液相系统,液相分析柱为T3(2.1 mm×100 mm,1.8 µm),柱温保持40 ℃,流动相A为0.1%甲酸溶液,流动相B为乙睛;洗脱梯度为0 min,1% B;0~2 min,1%~7% B;2~13 min,7%~40% B;13~14 min,40%~99% B;14~18 min,99%~1% B;流速0.3 mL/min,进样量1 μL。
MS条件:Waters ACQUITY UPLC配SYNAPT G2-Si HDMS质谱仪,配有电喷雾电离接口,采用负离子模式扫描;毛细管电压2.0 kV;离子源温度120 ℃;脱溶剂气流速(N2)800 L/h;脱溶剂气温度450 ℃;锥孔反吹气流速(N2)50 L/h;锥孔电压30 V;碰撞气电压10~50 eV;取样锥孔电压35 V,微通道板电压1 800 V;质量扫描范围m/z 100~1 200;锁定质量校正:亮氨酸-脑啡肽(质量浓度200 pg/μL,流速10 μL/min,[M-H]-=554.261 5 D,14 min为锁定质量溶液)。
1.3.2 定量分析
色谱条件:色谱柱:ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温40 ℃;流动相A为0.1%甲酸溶液,流动相B为0.1%乙腈溶液;洗脱程序:0~10 min,5%~24% B;11~13 min,24%~100% B;13~16 min,100%~5% B;进样量1 μL;流速0.3 mL/min;紫外检测器波长范围190~800 nm。
MS条件:ACQUITY UPLC-Xevo TQS超高效液相色谱三重四极杆串联质谱仪;电喷雾离子源;扫描方式:负离子扫描;MRM模式;离子源温度150 ℃;毛细管电压2.1 kV;锥孔电压40 V;脱溶剂气流速(N2)800 L/h;脱溶剂气温度400 ℃;锥孔反吹气流速(N2)150 L/h;碰撞氩气流速(Ar)0.13 mL/min;质量扫描范围m/z 100~1 200;数据处理采用MassLynx software version 4.1工作站。
1.3.3 溶液制备
1.3.3.1 对照品溶液制备
对照品储备液:取用1.5 mL EP管,准确称取各标准品1 mg,然后加入1 mL色谱甲醇溶解,其中鞣花酸,鞣花酸-4-O-β-D-吡喃葡萄糖苷和鞣花酸-4-O-D-木糖难溶于甲醇,需用N,N-二甲基甲酰胺溶解。配制为1 mg/mL标准储备液。混合对照品溶液配制:根据每个对照品信号强弱及峰面积大小,选择不同比例配制对照品,形成混标。然后采用50%甲醇溶液稀释为不同水平的质量浓度溶液。
1.3.3.2 样品溶液制备
用于方法学考察试样:2 g样品按照比1∶20(g/mL)的比例加入4 ℃预冷的80%甲醇溶液;10 g橄榄果肉冻干样品按上述比例加入有机溶剂(80%甲醇、80%乙醇、80%丙酮、80%乙酸乙酯和超纯水)。30 ℃超声波350 W(超纯水溶剂提取样在60 ℃水浴振荡器中提取60 min),提取25 min,滤纸过滤,果渣再重复提取2 次。合并3 次离心上清液,真空条件下45 ℃蒸干,方法学考察样品用甲醇-水(85∶15,V/V)定容至5 mL;-80 ℃冷藏备用。溶剂提取试样置于真空冷冻干燥器中冻干为粉末,转入玻璃密闭容器中-80 ℃冷藏备用。
1.3.3.3 质量控制溶液与回收率相关溶液制备
质量控制溶液配制:质量控制溶液为混合基质,其中含有3 个单糖(蔗糖、葡萄糖、果糖)质量浓度分别为2 μg/mL,分低、中、高3 个混合对照品质量浓度加入基质中,使混标溶液的终质量浓度为100、400、800 ng/mL,以此作为质量控制溶液。
回收率相关溶液配制:样品原液稀释500 倍,然后加入100、400 μL和800 μL的混标溶液(1 μg/mL)各两管以及未加标样品稀释液。
1.3.4 方法学考察
1.3.4.1 线性范围实验
将混合对照品溶液依次稀释,得到9 个质量浓度梯度的对照品溶液,每个质量浓度梯度进样3 次实验。以峰面积y(对照品峰面积)为纵坐标,以对照品的质量浓度x(ng/mL)为横坐标绘制标准曲线,并计算回归方程及相关系数。
1.3.4.2 准确度和精确度实验
准确度和精密度参照Bataglion等[7]的方法,利用质量控制样品来评价。日内重复测定3 次,随行标准曲线,根据随行标准曲线计算质量控制溶液质量浓度,连续测定3 d,共9 次,同理计算质量控制溶液质量浓度。准确度根据测定的质量控制溶液质量浓度和已知质量控制溶液质量浓度的比值分别计算日内和日间的平均百分比值,准确度达到80%~120%为合理区间。精密度为日内(n=3)和日间(n=9)的变异系数,精密度小于20%为合理区间。
1.3.4.3 回收率实验
回收率按下式计算:
1.3.4.4 检出限和定量限测定
将混合对照品溶液不断稀释,每个质量浓度梯度进样3 次。信噪比为3和10时所对应的对照品质量浓度即为检出限和定量限。
1.3.5 总多酚和总黄酮含量以及抗氧化活性分析
总多酚含量采用福林-酚比色法[4]并作适当修改,没食子酸作为标准曲线,总多酚提取量以每克干质量等同于没食子酸当量(gallic acid equivalent,GAE)的毫克数表示(mg GAE/g);总黄酮含量采用NaNO2-Al(NO3)3-NaOH方法测定[13],芦丁作为标准曲线,总黄酮含量以每克干质量等同于芦丁(rutin equivalent,RE)的毫克数表示(mg RE/g);多酚化合物含量以干质量计(mg/g)。
总还原力采用铁离子还原能力(ferric reducing antioxidant power,FRAP)法测定[14]。准确吸取橄榄果实多酚样提取液50 μL,加入3 mL TPTZ工作液,37 ℃条件下水浴30 min,测定波长593 nm处吸光度。Trolox作为标准曲线,样品中FRAP值以每克干质量相当Trolox当量的微摩尔数表示(μmol TE/g)。
DPPH法测定样品提取液的抗氧化能力[15]。取样品溶液50 μL,置于5 mL离心管中,加入3.0 mL 6.0×10-5mol/L的DPPH试剂(2.4 mg DPPH溶解与100 mL乙醇溶剂中得到,DPPH试剂现配现用),摇匀,室温避光反应30 min,同时以无水乙醇为空白,于波长517 nm处测定吸光度。计算自由基清除率达到50%的样品质量浓度(the half maximal inhibitory concentration,IC50)值。
清除ABTS+·能力测定参照Choi等[16]的方法,并略作修改。3.0 mL ABTS工作液,加入50 μL Trolox或不同质量浓度样品稀释液,准确振荡30 s,测定反应6 min后于波长734 nm处的吸光度,计算IC50值。
氧自由基清除能力(oxygen radical absorbance capacity,ORAC)参考Huang Dejian等[17]方法并加以改进。向96 孔板中加入橄榄果实提取液25 μL,10 min后向各孔加入150 μL FL工作液和25 μL AAPH,振荡5 s后进行读数。设置激发波长为485 nm,发射波长为530 nm,每2 min测定一次荧光强度,测定时间为达到初始荧光强度的5%为止。计算荧光衰退曲线下面积。然后将其与Trolox净荧光衰退曲线条件下面积的比值与二者浓度(C)的比值做比,获得ORAC值。
2.1 橄榄果实中12 种多酚化合物定性分析
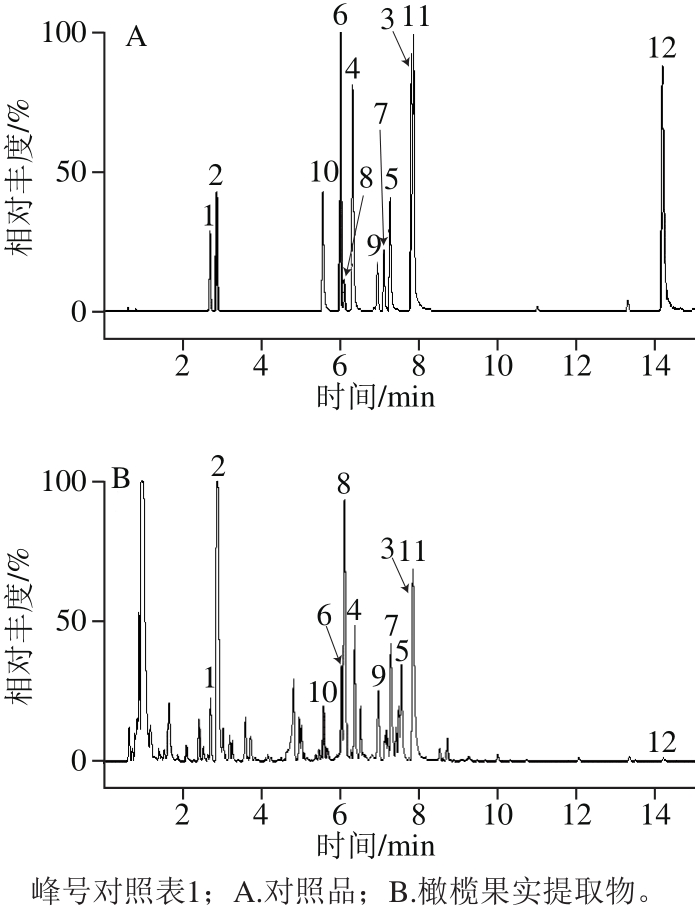
图1 UPLC-QTOF-MS图谱
Fig. 1 Representative UPLC-QTOF-MS chromatograms of fruit extracts of Chinese olives and a standard mixture of phenols
UPLC-QTOF-MS技术由于具有分辨率高、质量范围宽、灵敏度高等优点,已被广泛应用于酚类化合物的精确分子质量检测[18-21]。本研究利用UPLC-QTOF-MS技术检测了橄榄果实12 种多酚类化合物;并根据样品化合物的出峰时间、最大吸收波长以及在负离子模式下的质谱信息,结合对照品和相关文献[3-4],对化合物进行鉴定,如图1和表1所示。
表1 橄榄果实提取物的UPLC-QTOF-MS谱图鉴定
Table 1 UPLC-QTOF-MS characterization of phenolic compounds in Chinese olive fruit
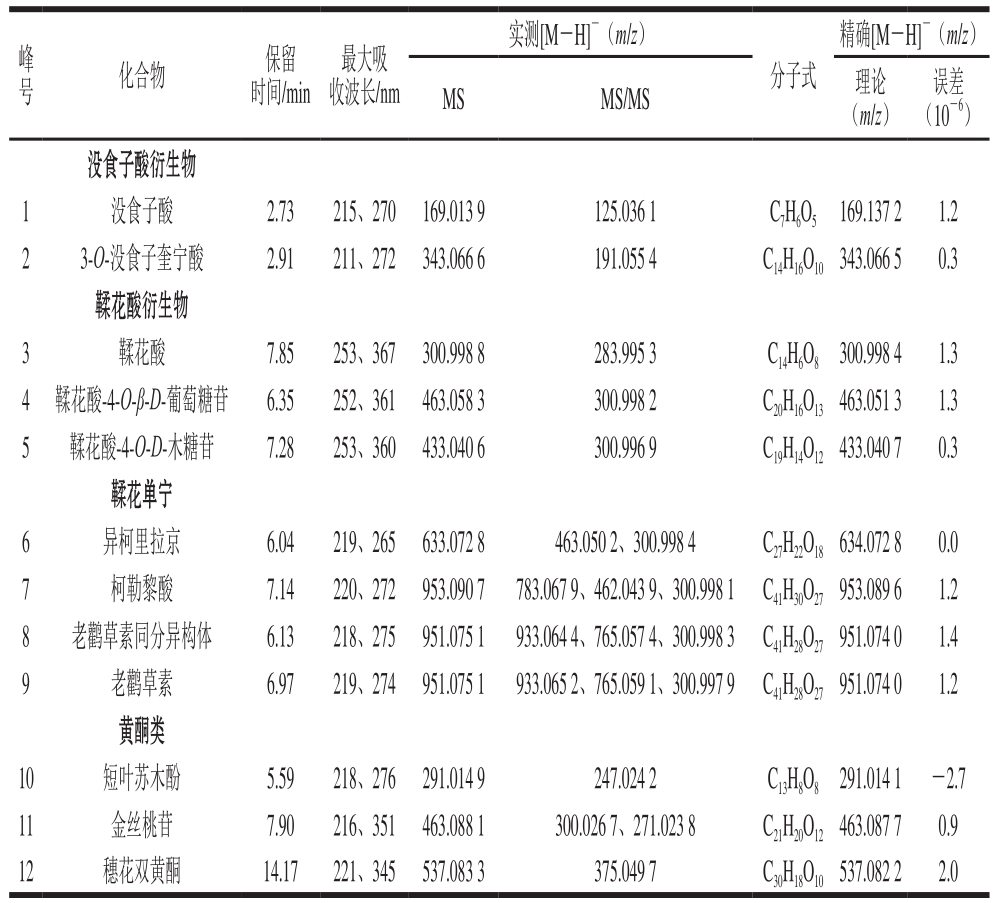
如图1所示,橄榄果实提取物中化合物主要集中于2~10 min内,该段时间的流动相为5%~24%乙腈溶液,说明橄榄果实多酚属中极性化合物。从表1可以看出,12 个已选化合物的最大吸收波长均在200~400 nm之间,属于多酚类物质的特征吸收波长。根据结构不同将12 个化合物分为4类:没食子酸衍生物(没食子酸和3-O-没食子酰基奎宁酸)、鞣花酸衍生物(鞣花酸、鞣花酸-4-O-β-D-吡喃葡萄糖苷和鞣花酸-4-O-D-木糖)、鞣花单宁(异柯里拉京、柯勒黎酸、老鹳草素及其同分异构体)、黄酮类(短叶苏木酚、穗花双黄酮、金丝桃苷)。
2.2 橄榄果实中12 种多酚化合物UPLC-MS/MS定量分析
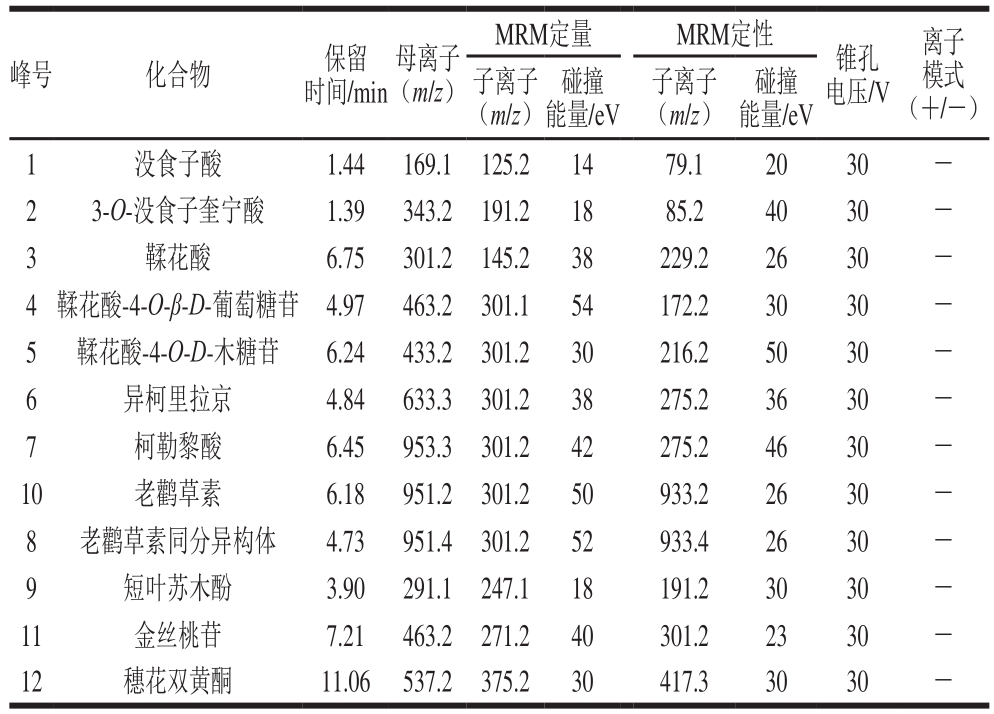
相比HPLC系统,UPLC具有更高的分离度和灵敏度以及更短的检测时间[22]。本研究选择12 种多酚化合物可在15 min内完成检测。UPLC的流动相选用文献中最为常见的系统[23]:0.1%甲酸-水溶液和0.1%甲酸-乙腈溶液。经正负离子扫描对比,发现负离子模式下响应高,背景干扰少,且橄榄果实中富含多元酚类物质,属于酸性化合物,适宜于负离子模式检测,因此采用负离子模式扫描。为了得到母离子和特征子离子以及优化锥孔电压和碰撞能量,采用针泵将标准品混标甲醇溶液进样,以全扫描确定母离子,然后找出响应信号最强的1 种或2 种碎片离子作为对应的子离子,最终以母离子和子离子组成检测离子对,以响应信号最强的离子为定量离子,采用MRM方式对样品进行定性定量分析。如图2、表2所示。优化后,MRM的质谱检测技术可对色谱峰重叠的化合物分别给出准确的定性定量信息,从而可有效避免因部分化合物在色谱上难以完全分离而导致不准确的定量结果,达到准确可靠的定量目的。
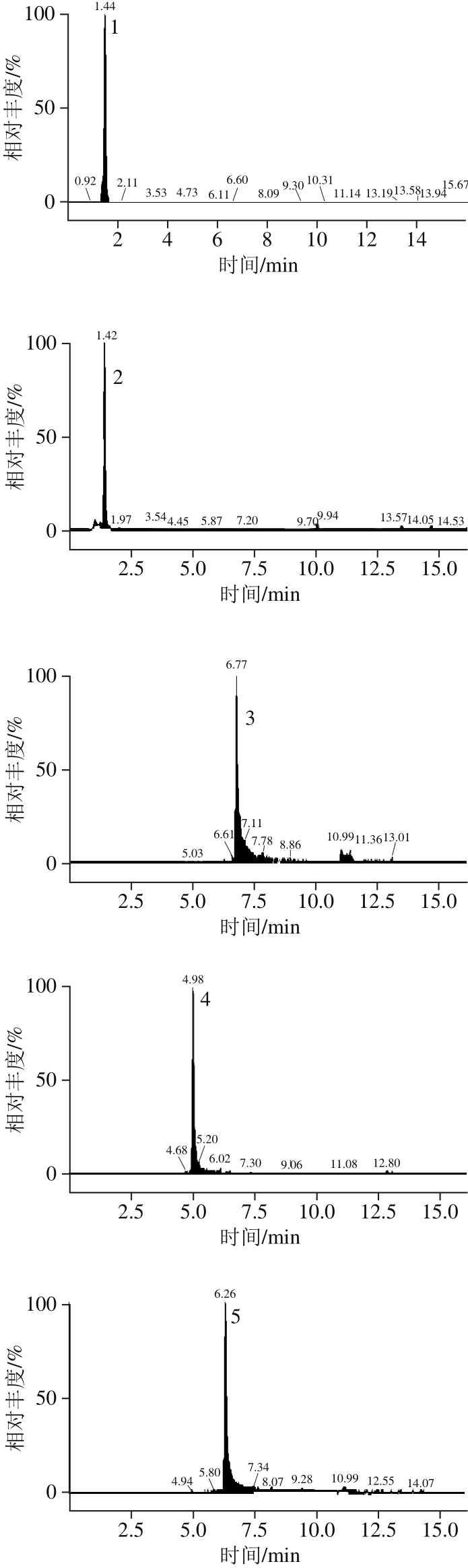
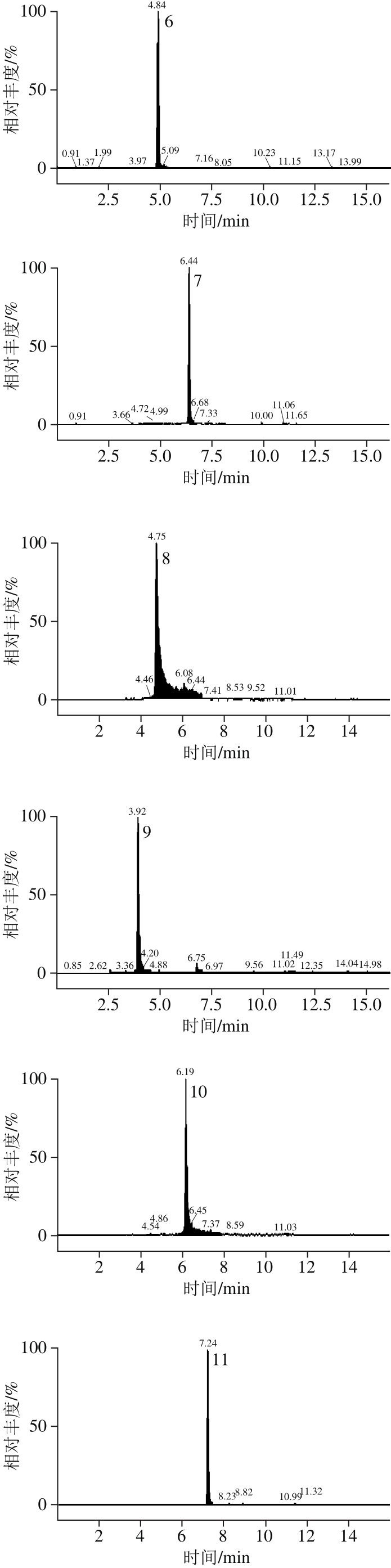
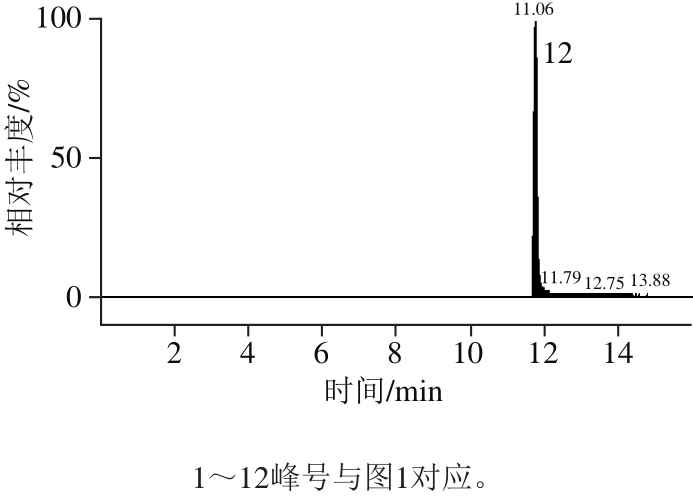
图2 多酚标准溶液的碎片离子色谱图
Fig. 2 UPLC-MS/MS identification of phenolic standards and phenolic compounds present in Chinese olive fruit
表2 UPLC-MS/MS分析定量酚类化合物的MRM参数
Table 2 List of MRM parameters for qualified and quantified phenolic compounds in the UPLC-MS/MS analysis
2.3 UPLC-MS/MS定量分析方法学考察结果
为了评价在MRM模式下UPLC-MS/MS检测方法的有效稳定性,本研究考察了相关质量控制参数,保证备选的多酚组分很好地被定性定量。
表3 UPLC-MS/MS定量分析的回归方程、线性范围、相关系数、检出限、定量限和回收率
Table 3 Regression equations, linearity ranges, correlation coefficients,limits of detection (LODs), limits of quantitation (LOQs) and recovery for quantitative analysis of phenolic compounds by UPLC-MS/MS
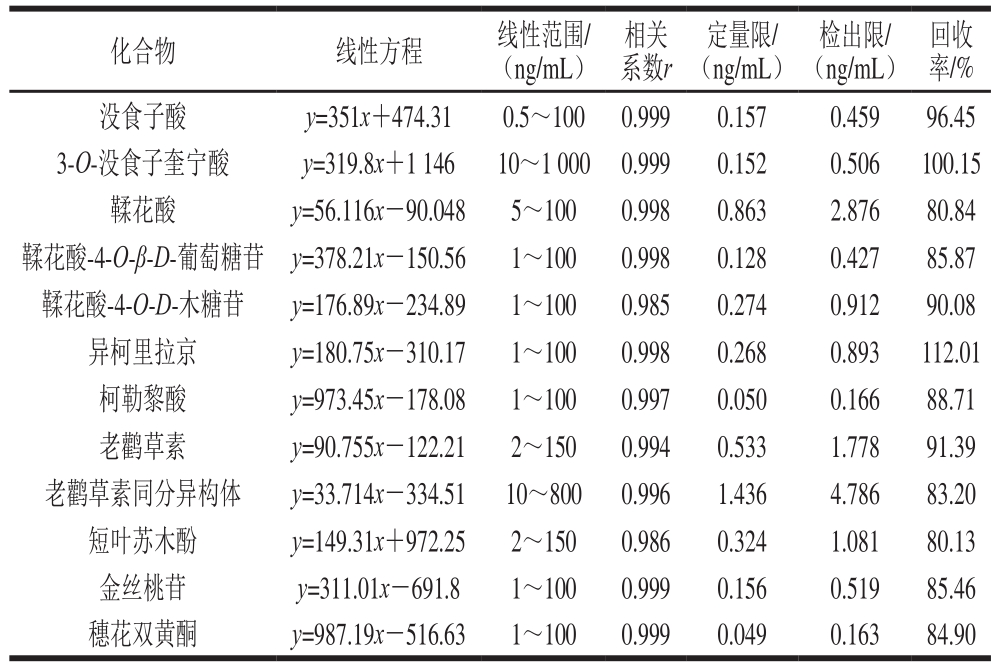
表4 质量控制样本评价方法的日内和日间准确度和精密度
Table 4 Intra-and inter-day precision and accuracy for quality control(QC) samples at three different concentration levels
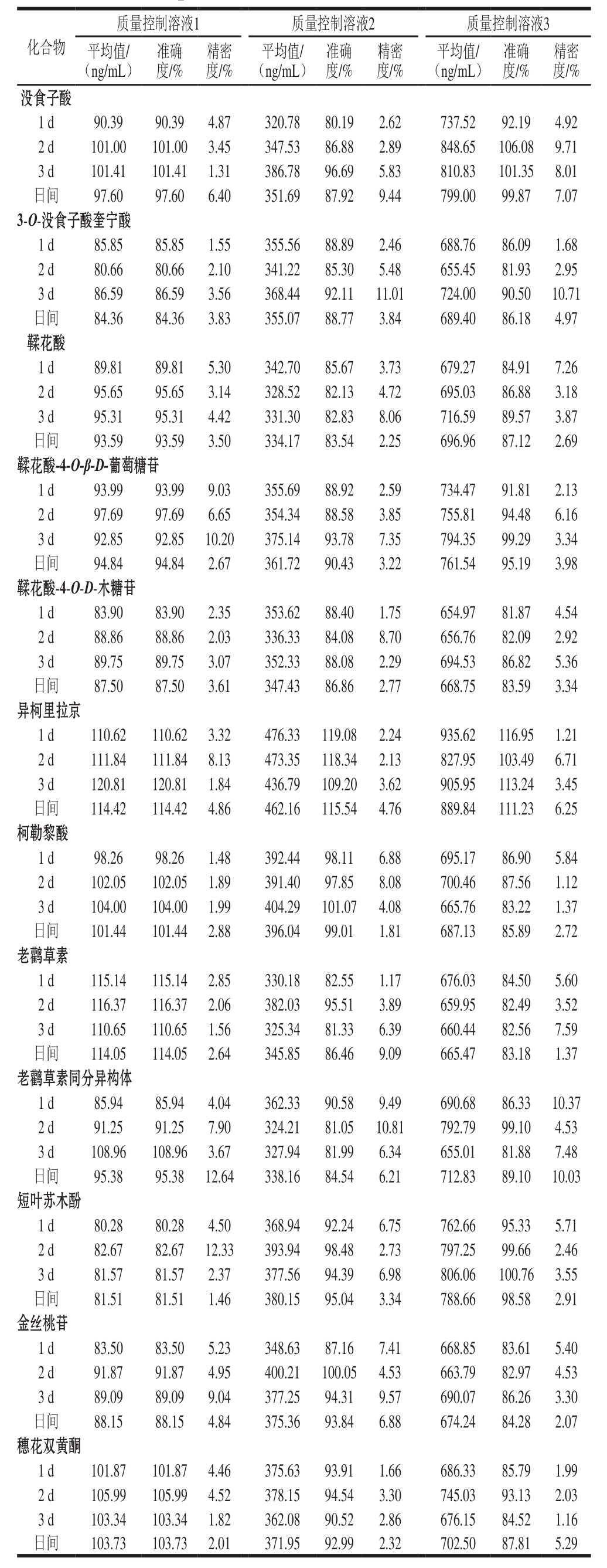
不同质量浓度混合标准品溶液,于优化后条件分别进样测定,以各组分特征离子峰面积为纵坐标,以9 种质量浓度为横坐标进行线性回归,得到回归方程、相关系数和线性范围,如表3所示。12 种多酚在0.5~1 000 ng/mL范围内线性良好(0.985~0.999);定量限和检出限分别为0.049~1.436 ng/mL和0.163~4.786 ng/mL。为了进一步评价该方法的准确性和精确性,利用质量控制溶液作为评价溶液体系,如表4所示。该方法的日内和日间准确度在80.19%~120.81%之间,日内和日间的精密度在1.12%~12.64%之间,均在所规定范围内(准确度为(100±20)%,变异系数小于10%)。表明该方法具有良好的准确度和精密度。平均回收率在80.13%~112.01%之间,表明该方法的回收率达到要求。可见,UPLC-MS/MS的MRM模式可在保证分离度的情况下大大缩短了分析时间,同时在很大程度上节省了溶剂消耗,降低了分析成本,具有灵敏度高、稳定性强、快捷准确的特点。
2.4 橄榄果实多酚组分含量以及抗氧化活性分析
表5 橄榄果实不同溶剂提取的多酚化合物含量
Table 5 Contents of phenolic compounds in different extract solvents of Chinese olive fruit
mg/g
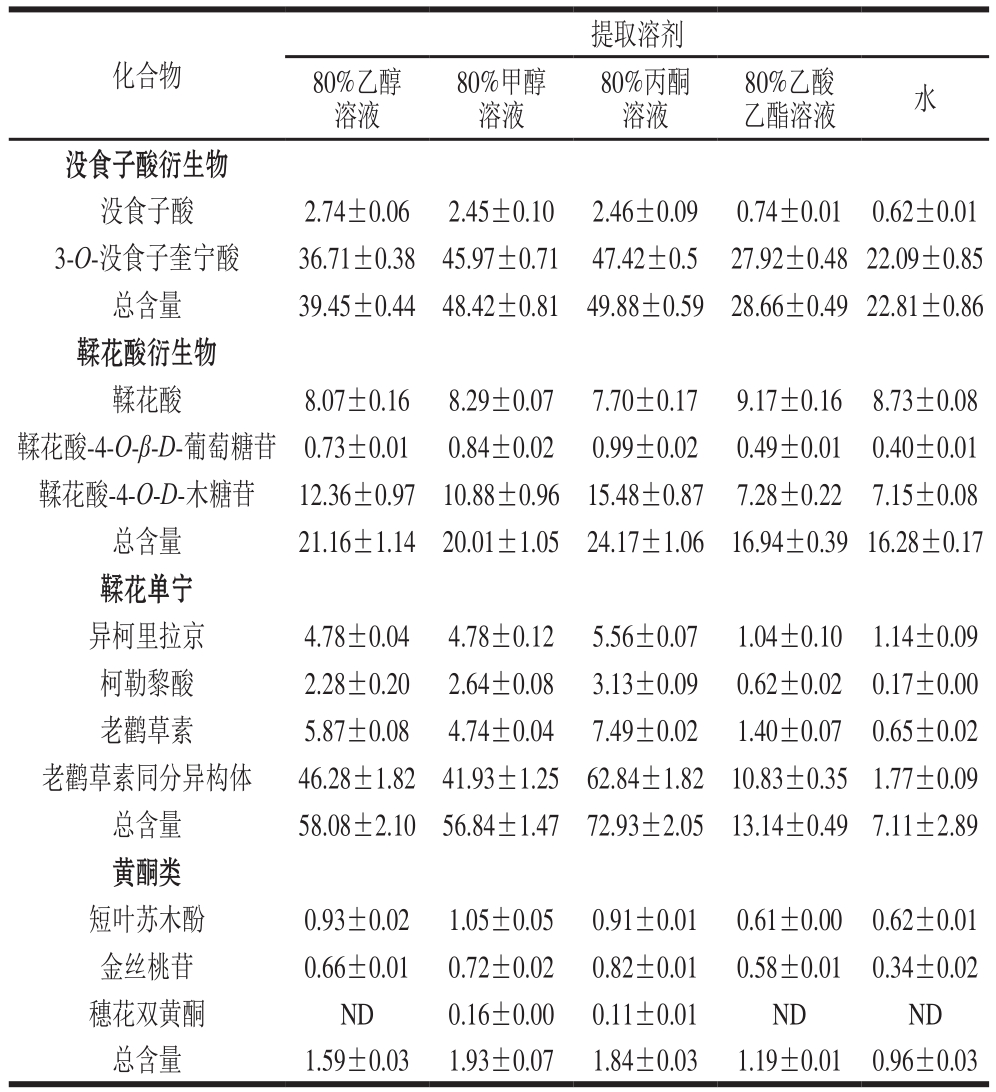
注:ND.未检出。
利用建立的UPLC-MS/MS的MRM模式对橄榄果实不同溶剂提取的多酚组分含量进行测定。如表5所示,80%丙酮溶液对12 种化合物具有更高的提取率,其次是80%甲醇溶液和80%乙醇溶液,80%乙酸乙酯溶液和水为最低。没食子酸衍生物、鞣花酸衍生物和鞣花单宁类物质为主要组成部分,黄酮类含量最低。单个组分中,3-O-没食子酸奎宁酸和老鹳草素同分异构体含量最高,分别为22.09~47.42 mg/g和1.77~62.84 mg/g。He Zhiyong等[4]研究表明橄榄果实多酚中没食子酸含量最高,而林玉芳等[24]则认为鞣花酸含量最高。本实验结果与前人研究存在差异的原因可能是采用不同检测方法所造成。本研究采用UPLC-MS/MS联用技术,主要是根据化合物的碎片离子的响应值定量并且利用相应离子对定性,而前人研究均采用HPLC分析技术,该方法是根据化合物吸收紫外光定量,由于叠加峰的存在很难达到定性的目的。因此,本研究对橄榄果实多酚组分的定性定量更具针对性。本研究还发现3-O-没食子酸奎宁酸和老鹳草素同分异构体在80%丙酮提取液中含量最高。据报道,3-O-没食子酸奎宁酸具有抗HIV活性[25],老鹳草素具有镇痛和抗感染病活性[26]。表明80%丙酮溶剂适用于提取橄榄果实中3-O-没食子酸奎宁酸和老鹳草素以用于药物先导化合物。
不同溶剂提取对橄榄果实提取物的总多酚和总黄酮含量同样有显著影响。从表6可以看出,总多酚提取量最高的为80%丙酮溶液,为171.95 mg GAE/g。其次为80%甲醇溶液和80%乙醇溶液,80%乙酸乙酯溶液和水最低。这表明溶剂的极性可能引起多酚提取量不同的原因。Kuo等[27]报道橄榄果实采用不同溶剂提取对多酚含量的提取能力依次为50%乙醇溶液>水>甲醇>丙酮>乙酸乙酯,本研究采用80%丙酮溶液提取多酚含量高于Kuo等[27]采用纯丙酮溶剂提取的多酚提取量。这表明双溶剂系统比单一溶剂系统多酚提取效率更高[28]。
表6 橄榄果实不同溶剂提取的总多酚、总黄酮含量以及抗氧化能力
Table 6 Contents of total phenolics, total flavonoids and antioxidant activities indifferent solvent extracts of Chinese olive fruit
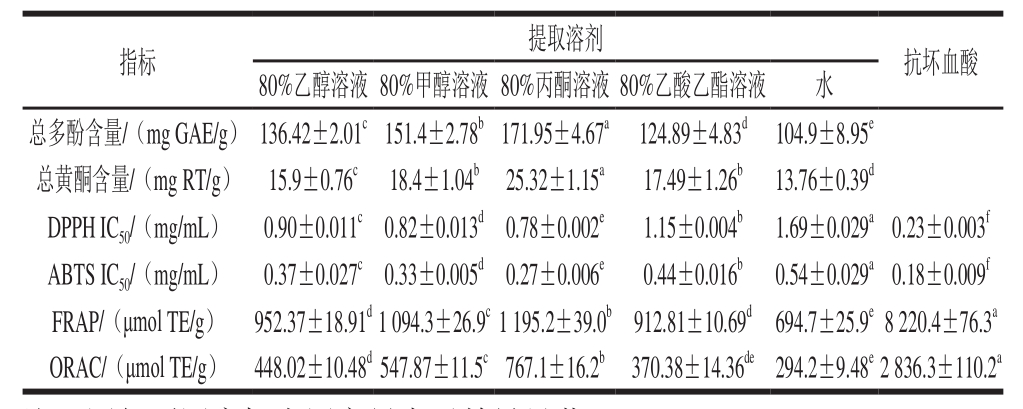
注:同行不同肩标小写字母表示差异显著(P<0.05)。
采用4 种抗氧化活性评价方法(DPPH、ABTS、FRAP和ORAC)对不同溶剂提取进行研究。由表6可知,80%丙酮溶液提取的DPPH和ABTS法IC50值最低,分别为0.78 mg/mL和0.27 mg/mL。较低的IC50值具有更高的自由基清除能力[29]。表明80%丙酮溶液的橄榄果实提取物清除自由基的能力最强,其余顺序依次为80%甲醇溶液>80%乙醇溶液>80%乙酸乙酯溶液>水。FRAP和ORAC表现为同样的趋势,说明80%丙酮溶液橄榄果实提取物的总还原能力和氧自由基清除能力最强。这表明提取溶剂对橄榄抗氧化能力同样具有显著影响。前人研究表明,提取物间抗氧化能力的显著差异,本质上是由于提取溶剂极性的差异,使得提取出的抗氧化物质含量存在差异[30]。
表7 抗氧化能力与总多酚和黄酮的相关性分析
Table 7 Correlation coefficients between antioxidant capacity and total phenols and total flavonids contents

注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
如表7所示,总多酚和总黄酮含量与抗氧化能力显著或极显著正相关,这表明橄榄果实抗氧化活性主要归因于其高含量的总多酚。单宁类物质相比黄酮具有更强的抗氧化能力[31],且没食子酰基数量、分子质量大小以及邻位酚羟基结构均可增强单宁的抗氧化[32]。本研究结果表明,橄榄果实提取物中主要含有没食子酸衍生物以及鞣花单宁类物质,如异柯里拉京、柯勒黎酸、老鹳草素及其同分异构体。此类具多羟基和没食子酰基的组分可能是强抗氧化活性的主要贡献者。
本研究利用UPLC-QTOF-MS分析了橄榄中已选择的12 种多酚化合物的质谱信息,并根据结构不同分为没食子酸及其衍生物、鞣花酸及其衍生物、鞣花单宁、黄酮共4 组。利用MRM模式的UPLC-MS/MS技术,建立了一个快速、稳定灵敏的可定性定量橄榄果实多酚的方法。该方法可在15 min内完成,其检测范围内线性良好(r>0.98);检出限小于4.786 ng/mL;定量限小于1.436 ng/mL;准确度大于80.19%,精密度大于1.12%。回收率大于80.13%;表明该方法可以对橄榄果实多酚组分进行真实的定性定量检测。对橄榄果实不同溶剂提取的多酚组分定量分析表明,没食子酸衍生物、鞣花酸衍生物和鞣花单宁类物质为主要组成部分,黄酮类含量最低。单个组分中,3-O-没食子酸奎宁酸和老鹳草素同分异构体含量最高,为橄榄果实提取物中主要多酚类化合物。对不同溶剂提取的橄榄果实多酚及其抗氧化能力的研究表明,80%丙酮溶剂提取具有更高的多酚含量和抗氧化能力。
参考文献:
[1] RUBIÓ L, MOTILVA M J, ROMERO M P. Recent advances in biologically active compounds in herbs and spices∶ a review of the most effective antioxidant and anti-inflammatory active principles[J].Critical Reviews in Food Science and Nutrition, 2013, 53(9)∶943-953. DOI∶10.1080/10408398.2011.574802.
[2] LIU H Y, QIU N X, DING H H, et al. Polyphenols contents and antioxidant capacity of 68 Chinese herbals suitable for medical or food uses[J]. Food Research International, 2008, 41(4)∶ 363-370.DOI∶10.1016/j.foodres.2007.12.012.
[3] HE Z Y, XIA W S, CHEN J. Isolation and structure elucidation of phenolic compounds in Chinese olive (Canarium album L.) fruit[J].European Food Research and Technology, 2008, 226(5)∶ 1191-1196.DOI∶10.1007/s00217-007-0653-5.
[4] HE Z Y, XIA W S. Analysis of phenolic compounds in Chinese olive (Canarium album L.) fruit by RPHPLC-DAD-ESI-MS[J].Food Chemistry, 2007, 105(3)∶ 1307-1311. DOI∶10.1016/j.foodchem.2007.04.049.
[5] XIANG Z B, CHEN H S, JIN Y S, et al. Phenolic constituents of Canarium album[J]. Chemistry of Natural Compounds, 2010, 46(1)∶119-120. DOI∶10.1007/s10600-010-9543-3.
[6] IGUAL M, GARCIA-MARTINEZ E, MARTIN-ESPARZA M E, et al. Effect of processing on the drying kinetics and functional value of dried apricot[J]. Food Research International, 2012, 47(2)∶ 284-290.DOI∶10.1016/j.foodres.2011.07.019.
[7] BATAGLION G A, DA SILVA F, EBERLIN M N, et al.Determination of the phenolic composition from Brazilian tropical fruits by UHPLC-MS/MS[J]. Food Chemistry, 2015, 180∶ 280-287.DOI∶10.1016/j.foodchem.2015.02.059.
[8] KUMARI S, ELANCHERAN R, KOTOKY J, et al. Rapid screening and identification of phenolic antioxidants in Hydrocotyle sibthorpioides Lam. by UPLC-ESI-MS/MS[J]. Food Chemistry, 2016,203∶ 521-529. DOI∶10.1016/j.foodchem. 2016. 02.101.
[9] BECERRA-HERRERA M, SÁNCHEZ-ASTUDILLO M, BELTRÁN R, et al. Determination of phenolic compounds in olive oil∶ new method based on liquid-liquid micro extraction and ultra high performance liquid chromatography-triple-quadrupole mass spectrometry[J].LWT-Food Science and Technology, 2014, 57(1)∶ 49-57.DOI∶10.1016/j.lwt.2014.01.016.
[10] WU Y H, JIANG X L, ZHANG S X, et al. Quantification of flavonol glycosides in Camellia sinensis by MRM mode of UPLC-QQQMS/MS[J]. Journal of Chromatography B, 2016, 1017∶ 10-17.DOI∶10.1016/j.jchromb.2016.01.064.
[11] ALARCÓN F M, ROMERO-GONZÁLEZ R, GARRIDO F A,et al. Analysis of phenolic compounds in olive oil by solid-phase extraction and ultra high performance liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2012, 134(4)∶ 2465-2472.DOI∶10.1016/j.foodchem.2012.04.058.
[12] 罗爽妍, 王超, 段翰英, 等. 野生桃金娘主要抗氧化成分及其抗氧化能力[J]. 食品科学, 2015, 36(17)∶ 77-82. DOI∶10.7506/spkx1002-6630-201517015.
[13] KHOSHNAM F, TABATABAEEFAR A, VARNAMKHASTI M G,et al. Mass modeling of pomegranate (Punica granatum L.) fruit with some physical characteristics[J]. Scientia Horticulturae, 2007, 114(1)∶21-26. DOI∶10.1016/j.scienta. 2007.05.008.
[14] GRIFFIN S P, BHAGOOLI R. Measuring antioxidant potential in corals using the FRAP assay[J]. Journal of Experimental Marine Biology and Ecology, 2004, 302(2)∶ 201-211. DOI∶10.1016/j.jembe.2003.10.008.
[15] BUCIĆ KOJIĆ A, PLANINIĆ M, TOMAS S, et al. Influence of solvent and temperature on extraction of phenolic compounds from grape seed, antioxidant activity and colour of extract[J]. International Journal of Food Science & Technology, 2009, 44(12)∶ 2394-2401.DOI∶10.1111/j.1365-2621.2008.01876.x.
[16] CHOI S H, AHN J B, KIM H J, et al. Changes in free amino acid,protein, and flavonoid content in jujube (Ziziphus jujube) fruit during eight stages of growth and antioxidative and cancer cell inhibitory effects by extracts[J]. Journal of Agricultural and Food Chemistry,2012, 60(41)∶ 10245-10255. DOI∶10.1021/jf302848u.
[17] HUANG D, OU B, HAMPSCH-WOODILL M, et al. High-throughput assay of oxygen radical absorbance capacity (ORAC) using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format[J]. Journal of Agricultural and Food Chemistry, 2002, 50(16)∶ 4437-4444. DOI∶10.1021/jf0201529.
[18] MELGAREJO P, SALAZAR D M, ARTÉS F. Organic acids and sugars composition of harvested pomegranate fruits[J]. European Food Research and Technology, 2000, 211(3)∶ 185-190. DOI∶10.1007/s002170050021.
[19] METROUH-AMIR H, DUARTE C M M, MAIZA F. Solvent effect on total phenolic contents, antioxidant, and antibacterial activities of Matricaria pubescens[J]. Industrial Crops and Products, 2015, 67∶249-256. DOI∶10.1016/j.indcrop.2015.01.049.
[20] IGLESIAS M J, GARCÍA-LÓPEZ J, COLLADOS-LUJÁN J F, et al. Differential response to environmental and nutritional factors of high-quality tomato varieties[J]. Food Chemistry, 2015, 176∶ 278-287.DOI∶10.1016/j.foodchem.2014.12.043.
[21] JIMÉNEZ-ZAMORA A, DELGADO-ANDRADE C, RUFIÁNHENARES J A. Antioxidant capacity, total phenols and color profile during the storage of selected plants used for infusion[J]. Food Chemistry,2016, 199∶ 339-346. DOI∶10.1016/j.foodchem.2015.12.019.
[22] JIANG H, ENGELHARDT U H, THRÄNE C, et al. Determination of flavonol glycosides in green tea, oolong tea and black tea by UHPLC compared to HPLC[J]. Food Chemistry, 2015, 183∶ 30-35.DOI∶10.1016/j.foodchem.2015.03.024.
[23] IGNAT I, VOLF I, POPA V I. A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables[J].Food Chemistry, 2011, 126(4)∶ 1821-1835. DOI∶10.1016/j.foodchem.2010.12.026.
[24] 林玉芳, 谢倩, 陈清西. 橄榄多酚类化合物组分分析[J]. 热带作物学报, 2014, 35(3)∶ 460-465. DOI∶10.3969/j.issn.1000-2561.2014.03.008.
[25] NONAKA G I, NISHIOKA I, NISHIZAWA M, et al. Anti-AIDS agents, 2∶ inhibitory effect of tannins on HIV reverse transcriptase and HIV replication in H9 lymphocyte cells[J]. Journal of Natural Products, 1990, 53(3)∶ 587-595. DOI∶10.1021/np50069a008.
[26] CHENG H S, TON S H, KADIR K A. Ellagitannin geraniin∶ a review of the natural sources, biosynthesis, pharmacokinetics and biological effects[J]. Phytochemistry Reviews, 2017, 16(1)∶ 159-193.DOI∶10.1007/s11101-016-9464-2.
[27] KUO C T, LIU T H, HSU T H, et al. Antioxidant and antiglycation properties of different solvent extracts from Chinese olive (Canarium album L.) fruit[J]. Asian Pacific Journal of Tropical Medicine, 2015,8(12)∶ 1013-1021. DOI∶10.1016/j.apjtm.2015.11.013.
[28] SPIGNO G, TRAMELLI L, DE FAVERI D M. Effects of extraction time, temperature and solvent on concentration and antioxidant activity of grape marc phenolics[J]. Journal of Food Engineering, 2007, 81(1)∶200-208. DOI∶10.1016/j.jfoodeng.2006.10.021.
[29] HATAMNIA A A, ABBASPOUR N, DARVISHZADEH R.Antioxidant activity and phenolic profile of different parts of Bene(Pistacia atlantica subsp. kurdica) fruits[J]. Food Chemistry, 2014,145∶ 306-311. DOI∶10.1016/j.foodchem.2013.08.031.
[30] WANG Y, LONG L E. Physiological and biochemical changes relating to postharvest splitting of sweet cherries affected by calcium application in hydrocooling water[J]. Food Chemistry, 2015, 181∶ 241-247. DOI∶10.1016/j.foodchem.2015.02.100.
[31] YOKOZAWA T, CHEN C P, DONG E, et al. Study on the inhibitory effect of tannins and flavonoids against the 1,1-diphenyl-2-picrylhydrazyl radical[J]. Biochemical Pharmacology, 1998, 56(2)∶213-222. DOI∶10.1016/S0006-2952(98)00128-2.
[32] RYU H W, SONG H H, KIM K O, et al. Secondary metabolite profiling and modulation of antioxidants in wild and cultivated Euphorbia supina[J]. Industrial Crops and Products, 2016, 89∶ 215-224.DOI∶10.1016/j.indcrop.2016.05.011.
Determination of Polyphenols and Antioxidant Activity in Chinese Olive Fruits by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
CHANG Qiang1,2, SU Minghua1,2,*, CHEN Qingxi1,*, ZENG Biyu1,2, LI Huihua2, WANG Wei1,2
(1. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou 350002, China; 2. Fujian Key Laboratory of Physiology and Biochemistry for Subtropical Plant, Fujian Institute of Subtropical Botany, Xiamen 361006, China)
Abstract:The aims of the study were to identify and quantify the phenolic compounds present in extracts of Chinese olive fruit (Canarium album L.) and to investigate their respective antioxidant activities. A total of 12 phenolic compounds were identified in Chinese olive fruit by ultra-performance liquid chromatography (UPLC) coupled to time-of-flight mass spectrometry (TOF-MS). A quantitative method was established by UPLC coupled to triple quadrupole mass spectrometry(TQ-MS/MS) under the multiple reaction monitoring (MRM) mode. Phenolic compounds were separated within 15 min.The linearity (r > 0.98), limit of detection (LOQ) (< 1.436 ng/mL), limit of quantification (LOQ) (< 4.786 ng/mL), interand intra-day accuracy ( > 80.19%), precision ( > 1.12%) and recovery ( > 80.13%) of the method were all satisfactory and thus it could provide an efficient protocol to analyze phenolic compounds in fruit pulp extracts of Chinese olive. Quantitative analysis of different solvent extracts suggested that 3-O-galloylquinic acid and Geraniin isomers was the most abundant polyphenols in Chinese olive. Furthermore 80% acetone extract contained more polyphenols and possessed stronger antioxidant capacity.
Key words:phenolic compounds; ultra-performance liquid chromatography coupled to triple quadrupole mass spectrometry(UPLC-MS/MS); Chinese olive
DOI∶10.7506/spkx1002-6630-201724024
中图分类号:S667.5
文献标志码:A
文章编号:1002-6630(2017)24-0150-09
引文格式:
常强, 苏明华, 陈清西, 等. 基于超高效液相色谱-串联质谱的橄榄果实多酚测定及其抗氧化活性分析[J]. 食品科学,2017, 38(24): 150-158.
DOI:10.7506/spkx1002-6630-201724024. http://www.spkx.net.cn
收稿日期:2017-04-12
基金项目:厦门市科技计划资助项目(3502Z20142001);福建省科技重大专项(2013N002-4);
厦门市重大科技创新平台项目(3502Z20131004);福建省亚热带植物研究所基金项目(20150318-1)
作者简介:常强(1983—),男,助理研究员,博士研究生,研究方向为植物天然产物开发。E-mail:chyile_1@163.com
*通信作者:苏明华(1952—),男,研究员,本科,研究方向为果树生理生化。E-mail:mhsu068@163.com
陈清西(1964—),男,教授,博士,研究方向为园艺植物栽培生理。E-mail:cqx0246@fafu.edu.cn
CHANG Qiang, SU Minghua, CHEN Qingxi, et al. Determination of polyphenols and antioxidant activity in Chinese olive fruits by ultra performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2017, 38(24)∶ 150-158. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724024. http∶//www.spkx.net.cn