姚轶俊1,2,王立峰1,鞠兴荣1,2
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023;2.江南大学食品学院,江苏 无锡 214122)
摘 要:建立纤维素载体固定化β-葡萄糖苷酶系统,用于黑豆浆中大豆异黄酮去糖基化反应,并对该催化系统进行了可行性评价。结果表明,在40 cm3纤维素颗粒上可结合超过40 mg β-葡萄糖苷酶,并且能有效将4-硝基苯-β-D-葡糖苷酸水解成对硝基苯酚,其反应最适温度为50 ℃。经动力学测试后可得其米氏常数Km值为(1.38±0.20)mmol/L。将该固定化酶系统用于黑豆浆中大豆异黄酮去糖基化,通过高效液相色谱检测其转化效率,表明该系统可以在30 min内利用40 cm3含酶载体将50 mL黑豆浆中的异黄酮全部转化为去糖基化形式。该固定化酶催化系统连续化催化稳定性实验表明,在经过15 次反应以及15 d之后,该固定化酶系统仍然可维持其60%的催化活性。
关键词:β-葡萄糖苷酶;固定化;纤维素颗粒;黑豆浆;异黄酮去糖基化
大豆异黄酮是存在于大豆中的天然非固醇类物质,在干燥大豆中的含量约为1~5 mg/g[1]。由于其被摄入体内后能与雌激素受体结合,调节人体内的激素表现,因此又被称为植物雌激素。经研究发现,摄入足量的大豆异黄酮可以有效降低罹患骨质疏松症及妇女更年期综合症的风险[2],在抗癌防癌[3]、预防心血管疾病[4]等方面也有重要的作用。另有文献指出,在人体内带有糖基形式的异黄酮不能直接被吸收,而是经肠道微生物产生的β-葡萄糖苷酶水解去糖基后进入血液,才能发挥各种生理作用[5-6]。但是人体肠道中的菌群由于个体因素会有较大差异,所以如果直接摄入不带糖基的苷元型异黄酮,则可以有效提高其利用效率[7]。
目前糖基水解方式主要有酸水解和酶水解2 种。由于酸水解存在不安全因素,在一定程度上也会破坏异黄酮的结构,而酶作用条件温和,所以后者越来越受到关注[8]。微生物生产的β-葡萄糖苷酶是目前主要应用于大豆异黄酮去糖基的酶。然而由于酶相对成本较高,反应过程中易失活,而且不能被回收利用,因此应用上存在局限性。所以,如果将酶固定到化学性质稳定的不溶性载体上,则可以有效解决上述问题[9]。
本实验探究了一种用纤维素颗粒作为载体固定β-葡萄糖苷酶的方法,用于黑豆浆中大豆异黄酮去糖基作用,以期建立可用于稳定、高效生产具有高生理活性黑豆浆的反应系统。其固定方法包括纤维素载体的合成与修饰,纤维素载体与酶的共价结合;利用固定化酶技术在黑豆浆的加工过程中实现酶的重复利用以及方便产物的分离,在生产应用中具有较高的经济效应;同时,由于纤维素是大多数农业废弃物的主要成分,因此该研究也为今后开发直接以农业废弃物为载体的固定化酶系统提供了理论支持。
1.1 材料与试剂
本研究所使用市售黑豆购自南京雨花路农产品市场,并贮存在干燥环境下;纤维素载体为本实验室合成,将醋酸纤维素粉末溶于丙酮和二甲基亚砜(dimethylsulfoxide,DMSO)以体积比3∶2所组成的有机溶剂中,并逐滴滴入冷水中形成纤维素小球[10]。
β-葡萄糖苷酶、4-硝基苯-β-D-葡糖苷酸(p-nitrophenyl-β-D-glucuronide,p-NPG)、乙腈(色谱级)、大豆苷元、大豆苷、染料木素、染料木苷标准品美国Sigma-Aldrich公司。
1.2 仪器与设备
高效液相色谱(high performance liquid chromatography,HPLC)仪 日本Jasco公司;Free Dry System/Freezone®4.5冷冻干燥机 美国Labconco公司;Model JSM-6300扫描式电子显微镜 日本JEOL公司;酶联免疫测试仪 美国Molecular Devices公司;CP213型电子天平 美国Ohaus公司;KW-1000DC型数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 纤维素载体的合成与修饰
取6.25 g市售纤维素粉末溶于50 mL丙酮与DMSO组成的有机溶剂中,将所得溶液用针筒逐滴滴入冷水中,形成纤维素颗粒并将其置于室温下干燥待用。量取体积大约为40 cm3所述纤维素颗粒置于100 mL浓度为0.2 mol/L的NaOH溶液中,40 ℃保温90 min,以增加其表面的羟基数目[11-12]。
1.3.2 纤维素载体与酶的共价结合
将经上述步骤加热处理过的40 cm3纤维素载体置于50 mL 100 ℃体积分数为3%的戊二醛溶液中1 h后,在室温下用蒸馏水冲洗。将β-葡萄糖苷酶溶于浓度为0.1 mol/L、pH 6的磷酸缓冲液中形成质量浓度为1 mg/mL的酶溶液50 mL,并与经上述步骤处理过的纤维素载体在4 ℃条件下混合静置16 h。最后,用纱布将酶溶液滤去并保留滤液待测,用0.1 mol/L、pH 6的磷酸缓冲液冲洗纤维素载体,得到所述固定化酶,4 ℃贮存。
1.3.3 固定化酶含量测定
将1 mg/mL的β-葡萄糖苷酶溶液稀释,分别加入10 μL与200 μL 10%的染色剂考马斯亮蓝,30 min后测定其在595 nm波长处的吸光度,绘制标准曲线。在制备固定化酶所得的滤液中加入10 μL 10%的染色剂考马斯亮蓝,30 min后测定其在595 nm波长处的吸光度,根据标准曲线方程得出滤液中残留的蛋白含量,从而得到固定于载体上的酶含量[13]。
1.3.4 载体表面共价键及形态学描述
用于化学分析的电子能谱(electron spectroscopy for chemical analysis,ESCA)属于表面分析法,可侦测固体样品表面所含的元素种类、化学组成以及有关的电子结构等重要信息,在各种固体材料的基础研究中具有重要应用价值[14]。在本实验中,ESCA被用于检测并验证酶蛋白分子以共价键成功固定化于纤维素载体上。
利用扫描式电子显微镜能够快速、有效地获得固体样品表面的微小区域形貌和成分信息。其应用于固定化酶的分析检测中可以用以观察晶体形态,酶表面结构,以及载体上活性成分的分散状态以便鉴定酶的固定化情况[15]。在本实验中,将固定化前后的载体样品冷冻干燥并在真空条件下镀金60 s两次后用扫描式电子显微镜在10 kV的电子强度下观察其表面结构的变化。
1.3.5 固定化酶最适作用温度及酶促反应动力学性质测定
在pH值为6的磷酸缓冲液中加入5 mg p-NPG,依次以所述固定化酶在30、40、50、60 ℃和70 ℃,100 r/min反应1 h。取反应后的底物900 μL加入到1 mL浓度为1 mol/L Na2CO3溶液中,在425 nm波长处测定其OD值。
配制浓度为0.1~20 mmol/L的p-NPG溶液作为底物,分别用固定化酶在其最适反应温度下作用5 min后,取900 μL加入到1 mL浓度为1 mol/L的Na2CO3溶液中,在425 nm波长下测定其OD值并根据标准曲线算出产物浓度,酶促反应动力学常数Km值计算见公式(1):
式中:Km为米氏常数/(mmol/L);v为反应初速率/(mmol/(L·min));vmax为最大反应速率/(mmol/(L·min));[S]为底物浓度/(mmol/L)。
1.3.6 HPLC分析
1.3.6.1 样品制备
将100 g黑豆浸泡于1 L 4 ℃水中过夜。将浸泡过的黑豆及水一起磨成豆浆,并用双层豆浆布过滤,滤去豆渣。将磨好的豆浆在杀菌釜中121 ℃灭菌20 min后于4 ℃贮存备用。
将50 mL黑豆浆与50 cm3纤维素固定化酶混合,50 ℃反应2 h。取反应后的黑豆浆0.5 mL,与0.5 mL溶有0.2%苯甲酸(内标)的甲醇溶液混合,离心3 min取上清液0.5 mL,与体积分数50%的甲醇溶液混合,用0.45 nm滤膜过滤后离心3 min,用于HPLC分析其中异黄酮组成及含量。
1.3.6.2 色谱条件
HPLC是在气相层级色谱和传统液相色谱的基础上发展起来的分析分离技术,是利用物质在固定相和流动相之间具有不同的平衡分配系数来进行分离的方法。当两相做相对运动时,被测样品在两相之间进行反复多次的物质交换,这样使原来微小的性质差异产生了很大的效果,进而达到分析、分离及测定一些物理化学常数的目的[16]。
依据Wang Huiju等[17]的方法加以修饰。使用YMCPack ODS-AMC C18色谱柱(250 mm×4.6 mm,5 μm),在室温下以梯度流洗的方式进行分析,梯度条件如下:A为体积分数0.1%冰醋酸溶液,pH 3.4,B为含体积分数0.1%冰醋酸-乙腈。进样量20 μL,洗脱程序:0~20 min,15%~30% B;20~30 min,30%~45% B;30~35 min,45%~60% B;35~45 min,60%~70% B。平衡时间10 min,流速1.0 mL/min,检测波长254 nm。
1.4 数据计算
大豆异黄酮含量、去糖基化效率、总异黄酮中苷元比例的计算见公式(2)~(4):
式中:As为异黄酮组分所对应HPLC图谱的积分面积;AIS为苯甲酸的HPLC图谱积分面积;CIS为内标浓度/(mmol/L);RRF为相对反应因子(大豆苷4.23,染料木苷7.50,大豆苷元9.91,染料木素9.09);mw为大豆异黄酮相对分子质量。

2.1 固定化酶含量
据文献[18-20],在固体颗粒表面固定化β-葡萄糖苷酶时,载体体积为40 cm3其固定化效果最佳。因此在本实验中纤维素载体量采用40 cm3。在pH 6、4 ℃条件下,每40 cm3的固体载体上可固定(40.27±1.42)mg酶,其蛋白结合率可达到(80.53±2.85)%。
2.2 β-葡萄糖苷酶与纤维素载体的电子能图谱
ESCA技术又称为X射线光电子能谱,当X射线与样品相互作用后,激发出某个能量上的电子,测量这一电子的动能,可以得到样品中有关的电子结构信息[21]。在本实验中,利用该方法可以验证固定化β-葡萄糖苷酶前后,纤维素载体表面的键结变化情况。由图1可知,纤维素经NaOH修饰处理后表面羟基数目增加,并与戊二醛发生缩醛反应。


图1 以碳、氮元素为基准的纤维素载体固定化酶前后表面键结ESCA结果
Fig. 1 C1s and N1s ESCA spectra of free and immobilized β-glucosidase
图1 A2与图1A1相比,可以发现285.8 eV处新增加了表示—C=N—键结的尖峰,在287.35 eV处的峰值降低;图1B2与图1B1相比可发现在399.8 eV处新增了表示—C=N—官能基的尖峰。综上可得,酶蛋白分子的游离氨基端通过戊二醛的作用连接到了纤维素载体表面的游离羟基上,并与纤维素分子形成交联结构。
2.3 固定β-葡萄糖苷酶前后纤维素载体的表面微观结构

图2 纤维素载体固定化酶前后表面微观结构
Fig. 2 Microstructure of cellulose particles without and with β-glucosidase immobilization
由图2A可知,该纤维素载体直径约为1.5 mm,在高倍率检测下其表面均匀光滑。由图2B可知,在相同条件下测得固定化β-葡萄糖苷酶后的纤维素载体,可以发现其表面布满了蛋白颗粒,将其放大至3 000 倍,可清晰观察到其蛋白质分子的颗粒。
2.4 不同温度下固定化酶与游离酶的相对活性对比
不同温度会影响酶的活性,且与其固定化的材料、方法密切相关。固定化酶与其游离酶相比,在不同温度下的相对酶活性会发生改变[22]。可能的原因是载体改变了反应过程中的传质速率,以及在高温下载体上会有用于修饰的化学物质释出,影响酶活性。用p-NPG作为反应底物,通过测定相同反应时间后的产物对硝基苯酚的量以表示该条件下的相对酶活性。首先将不同浓度(1 mmol/L对硝基苯酚稀释5 次)的对硝基苯酚置于适量1 mol/L NaCO3溶液中,测定425 nm波长处的吸光度,并据此绘制标准曲线,其R2为0.997 5,标准曲线方程为y=2.911 5x+0.083 2。由于1 mol p-NPG被水解后产生1 mol对硝基苯酚,因此溶液中p-NPG被完全催化产生0.33 mol对硝基苯酚,根据标准曲线得到对应吸光度为1.04。将反应测得吸光度与该值相比可得到相对酶活性。

图3 不同温度条件下固定化酶与游离酶的相对活性
Fig. 3 Relative activity of free and immobilized β-glucosidase at different temperatures
由图3可知,纤维素固定化酶的最适作用温度是50 ℃,与游离酶相比降低了10 ℃,并且在最适温度处的酶活性显著大于游离酶活性,从而有利于降低反应成本。
2.5 固定化酶系统动力学分析
利用不同浓度的底物在相同反应时间内生成产物的量,对纤维素固定化酶系统进行酶动力学测试。当系统的最大反应速率越大,酶动力学参数Km值越小,表明此系统催化反应时最大反应速率越大,同时达到最大反应速率所需底物浓度越小,该系统越有优势[23]。根据酶动力学方程(R2=0.98)可得纤维素固定化酶的最大反应速率为(0.073 3±0.003 4)mmol/(L·min),表示当其反应速率达到(0.073 3±0.003 4)mmol/(L·min)时,增加底物浓度其反应速率不会增加。酶动力学参数Km值为(1.382 6±0.204 3)mmol/L,表示该系统达到最大反应速率一半时所需要的底物浓度为(1.382 6±0.204 3)mmol/L。
2.6 纤维素固定化酶系统对黑豆浆中大豆异黄酮的水解效率
纤维素固定化酶系统在与黑豆浆反应0~45 min时豆浆中4 种异黄酮的含量以及去糖基化效率见表1。该系统完全水解转化50 mL黑豆浆中的大豆苷和染料木苷分别需要20 min和30 min。此结果与文献中利用咖啡渣[18]以及纳米玻璃粉末[19]作为载体的固定化酶系统相比大致相同。反应结束后豆浆中苷元形式的异黄酮占原来豆浆中总异黄酮含量的70.6%,相同时间内染料木苷的转化率高于大豆苷。
表1 纤维素固定化酶系统催化反应不同时间后黑豆浆中异黄酮含量以及转化率
Table 1 Isoflavone contents of black soymilk treated for different time by immobilized β-glucosidase
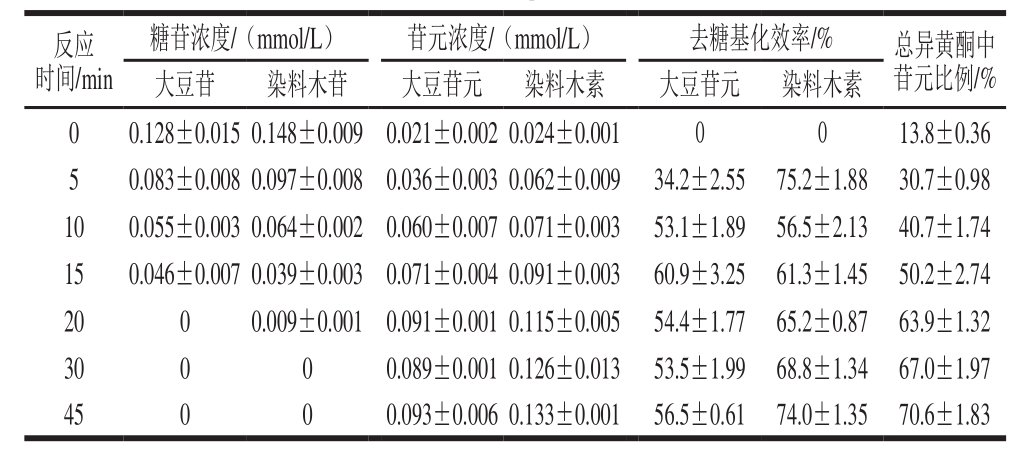
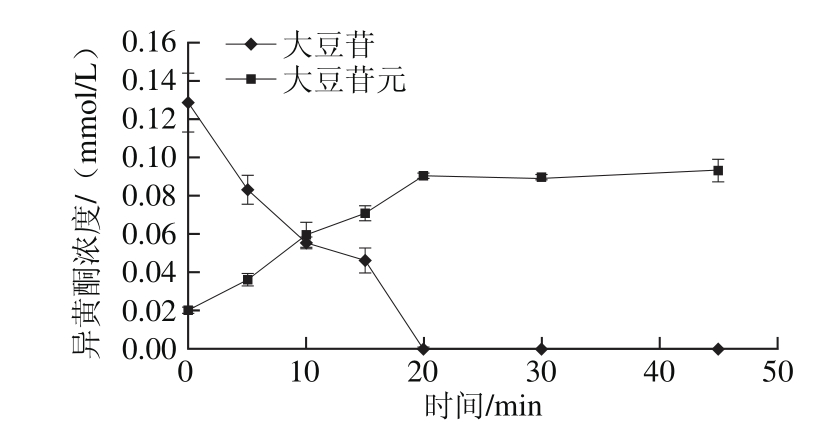
图4 固定化酶系统催化条件下黑豆浆中大豆苷与大豆苷元的转化
Fig. 4 Conversion of daidzin to daidzein in black soymilk by the immobilized enzyme
图5 固定化酶系统催化条件下黑豆浆中染料木苷与染料木素的转化
Fig. 5 Conversion of genistin to genistein in black soymilk by the immobilized enzyme
由图4和图5可得,大豆苷及染料木苷水解中所有糖苷型异黄酮完全转化为所对应苷元所需时间分别为20 min和30 mim。50%糖苷型异黄酮转化为所对应苷元所需时间分别为8 min和9 min。与使用霉菌发酵最少需要4~8 h相比[24-25],该固定化酶系统具有明显的优势,能够在短时间内将黑豆浆中的异黄酮转化为具有高价值的苷元形式。
2.7 纤维素固定化酶系统的稳定性
使用该固定化酶系统进行连续转化生产富含去糖基化形式大豆异黄酮的黑豆浆,系统的稳定性显得尤为重要。因此,本实验通过连续催化20 个重复周期以及催化30 d以测试其反应稳定性。
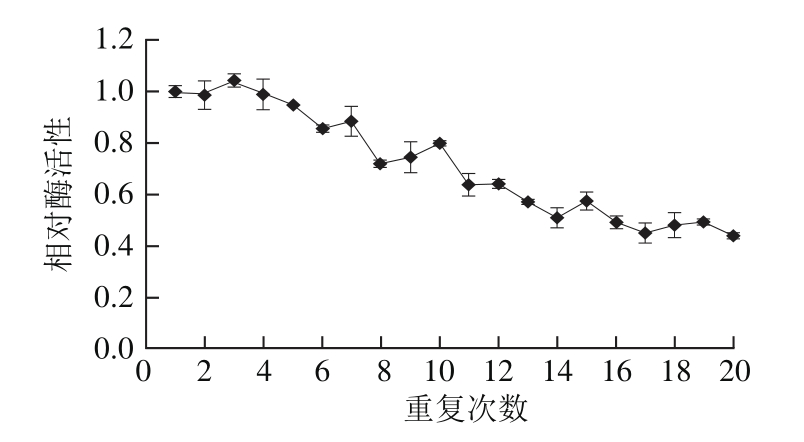
图6 纤维素固定化酶系统水解黑豆浆中异黄酮重复使用稳定性
Fig. 6 Reusable stability of immobilized β-glucosidase for isoflavone deglycosylation in black soymilk
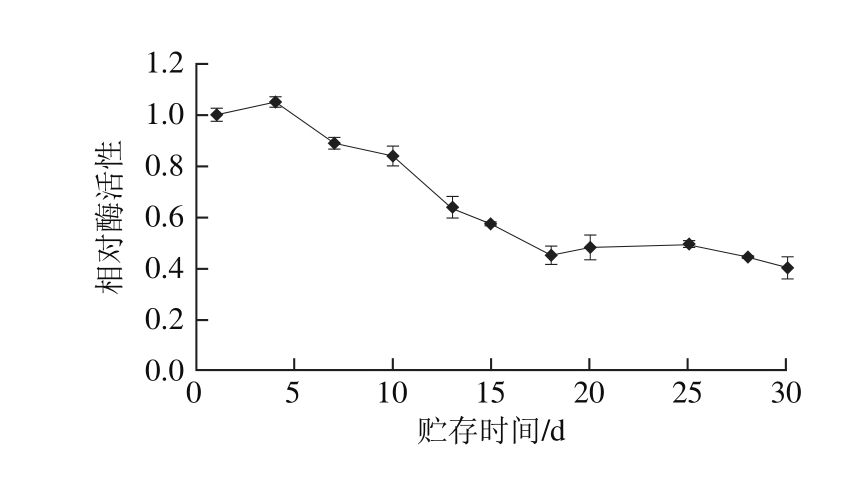
图7 纤维素固定化酶系统水解黑豆浆中异黄酮贮存稳定性
Fig. 7 Storage stability of immobilized β-glucosidase for isoflavone deglycosylation in black soymilk
图6 为连续20 次反应中异黄酮糖苷的转化率。在实验过程中,在40 cm3固定化酶系统中加入50 mL新鲜黑豆浆,在50 ℃条件下催化30 min后以其中苷元态的异黄酮占总异黄酮比例作为指标。之后移除黑豆浆用蒸馏水冲洗系统后重新加入新鲜黑豆浆再次反应,如此重复10 次。由图6可知,10 次催化反应后其转化率可保持初始效率的70%以上。连续15 次反应后系统催化活性为初始值的50%~60%。因此该系统可被认为具有较高的重复利用稳定性。由图7可知,实验中测试了30 d中该系统对异黄酮糖苷转化率的变化,将新制得的固定化酶系统从第1天起每隔2~5 d进行催化,其余时间贮存于4 ℃条件下。15 d之后该系统仍可维持初始转化率的60%,因此在工业生产中可以维持约两周的生产,符合生产的经济效益。
比较以上两部分实验结果可得,在进行连续催化过程中重复使用对固定化酶系统活性的影响比较大,在贮存5 d之内再次测试该系统酶活性无显著差异。因此,如果将其应用在工业化生产过程中5 d之内只需考虑其因重复使用而降低的活性,因此该系统适合进行密集式的生产。之前微生物系统经常用于对豆浆中异黄酮进行水解去糖基化,利用霉菌所产生的酶对其进行不同条件的发酵,以达到目的。但是该方法设备昂贵(如发酵槽)、操作复杂以及需要花费大量成本用来防治杂菌污染[26]。此外,与固定化酶系统相比,微生物系统最大的劣势是所需时间较长,由于霉菌自身生长以及将酶分泌到胞外均需要一定时间,所以在微生物系统时首先需要对菌种进行活化,在催化异黄酮糖苷转化过程中也需要比较长的时间[27-28]。经实验证明,如利用根霉菌进行转化,首先需要8 d进行菌的活化及菌丝生长;该系统至少需要8 h可将黑豆浆中的异黄酮完全转化为苷元形式[29-30]。
将β-葡萄糖苷酶固定化到纤维素载体上可建立高效、经济与稳定的催化反应系统应用于黑豆浆中大豆异黄酮去糖基作用,以得到具有高生理活性的黑豆浆。该系统最适作用温度为50 ℃,并可在30 min内用40 cm3固定化之后的载体将50 mL黑豆浆中的异黄酮全部水解成苷元形式。该系统具有较高反应稳定性。在重复使用15 次以及催化15 d之后仍可维持60%的初始酶活性。
在未来的工作中,需要进一步研究突破的有两点。其一是寻找更为廉价易得酶固定化载体以降低成本。在这方面,农业废弃物拥有重要地位。由于农业废弃物绝大多数含有大量纤维素成分,因此被开发作为酶固定化载体被认为是可行的。目前已经利用咖啡渣作为载体的研究,将来可进一步延伸扩展至茶叶渣、秸秆等多种材料。其二,目前在成本方面最大的限制是酶本身,商业化的酶由于其来源及制备提纯工艺往往成本较高,所以在未来如能利用基因工程等分子生物学技术进行菌种改良,将表达该酶的基因转入如大肠杆菌等细菌中,实现酶的大量表达,可以从根本上降低生产的成本。
参考文献:
[1] MURPHY P A, SONG T, BUSEMAN G, et al. Isoflavones in retail and institutional soy foods[J]. Journal of Agricultural & Food Chemistry, 1999, 47(7)∶ 2697-2704. DOI∶10.1021/jf981144o.
[2] ATKINSON C, COMPSTON J E, DAY N E, et al. The effects of phytoestrogen isoflavones on bone density in women∶ a double-blind,randomized, placebo-controlled trial[J]. American Journal of Clinical Nutrition, 2004, 79(2)∶ 326-333. DOI∶10.1051/rnd∶2004021.
[3] MAGEE P J, ROWLAND I R. Phyto-oestrogens, their mechanism of action∶ current evidence for a role in breast and prostate cancer[J].British Journal of Nutrition, 2004, 91(4)∶ 513-531. DOI∶10.1079/BJN20031075.
[4] LICHTENSTEIN A H. Soy protein, isoflavones and cardiovascular disease risk[J]. Journal of Nutrition, 1998, 128(10)∶ 1589-1592.DOI∶10.1046/j.1365-277X.1998.00124.x.
[5] IZUMI T, PISKULA M K, OSAWA S, et al. Soy isoflavone aglycones are absorbed faster and in higher amounts than their glucosides in humans[J]. Journal of Nutrition, 2000, 130(7)∶ 1695-1699.DOI∶10.1038/sj.ijo.0801256.
[6] RIE T, REILO O, CHIKAKO K, et al. Antioxidant activities of black and yellow soybeans against low density lipoprotein oxidation[J].Journal of Agricultural & Food Chemistry, 2005, 53(11)∶ 4578-4582.DOI∶10.1021/jf048062m.
[7] TSANGALIS D, STOJANOVSKA A L, WILCOX G, et al.Development of an isoflavone aglycone-enriched soymilk using soy germ, soy protein isolate and bifidobacteria[J]. Food Research International, 2004, 37(4)∶ 301-312. DOI∶10.1016/j.foodres.2004.01.003.
[8] LEI Z, JIANG Q. Synthesis and properties of immobilized pectinase onto the macroporous polyacrylamide microspheres[J]. Journal of Agricultural & Food Chemistry, 2011, 59(6)∶ 2592. DOI∶10.1021/jf103719t.
[9] DERVAKOS G A, WEBB C. On the merits of viable-cell immobilisation[J]. Biotechnology Advances, 1991, 9(4)∶ 559-612.DOI∶10.1016/0734-9750(91)90733-C.
[10] CHEN L F, TSAO G T. Physical characteristics of porous cellulose beads as supporting material for immobilized enzymes[J].Biotechnology & Bioengineering, 1976, 18(11)∶ 1507-1516.DOI∶10.1002/bit.260181103.
[11] ALBAYRAK N, YANG S T. Immobilization of Aspergillus oryzae, β-galactosidase on tosylated cotton cloth[J]. Enzyme &Microbial Technology, 2002, 31(4)∶ 371-383. DOI∶10.1016/S0141-0229(02)00115-1.
[12] CHEN L F, TSAO G T. Chemical procedures for enzyme immobilization on porous cellulose beads[J]. Biotechnology &Bioengineering, 1977, 19(10)∶ 1463-1473. DOI∶10.1002/bit.260191005.
[13] RASOOLY A, HEROLD K E, RASOOLY, et al. Biosensors and biodetection∶ methods and protocols[M]. Clifton∶ Humana Press, 2009∶31-35.
[14] FELGUAIRAS M L, CHICAU G, MOUTINHO-PEREIRA J M, et al. Effects of Esca disease on leaf gas exchanges of cv. Alvarinho in a vineyard of the Portuguese Vinho Verde Region[C]//International Workshop on Grapevine Trunk Diseases∶ Esca and Grapevine Declines, 2006∶ 17-21.
[15] LIU F Y, LI J F, GUAN X, et al. SEM study on filum terminale with tethered cord syndrome[J]. Child’s Nervous System, 2011, 27(12)∶2141-2144. DOI∶10.1007/s00381-011-1414-0.
[16] GARNDER C D, OELRICH B, LIU J P, et al. Prostatic soy isoflavone concentrations exceed serum levels after dietary supplementation[J].Prostate, 2009, 69(7)∶ 719-726. DOI∶10.1002/pros.20922.
[17] WANG H J, MURPHY P A. Isoflavone composition of American and Japanese soybeans in Iowa∶ effects of variety, crop year, and location[J]. Journal of Agricultural and Food Chemistry, 1994, 42(8)∶1674-1677. DOI∶10.1021/jf00044a017.
[18] CHEN K I, LO Y C, LIU C W, et al. Enrichment of two isoflavone aglycones in black soymilk by using spent coffee grounds as an immobiliser for β-glucosidase[J]. Food Chemistry, 2013, 139(1/2/3/4)∶79-85. DOI∶10.1016/j.foodchem.2013.01.093.
[19] CHEN K I, LO Y C, SU N W, et al. Enrichment of two isoflavone aglycones in black soymilk by immobilized β-glucosidase on solid carriers[J]. Journal of Agricultural & Food Chemistry, 2012, 60(51)∶12540-12546. DOI∶10.1021/jf304405t.
[20] YANG P H, WEI W, CAI H H, et al. Immobilization of antitransferrin on nano-gold and its immune recognition of transferrin[J].Spectroscopy & Spectral Analysis, 2009, 29(5)∶ 1398-1401.DOI∶10.3964/j.issn.1000-0593(2009)05-1398-04.
[21] 刘芬, 赵志娟, 邱丽美, 等. XPS光电子峰和俄歇电子峰峰位表[J]. 分析测试技术与仪器, 2009(1)∶ 1-17. DOI∶10.3969/j.issn.1006-3757.2009.01.001.
[22] 曹诗林, 徐培, 马永正, 等. 纳米载体固定化酶的最新研究进展[J]. 催化学报, 2016(11)∶ 1814-1823. DOI∶10.1016/S1872-2067(16)62528-7.
[23] GOIDSTEIN L. Kinetic behavior of immobilized enzyme systems[J].Methods in Enzymology, 1976, 44(1)∶ 397. DOI∶10.1016/S0076-6879(76)44031-4.
[24] CHENG K C, LIN J T, WU J Y, et al. Isoflavone conversion of black soybean by immobilized Rhizopus spp.[J]. Food Biotechnology, 2010,24(4)∶ 312-331. DOI∶10.1080/08905436.2010.524459.
[25] CHENG K C, WU J Y, LIN J T, et al. Enhancements of isoflavone aglycones, total phenolic content, and antioxidant activity of black soybean by solid-state fermentation with Rhizopus spp.[J].European Food Research and Technology, 2013, 236(6)∶ 1107-1113.DOI∶10.1007/s00217-013-1936-7.
[26] 发酵技术. 食品工业中发酵技术的前景[J]. 食品与发酵工业,1977(2)∶ 92-99.
[27] 张雯煜, 王雪奇. 异黄酮的微生物发酵和酶转化生产[J]. 轻工科技,2007, 23(8)∶ 13-14. DOI∶10.3969/j.issn.1003-2673.
[28] CHIEN H L, HUANG H Y, CHOU C C. Transformation of isoflavone phytoestrogens during the fermentation of soymilk with lactic acid bacteria and bifidobacteria[J]. Food Microbiology, 2006, 23(8)∶ 772-778. DOI∶10.1016/j.fm.2006.01.002.
[29] 李爽, 郑毅男, 韩佳彤, 等. 发酵处理对毛豆异黄酮苷元含量及其乙醇提取物抗氧化活性的影响[J]. 西北农林科技大学学报(自然科学版), 2016(7)∶ 202-208; 214. DOI∶10.13207/j.cnki.jnwafu.2016.07.028.
[30] LEE M, HONG G E, ZHANG H, et al. Production of the isoflavone aglycone and antioxidant activities in black soymilk using fermentation with Streptococcus thermophilus, S10[J]. Food Science and Biotechnology, 2015, 24(2)∶ 537-544. DOI∶10.1007/s10068-015-0070-7.
Immobilization of β-Glucosidase onto Cellulose Particles for Application in Hydrolysis of Soybean Isoflavones
YAO Yijun1,2, WANG Lifeng1, JU Xingrong1,2
(1. Collaborative Innovation Center for Modern Grain Circulation and Safety, College of Food Science and Engineering,Nanjing University of Finance and Economics, Nanjing 210023, China;2. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Abstract:This study was conducted to evaluate the feasibility of conversion of isoflavones in soymilk using celluloseimmobilized β-glucosidase. β-glucosidase was immobilized onto cellulose particles with a loading capacity of over 40 mg of enzyme/40 cm3carrier. The immobilized enzyme exhibited a significant efficiency for the conversion of 4-nitrophenylβ-D-glucuronide (p-NPG) to p-nitrophenol. The optimal temperature for the enzyme was 50 ℃ and the Michaelis constant(Km) value was determined to be (1.38 ± 0.20) mmol/L. All isoflavones in black soymilk were completely converted to deglycosylated derivatives within 30 min using 40 cm3of the immobilized enzyme as analyzed by high-performance liquid chromatography (HPLC). Experimental evaluation of the stability showed that immobilized β-glucosidase retained 60% of its original activity after 15 times repeated use and after 15 days of storage.
Key words:β-glucosidase; immobilization; cellulose particles; black soymilk; isoflavone deglycosylation
DOI∶10.7506/spkx1002-6630-201724028
中图分类号:Q814.2
文献标志码:A
文章编号:1002-6630(2017)24-0177-06
引文格式:
姚轶俊, 王立峰, 鞠兴荣. 纤维素载体固定化β-葡萄糖苷酶及其在大豆异黄酮水解中的应用[J]. 食品科学, 2017, 38(24)∶177-182. DOI∶10.7506/spkx1002-6630-201724028. http∶//www.spkx.net.cn
YAO Yijun, WANG Lifeng, JU Xingrong. Immobilization of β-glucosidase onto cellulose particles for application in hydrolysis of soybean isoflavones[J]. Food Science, 2017, 38(24)∶ 177-182. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724028. http∶//www.spkx.net.cn
收稿日期:2017-01-22
基金项目:江苏省高校自然科学研究面上项目(15KJB550006);“十三五”国家重点研发计划重点专项(2016YFD0400201-1);
江苏省产学研前瞻性联合研究项目(BY2016009-01);江苏高校优势学科建设工程资助项目(PAPD)
作者简介:姚轶俊(1989—),女,助理研究员,博士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:yyj@njue.edu.cn