
图1 免疫荧光猝灭试纸条检测SQX的原理
Fig. 1 Schematic principle of FQICS based on fluorescence quenching for the detection of SQX
胡高爽,张 燕,生 威,李 志,王俊平,王 硕*
(天津科技大学食品工程与生物技术学院,教育部食品营养与安全重点实验室,天津 300457)
摘 要:目的:根据荧光共振能量转移(fluorescence resonance energy transfer,FRET)的原理,构建一种基于上转换荧光纳米材料的新型免疫标记荧光猝灭试纸条检测牛奶中的兽药磺胺喹恶啉(sulfaquinoxaline,SQX)残留。方法:通过热分解方法合成上转换纳米荧光材料,通过柠檬酸三钠还原法制备胶体金纳米颗粒。将合成的上转换荧光颗粒固定在试纸条C线上,并将上转换荧光颗粒与SQX包被抗原的混合物固定在T线上,将胶体金标记的SQX单克隆抗体喷涂在金标垫上。滴加样品后,随着样品液的流动,金标抗体会移动到T线处并与SQX包被抗原结合,这种结合会导致抗体上的纳米金颗粒(受体)与T线上的上转换颗粒靠近(供体),从而发生FRET,产生荧光猝灭。在980 nm激发器激发波长下通过目测检测荧光强弱变化,从而实现对SQX的检测。结果:该免疫荧光猝灭试纸条检测SQX的方法检测限为1 µg/L,牛奶样品的检测限为8 μg/L。整个检测过程不超过15 min。结论:该方法操作简便、灵敏度高、检测时间短、结果易于判断,可以满足牛奶中SQX残留的现场快速检测的要求。
关键词:磺胺喹恶啉;上转换材料;免疫荧光猝灭试纸条;牛奶
磺胺类药物具有广谱抗革兰氏阴性菌和阳性菌的活性、价格便宜、使用方便等特点,广泛应用在兽医临床及动物饲料添加剂等研究领域中[1-2]。由于其在兽医临床应用时可能产生耐药性,而且会造成动物源性食品中出现兽药残留,进而对人体产生慢性的毒副作用,引起各种器官的病变,因此我国对肉类以及动物其他可食部分中磺胺类药物残留制定了最高限量[3-4]。目前用于检测磺胺喹恶啉(sulfaquinoxaline,SQX)的方法主要包括毛细管电泳法[5-6]、气相色谱-串联质谱法[7-8]、高效液相色谱法[9-10]、液相色谱-串联质谱法[11-13]等。上述方法虽灵敏度高,但因仪器昂贵,前处理步骤繁琐,耗费时间长等问题,并不适合进行大量样品筛查以及现场快速检测。基于抗原抗体特异性反应的免疫分析检测技术因其具有灵敏、精确、快速、成本低廉等特点,在兽药残留的快速检测中得到了广泛的应用[14-17]。
荧光纳米材料是一种新型材料,近年来得到了国内外科研人员的广泛关注,并作为一种免疫标记材料在免疫检测中得以应用[18-19]。荧光共振能量转移(fluorescence resonance energy transfer,FRET)是一种对于相互靠近的供体与受体通过偶极子-偶极子相互作用而产生的非辐射性的过程,荧光猝灭是荧光能量共振转移的现象之一[20-22]。本实验根据荧光共振能量转移的原理,构建了一种新型的基于上转换纳米材料(upconversion nanoparticles,UCNPs)和胶体金的免疫荧光猝灭试纸条检测牛奶中SQX。UCNPs固定在试纸条C线上。同时,上转换颗粒与SQX包被抗原(SQX半抗原与卵白蛋白(ovalbumin,OVA)复合物,SQX-OVA)固定在试纸条T线上,胶体金标记的SQX抗体喷涂在金标结合垫上。当滴加阴性样品后,样品液带动金标抗体到T线处与SQX-OVA结合,这种结合导致抗体上的金颗粒(受体)与T线上的上转换荧光颗粒靠近(供体),从而发生FRET,产生荧光猝灭,实验原理如图1所示。当滴加阳性样品后,游离SQX与金标抗体结合,从而使得T线处的金标抗体与SQX-OVA的结合量减少,从而导致T线上的荧光猝灭现象减少,会部分荧光保持,加入足量的阳性样品后,T线完全不产生荧光猝灭,会全部荧光保持。这样目标物SQX与T线的荧光强度会产生一个正比的关系。

图1 免疫荧光猝灭试纸条检测SQX的原理
Fig. 1 Schematic principle of FQICS based on fluorescence quenching for the detection of SQX
1.1 材料与试剂
玻璃纤维、聚酯纤维 上海金标公司;硝酸纤维素膜 美国Millipore公司;SQX标准品 中国兽医药品检查所;SQX单克隆抗体和SQX半抗原H3由实验室自制;柠檬酸三钠、氯金酸、醋酸镱、醋酸铒、聚丙烯酸(poly(acrylic acid),PAA)、羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、碳化二亚胺(1-ethyl-3-[3-(dimethylamino) propyl] carbodiimide,EDC)、OVA 美国Sigma公司;醋酸钇 美国Aladdin公司;二甘醇(diethylene glycol,DEG)、氢氧化钠(均为分析纯) 天津市化学试剂一厂;乙腈(分析纯) 德国Merck公司;油酸(oleic acid,OA)(分析纯) 美国Alfa公司。
1.2 仪器与设备
JEM-2010 FEF透射电镜 日本JEOL公司;UV-2300紫外分光光度计 日本Shimadzu公司;F-4500荧光光谱仪 日本Hitachi公司;可连续调节波长980nm激发器中国北京海特光电公司。
1.3 方法
1.3.1 SQX单克隆抗体及包被抗原的制备
SQX包被原(SQX-OVA)的制备采用活化酯的方法[23]。0.025 mmol的半抗原H3加入到无水N,N-二甲基甲酰胺中,充分搅拌使其全部溶解。向上述溶液中加入9.3 mg的EDC,充分混合。将此混合溶液缓慢滴加到含有10 mg载体蛋白OVA的碳酸氢钠溶液(130 mmol/L,pH 8.1)中,室温下搅拌反应4~6 h。最后再加入4.7 mg EDC到混合液中,4 ℃搅拌过夜。第2天取出,室温下放置2~3 h。在4 ℃条件下,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)(10 mmol/L,pH 7.4)中透析3 d后,分装,-20 ℃保存。
SQX单克隆抗体由本实验室制备并采用辛酸-硫酸铵法[24]纯化得到。
1.3.2 上转换纳米材料的制备
采用热分解方法制备油溶性上转换纳米材料[25-26]。醋酸钇、醋酸镱、醋酸铒按照78∶20∶2的物质的量比例,与6 mL油酸和17 mL十八烯混合,搅拌均匀后,先将混合液加热至100 ℃,抽真空反应10 min,之后将反应体系加热至160 ℃。随后,将体系自然冷却至室温。向反应体系中加入含有氢氧化钠(2.5 mmol)与氟化铵(4 mmol)的10 mL甲醇溶液,在室温下充分搅拌30 min。再将混合液在惰性气体保护下加热到300 ℃,反应1 h,冷却至室温。最后用乙醇清洗3 次,即可得到绿色发光油溶性上转换纳米材料(OA-UCNPs)。
采用配体交换方法是制备水分散性上转换纳米材料。准确称取0.5 g PAA溶解在DEG中,在氩气保护下加热至110 ℃,保持反应1 h。之后注入含有30 mg油溶性上转换纳米材料的甲苯溶液,继续保持反应1 h。将体系温度升高至240 ℃,反应1 h。反应结束后加入过量的pH 4~5稀盐酸,再用超纯水清洗,即可获得水分散性的上转换纳米材料PAA-UCNPs。
1.3.3 UCNPs-OVA复合物的制备
称取5 mg上述制备的PAA-UCNPs,超声处理使其均匀分散在2-N-吗啡代烷磺酸缓冲液(pH 5.5)中,加入1.5 mg EDC和2.4 mg NHS,在室温条件下振荡孵育4 h。用2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸缓冲溶液(pH 7.2)洗涤3 次,向离心沉淀物中加入OVA蛋白,4 ℃条件下,搅拌反应过夜。离心洗涤3 次,即得到UCNPs-OVA荧光复合物。
1.3.4 胶体金纳米颗粒的制备
胶体金溶液采用柠檬酸三钠还原法制备[27-28]。步骤如下:加入足量的双蒸水到制备胶体金的三角瓶中,于恒温加热磁力搅拌器上加热至沸腾,约2 min后,倒掉沸水。量取99 mL双蒸水加入1 mL 1 g/100 mL氯金酸溶液,混合均匀后加热至沸腾。向溶液中迅速加入2.25 mL 1 g/100 mL柠檬酸三钠溶液。约2 min后,溶液颜色发生变化,最终呈现稳定的酒红色。继续煮沸搅拌溶液15 min,冷却至室温,使用去离子水定容至100 mL,4 ℃避光保存。
1.3.5 金标抗体的制备
取1 mL胶体金,用0.2 mol/L的K2CO3将胶体金溶液调至最佳pH值,加入18 μL的SQX单克隆抗体,充分混匀,室温静置1 h。加入20 μL 20 g/100 mL BSA溶液和10 μL 20% PEG-20000溶液,室温静置20 min,以稳定胶体金与抗体的结合物。之后将溶液于4 ℃、2 000 r/min离心15 min,保留上清液,除去标记过程中的各种聚合物。接下来再将上清液于4 ℃、10 000 r/min离心30 min,弃去950 μL上清液,将沉淀用金标工作液稀释8 倍,4 ℃保存备用。
1.3.6 荧光猝灭试纸条的组装
UCNPs-OVA荧光复合物与SQX包被抗原混合后固定于硝酸纤维素膜的T线区域0.8 μL/cm。并将UCNPs-OVA荧光复合物直接固定于硝酸纤维素膜的C线区域0.8 μL/cm。固定后的硝酸纤维素膜置于37 ℃烘箱过夜干燥,金标抗体按30 μL/cm剂量喷在金标垫上,37 ℃真空干燥过夜。将NC膜、金标垫、样品垫、吸水纸以及 PVC背板按一定顺序组装好后,使用全自动斩切机将其切成3.7 mm宽条装在聚氯乙烯卡壳中,置于室温干燥环境下保存备用。
1.3.7 实际样品检测
称取1 g牛奶样品用PBS溶液加Tween-20(PBST)稀释8 倍,直接用免疫荧光猝灭试纸条检测。
2.1 胶体金纳米材料表征

图2 上转换材料荧光光谱图和胶体金紫外图谱
Fig. 2 Fluorescence spectra of UCNPs and UV-vis absorption spectra of colloidal gold
实验制备出的胶体金溶液用肉眼观察为酒红色,澄清透明,状态稳定,表面无悬浮杂质,溶液底部无聚沉颗粒,初步说明制备的胶体金质量较好。用紫外-可见分光光度计对其在200~800 nm波长下进行全波长扫描,得到的胶体金紫外-可见吸收光谱图如图2所示。所制备的胶体金溶液最大吸收峰波长为520 nm,峰形流畅。同时本实验利用透射电子显微镜对胶体金颗粒的超微结构进行扫描,得到透射电镜图如图3所示,胶体金粒径平均粒径在18 nm左右,形状为规则的圆形,大小基本相同。

图3 胶体金透射电镜图
Fig. 3 Transmission electron microscopic image of colloidal gold particles
2.2 上转换荧光纳米材料表征
以稀土元素Er作为激活剂合成的上转换材料会在激发波长为980 nm的照射下,发射出绿色可见光,这源自于稀土元素Er能级的2H11/2,4S3/2→4I15/2转移[29]。如图2所示,合成的上转换材料的荧光光谱表明其发射波长为542 nm。从图2可以看出,胶体金的吸收波长为520 nm,与上转换的发射波长542 nm能够很好重合,从而为上转换与胶体金发生能量共振转移提供必要条件。图4表明,合成的油溶性上转换(OA-UCNPs)材料直径约30 nm,PAA修饰后上转换材料(PAA-UCNPs)的直径有所增加,这是因为通过配体交换,OA-UCNPs的表面修饰上一层薄薄的PAA层。

图4 材料的表征
Fig. 4 Characterization of the materials
2.3 工作条件的确定
表1 最佳抗原包被量和荧光复合物用量的优化
Table 1 Optimized amount of coating antigen and UCNPs-OVA complex

注:C、T、G分别表示质控线、检测线荧光强度和检测梯度;+.荧光可见但偏弱或梯度一般;++.荧光亮度清晰或梯度明显;+++.荧光过强。
分别对固定于硝酸纤维素膜UCNPs-OVA荧光复合物与SQX包被抗原进行优化,结果见表1。当UCNPs-OVA荧光复合物稀释倍数为1∶1 000,包被抗原稀释倍数为1∶8时,质控线荧光强度清晰适中,检测线荧光能够被完全猝灭且添加待测物后梯度较好。
2.4 荧光猝灭免疫层析试纸条灵敏度的确定
按照上述优化好的条件制备试纸条,用PBST释SQX至质量浓度梯度为0、0.5、1、5、15、20 µg/L。滴加SQX质量浓度梯度样品后,在激发波长为980 nm的激发器照射下观测结果。定义该建立的荧光猝灭免疫层析试纸条的检测限为:使T线上的荧光猝灭现象减少,即出现荧光条带,所使用的SQX的最低质量浓度。如图5所示,当加入的SQX样品为0.5 µg/L时,T线没有出现荧光条带,但当加入的SQX样品为1 µg/L时,T线出现荧光条带。因此,得到的结果显示该试纸条对溶于PBST中的SQX的检测限为1 µg/L。
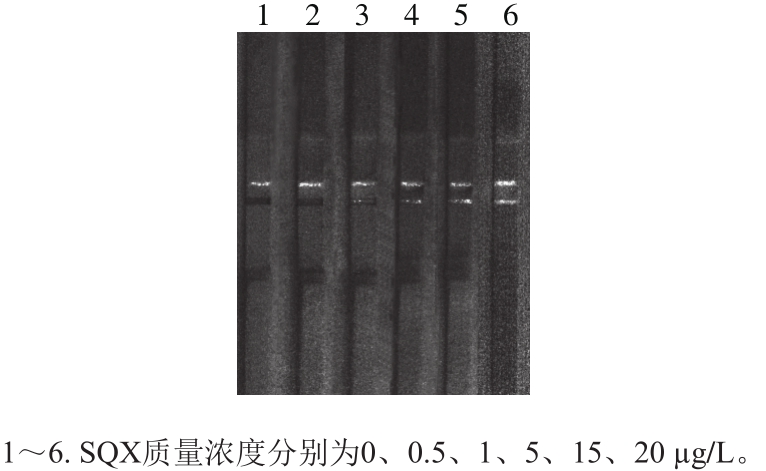
图5 上转换荧光猝灭试纸条检测PBST溶液中的SQX
Fig. 5 The detection limit of SQX in PBST solution using upconversion nanoparticle-based FQICS
2.5 特异性分析

图6 上转换荧光猝灭试纸条特异性分析
Fig. 6 Specificity analysis of upconversion nanoparticle-based FQICS
本实验测定12 种SQX的结构类似物来研究改建立方法的特异性,测定质量浓度分别为5、20、1 000 µg/L。如图6所示,当磺胺氯哒嗪、磺胺甲氧嗪、磺胺甲恶唑的质量浓度为5 µg/L,T线出现明亮的条带,荧光猝灭现象减少。对于磺胺甲氧嘧啶、磺胺地索辛,当其质量浓度达到20 µg/L,荧光猝灭现象降低,T线出现明亮的条带。然而对于其他的7 种类似物,如磺胺塞唑、磺胺吡啶、磺胺二甲唑、磺胺嘧啶、磺胺异恶唑、磺胺二甲嘧啶、磺胺多辛,即使质量浓度达到1 000 µg/L时,T线也没有出现明亮的条带,荧光猝灭现象没有完全消除。结果表明,所建立的试纸条法不仅能够被应用于检测SQX,还可以用于检测磺胺氯哒嗪、磺胺甲氧嗪、磺胺甲恶唑、磺胺甲氧嘧啶、磺胺地索辛等。
2.6 牛奶中SQX的检测结果
牛奶样品(经验证不含有SQX)分别添加一系列质量浓度的SQX(0、8、40、120、160 µg/L),PBST最低稀释8 倍后,能够消除机制的干扰,并用免疫荧光猝灭试纸条进行检测。得到在980 nm荧光激发波长下用肉眼看到的结果,如图7所示,该荧光猝灭试纸条对牛奶样品的检测限为8 µg/L。

图7 上转换荧光猝灭试纸条检测牛奶样品中的SQX
Fig. 7 The detection limit of SQX in milk samples using upconversion nanoparticle-based FQICS
本实验利用FRET原理在免疫层析试纸条平台上建立了新型荧光免疫猝灭试纸条。检测结果可以通过目测试纸条的荧光强弱定性半定量检测SQX的含量。整个检测过程不超过15 min。与何方洋[30]和李海龙[31]等的研究使用胶体金免疫层析试纸条检测SQX(标准溶液中SQX检测限为10 µg/L,牛奶样品检测限为80 µg/L)相比,该新型荧光猝灭试纸条具有低的检测限(标准溶液中SQX的检测限为1 µg/L,牛奶样品检测限为8 µg/L)。相对于仪器分析方法,该方法操作简便,检测时间短,结果易于判断,不需要大型仪器设备。因此,建立的该方法可以作为牛奶样品中SQX残留的现场快速检测的有用工具。
参考文献:
[1] LONG A R, HSIEH L C, MALBROUGH M S, et al. Multiresidue method for the determination of sulfonamides in pork tissue[J]. Journal of Agricultural and Food Chemistry, 1990, 38: 423-426. DOI:10.1021/jf00092a018.
[2] SOLEYMANPOUR A, REZVANI S A. Development of a novel carbon paste sensor for determination of micromolar amounts of sulfaquinoxaline in pharmaceutical and biological samples[J].Materials Science and Engineering: C, 2016, 58: 504-509.DOI:10.1016/j.msec.2015.08.034.
[3] CUI C Z, JIN L, JIANG L, et al. Removal of trace level amounts of twelve sulfonamides from drinking water by UV-activated peroxymonosulfate[J]. Science of the Total Environment, 2016, 161:748-754. DOI:10.1016/j.scitotenv.2016.07.183.
[4] 张国红. 兽医抗感染药物的合理应用(二): 磺胺类抗菌药的合理应用[J]. 畜禽业, 2003(4): 58-59. DOI:10.3969/j.issn.1008-0414.2003.04.042.
[5] ACKERMANS M T, BECKERS J L, EVERAERTS F M, et al.Determination of sulphonamides in pork meat extracts by capillary zone electrophoresis[J]. Journal of Chromatography, 1992, 596: 101-109. DOI:10.1016/0021-9673(92)80209-D.
[6] TUBAON R M, HADDAD P R, QUIRINO J P. High-sensitivity analysis of anionic sulfonamides by capillary electrophoresis using a synergistic stacking approach[J]. Journal of Chromatography A, 2014,1349: 129-134. DOI:10.1016/j.chroma.2014.05.007.
[7] REEVES V B. Confirmation of multiple sulphonamide residues in bovine milk by gas chromatography positive chemical ionization mass spectrometry[J]. Journal of Chromatography B, 1999, 723: 127-137.DOI:10.1016/S0378-4347(98)00548-9.
[8] PORTOLÉS T, ROSALES L E, SANCHO J V, et al. Gas chromatography-tandem mass spectrometry with atmospheric pressure chemical ionization for fluorotelomer alcohols and perfluorinated sulfonamides determination[J]. Journal of Chromatography A, 2015,1413: 107-116. DOI:10.1016/j.chroma.2015.08.016.
[9] LIU Z L, YU W, ZHANG H Q, et al. Salting-out homogenous extraction followed by ionic liquid/ionic liquid liquid-liquid microextraction for determination of sulfonamides in blood by high performance liquid chromatography[J]. Talanta, 2016, 161: 748-754.DOI:10.1016/j.talanta.2016.09.006.
[10] DENG K J, LAN X H, SUN G, et al. Determination of sulfonamide residues in chicken liver using high-performance liquid chromatography[J]. Food Analytical Methods, 2016, 9(12): 3337-3344. DOI:10.1007/s12161-016-0514-6.
[11] ZHANG Z W, LI X W, DING S Y, et al. Multiresidue analysis of sulfonamides, quinolones, and tetracyclines in animal tissues by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2016, 204: 252-262. DOI:10.1016/j.foodchem.2016.02.142.
[12] MITROWSKA K, ANTCZAK M. Determination of sulfonamides in beeswax by liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chromatography B, 2015, 1006: 179-186.DOI:10.1016/j.jchromb.2015.10.040.
[13] STOREY J M, CLARK S B, JOHNSON A S, et al. Analysis of sulfonamides, trimethoprim, fluoroquinolones, quinolones,triphenylmethane dyes and methyltestosterone in fish and shrimp using liquid chromatography-mass spectrometry[J].Journal of Chromatography B, 2014, 972: 38-47. DOI:10.1016/j.jchromb.2014.09.009.
[14] JIANG W X, BELOGLAZOVA N V, WANG Z H, et al. Development of a multiplex flow-through immunoaffinity chromatography test for the on-site screening of 14 sulfonamide and 13 quinolone residues in milk[J]. Biosensors and Bioelectronics, 2015, 66: 124-128.DOI:10.1016/j.bios.2014.11.004.
[15] HAN S J, ZHOU T J, YIN B J, et al. A sensitive and semi-quantitative method for determination of multi-drug residues in animal body fluids using multiplex dipstick immunoassay[J]. Analytica Chimica Acta,2016, 927: 64-71. DOI:10.1016/j.aca.2016.05.004.
[16] HU L, ZUO P, YE B C. Multicomponent mesofluidic system for the detection of veterinary drug residues based on competitive immunoassay[J]. Analytical Biochemistry, 2010, 405: 89-95.DOI:10.1016/j.ab.2010.05.034.
[17] 蔡勤仁, 曾振灵, 杨桂香. 兽药残留免疫检测技术应用进展[J]. 动物医学进展, 2002(2): 25-28. DOI:10.3969/j.issn.1007-5038.2002.02.008.
[18] QU H H, ZHANG Y, QU B P, et al. Rapid lateral-flow immunoassay for the quantum dot-based detection of puerarin[J]. Biosensors and Bioelectronics, 2016, 81: 358-362. DOI:10.1016/j.bios.2016.03.008.
[19] CHEN Y Q, CHEN Q, HAN M M, et al. Near-infrared fluorescencebased multiplex lateral flow immunoassay for the simultaneous detection of four antibiotic residue families in milk[J]. Biosensors and Bioelectronics, 2016, 79: 430-434. DOI:10.1016/j.bios.2015.12.062.
[20] SHI C Y, DENG N, LIANG J J, et al. A fluorescent polymer dots positive readout fluorescent quenching lateral flow sensor for ractopamine rapid detection[J]. Analytica Chimica Acta, 2015, 854:202-208. DOI:10.1016/j.aca.2014.11.005.
[21] 史聪颖. 基于FRET的新型莱克多巴胺荧光猝灭试纸条的研究[C]//中国化学会第十七届全国有机分析与生物分析学术研讨会论文集.南京: 中国化学会, 2013: 4.
[22] FU Q Q, TANG Y, SHI C Y, et al. A novel fluorescence-quenching immunochromatographic sensor for detection of the heavy metal chromium[J]. Biosensors and Bioelectronics, 2013, 49: 399-402.DOI:10.1016/j.bios.2013.04.048.
[23] HU G S, SHENG W, ZHANG Y, et al. Upconversion nanoparticles and monodispersed magnetic polystyrene microsphere based fluorescence immunoassay for the detection of sulfaquinoxaline in animal-derived foods[J]. Journal of Agricultural and Food Chemistry, 2016, 64(19):3908-3915. DOI:10.1021/acs.jafc.6b01497.
[24] 叶群瑞, 陈伯权, 吴美英. 一种简单、快速、量大的辛酸纯化单克隆抗体法[J]. 生物化学与生物物理进展, 1991, 18(1): 60-62.DOI:10.3321/j.issn:1000-3282.1991.01.013.
[25] GUO T, DENG Q L, FANG G Z, et al. Molecularly imprinted upconversion nanoparticles for highly selective and sensitive sensing of cytochrome c[J]. Biosensors and Bioelectronics, 2015, 74: 498-503.DOI:10.1016/j.bios.2015.06.058.
[26] HU G S, SHENG W, ZHANG Y, et al. A novel and sensitive fluorescence immunoassay for the detection of fluoroquinolones in animal-derived foods using upconversion nanoparticles as labels[J].Analytical and Bioanalytical Chemistry, 2015, 407(28): 8487-8496.DOI:10.1007/s00216-015-8996-4.
[27] 刘冰, 王玲玲, 童贝, 等. 沙丁胺醇免疫层析试纸条的应用研究[J]. 食品研究与开发, 2016, 37(18): 124-128. DOI:10.3969/j.issn.1005-6521.2016.18.028.
[28] SHENG W, LI Y Z, XU X, et al. Enzyme-linked immunosorbent assay and colloidal gold-based immunochromatographic assay for several(fluoro) quinolones in milk[J]. Microchimica Acta, 2011, 173(3/4):307-316. DOI:10.1007/s00604-011-0560-0.
[29] HUANG W J, LU C H, JIANG C F, et al. Controlled synthesis of NaYF4nanoparticles and upconversion properties of NaYF4:Yb,Er (Tm)/FC transparent nanocomposite thin films[J]. Journal of Colloid and Interface Science, 2012, 376: 34-39. DOI:10.1016/j.jcis.2012.02.047.
[30] 何方洋, 万宇平, 丁双阳, 等. 检测猪肉中磺胺喹噁啉的快速检测试纸条的研制[J]. 中国兽医杂志, 2009(2): 69-70. DOI:10.3969/j.issn.0529-6005.2009.02.039.
[31] 李海龙, 万宇平, 冯才茂, 等. 应用胶体金免疫层析法测定牛奶中的磺胺类药物残留[J]. 山东畜牧兽医, 2012(6): 6-8. DOI:10.3969/j.issn.1007-1733.2012.06.004.
Upconversion Nanoparticles (UCNPs)-Based Fluorescence Quenching Immunochromatographic Strips for Rapid Detection of Sulfaquinoxaline in Milk
HU Gaoshuang, ZHANG Yan, SHENG Wei, LI Zhi, WANG Junping, WANG Shuo*
(Key Laboratory of Food Nutrition and Safety, Ministry of Education, College of Food Engineering and Biotechnology,Tianjin University of Science and Technology, Tianjin 300457, China)
Abstract:Purpose∶ A novel fluorescent quenching immune chromatographic strip (FQICS) using upconversion nanoparticles(UCNPs) was developed to detect sulfaquinoxaline (SQX) in milk samples based on the principle of fluorescence resonance energy transfer (FRET). Methods∶ UCNPs was prepared using a pyrolytic process, and colloidal gold was prepared using sodium citrate reduction method. Then OVA-UCNPs were distributed to the upper side to form C line. OVA-UCNPs and SQX-OVA coating antigen were added to the lower side of the NC membrane to form the T line. When a negative sample was added to the sample pad, the liquid sample containing colloidal gold-labeled antibody migrated via capillary action toward the end of the strip. When the mixture reached the T line, which was coated with SQX-OVA coating antigen and OVA-UCNPs, the gold-labeled antibody bound to SQX-OVA coating antigen. Since the UCNPs were simultaneously coated at the same location as the SQX-OVA coating antigen, the binding of gold-labeled antibody to SQX-OVA coating antigen could provide a suitable distance between the UCNPs and colloidal gold to cause FRET. Using a 980 nm laser, the test results could be evaluated visually according to fluorescence intensity. Results∶ The limit of detection (LOD) of this assay for SQX in PBS buffer was 1 µg/L, and the LOD for SQX in milk samples was 8 μg/L. The whole detection process could be completed within 15 min. Conclusion∶ The FQICS based on UCNPs allowed for simple, sensitive, time-saving, and rapid onsite detection of SQX residues in milk.
Key words:sulfaquinoxaline; upconversion nanoparticles; fluorescence quenching immune chromatographic strips; milk
DOI∶10.7506/spkx1002-6630-201724035
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)24-0218-06
引文格式:
胡高爽, 张燕, 生威, 等. 上转换荧光猝灭试纸条检测牛奶中磺胺喹恶啉[J]. 食品科学, 2017, 38(24): 218-223.
DOI:10.7506/spkx1002-6630-201724035. http://www.spkx.net.cn
收稿日期:2016-12-22
基金项目:国家国际科技合作专项(2014DFR30350);天津市科技计划项目(14ZCDGNC00098)
作者简介:胡高爽(1989—),女,博士研究生,研究方向为食品安全。E-mail:hugaoshuang1989@163.com
*通信作者:王硕(1969—),男,教授,博士,研究方向为食品安全。E-mail:s.wang@tust.edu.cn
HU Gaoshuang, ZHANG Yan, SHENG Wei, et al. Upconversion nanoparticles (UCNPs)-based fluorescence quenching immunochromatographic strips for rapid detection of sulfaquinoxaline in milk[J]. Food Science, 2017, 38(24)∶ 218-223. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724035. http∶//www.spkx.net.cn