SNP标记用于猪肉产品DNA溯源
吴 潇,吕贝贝,王金斌,蒋 玮,李 鹏,武国干,唐雪明*
(上海市农业科学院生物技术研究所,上海 201106)
摘 要:采用基于个体基因组DNA序列的差异而进行个体识别的DNA溯源技术,建立DNA溯源系统对肉产品的质量安全进行控制。在实验群体中(10 个品种,233 个个体)检测了33 个新单核苷酸多态性(single nucleotide polymorphism,SNP)标记的遗传多样性,通过杂合度计算筛选出6 个SNP标记可用于猪肉产品DNA溯源。进一步在屠宰场采样进行溯源模拟实验,结果表明筛选的18 个SNP标记(6 个新SNP标记结合已有的12 个SNP标记)能有效区分100 头猪个体,随机抽取的10 个个体的组织样品都能通过基因型比对找到对应的个体。本研究可为早日建立猪肉产品的DNA溯源系统提供一定的技术参考。
关键词:猪肉产品溯源;DNA溯源技术;SNP标记;个体识别
猪肉作为我国最主要的动物蛋白来源,其安全问题受到普遍关注。建立猪肉的溯源体系,可以实现对猪肉制品的可追溯管理,从而为消费者提供产品有关的详细信息,包括养殖、运输、屠宰、分割、销售等各个环节,大大加强了政府相关部门对肉制品质量安全监管的力度[1-2]。
标签溯源技术因为操作简单、成本低,在我国得到广泛的应用。但标签存在易混淆、易脱落丢失,而且一旦猪肉产品间分割离开胴体就无法再进一步追溯。生物体的DNA存在于其任何组织的细胞中,而且个体的DNA序列具有特异性(同卵双生除外)和稳定性,因此不受动物被分割的影响[3],通过鉴别个体DNA特征能够准确地识别动物个体,因此DNA技术被用于肉产品的溯源中。
DNA溯源技术需要借助分子标记体现个体基因组序列的差异[4]。当前被认为是最具应用潜力的分子标记是SNP标记,已在多个国家得到应用。受饮食习惯影响,SNP标记主要在牛肉制品上应用较多,Heaton等[5]采用SNP标记对美国中西部17 个州进行了牛肉的追溯,在前期研究的基础上将SNP标记数目缩小到20 个,这组标记实现了从在售牛肉样品追溯到屠宰厂和农场[6]。日本为了杜绝疯牛病牛肉疫情的传播,Suekawa等[7]研究并使用SNP标记来筛选能区分日本本土黑牛、荷斯坦牛与进口的澳大利亚牛肉、美国牛肉,从而确保了日本牛肉食品的安全。韩国为了支持本国牛肉产业和维护消费者的知情权,Cheonga等[8]研发一组SNP标记用以区分韩国本地牛肉、进口牛肉和国产荷斯坦牛肉。比利时的Goffaux等[9]于就对猪基因的5’和3’非翻译区的SNP标记进行研究,获得一组21 个SNP标记,能有效区分比利时的主要商品猪品种。而我国猪肉产品溯源还停留在耳标等标签技术阶段。
在猪的长期育种工作中,已经积累了大量SNP标记,但只有至少满足下列条件的标记才能用于溯源:1)变异度高,等位基因频率较为接近;2)不同品种的等位基因分布差异小;3)杂合度要大于或等于0.3[2-3]。
由于现有SNP标记多为育种标记,跟某一类生产形状相关,因此往往集中分布在某些染色体上,如1号染色体、12号染色体等,而另外部分染色体,如5号、8号、14号染色体等则缺乏SNP标记。因此为了满足对猪肉产品进行DNA溯源的要求本研究率先进行了新SNP溯源标记的研究工作。
1 材料与方法
1.1 材料
实验样品采自上海崇明富农猪场,包括:皮特兰(P)24 头;申农(SN)32 头;大申(DS)31 头;皮申(PS)12 头;长申(CS)26 头;杜申(DuS)23 头;皮大申(PDS)19 头;长大申(CDS)25 头;杜大申(DDS)7 头;杜皮大申(DPDS)31 头。
溯源模拟实验的猪样品采自上海复兴屠宰场,随机采集100 头猪个体的耳组织样品和其中10 头猪个体的组织样品(包括心脏、肝脏、胃部、肾脏、小肠、大肠、尾巴、肌肉样品)。
1.2 方法
1.2.1 DNA的提取
采用酚/氯仿抽提法提取DNA,并稀释到25 ng/μL,-20 ℃保存。提取方法参考《分子克隆实验指南》。
1.2.2 PCR扩增和酶切
对缺乏SNP标记的猪4、5、14、15、16号和18号染色体,利用NCBI数据库中猪的基因组序列作为模板,用Primer 5.0设计引物分离基因片段。PCR扩增体系为20 μL:其中Taq DNA聚合酶(5U/μL)0.20 μL,10×PCR Buffer 2.0 μL,dNTPs(2.5 mmol/L)0.40 μL,引物0.60 μL,DNA模板(稀释后)3.0 μL,去离子蒸馏水13.20 μL,退火温度依引物而定。酶切体系10~12 μL,其中扩增产物3~8 μL,酶切Buffer 1.2 μL,限制性内切酶5 U,反应6 h(各种酶的作用温度不相同)。酶切产物用1%~2%的琼脂糖电泳分析。
表1 19 对引物序列及片段长度
Table 1 Sequences and length of the 19 primers used in this study

引物名称 引物序列 退火温度/℃预期长度/bp S4-1 PF:5’-TCCAGGATGGTCAGCGATAC-3’PR:5’-CATGCTAAGCCACAGAGGAAC-3’ 62 1 415 S4-2 PF:5’-AGTCAGGTGAATGCTCAGG-3’PR:5’-GACATCTTCTCTCCACTCCAC-3’ 62 1 162 S4-3 PF:5’-GCAAGTGGAGTGGAGAGAAG-3’PR:5’-ACTCGTGTGAATCCGTAAGG-3’ 62 1 059 S5-1 PF:5’-TGCGATCTGTGTCTGTGAAG-3’PR:5’-TCGCTCATTACACTCCTCCT-3’ 60 898 S5-2 PF:5’-GACTAGGAACCATGAGGTTG-3’PR:5’-CTGGACGTAGCTGTTGAGG-3’ 59 926 S5-3 PF:5’-TGGTCCTTAGTGTTCAGTGC-3’PR:5’-ATCGAACCTGAGTCCTCGT-3’ 62 1 120 S14-1 PF:5’-TGAGAGTCTGACGCAGGTG-3’PR:5’-CAGATGAGACAACTGAGGCTC-3’ 62.5 1 393 S14-2 PF: 5’-ACAGCCACAGCAACACCA-3’PR:5’-TGGAGGAGAGAGGAAGGAGA-3’ 59 909 S14-3 PF:5’-TGCCATTAGCCTGAAGAAGT-3’PR:5’-CTATCCAAGGTCACACAGTCA-3’ 56 1 066 S15-1 PF:5’-GGCTTCTGTTGACTGGACTA-3’PR:5’-TAGAGGTGGCTGATTGAGG-3’ 58 919 S15-2 PF: 5’-GCTGTTCCTTCCTTCTGTTC-3’PR: 5’-GCCTGAGGCATAGACTCTCT-3’ 60.5 1 365 S15-3 PF:5’-TAGGTTACAGACACGGCTCA-3’PR:5’-CCTATCTACACCTTCCTTCG-3’ 60 1 329 SSC15-4 PF:5’- TTTCTCCCTAAGTCGTCG-3’PR:5’-GTAGCCACTGGCCTATGT-3’ 59.3 1 325 S16-1 PF:5’-TGGCAGCTTCTGTTGACCTT-3’PR:5’-GGCAGGCACAAGTCTATTCTC-3’ 62.5 954 S16-2 PF:5’-TAGTCACTTGTCCACGAAGG-3’PR:5’-AACACTGGTGCTTATGCTCT-3’ 60 1 134 S16-3 PF:5’-GGATTGAACCTACGCTACAG-3’PR:5’-TGCACATACACAGACACACAT-3’ 61 1 332 S18-1 PF:5’-CCTAGATAGGATGGTGTGGA-3’PR:5’-TAGAGAACGACCTTGAGAGC-3’ 62 872 S18-2 PF:5’-TTTGTGATGGTGCTCTGCGTTT-3’PR:5’-CCCTGCCTGAAGGTGGTTGT-3’ 62 1 129 S18-3 PF:5’-CTTGAGAGCAGAGAACATCC-3’PR:5’-CTGATCCTGGTGACAATCG-3’ 62 1 599
1.2.3 SNP标记的筛选
根据电泳图片记录个体的基因型,然后计算等位基因频率(P)公式如下:
杂合度(heterozygosity,H)表示基因多样性,群体的杂合度表示某位点为杂合子的概率,计算公式如下:
式中:Pi为i位点的等位基因频率;n为等位基因数。
根据引物的扩增效率、琼脂糖电泳的分辨率、等位基因频率和杂合度是否大于0.3来进行SNP标记的筛选。
1.2.4 溯源模拟实验
将采自屠宰场的100 头猪个体的耳组织样品按照1~100依次编号,其中10 头猪只个体的样品按照组织编号,如:L(肝脏样品)、S(胃部样品)、H(心脏样品)、K(肾脏)、T(尾巴样品)、I(大肠样品)和M(肌肉样品)。对于每一份样品,检测筛选的所有SNP标记的基因型,耳组织样品的基因型代表个体的基因型,组织样品的基因型代表猪分割肉的基因型,按照酶切带型,1条带记为1,出现2条带记为2,3 条带记为3,每一份样品所有SNP的基因型形成一个类似条形码的一串数字。将10 个组织样品的基因型数字条码和100 头猪个体的基因型数字条码进行比对。
2 结果与分析
2.1 SNP标记的挖掘
通过克隆子测序和序列比对分析,发现了33 个可以用PCR-RFLP方法识别的新SNP位点。SNP位点的碱基替代情况和内切酶如表2所示。
在实验群体中进行33 个SNP标记的检测,记录每个位点的杂合子和纯合子的个体数目。然后根据公式计算基因频率和杂合度,其中有6 个SNP标记复合溯源标记的要求,详见表3。6 个SNP标记等位基因分布均衡,杂合度最大为0.500 0,最小为0.244 9。杂合度低于0.3的有两个,是SNP2和SNP3两个位点在杜大申群体中的杂合度,这可能是因为杜大申样本数太少的原因,除此之外,这两个位点除了杜大申群体中杂合度稍低于0.3,其他群体中的杂合度都大于0.3,而且杂合度平均值分别为0.401 9和0.413 9,均大于0.3,所以这两个位点也是符合溯源标记要求的。并且可以用于猪肉产品的溯源。
表2 新SNP位点及内切酶
Table 2 New SNP sites and the corresponding endonucleases

引物 替换碱基 突变位点 切点 酶(括号内是同工酶)S4-1 C/A 981 983 Bsh1236(BstUⅠ、AccⅡ、MvnⅠ、ThaⅠ)C/T 992 994 XagⅠ(EcoNⅠ)A/C 1 033 1 031 Eco91Ⅰ(Eco065Ⅰ、PspEⅠ、BstE1Ⅰ、BptP1)S4-2 C/A 852 848 EcoO109ⅠT/C 508 512 PstⅠC/T 551 546(15) Mva1269ⅠC/T 785 784(123、1 135) Hin6Ⅰ(CfoⅠ、HhaⅠ)C/T 787 782 MluⅠS4-3-1 T/C 439 438(336) BseGⅠC/A 543 540(198) NmuCⅠC/A 575 571(1 005) TatⅠC/A 603 603 MvaⅠ(EcoRⅡ)T/C 104 98 Eco91ⅠA/G 170 169 PstⅠG/T 925 924 Eco47ⅠS4-3-3 A/G 829 831 Eco24ⅠS5-3-1 G/A 301 298(522) MspⅠS5-3-3 T/G 424 420(492) NdeⅠS14-3-1 G/C 247 247 Csp6Ⅰ、RsaⅠ(248)A/C 275 271 BamHⅠS14-3-4 /C 209 213(877) AgeⅠC/T 491 289(882) Eco147ⅠS15-1-2 A/C 187 187 Eco31ⅠS4-3-2 S16-2-2 G/A 165 169(165) Eco24Ⅰ(Bsp120Ⅰ)/C 185 185(654) Bpu1102ⅠA/G 486 484 TaqⅠAT/GG 608-9 609(365) SspⅠT/C 675 673 Eco130ⅠS16-3-2 A/G 603 601(412) NdeⅠT/C 632 632 Eco81ⅠG/A 1 183 1 187(672) Mph1103ⅠS18-3 A/G 1 005 1 003 SmaⅠ(Cfr9Ⅰ、XmaⅠ、XmacⅠ、PspAⅠ)、/T 631 628 NdeⅠ(FauNDⅠ)C/T 984 985 Bpu1102Ⅰ(Bsp1720Ⅰ、CeⅢ)、
表3 6 个新SNP在11 个猪种中基因频率及杂合度
Table 3 Gene frequencies and heterozygosity of 6 new SNPs in 11 pig breeds
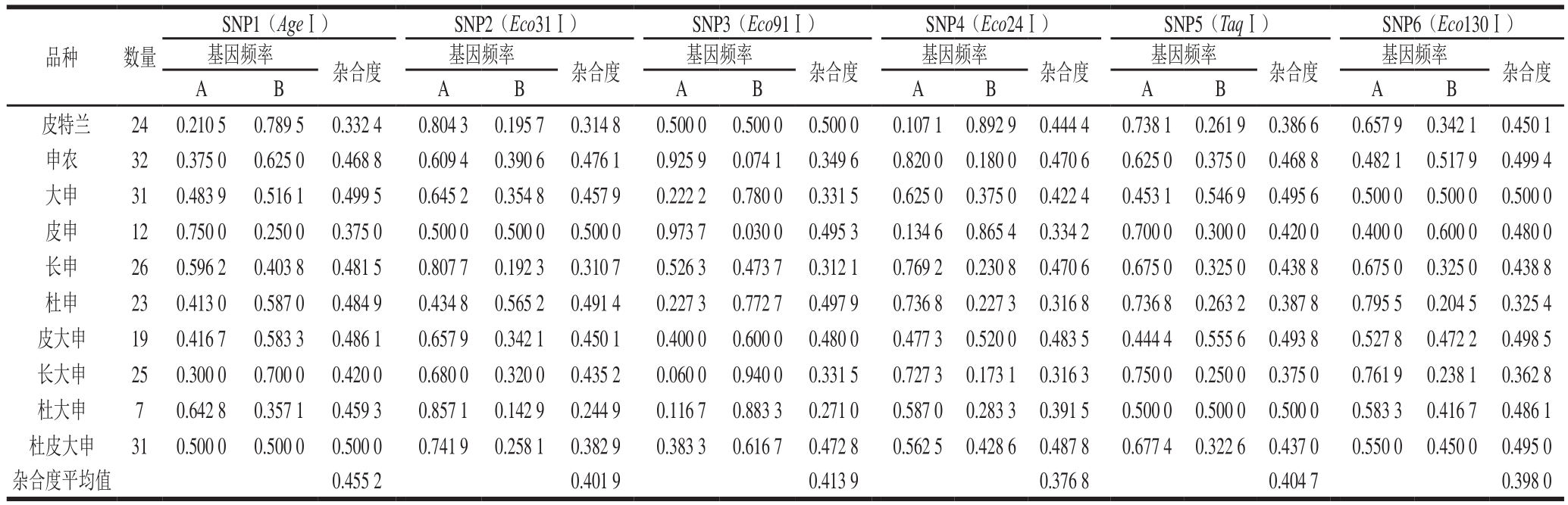
SNP1(AgeⅠ) SNP2(Eco31Ⅰ) SNP3(Eco91Ⅰ) SNP4(Eco24Ⅰ) SNP5(TaqⅠ) SNP6(Eco130Ⅰ)基因频率 杂合度 基因频率 杂合度 基因频率 杂合度 基因频率 杂合度 基因频率 杂合度 基因频率 杂合度A B A B A B A B A B A B皮特兰 24 0.210 5 0.789 5 0.332 4 0.804 3 0.195 7 0.314 8 0.500 0 0.500 0 0.500 0 0.107 1 0.892 9 0.444 4 0.738 1 0.261 9 0.386 6 0.657 9 0.342 1 0.450 1申农 32 0.375 0 0.625 0 0.468 8 0.609 4 0.390 6 0.476 1 0.925 9 0.074 1 0.349 6 0.820 0 0.180 0 0.470 6 0.625 0 0.375 0 0.468 8 0.482 1 0.517 9 0.499 4大申 31 0.483 9 0.516 1 0.499 5 0.645 2 0.354 8 0.457 9 0.222 2 0.780 0 0.331 5 0.625 0 0.375 0 0.422 4 0.453 1 0.546 9 0.495 6 0.500 0 0.500 0 0.500 0皮申 12 0.750 0 0.250 0 0.375 0 0.500 0 0.500 0 0.500 0 0.973 7 0.030 0 0.495 3 0.134 6 0.865 4 0.334 2 0.700 0 0.300 0 0.420 0 0.400 0 0.600 0 0.480 0长申 26 0.596 2 0.403 8 0.481 5 0.807 7 0.192 3 0.310 7 0.526 3 0.473 7 0.312 1 0.769 2 0.230 8 0.470 6 0.675 0 0.325 0 0.438 8 0.675 0 0.325 0 0.438 8杜申 23 0.413 0 0.587 0 0.484 9 0.434 8 0.565 2 0.491 4 0.227 3 0.772 7 0.497 9 0.736 8 0.227 3 0.316 8 0.736 8 0.263 2 0.387 8 0.795 5 0.204 5 0.325 4皮大申 19 0.416 7 0.583 3 0.486 1 0.657 9 0.342 1 0.450 1 0.400 0 0.600 0 0.480 0 0.477 3 0.520 0 0.483 5 0.444 4 0.555 6 0.493 8 0.527 8 0.472 2 0.498 5长大申 25 0.300 0 0.700 0 0.420 0 0.680 0 0.320 0 0.435 2 0.060 0 0.940 0 0.331 5 0.727 3 0.173 1 0.316 3 0.750 0 0.250 0 0.375 0 0.761 9 0.238 1 0.362 8杜大申 7 0.642 8 0.357 1 0.459 3 0.857 1 0.142 9 0.244 9 0.116 7 0.883 3 0.271 0 0.587 0 0.283 3 0.391 5 0.500 0 0.500 0 0.500 0 0.583 3 0.416 7 0.486 1杜皮大申 31 0.500 0 0.500 0 0.500 0 0.741 9 0.258 1 0.382 9 0.383 3 0.616 7 0.472 8 0.562 5 0.428 6 0.487 8 0.677 4 0.322 6 0.437 0 0.550 0 0.450 0 0.495 0杂合度平均值 0.455 2 0.401 9 0.413 9 0.376 8 0.404 7 0.398 0品种 数量
2.2 溯源模拟实验结果
表4 12 个已有的可用于溯源的SNP标记[10-19]
Table 4 Twelve existing SNP tags that can be used for traceability

基因名称 引物序列(5’-3’) 退火温度/℃ 内切酶 位点ADAMTS-1 PF:TGGGGAGATTGTTCCAGAAC PR:CTGCAGAACGAAGAAGTAGCC 58 PvuⅡ 1 ESR PF:CCTGTTTTTACAGTGACTTTTACAGAG PR:CACTTCGAGGGTCAGTCCAATTAG 54 PvuⅡ 2 MyoG PF:TGGACTGGATGGTTCAGACTGTG PR:AGACAGTCTCAGTTGGGCATGG 58 MspⅠ 3 H-FABP PF1:GGACCCAAGATGCCTACGCCG PR1:CTGCATCTTTGACCAAGAGG 60 HinfⅠ 4 PF2:ATTGCCTTCGGTGTGTTTGAG PR2:TCAGGAATGGGAGTTATTGG 58 MspⅠ 5 MC4R PF1:TACCCTGACCATCTTGATTG PR1:ATAGCAACAGATCTCTTTG 55 TaqⅠ 6 PF2:ATGAACTCAACCCATCACC PR2:TTAATATCTGCTAGACAAATCACAG 54 ClaⅠ 7 PSMB10 PF:AGCTGCGAAAAGATCCACTT PR:GGTCTTCTAGCACTGCCAGG 58 Eco72Ⅰ 8 PSMC3 PF:TGCCGTACCTGGTCTCCAAC PR:TTGGCACCATCTTCCTCTTG 64 MvaⅠ 9 PSMA1 PF:CTTATGCCTCAGGTGTGGTC PR:GTACGAGCTGATTGAGAACG 58 Alw26Ⅰ 10 MMP3 PF:GCAGAAGTTCCTTGGGTTGG PR:AAACTTTTCCAGGTCCGTCAA 56 HpyF3Ⅰ 11 TRIM55 PF:CCCGTGGTCATTCTTCCCTG PR:TGCCGAGCAAGAAAAGAGGAAT 58 Bse3DⅠ 12
为验证筛选的SNP标记能否有效地进行猪肉产品溯源,本实验在上海复兴屠宰场进行了溯源模拟实验。随机采取了100 头猪个体的耳组织样,采集了其中10 头个体的一处组织器官的样品,代表市面上销售的猪的分割产品。先在100 头猪个体中检测了18 个SNP的基因型,按照酶切带型,记录顺序按照表4位点顺序排列,再加表3中的6 个新SNP位点,个体的基因型可以表示为:212323222233113232。统计分析结果显示这18 个SNP标记能鉴别出这100 头猪个体。实验同时测定了10 份组织器官样品,同样用数字表示基因型,如表5可知,通过查找和比对,10 个样品都能在100 头猪个体的基因型中找到基因型匹配的个体。
表5 10 份组织样品基因型及对应的个体
Table 5 Ten tissue samples and the corresponding individual genotypes

编号 组织器官 基因型 对应个体L1 肝脏 312131333213133131 56 S胃232131333321323232 36 H 心脏 231221321321313213 47 K 肾脏 211221123123221123 19 T1 尾巴 331233113123113312 3 I 大肠 131311233331223211 84 M1 前腿肉 211213322233322133 27 M2 后腿肉 321223112113133133 41 T2 尾巴 313132112211113322 59 L2 肝脏 312231221331212211 93
3 讨论与结论
肉类食品安全问题关系到消费者的健康与生命安全[20-21],针对畜禽养殖、屠宰加工、产品贮运和销售等环节存在的安全隐患,肉产品的追溯系统能起到一定的监管作用[22-24],有利于监管部门发现食品安全隐患后能迅速确定肉产品的来源及去向,及时召回受污产品,因此世界上许多国家已积极发展并建立肉类食品的追溯系统[2-3]。个体DNA存在于动物的每个细胞之中,不受动物发育期和器官的影响,而且每个个体的DNA是独一无二的(同卵双生除外)。研究者根据个体DNA的特异性和组织无差异性建立了DNA溯源技术,使得追溯不受动物分割的限制,因此DNA溯源技术被越来越多的国家广泛应用到肉产品的溯源中[3]。
SNP标记是第3代分子标记,是单个核苷酸发生改变而产生多态性的DNA分子标记[25-27],属于二等位基因多态,因此一个SNP理论上可以区分3 个动物个体,如果有n个位点,则能区分3n个个体。SNP在基因组内分布十分广泛,如在哺乳动物中每500~1 000 bp序列就有可能包含一个SNP[4]。近年来,SNP标记作为分析生物遗传多样性的分子标记,已被广泛用于猪的遗传学[28-29]研究中。但是不是所有的SNP标记都可以用作溯源,因此需要建立群体对SNP标记进行筛选,只有符合品种内变异度高,品种间等位基因分布差异小,杂合度大于0.3的SNP标记才能用于DNA溯源。本实验根据文献[10-19]报道,检索出大量的SNP标记,通过检测分析,筛选出12 个可以用于溯源的SNP标记,如表4所示。同时,针对缺乏SNP溯源标记的染色体进行了新SNP标记的挖掘。根据NCBI数据库猪的序列信息,设计了19 对引物,通过DNA池测得方法,发现了33 个可以用PCR-RFLP方法识别的新SNP位点。在采自上海崇明富农猪场的233 头猪的实验群体中检测了这33 个SNP位点,通过等位基因频率分析和杂合度计算,筛选到6 个可以用于溯源的SNP标记。将文献中筛选获得的12 个已有的SNP标记和6 个新SNP标记结合在一起形成一个SNP溯源标记的组合。
本研究为了验证获得的18个SNP溯源标记组合的溯源准确性,进行了猪肉产品的溯源模拟实验。在上海复兴屠宰场随机采集了100 头猪个体的耳组织样品和其中10 头猪个体的组织样品,耳组织样品的基因型代表个体的基因型,组织样品的基因型代表分割肉的基因型。对于每一份样品,检测上步筛选的所有SNP标记的基因型,根据带型记录个体的基因型。溯源模拟结果显示这18 个SNP标记能有效区分这100 头猪个体。本研究同时检测了采集的10 份组织器官样品,同样用数字表示基因型,通过查找和比对,10 个样品都能在100 头猪个体的基因型中找到基因型匹配的个体。阮泓越等[30]使用SNP标记对3 个国外引进猪品种(大白猪、长白猪和杜洛克猪)进行个体识别的研究,结果表明利用14 个SNP标记即可区分所有样本,此外还进一步利用这些SNP标记对屠宰场随机取样的5 头猪进行从肉样到血液样品的溯源研究,结果表明同一头猪的肉样和血液样品的SNP座位是一一对应的。胡肄农等[31]使用7 对引物,扩增52 个SNP位点,经关联性分析及杂合度过滤(杂合度不低于0.1)后,选留41 个SNP位点,用于苏钟猪个体身份识别,7 对引物扩增片段理论上可用于近5.0×106头猪个体身份DNA识别的数字条形码编制,基本可以满足规模苏钟猪养猪场猪的个体身份识别。本实验使用了18 个SNP标记,理论上有318个基因型体,能区分3.87×108个个体,因此18 个SNP标记是完全可以用于大规模的猪只个体识别和追溯。
采用DNA溯源技术进行猪肉产的溯源准确、可靠,但目前进行猪只个体DNA身份识别的成本比传统的耳标等识别方法高,因此在我国难以普及,但是可以优先应用于一些生产品牌猪肉的大型养猪场。另外,针对猪的主要品种开发分辨率高、检测位点少的检测体系,可以针对地域性的主打品种进行SNP标记的筛选,随着生物技术的发展,DNA溯源技术的成本会逐步降低,相信在不久的将来DNA溯源技术一定能广泛的应用于我国动物个体识别和猪肉产品追溯中。
参考文献:
[1] 吴潇, 潘玉春, 唐雪明. 肉制品的DNA溯源技术[J]. 猪业科学, 2009,26(3)∶ 105-106. DOI∶10.3969/j.issn.1673-5358.2009.03.031.
[2] 吴潇, 张小波, 朱连龙, 等. 肉产品分子溯源标记的研究进展[J]. 食品科学, 2010, 31(7)∶ 308-311. DOI∶10.3969/j.issn.1673-5358.2009.03.031.
[3] 张小波, 吴潇, 何慧, 等. 基于SNPs标记的猪肉DNA溯源技术的研究[J]. 中国农业科技导报, 2011, 13(3)∶ 85-91. DOI∶10.3969/i.issn.1008-0864.2011.03.14.
[4] 王淑新, 连林生. 单核苷酸多态性作为新一代分子标记的优越性[J].中国畜牧兽医, 2008, 35(4)∶ 31-33.
[5] HEATON M P, HARHAY G P, BENNETT G L, et al. Selection and use of SNP markers for animal identification and paternity analysis in US beef cattle[J]. Mammalian Genome, 2002, 13(5)∶ 272-281.
[6] HEATON M P, JAMES E K, CLAWSON M L, et al. Use of bovine single nucleotide polymorphism markers to verify sample tracking in beef processing[J]. Journal of the American Veterinary Medical Association, 2005, 226(8)∶ 1311-1314.
[7] SUEKAWA Y, AIHARA H, ARAKI M D, et al. Development of breed identification markers based on a bovine 50K SNP array[J].Meat Science, 2010, 85(2)∶ 285-288.
[8] CHEONG H S, KIM L H, NAMGOONG S, et al. Development of discrimination SNP markers for Hanwoo (Korean native cattle)[J].Meat Science, 2013, 94(3)∶ 355-359.
[9] GOFFAUX F, CHINA B, DAMS L, et al. Development of a genetic traceability test in pig based on single nucleotide polymorphism detection[J]. Forensic Science International, 2005, 151(2/3)∶ 239-247.
[10] WU X, YANG S F, WANG J B, et al. Investigating identification and DNA traceability of pig by autosomal SNP and mitochondrial D-loop variant region markers[J]. Advanced Science Letters, 2013, 19(10)∶2995-2998.
[11] 黄敏瑞, 孙俊丽, 潘天彪, 等. 6 个SNP DNA标记在陆川猪群体中的遗传多样性分析[J]. 广西畜牧兽医, 2008, 24(2)∶ 67-69.
[12] 张桂香, 王志刚, 孙飞舟, 等. 56 个中国地方猪种SNP基因座的遗传多样性[J]. 遗传学报, 2003, 30(3)∶ 225-233.
[13] 牛荣, 黄中波, 商海涛, 等. 广西巴马小型猪21 个SNP座位的DNA多态性分析[J]. 中国兽医科技, 2002, 32(8)∶ 11-3. DOI∶10.3969/j.issn.1673-4696.2002.08.004.
[14] 吴迪, 张亚妮, 周占琴, 等. 合作猪和迪庆猪的SNP遗传多样性分析[J]. 甘肃农业大学学报, 2004, 39(2)∶ 106-109. DOI∶10.3969/j.issn.1003-4315.2004.02.002.
[15] 郭宏宇, 林家栋. 利用SNP DNA标记分析贵州3 个地方猪种的遗传多样性[J]. 安徽农业科学, 2009, 37(8)∶ 3453-3454. DOI∶10.3969/j.issn.0517-6611.2009.08.044.
[16] 徐玲玲, 吴艳花, 路静, 等. 筛选适用于小型猪遗传检测的SNP位点[J]. 中国比较医学杂志, 2009, 19(2)∶ 11-6. DOI∶10.3969/j.issn.1671-7856.2009.02.004.
[17] 公维华, 张宁波, 程佳月, 等. 小型猪SNP标记多重PCR体系的建立与应用[J]. 中国比较医学杂志, 2009, 19(2)∶ 21-25. DOI∶10.3969/j.issn.1671-7856.2009.02.006.
[18] 曹果清, 李步高, 石建中, 等. 应用21 个SNP标记监测马身猪遗传多样性变化趋势[J]. 畜牧兽医学报, 2010, 41(8)∶ 932-928.
[19] 霍金龙, 霍海龙, 苗永旺, 等. 利用76 个SNP标记分析滇南小耳猪的遗传多样性[J]. 云南农业大学学报, 2008, 23(5)∶ 638-643.DOI∶10.3969/j.issn.1004-390X.2008.05.012.
[20] 张秋, 陈慧. 肉类食品安全事件模拟演练设计与实施[J]. 肉类研究,2016, 30(11)∶ 43-47. DOI∶10.15922/j.cnki.rlyj.2016.11.009.
[21] 李天仪. 对肉类食品安全问题的思考[J]. 养殖与饲料, 2017(4)∶ 97-98.DOI∶10.13300/j.cnki.cn42-1648/s.2017.04.055.
[22] 王立方, 陆昌华, 胡肄农, 等. 新型生猪标识及肉产品可追溯系统的设计和实现[J]. 农业网络信息, 2006(12)∶ 25-27. DOI∶10.3969/j.issn.1672-6251.2006.12.008.
[23] 杨亮, 罗清尧, 熊本海, 等. 猪肉质量安全可追溯系统屠宰环节的设计与实现[J]. 农业网络信息, 2008(1)∶ 22-25. DOI∶10.3969/j.issn.1672-6251.2008.01.007.
[24] 谢菊芳, 陆昌华. 安全猪肉全程可追溯系统的设计与实现[J]. 黑龙江畜牧兽医, 2007(4)∶ 94-96. DOI∶10.3969/j.issn.1004-7034.2007.04.049.
[25] 唐立群, 肖层林, 王伟平. SNP分子标记的研究及其应用进展[J]. 中国农学通报, 2012, 28(12)∶ 154-158. DOI∶10.3969/j.issn.1000-6850.2012.12.028.
[26] 李兆波, 吴禹, 王岩, 等. SNP标记技术及其在农作物育种中的应用[J]. 辽宁农业职业技术学院学报, 2010, 12(3)∶ 8-9. DOI∶10.3969/j.issn.1671-0517.2010.03.004.
[27] 卞光明, 胡则辉, 柴学军, 等. SNP标记技术及其在水产动物遗传学中的应用[J]. 浙江海洋学院学报(自然科学版), 2016, 35(4)∶346-353. DOI∶10.3969/j.issn.1008-830X.2016.04.014.
[28] 王彦平, 王怀中, 姜运良, 等. 影响猪生长和肉质性状的显著SNP在大约克和长白群体内的多态性分析[J]. 山东农业科学, 2016, 48(8)∶128-133. DOI∶10.14083/j.issn.1001-4942.2016.08.029.
[29] 曾治君, 刘晨龙, 杨慧, 等. 利用高密度SNP对猪血糖和糖基化血清蛋白性状的全基因组关联分析[J]. 中国农业科学, 2014, 47(18)∶3700-3707. DOI∶10.3864/j.issn.0578-1752.2014.18.018.
[30] 阮泓越, 宛煜嵩, 贺辉群, 等. 14 个SNP DNA 标记在猪个体识别和溯源中的应用研究[J]. 农业生物技术学报, 2010, 18(6)∶ 1129-1133.DOI∶10.3969/j.issn.1674-7968.2010.06.015.
[31] 胡肄农, 丁潜, 纪红军, 等. 邢光东苏钟猪个体身份SNP识别的数字条形码编制[J]. 江苏农业学报, 2014, 30(4)∶ 779-783.
Development and Application of Pork Traceability System Based on SNP Markers
WU Xiao, LÜ Beibei, WANG Jinbin, JIANG Wei, LI Peng, WU Guogan, TANG Xueming*
(Biotechnology Research Institute, Shanghai Academy of Agricultural Sciences, Shanghai 201106, China)
Abstract:DNA traceability technology is based on DNA sequence differences between individuals for individual identification and the tracing of meat back to an individual animal. Establishing a DNA-based traceability system is important for the safety and quality of meat products. The genetic diversity of 33 new single nucleotide polymorphism (SNP)markers was detected in a test group (233 individuals, 10 varieties) and 6 SNP markers, which are useful for pork product traceability, were obtained by heterozygosity calculation. A total of 18 SNP markers (6 new SNP markers in combination with 12 SNP markers) could effectively distinguish between 100 individuals collected from a local slaughter house in traceability simulation experiments. The corresponding individuals for tissue samples from 10 random individuals were found by genotype. This study has shown that SNP markers could be used for individual identification and pork traceability.
Key words:pork traceability; DNA traceability technology; SNP markers; individual identification
DOI:10.7506/spkx1002-6630-201724045
中图分类号:Q819
文献标志码:A
文章编号:1002-6630(2017)24-0278-05
引文格式:
吴潇, 吕贝贝, 王金斌, 等. SNP标记用于猪肉产品DNA溯源[J]. 食品科学, 2017, 38(24)∶ 278-282. DOI∶10.7506/spkx1002-6630-201724045. http∶//www.spkx.net.cn
WU Xiao, LÜ Beibei, WANG Jinbin, et al. Development and application of pork traceability system based on SNP markers[J]. Food Science, 2017, 38(24)∶ 278-282. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724045. http∶//www.spkx.net.cn
收稿日期:2016-10-20
基金项目:闵行区产学研合作计划项目(2016MH256)
作者简介:吴潇(1978—),女,副研究员,博士,研究方向为食品安全。E-mail:qwuxiao@126.com
*通信作者:唐雪明(1970—),男,研究员,博士,研究方向为食品安全。E-mail:xueming70@foxmail.com




