
图1 N-Cs(A)和N-Cs-Au(B)的扫描电镜图
Fig. 1 SEM images of N-Cs (A) and N-Cs-Au (B)
金华丽,姜海洋*
(河南工业大学粮油食品学院,河南 郑州 450001)
摘 要:以氮掺杂碳球(nitrogen doped carbon spheres,N-Cs)为基质,制备新型的氮掺杂碳球生长金纳米复合材料(N-Cs-Au),采用交联法制备新型的基于N-Cs-Au修饰玻碳电极(glassy carbon electrode,GCE)的乙酰胆碱酯酶(acetylcholinesterase,AChE)生物传感器(AChE/N-Cs-Au/GCE)并用于菠菜中克百威的定量分析。结果表明:N-Cs-Au具有较好的导电性和电催化活性,能够有效地促进电子转移,提高AChE/N-Cs-Au/GCE的灵敏度。利用AChE/N-Cs-Au/GCE对菠菜中的克百威进行检测分析,克百威质量浓度的负对数与其对AChE/N-Cs-Au/GCE的抑制率在2.3×10-10~2.3×10-5g/L的线性范围内呈良好的线性关系,线性方程为Y/%=-8.246 7X+93.867 6(X为克百威质量浓度的负对数),R2为0.992 9,按抑制率10%计算,检出限为6.763 9×10-11g/L,用AChE/N-Cs-Au/GCE对菠菜中的克百威进行检测分析,样品回收率在91.417 7%~95.859 7%之间,精密度较高,符合实验要求,且该传感器对常见的重金属Pb、Cu、Cd和Mn有较好的抗干扰能力,为食品中克百威的检测提供了一种新方法。
关键词:克百威;氮掺杂碳球生长;传感器;检测
克百威,别名呋喃丹,化学名称为2,3-二氢-2,2-二甲基-7-苯并呋喃基甲氨基甲酸酯,分子式为C12H15NO3是一种常用的高效氨基甲酸酯类杀虫剂和杀螨剂[1]。克百威由于具有广谱性、触杀、胃毒等作用被广泛应用于棉花、甘蔗、茶树、稻、玉米、马铃薯、花生、谷物、香蕉等80多种作物害虫的防治。克百威可以和人体内的胆碱酯酶发生不可逆的结合[2],因此毒性很高,而且在土壤中、昆虫以及捕食昆虫的鸟类、家禽等体内残效期较长,其在土壤中的半衰期一般为30~60 d,极易造成二次中毒[3]。近些年来,由于克百威农药过度以及不合理的使用对人们的饮食安全和生态环境造成了严重的威胁[4],因此研究一种方便、快捷的检测方法对食品中的克百威进行现场快速、有效地检测分析具有重要的意义。
目前,关于克百威检测的传统方法有气相色谱法、高效液相色谱法、质谱法等。这些方法虽然具有灵敏度、精密度高,准确度好等优点,但其操作复杂,仪器价格昂贵而且需要专业人员操作[5-8],因此不适合对克百威农药现场、快速地检测分析。基于酶传感器的电化学分析法由于具有操作简单、方便、快捷等优点,因此,在对克百威现场快速筛查等方面存在较大的应用潜力[9],是对克百威进行快速检测的理想方法之一。
氮掺杂碳球(nitrogen doped carbon spheres,N-Cs)纳米复合材料,由于碳球具有较大的比表面积,因此,为酶的附着提供了较好的结合位点,有利于酶促反应的进行[10-13],同时纳米金的引入进一步提高了N-Cs的导电性。目前,虽然关于N-Cs纳米复合材料已有报道,但关于N-Cs生长金纳米复合材料的报道鲜见发表。因此,本实验以N-Cs-Au为基质,制备酶传感器来对克百威进行快速、有效的定量分析。
1.1 材料与试剂
菠菜购自郑州市高新区丹尼斯便利店;氯化乙酰胆碱(acetylcholine chloride,ATCl)、C3389型乙酰胆碱酯酶(acetylcholinesterase,AChE,236 U/mg) 美国Sigma公司;克百威 中国食品药品检定研究院;氯化钾洛阳昊化化学试剂有限公司;亚铁氰化钾 天津市光复精细化工研究所;铁氰化钾 洛阳市化学试剂厂;实验中所用到的试剂均为分析纯。
1.2 仪器与设备
CHI-660E电化学工作站 上海辰华仪器有限公司;JSM-7001F场发射扫描电子显微镜 日本JEOL公司;KQ-100E型超声波清洗器 昆山市超声仪器有限公司;S25-2型恒温磁力搅拌器 上海司乐仪器有限公司;ATY224型电子分析天平 岛津国际贸易(上海)有限公司;移液枪 赛默飞世尔(上海)仪器有限公司。
1.3 方法
1.3.1 N-Cs-Au的制备
N-Cs纳米材料参考文献[14]制备。准确称取N-Cs纳米材料0.010 3 g于50 mL的具塞锥形瓶中,加入20.00 mL超纯水,超声分散2~3 h,使其分散均匀。在剧烈搅拌条件下,向N-Cs分散液中加入0.60 mL 1 g/100 mL的HAuCl4和0.20 mL 0.20 mol/L的K2CO3溶液,然后再迅速加入新鲜配制的0.04 mol/L的NaBH4溶液0.40 mL,重复滴加3~5 次,继续搅拌5 min,即得纳米金颗粒。
将上述悬浊液静置,除去上清液,用超纯水洗涤3 次,然后再稀释到20.00 mL,在磁力搅拌条件下再加入0.10 mL 1 g/100 mL的HAuCl4和0.5 mL 0.04 mol/L的NH2OH·HCl溶液,继续搅拌20 min,即得N-Cs-Au,然后于10 000 r/min、室温条件下离心5 次,每次10 min,用超纯水对离心产物洗涤3~5次,60 ℃条件下干燥,备用。
1.3.2 传感器的制备
将玻碳电极(glassy carbon electrode,GCE)用1 000 目砂纸打磨后,分别用0.3 μm和0.05 μm的氧化铝粉抛光至镜面,然后依次用无水乙醇、二次蒸馏水进行超声清洗3 次,每次3~5 min,在常温条件下让其自然干燥,备用[15-17]。用10 μL移液枪吸取4.0 μL的1.0 mg/mL的N-Cs-Au修饰液滴于GCE表面,然后用烧杯罩在上面(防止其被污染),常温自然干燥,即得N-Cs-Au/GCE。然后再取1.0 μL 0.5 g/100 mL的壳聚糖溶液和2.0 μL 0.1 U/μL AChE以及1.0 μL 1 g/100 mL牛血清蛋白混合均匀,取其混合液滴加在N-Cs-Au/GCE电极表面,室温条件下干燥,即得AChE/N-Cs-Au/GCE生物传感器[18-20]。
1.3.3 样品处理和测定
选用菠菜作为实际样品对克百威进行加标实验。准确称取菠菜10.000 0 g,用捣碎机捣碎混匀,然后转移至洁净的表面皿中并用微量注射器吸取100 μL 5.103 5×10-3g/L克百威标准溶液,均匀喷撒在准备好的样品上,盖上保鲜膜,在4 ℃冰箱中放置1 h,然后用丙酮萃取过滤并转移至100 mL容量瓶中定容,取一定量的上述溶液于5 mL磷酸盐缓冲溶液(phosphate buffer saline,PBS)中分别制备5.103 5×10-6、5.103 5×10-7g/L和5.103 5×10-8g/L克百威溶液,对其进行定量分析。
2.1 不同材料的形貌表征
由图1A可知,制备好的N-Cs纳米复合材料呈球形,且表面无任何物质存在;由图1B可知,经生长过金的N-Cs纳米复合材料表面被负载了一层颗粒状的物质,且相对均匀,这说明金纳米颗粒已经很好地被负载到了N-Cs表面。

图1 N-Cs(A)和N-Cs-Au(B)的扫描电镜图
Fig. 1 SEM images of N-Cs (A) and N-Cs-Au (B)
2.2 电极的电化学表征
在10 mmol/L的[Fe(CN)6]3-溶液(含0.1 mol/L KCl)中分别对GCE、N-Cs-Au/GCE和AChE/N-Cs-Au/GCE进行交流阻抗分析,结果见图2。
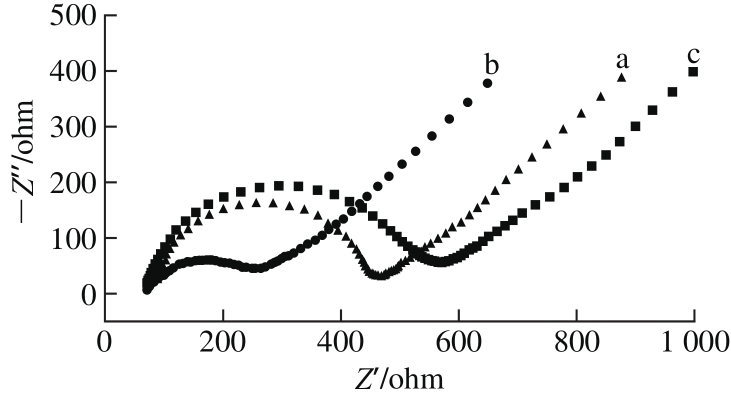
图2 GCE(a)、N-Cs-Au/GCE(b)、AChE/N-Cs-Au/GCE(c)在10 mmol/L的[Fe(CN)6]3-(含0.1 mol/L KCl)溶液中的交流阻抗图谱
Fig. 2 Electrochemical impedance spectra of GCE (a), N-Cs-Au/GCE (b)and AChE/N-Cs-Au/GCE (c) in 10 mmol/L [Fe(CN)6]3-containing 0.1 mol/L KCl
由图2可知,GCE电阻为375.5 Ω,N-Cs-Au/GCE电阻为195.5 Ω,与GCE相比电阻降低了47.94%,这说明N-Cs表面生长金以后,能够有效提高电子的转移速率,减小电极表面的阻抗,增加电极的导电性;当滴加上AChE以后电阻增大到481.3 Ω,与N-Cs-Au/GCE相比电阻增大了146.19%,这是因为AChE是不导电的生物大分子,阻碍了电子的传递,从而增加了电极表面的电阻,这同时也说明AChE已经很好地被固定到电极表面[21]。
2.3 ATCl在不同电极上的电化学行为
以pH 7.5的PBS(0.1 mol/L)为支持电解质,分别用AChE/GCE和AChE/N-Cs-Au/GCE对1 mmol/L的ATCl溶液进行差分脉冲扫描,其结果如图3所示。
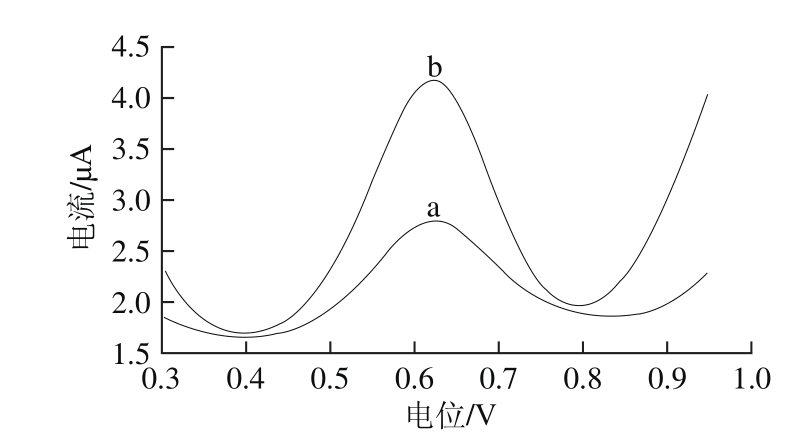
图3 AChE/GCE(a)和AChE/N-Cs-Au/GCE(b)在1.0 mmol/L的ATCl溶液中的差分脉冲曲线
Fig. 3 Differential pulse voltammetry curves of AChE/GCE (a) and AChE/N-Cs-Au/GCE (b) in 1.0 mmol/L ATCl
由图3可知,AChE/GCE的氧化峰电流为1.033 μA,AChE/N-Cs-Au/GCE氧化峰电流为2.329 μA,与AChE/GCE相比氧化峰电流增加了1.254 6 倍,这说明AChE/N-Cs-Au/GCE具有较高的电催化活性,N-Cs-Au能够有效地降低电极表面的阻抗,促进电子地转移速率,提高传感器的灵敏度。
2.4 不同交联剂的选择
分别以1 μL 0.5g/100 mL戊二醛和0.5 g/100 mL壳聚糖为交联剂,制备AChE/N-Cs-Au/GCE生物传感器,对1 mmol/L的ATCl进行差分脉冲扫描,其结果如图4所示。
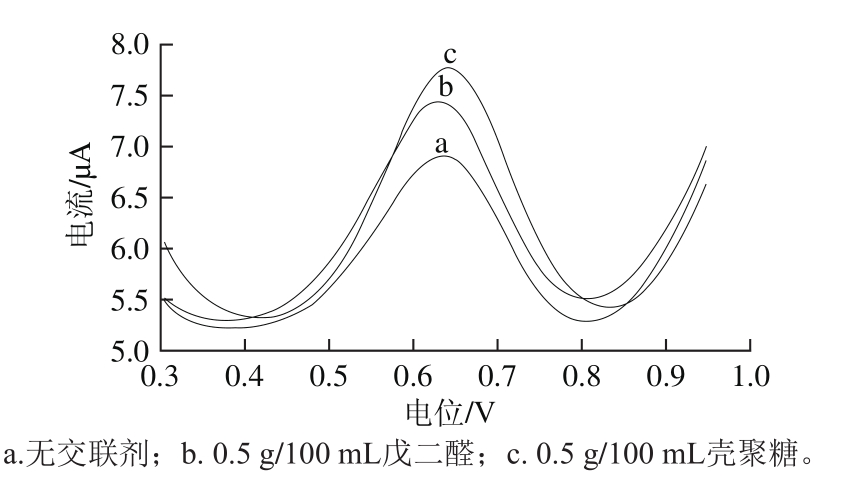
图4 不同交联剂条件下的差分脉冲曲线
Fig. 4 Differential pulse voltammetry curves of sensors made with different crosslinking agents
由图4可知,不用交联剂制备的生物传感器测得的氧化峰电流为1.625 μA;以0.5 g/100 mL戊二醛为交联剂制备的生物传感器测得的氧化峰电流为2.014 μA,与不用交联剂制备的生物传感器相比氧化峰电流提高了23.94%,这说明戊二醛能够起到很好的交联作用,防止酶分子从电极表面脱落,增加电极表面的响应信号。以0.5 g/100 mL壳聚糖为交联剂制备的生物传感器测得的氧化峰电流为2.392 μA,与以0.5 g/100 mL的戊二醛为交联剂制备的生物传感器测得的氧化峰电流相比提高了18.77%,这是因为戊二醛虽然能够对酶起到很好的交联作用,但其有一定的毒性,抑制了酶分子的活性[22],而壳聚糖是天然的生物分子,无毒,具有较好的成膜特性,不仅能够对酶分子起到很好的交联作用,还能够防止酶分子的聚集,因此具有较好的交联效果,能够有效促进酶促反应的进行,增加响应信号[23]。因此,本实验选取0.5 g/100 mL壳聚糖为交联剂制备的生物传感器。
2.5 修饰量的选择
以pH 7.5的PBS(0.1 mol/L)为支持电解质,分别以2.0、3.0、4.0、5.0、6.0 μL和7.0 μL的N-Cs-Au修饰GCE制备AChE/N-Cs-Au/GCE传感器,对1.00 mmol/L的ATCl进行差分脉冲扫描,其结果如图5所示。
由图5可知,随着N-Cs-Au修饰量的增加,AChE/N-Cs-Au/GCE传感器在1.00 mmol/L的ATCl中测得的氧化峰电流呈现先增加后减小的趋势,且当修饰量为4 μL时氧化峰电流达到最大为2.384 μA。这是因为当电极表面涂层过厚时会影响到反应物和生成物的传质过程,同时厚度的增大,也会增加电极表面的阻抗,阻碍电极表面电子的转移过程,致使电极响应变得迟缓,响应电流随之降低。因此,N-Cs-Au的修饰量选取4 μL。
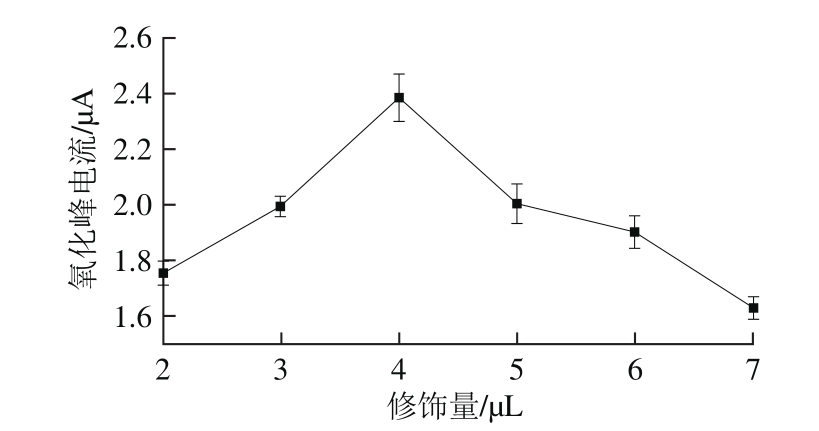
图5 N-Cs-Au修饰量对AChE/N-Cs-Au/GCE传感器的影响
Fig. 5 Effect of N-Cs-Au loading on the response of AChE/N-Cs-Au/GCE biosensor
2.6 pH值优化
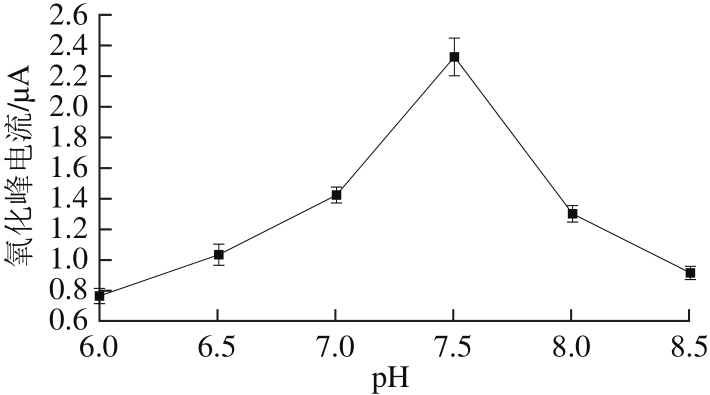
图6 pH值对AChE/N-Cs-Au/GCE传感器的影响
Fig. 6 Effect of pH on the response of AChE/N-Cs-Au/GCE biosensor
分别以pH6.0、6.5、7.0、7.5、8.0和8.5的PBS(0.1 mol/L)为支持电解质溶液,对1.00 mmol/L的ATCl进行差分脉冲扫描,其结果如图6所示。由图6可知,随着PBS pH值的升高,氧化峰电流呈现先增大后减小的趋势,且当pH 7.5时,氧化峰电流达到最大为2.328 μA,这是因为过强的酸碱性会对酶分子产生可逆或不可逆性的破坏,影响酶促反应的进行[24]。因此,本实验选取pH 7.5的PBS为支持电解质。
2.7 抑制时间的选择
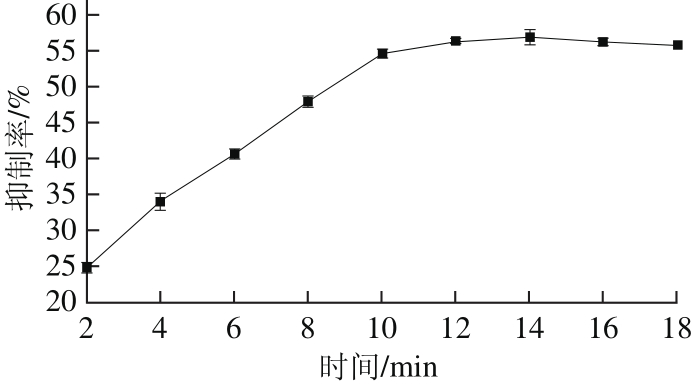
图7 克百威作用时间与抑制率之间的关系曲线
Fig. 7 Relationship between percentage inhibition and incubation time with carbofuran
将制备好的AChE/N-Cs-Au/GCE生物传感器置于1.00 mmol/L的ATCl溶液中,然后用2.3×10-5g/L的克百威对其进行抑制,记录不同抑制时间的氧化峰电流,根据抑制前后峰电流值的变化计算出其抑制率,其结果如图7所示。
由图7可知,当加入2.3×10-5g/L的克百威后,克百威对AChE的抑制作用随着时间的延长逐渐增大,且当抑制时间达到10 min后逐渐趋于平缓。因此克百威对AChE/N-Cs-Au/GCE生物传感器的抑制时间选取10 min。
2.8 克百威质量浓度与其抑制率间的关系
在最佳实验条件下分别用2.3×10-11~2.3×10-4g/L的克百威对AChE/N-Cs-Au/GCE进行抑制测定,其结果如图8所示。
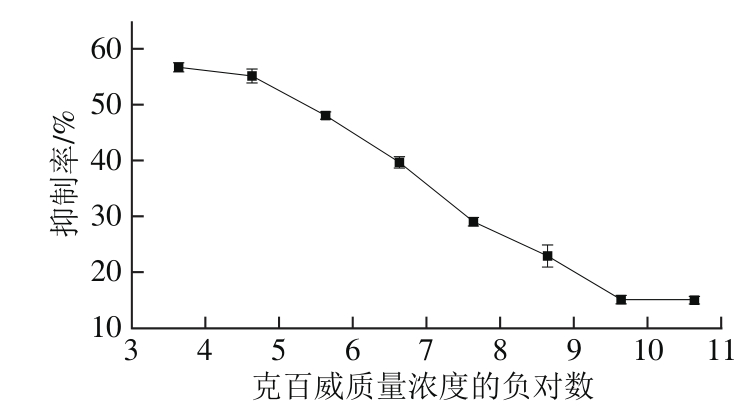
图8 克百威质量浓度与其抑制率间的关系曲线
Fig. 8 Relationship curve between percentage inhibition and carbofuran concentration
由图8可知,克百威质量浓度的负对数与其对AChE/N-Cs-Au/GCE的抑制率在2.3×10-10~2.3×10-5g/L的范围内呈良好的线性关系,线性范围较宽,按抑制率10%计算,检出限为6.763 9×10-11g/L,满足实验要求。与之前的文献报道[25-28]相比,本实验所构建的AChE/N-Cs-Au/GCE生物传感器明显优于其他生物传感器,结果如表1所示。
表1 AChE/N-Cs-Au/GCE生物传感器与其他传感器的结果比较
Table 1 Performance comparison of AChE/N-Cs-Au/GCE for carbofuran detection with other biosensors

2.9 实际样品的检测结果
对实际样品菠菜中的克百威进行检测,由建立的标准曲线计算出克百威的含量,平行测定3 次,做回收率实验,其结果如表2所示。
由表2可知,克百威加标回收率在91.417 7%~95.859 7%之间,精密度较高,符合实验要求,适用于实际样品中克百威的检测分析。
表2 菠菜中克百威的检测结果
Table 2 Detection of carbofuran in actual spinach samples

2.10 传感器的抗干扰分析
常见的重金属元素可能会影响到酶的活性,进而影响到传感器的稳定性,影响其灵敏度,因此本实验探讨了常见重金属Cr(50.00 mmol/L)、Pb(50.00 mmol/L)、Cu(50.00 mmol/L)、Cd(50.00 mmol/L)和Mn(50.00 mmol/L)[29-30]对传感器的影响,结果如图9所示。

图9 不同重金属对传感器的影响
Fig. 9 Effects of different heavy metals on the response of AChE/N-Cs-Au/GCE biosensor
由图9可知,加入重金属Pb、Cu、Cd和Mn后AChE/N-Cs-Au/GCE测得的氧化峰电流保持在空白电流的91.65%~103.68%之间,这说明Pb、Cu、Cd和Mn对传感器的干扰较小;当加入重金属Cr后电流值为原来的79.27%,降低了20.73%,这说明AChE/N-Cs-Au/GCE生物传感器对Cr的抗干扰能力较差。
在N-Cs的基础上制备了N-Cs-Au纳米复合材料,采用交联法制备了新型的AChE/N-Cs-Au/GCE传感器并用于菠菜中克百威的定量分析。结果表明:N-Cs-Au具有较好的导电性和电催化活性,能够有效地促进电子的转移,提高AChE/N-Cs-Au/GCE传感器的灵敏度。利用AChE/N-Cs-Au/GCE传感器对菠菜中的克百威进行检测分析,样品回收率在91.417 7%~95.859 7%之间,精密度较高,符合实验要求,且该传感器对常见的重金属Pb、Cu、Cd和Mn有较好的抗干扰能力,稳定性较好,适用于克百威的现场检测分析。
参考文献:
[1] SAMPHAO A, SUEBSANOH P, WONGS Y, et al. Alkaline phosphatase inhibition-based amperometric biosensor for the detection of carbofuran[J]. International Journal of Electrochemical Science,2013, 8(3): 3254-3264.
[2] DOUNINA V, ANTHONY J, HOLGER S V, et al. Disposable electrochemical printed gold chips for the analysis of acetylcholinesterase inhibition[J]. Analytica Chimica Acta, 2010,669(1/2): 63-67. DOI:10.1016/j.aca.2010.04.037.
[3] 刘丽. 固定化漆酶降解克百威与毒死蜱的研究[D]. 沈阳: 沈阳工业大学, 2015: 13.
[4] YANG L, WANG G C, LIU Y J, et al. Development of a biosensor based on immobilization of acetylcholinesterase on NiO nanoparticlescarboxylic graphene-nafion modified electrode for detection of pesticides[J]. Talanta, 2013, 113(113C): 135-141. DOI:10.1016/j.talanta.2013.03.025.
[5] WANG X D, YANG Y Y, DONG J, et al. Lanthanum-functionalized gold nanoparticles for coordination-bonding recognition and colorimetric detection of methyl parathion with high sensitivity[J].Sensors and Actuators B Chemical, 2014, 204∶ 119-214. DOI∶10.1016/j.snb.2014.07.093.
[6] SUN X, DU S Y, WANG X Y. Amperometric immunosensor for carbofuran detection based on gold nanoparticles and PB-MWCNTs-CTS composite film[J]. European Food Research and Technology,2012, 235(3)∶ 469-477. DOI∶10.1007/s00217-012-1774-z.
[7] JEYAPRAGASAM T, SARASWATHI R. Electrochemical biosensing of carbofuran based on acetylcholinesterase immobilized onto iron oxide-chitosan nanocomposite[J]. Sensors and Actuators B Chemical,2014, 191(6/7): 681-687. DOI:10.1016/j.snb.2013.10.054.
[8] TAN X C, HU Q, WU J W, et al. Electrochemical sensor based on molecularly imprinted polymer reduced graphene oxide and gold nanoparticles modified electrode for detection of carbofuran[J].Sensors and Actuators B Chemical, 2015, 220: 216-221. DOI:10.1016/j.snb.2015.05.048.
[9] WANG G C, TAN X C, ZHOU Q. Synthesis of highly dispersed zinc oxide nanoparticles on carboxylic graphene for development a sensitive acetylcholinesterase biosensor[J]. Sensors and Actuators B Chemical, 2014, 190(1): 730-736. DOI:10.1016/j.snb.2013.09.042.
[10] YU Y Y, GUO C X, YONG Y C. Nitrogen doped carbon nanoparticles enhanced extracellular electron transfer for high-performance microbial fuel cells anode[J]. Chemosphere, 2015, 140: 26-33.DOI:10.1016/j.chemosphere.2014.09.070.
[11] GONG K P, DU F, XIA Z H, et al. Nitrogen-doped carbon nanotube arrays with high electrocatalytic activity for oxygen reduction[J].Science, 2009, 323: 760-764. DOI:10.1126/science.1168049.
[12] ZAHOOR A, CHRISTY M, HWANG Y J, et al. Improved electrocatalytic activity of carbon materials by nitrogen doping[J].Applied Catalysis B: Environmental, 2014, 147(5): 633-641.DOI:10.1016/j.apcatb.2013.09.043.
[13] SOARES O, ROCHA R, GONCALVES A G, et al. Easy method to prepare N-doped carbon nanotubes by ball milling[J]. Carbon, 2015,91: 114-121. DOI:10.1016/j.carbon.2015.04.050.
[14] 李晓伟. 基于氮掺杂碳球的电化学传感器对铅,镉的检测研究[D].郑州: 河南工业大学, 2016: 13.
[15] LEE P M, WANG Z M, LIU X X, et al. Glassy carbon electrode modified by graphene-gold nanocomposite coating for detection of trace lead ions in acetate buffer solution[J]. Thin Solid Films, 2015,584: 85-89. DOI:10.1016/j.tsf.2015.03.017.
[16] CHEN T, TIAN L L, CHEN Y, et al. A facile one-pot synthesis of Au/Cu2O nanocomposites for nonenzymatic detection of hydrogen peroxide[J]. Nanoscale Research Letters, 2015, 10(1): 252-259.DOI:10.1186/s11671-015-0935-y.
[17] MINH P, NGOC B. Electrochemical analysis of parathion-ethyl using zirconium oxide-laponite nanocomposites-modified glassy carbon electrode[J]. Journal of Applied Electrochemistry, 2015, 45(4): 365-373. DOI:10.1007/s10800-015-0789-0.
[18] WEI M, WANG J J. A novel acetylcholinesterase biosensor based on ionic liquids-AuNPs-porous carbon composite matrix for detection of organophosphate pesticides[J]. Sensors and Actuators B Chemical,2015, 211: 291-296. DOI:10.1016/j.snb.2015.01.112.
[19] HUO D Q, LI Q, ZHANG Y C, et al. A highly efficient organophosphorus pesticides sensor based on CuO nanowires-SWCNTs hybrid nanocomposite[J]. Sensors and Actuators B:Chemistry, 2014, 199(4): 410-417. DOI:10.1016/j.snb.2014.04.016.
[20] ZHAI C, GUO Y M, SUN X, et al. An acetylcholinesterase biosensor based on graphene-gold nanocomposite and calcined layered double hydroxide[J]. Enzyme and Microbial Technology, 2014, 58/59: 8-13.DOI:10.1016/j.enzmictec.2014.02.004.
[21] WEI M, WANG J J, GUO J X, et al. Nanoparticles-polyanilinemultiwalled carbon nanotubes for determination of organophosphate pesticides[J]. Asian Journal of Chemistry, 2014, 26(15): 4679-4683.
[22] 曾高英. 基于纳米金复合材料传感器的有机磷农药检测研究[D].郑州: 河南工业大学, 2013: 32-34.
[23] YANG L, WANG G C, LIU Y J. An acetylcholinesterase biosensor based on platinum nanoparticles-carboxylic graphene-nafion-modified electrode for detection of pesticides[J]. Analytical Biochemistry, 2013,437(2): 144-149. DOI:10.1016/j.ab.2013.03.004.
[24] ZHU W X, LIN W, LI T B, et al. Facile green synthesis of grapheme-Au nanorod nanoassembly for on-line extraction and sensitive stripping analysis of methyl parathion[J]. Electrochimica Acta, 2014,146: 419-428. DOI:10.1016/j.electacta.2014.09.085.
[25] SUN X, ZHU Y, WANG X Y. Amperometric immunosensor based on deposited gold nanocrystals/4,4ʹ-thiobisbenzenethiol for determination of carbofuran[J]. Food Control, 2012, 28(1): 184-191. DOI:10.1016/j.foodcont.2012.04.027.
[26] DONG J, LIU T, MENG X M, et al. Amperometric biosensor based on immobilization of acetylcholinesterase via specific binding on biocompatible boronic acid-functionalized Fe@Au magnetic nanoparticles[J]. Journal of Solid State Electrochemistry, 2012, 16(12):3783-3790. DOI:10.1007/s10008-012-1812-6.
[27] YANG L, WANG G C, LIU Y J, et al. Development of a stable biosensor based on a SiO2nanosheet-Nafion-modified glassy carbon electrode for sensitive detection of pesticides[J]. Analytical and Bioanalytical Chemistry, 2013, 405(8): 2545-2552. DOI:10.1007/s00216-012-6634-y.
[28] YIN H S, AI S Y, XU J, et al. Amperometric biosensor based on immobilized acetylcholinesterase on gold nanoparticles and silk fibroin modified platinum electrode for detection of methyl paraoxon,carbofuran and phoxim[J]. Journal of Electroanalytical Chemistry,2009, 637(1/2): 21-27. DOI:10.1016/j.jelechem.2009.09.025.
[29] ZHOU Q, YANG L, WANG G C, et al. Acetylcholinesterase biosensor based on SnO2nanoparticles-carboxylic grapheme-nafion modified electrode for detection of pesticides[J]. Biosensors and Bioelectronics,2013, 49(2): 25-31. DOI:10.1016/j.bios.2013.04.037.
[30] CHAUHAN N, PUNDIR C S. An amperometric biosensor based on acetylcholinesterase immobilized onto iron oxide nanoparticles/multiwalled carbon nanotubes modified gold electrode for measurement of organophosphorus insecticides[J]. Analytica Chimica Acta, 2011,701(1): 66-74. DOI:10.1016/j.aca.2011.06.014.
Development of Acetylcholinesterase Biosensor for Detection of Carbofuran in Vegetables Based on Nitrogen-Doped Carbon Sphere-Gold Nanoparticles Composite Modified Electrode
JIN Huali, JIANG Haiyang*
(College of Grain and Oil, Henan University of Technology, Zhengzhou 450001, China)
Abstract:An acetylcholinesterase (AChE) biosensor was prepared by cross-linking AChE and bovine serum albumin(BSA) onto nitrogen doped carbon sphere-gold (N-Cs-Au) nanoparticles composite modified glassy carbon electrode(GCE) and used for detecting carbofuran in spinach. The results showed that N-Cs-Au had a good electrical conductivity and catalytic activity, effectively promoting electron transfer and consequently improving the sensitivity of AChE/N-Cs-Au/GCE. It was found that there was a good linear relationship between the negative common logarithm of carbofuran concentration (X) in the range from 2.3 × 10-10to 2.3 × 10-5g/L and the percentage inhibition of the peak current by carbofuran (Y) as indicated by the equation∶ Y/% = -8.246 7X + 93.867 6 (R2= 0.992 9). As calculated by 10% inhibition,the limit of detection (LOD) for carbofuran was 6.763 9 × 10-11g/L. The sensor showed recoveries of 91.417 7%–95.859 7%for carbofuran in spiked spinach and high precision, which could meet the analytical requirements. Moreover, the sensor was free from the interference of common heavy metals such as Pb, Cu, Cd and Mn and could provide a new method for detecting carbofuran in foods.
Key words:carbofuran; nitrogen doped-carbon spheres-gold nanoparticles; sensor; detection
DOI∶10.7506/spkx1002-6630-201724048
中图分类号:TS207.7
文献标志码:A
文章编号:1002-6630(2017)24-0296-06
引文格式:
金华丽, 姜海洋. 基于氮掺杂碳球生长金的酶传感器检测蔬菜中的克百威[J]. 食品科学, 2017, 38(24): 296-301.
DOI:10.7506/spkx1002-6630-201724048. http://www.spkx.net.cn
JIN Huali, JIANG Haiyang. Development of acetylcholinesterase biosensor for detection of carbofuran in vegetables based on nitrogen-doped carbon sphere-gold nanoparticles composite modified electrode[J]. Food Science, 2017, 38(24)∶ 296-301.(in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724048. http∶//www.spkx.net.cn
收稿日期:2016-11-25
作者简介:金华丽(1966—),女,教授,硕士,研究方向为食品工程与品质安全控制。E-mail:jinhuali66@163.com
*通信作者:姜海洋(1990—),男,硕士研究生,研究方向为食品工程与品质安全控制。E-mail:jianghaiyang523@163.com