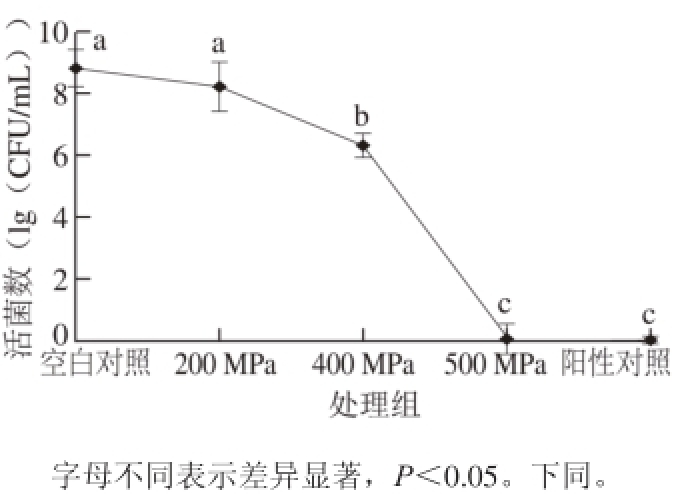
图1 不同压力处理大肠杆菌O157:H7培养计数结果
Fig. 1 Survival rates of E. coli O157:H7 cells exposed to different high hydrostatic pressures
孔晓雪1,付 勇1,姬赛赛1,江 芸1,*,张志国2,*
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.齐鲁工业大学食品科学与工程学院,山东 济南 250353)
摘 要:本研究旨在揭示超高压对食源性致病微生物大肠杆菌O157:H7细胞膜的损伤。研究了200、400、500 MPa不同压力对大肠杆菌O157:H7的灭活作用,通过对菌体细胞核酸类物质、钾离子和镁离子泄漏量、碘化丙啶(propidium iodide,PI)摄入量、细胞膜Na+/K+-ATP酶和Ca2+/Mg2+-ATP酶活性变化的分析研究,评价不同超高压处理压力对大肠杆菌O157:H7膜损伤效应。结果表明,经200、400 MPa压力处理5 min后,大肠杆菌O157:H7菌落总数由初始8.8(lg(CFU/mL))分别下降至8.2(lg(CFU/mL))和6.3(lg(CFU/mL)),500 MPa压力处理后,大肠杆菌O157:H7全部死亡。压力升高,细菌细胞内核酸类物质、K+、Mg2+离子泄漏量、PI摄入量均显著增加,细胞膜上Na+/K+-ATP酶和Ca2+/Mg2+-ATP酶活性显著降低。Ca2+/Mg2+-ATP酶对压力的敏感性更强,500 MPa处理组该酶活性几乎完全丧失。超高压处理引起大肠杆菌O157:H7细胞膜产生显著损伤,细胞膜上Ca2+/Mg2+-ATP酶的失活是导致大肠杆菌O157:H7死亡的主要原因。
关键词:超高压;大肠杆菌O157:H7;细胞膜
超高压作为一项新型非热加工技术,在食品加工和贮藏领域中的应用日趋广泛[1-4]。相较于传统热加工处理方式,超高压在保持食品固有风味、质构、营养价值、色泽、新鲜程度等方面具有明显优势[5-7]。超高压处理可有效抑制食品中的腐败菌及致病菌,如大肠杆菌O157:H7、单增李斯特菌、金黄色葡萄球菌、鼠伤寒沙门氏菌等[1-3]。研究表明,超高压杀菌机制主要与细菌细胞膜破坏、核酸结构变化、胞内蛋白质变性、关键酶活性降低等有关[8-11],Bernadette等[12]的研究认为,超高压处理后大肠杆菌的死亡与细菌细胞膜破坏导致胞内蛋白质泄漏有关,Chilton等[13]对超高压处理后微生物菌体细胞修复的研究也表明超高压影响细胞膜的完整性,多数研究认为,细胞膜的破坏是超高压造成微生物死亡最重要的原因之一[14-16]。超高压杀菌机理研究中所用的菌株包括腐败菌、致病菌甚至芽孢类,但针对大肠杆菌O157:H7,尤其是致病性大肠杆菌O157:H7的研究尚较少。
致病性大肠杆菌O157:H7是重要的食源性致病微生物,该菌致病性强、致死率高,引起全世界广泛重视[17]。目前超高压杀灭致病性大肠杆菌O157:H7的机制仍未完全阐明[18]。本实验以致病性大肠杆菌O157:H7 CICC21530菌株为对象,研究不同压力处理后细菌细胞内核酸类物质、K+、Mg2+泄漏情况,细胞膜完整性破坏以及细胞膜上关键酶的活力变化情况,以揭示超高压诱导细菌致死(损伤)的原因,为超高压技术更有效科学地控制该致病菌、保证食品安全提供理论依据。
1.1 材料与试剂
大肠杆菌O157:H7(CICC21530),其毒力基因为stx1、stx2、eae[19],保藏于中国工业微生物菌种保藏中心;胰酪胨大豆酵母浸膏琼脂(trypticase soy agar-yeast extract,TSA-YE)、胰蛋白胨大豆肉汤(tryptic soy broth,TSB) 北京陆桥技术有限责任公司;氯化钠、磷酸二氢钠、磷酸氢二钠(均为分析纯),甲醇、甲醇钠、氯仿、正己烷、三氟化硼(均为色谱纯) 南京化学试剂有限公司;240 mm×190 mm聚乙烯耐高压包装袋南京圣比澳生物科技有限公司;考马斯亮蓝染色液、钾离子测定试剂盒、镁离子测定试剂盒、超微量Na+/K+-ATPase测定试剂盒、超微量Ca2+/Mg2+-ATPase测定试剂盒 南京建成生物工程研究所;碘化丙啶(propidium iodide,PI) 美国Sigma公司。
1.2 仪器与设备
S-FL-100-850-9-W型超高压处理设备 英国SFT公司;V-5100可见分光光度计 上海元析仪器有限公司;970CRT荧光分光光度计 上海精密科学仪器有限公司;QL-200微型涡旋混合仪 海门其林贝尔仪器有限公司;FR-300手压式塑料薄膜袋封口机 特力包装机械有限公司;2-16KL型高速冷冻离心机 美国Sigma公司;GL-ZZM型高速冷冻离心机 赛特湘仪离心机仪器有限公司;WGZ-2XJ细菌浊度计 上海昕瑞仪器仪表有限公司;ZQTY-70型台式振荡培养箱 上海知楚仪器有限公司;DHP-9052型电热恒温培养箱 上海一恒科技有限公司;SZX型超净工作台 上海浦东跃欣仪器厂。
1.3 方法
1.3.1 菌悬液制备
大肠杆菌O157:H7单菌落接种于10 mL新鲜TSB中,37 ℃、150 r/min振荡培养24 h,吸取上述活化的菌悬液1 mL接种于50 mL新鲜TSB中,37 ℃、150 r/min振荡培养18 h。该培养液8 000×g、4 ℃离心5 min,弃去上清液,用灭菌pH 7.0 PBS缓冲液洗涤菌体3 次,用细菌浊度计调整浊度,再稀释菌悬液浓度至108~109CFU/mL。无菌聚乙烯耐高压包装袋热封包装,不留顶隙,置于冰上保存。
1.3.2 超高压处理
菌悬液样品分别采用200、400、500 MPa,25 ℃超高压处理5 min(加压处理时间不包括升、卸压所用时间),处理介质为水。超高压处理后的样品立即于冰上保存。未经超高压处理样品作为空白对照组,沸水浴15 min的样品作阳性对照组,5 组样品每组设3 个重复样进行处理。
1.3.3 活菌计数
各组菌悬液样品选择合适的稀释度用TSA进行平板涂布,37 ℃培养48 h后计数。平板计数操作按照GB 4789.2—2010《食品微生物学检验 菌落总数测定》进行。
1.3.4 细菌细胞内核酸物质泄漏量的测定
超高压处理组、空白对照组以及阳性对照组的菌悬液样品,分别于8 000×g、4 ℃离心5 min,取上清液1 mL于石英比色皿中,紫外分光光度计于260 nm波长处测定吸光度[20]。
1.3.5 细菌细胞内外K+、Mg2+离子泄漏量测定
取空白对照组与各超高压处理组的菌悬液样品在8 000×g、4 ℃离心10 min,取上清液采用试剂盒测定胞外K+、Mg2+质量浓度。沉淀用无菌生理盐水洗涤两次,悬浮稀释为106~107CFU/mL,超声破碎细胞(破碎条件:工作5 s,间歇15 s,共10 min,功率400 W),用试剂盒测定胞内K+、Mg2+质量浓度,每个样品做3 次平行。
1.3.6 超高压处理后细菌细胞PI摄取量的测定
PI溶于去离子水,配成1 mg/mL的贮备液,于4 ℃条件下暗处贮存。菌悬液在8 000×g、4 ℃离心10 min,弃上清液,沉淀用无菌生理盐水悬浮稀释为106CFU/mL。
超高压处理前PI染色组:取5 组菌悬液每组10 mL各加入PI贮备液0.5 mL,分别经200、400、500 MPa超高压处理,同时做空白对照组与阳性对照组,空白对照组不做任何处理直接加入PI贮备液,阳性对照组加入PI贮备液后沸水浴15 min,每组设3 个平行。
超高压处理后PI染色组:取5组菌悬液每组10 mL,分别经200、400、500 MPa超高压处理,超高压处理后加入PI贮备液0.5 mL,空白对照组不做任何处理直接加入PI贮备液,阳性对照组沸水浴15 min后加入PI贮备液,每组设3 个平行。
所有染色组均于37 ℃暗处孵化15 min,8 000×g、4 ℃离心10 min,弃上清液,沉淀用无菌生理盐水洗涤2 次,用荧光分光光度计测定吸光度,激发光波长485 nm,发射光波长625 nm,狭缝宽度10 nm,生理盐水作为空白对照。
1.3.7 细胞膜Na+/K+-ATP酶和Ca2+/Mg2+-ATP酶活性测定
取空白对照组与各超高压处理组的菌悬液样品在8 000×g、4 ℃离心10 min,弃上清液,沉淀用无菌生理盐水悬浮稀释为106~107CFU/mL,超声破碎细胞(破碎条件:工作5 s,间歇15 s,共10 min,功率400 W)。采用考马斯亮蓝法测定蛋白质含量,以牛血清蛋白作为标准品。用试剂盒测定Na+/K+-ATP酶、Ca2+/Mg2+-ATP酶活性,每个样品做3 次平行。
1.4 统计分析
采用SPSS V17.0进行数据处理和统计分析,采用ANOVA进行单因素方差分析及Duncans多重比较检验(P<0.05),并用Excel进行图形制作。
2.1 活菌计数结果

图1 不同压力处理大肠杆菌O157:H7培养计数结果
Fig. 1 Survival rates of E. coli O157:H7 cells exposed to different high hydrostatic pressures
平板计数结果表明,空白对照组(未经超高压处理)大肠杆菌O157:H7菌落总数为8.8(lg(CFU/mL)),经200 MPa压力处理后菌落总数下降至8.2(lg(CFU/mL)),与空白对照组相比没有显著性差异(P>0.05);经4 0 0 M P a压力处理后菌落总数对数值下降至6.3(lg(CFU/mL)),与空白对照组相比具有显著性差异(P<0.05),经500 MPa压力处理后大肠杆菌O157:H7全部死亡。随着压力增大,大肠杆菌O157:H7死亡率增加,500 MPa压力处理导致大肠杆菌O157:H7全部死亡。
2.2 核酸类物质泄漏量的变化

图2 超高压处理大肠杆菌O157:H7紫外吸收物质泄漏量
Fig. 2 Leakage of intracellular UV-absorbing substances from E. coli O157:H7 after HPP treatment
核酸中含有共轭双键结构的嘌呤、嘧啶碱基,所以在紫外光区有强烈的光吸收作用,核酸最大吸收峰在260 nm左右,故可通过测定260 nm波长处紫外吸光度来反映核酸类物质泄漏情况[21]。由图2可知,沸水浴15 min处理对细菌细胞膜的破坏作用非常显著,阳性对照组核酸类物质泄漏量为100%。超高压处理组随着处理压力的升高,菌体上清液中核酸类物质的含量显著增加,表明细胞膜通透性逐渐增大。但500 MPa压力处理组核酸类物质泄漏量仅为58%,与阳性对照组相比差异显著,表明经500 MPa压力处理后细菌细胞膜没有被完全破坏。
2.3 超高压处理后细胞膜内外K+、Mg2+质量浓度变化
表1 超高压处理对大肠杆菌O157:H7细胞内外K+、Mg2+质量浓度的影响
Table 1 Effect of high hydrostatic pressure on the amounts of intracellular and extracellular K+and Mg2+
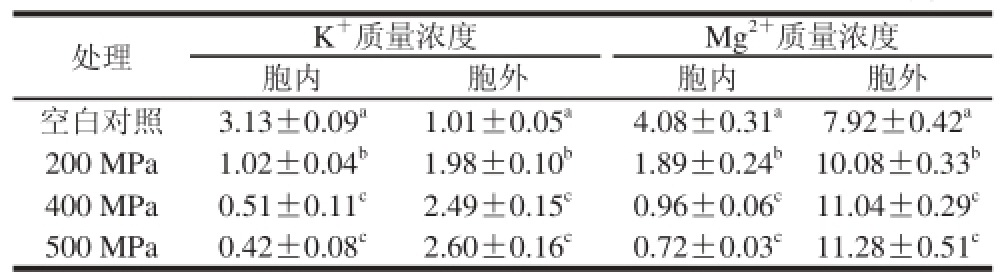
注:同列不同字母表示差异显著(P<0.05)。
K+和Mg2+是维持细胞渗透压平衡的重要无机盐离子,上清液中K+和Mg2+质量浓度可反映细胞膜通透性变化[22]。由表1可以看出,超高压引起大肠杆菌O157:H7胞内K+、Mg2+的泄漏,泄漏量随着压力升高显著增加,当压力超过400 MPa时,随压力升高K+、Mg2+泄漏量变化不显著。超高压处理引起细胞膜通透性增加,导致胞内大量无机盐离子外泄。这与高瑀珑等[23]研究结果一致。
2.4 超高压处理后细菌细胞PI摄取量变化
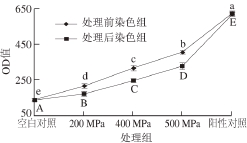
图3 大肠杆菌O157:H7细胞PI摄取量随着压力的变化
Fig. 3 Changes in PI uptake in E. coli O157:H7 before and after HPP treatment
PI是一种大分子荧光染料,几乎无法穿过完整的细胞膜,只有细胞膜被破坏,通透性发生改变,PI才能穿过细胞膜与核酸物质结合发出荧光[24],因此可以用细胞内PI的摄取量来判断细胞膜的完整性[25-26]。在超高压处理前对细胞进行PI染色可以测定超高压处理过程中细胞膜通透性的变化,在超高压处理后对细胞进行PI染色可以测定大肠杆菌O157:H7细胞膜损伤与修复的情况[27]。
在超高压处理前对细胞进行PI染色,OD值随着处理压力升高而增大,不同压力处理组之间有显著差异。如图3所示,未经超高压处理组OD值为140±9,显著低于各超高压处理组;阳性对照组OD值为621±13显著高于500 MPa处理组的OD值407±8。实验结果表明,超高压处理可以使细菌细胞膜完整性部分丧失。随着压力增加OD值显著增大,且超高压处理后染色组的OD值均低于超高压处理前染色组的OD值,而沸水浴处理前染色组与沸水浴处理后染色组OD值是相同的。结果表明大肠杆菌O157:H7对超高压造成的细胞膜损伤在撤去压力后能够部分修复;而沸水浴处理对大肠杆菌O157:H7细胞膜造成的损伤是不可修复的。与细菌死亡曲线对照,在500 MPa已检测不到活菌,表明超高压对大肠杆菌O157:H7细胞膜的损伤可能不是导致细菌死亡的主要原因。
2.5 超高压处理对大肠杆菌O157:H7 Na+/K+-ATP酶和Ca2+/Mg2+-ATP酶活性影响
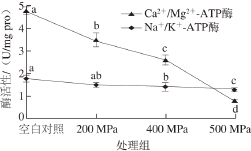
图4 超高压处理大肠杆菌O157:H7细胞膜关键酶活性变化
Fig. 4 Changes in key enzyme activities of Escherichia coli O157:H7 after high hydrostatic pressure treatment
由图4可知,随着压强升高,细胞膜Na+/K+-ATP酶与Ca2+/Mg2+-ATP酶活性显著降低,其中超高压对膜Ca2+/Mg2+-ATP酶活性的影响更大。未经超高压处理组大肠杆菌O157:H7 Na+/K+-ATP酶活性为(1.80±0.15)U/mg pro,当压力达到500 MPa时,酶活性下降至(1.28±0.09)U/mg pro,失活率为29%。未经超高压处理组大肠杆菌O157:H7 Ca2+/Mg2+-ATP酶活性为(4.80±0.40)U/mg pro,当压力达到500 MPa时,酶活性仅为(0.80±0.06)U/mg pro,失活率为83%。
本实验通过对细菌细胞膜通透性以及细胞膜上Na+/ K+-ATP酶与Ca2+/Mg2+-ATP酶活性等生理指标的检测,对超高压处理后大肠杆菌O157:H7的损伤情况进行探讨。结果表明超高压对大肠杆菌O157:H7具有较强的杀灭作用,在本研究条件下当静水压力达到500 MPa时,大肠杆菌O157:H7的存活数在检测限以下。
超高压处理引起细菌细胞膜完整性被破坏,膜通透性增大,导致无机盐离子和核酸类大分子物质泄漏出细胞外。200、400 MPa压力条件下胞外无机盐离子质量浓度显著增加,400 MPa处理组与500 MPa处理组之间胞外无机盐离子质量浓度无显著差异。随着处理压力升高,核酸类物质泄漏量增加,不同处理压力下有显著差异。当处理压力上升至500 MPa时,核酸类物质泄漏量为58%,此时已检测不到活菌,但与热致死处理组之间核酸类物质泄漏量仍有显著差异。
对大肠杆菌O157:H7在超高压处理前后分别用PI染色,进行荧光检测,结果表明随着压力增加超高压处理前后的染色组细胞的PI摄入量均显著增加,但与阳性对照组存在显著差异,说明超高压并不能像沸水浴处理那样使细菌细胞膜完整性破坏的彻底[28],同时超高压处理前染色与超高压处理后染色各组之间PI摄入量也均有显著差异,这表明超高压导致大肠杆菌O157:H7细胞膜完整性的破坏在压力撤除后有一部分是可以被修复的,这有可能是大肠杆菌O157:H7有较好耐压性的原因之一[29]。
超高压引起大肠杆菌O157:H7细胞膜破坏,导致胞内无机盐离子、核酸类大分子物质外泄,但这些与大肠杆菌O157:H7死亡曲线并不一致,表明细胞膜完整性的破坏与胞内物质的外泄并不是超高压杀灭大肠杆菌O157:H7的主要原因。这与高瑀珑[23]、陆海霞[27]等对单增李斯特菌的超高压致死机理的报道一致。
超高压处理降低了细胞膜Na+/K+-ATP酶与Ca2+/ Mg2+-ATP酶活性[30-31]。尤其是Ca2+/Mg2+-ATP酶对压力更为敏感,其失活趋势与大肠杆菌O157:H7死亡曲线基本一致。Ca2+/Mg2+-ATP酶是镶嵌在细胞膜脂质双层中的一种蛋白质,是一种重要载体,能催化ATP为细胞供能,驱动膜两侧Ca2+、Mg2+对向运动,调节细胞渗透压,提供营养成分吸收的动力,对大肠杆菌O157:H7细菌细胞物质运送、信息传递和能量转换等生理活动具有重要的意义[32]。Ca2+/Mg2+-ATP酶在500 MPa失活率达到83%,这很可能是导致大肠杆菌O157:H7致死的主要原因。
参考文献:
[1] OLMO A D, CALZADA J, NUÑEZ M. Effect of lactoferrin and its derivatives, high hydrostatic pressure, and their combinations, on Escherichia coli O157:H7 and Pseudomonas fluorescens in chicken fi lets[J]. Innovative Food Science and Emerging Technologies, 2012, 13: 51-56.
[2] HUANG Y X, YE M, CHEN H Q. Inactivation of Escherichia coli O157:H7 and Salmonella spp. in strawberry puree by high hydrostatic pressure with/without subsequent frozen storage[J]. International Journal of Food Microbiology, 2013, 160: 337-343.
[3] JOFRÉJ A, AYMERICH T, BOVER-CID S, et al. Inactivation and recovery of Listeria monocytogenes, Salmonella enterica and Staphylococcus aureus after high hydrostatic pressure treatments up to 900 MPa[J]. International Microbiology, 2010, 13: 105-112.
[4] 韩衍青. 应用超高压技术延长低温火腿的货架期[D]. 南京: 南京农业大学, 2011: 1-2.
[5] MATSER A M, KREBBERS B, BERG R W, et al. Advantages of high pressure sterilisation on quality of food products[J]. Trends in Food Science & Technology, 2004, 15(2): 79-85. DOI:10.1016/ j.tifs.2003.08.005.
[6] HUI L, YI C, XIAO J L, et al. Inactivation, morphology, interior structure and enzymatic activity of high pressure CO2-treated Saccharomyces cerevisiae[J]. Innovative Food Science and Emerging Techologies 2012, 14(6): 99-106. DOI:10.1016/j.ifset.2011.11.009.
[7] BUTZ P, EDENHARDER R, GARCÍA A F, et al. Changes in functional properties of vegetables induced by high pressure treatment[J]. Food Research International, 2002, 35(2): 295-300. DOI:10.1016/S0963-9969(01)00199-5.
[8] SHIGENOBU K, YASUKO M, KAZUTAKA Y. Use of mild-heat treatment following high-pressure processing to prevent recovery of pressure-injured Listeria monocytogenes in milk[J]. Food Microbiology, 2008, 25(2): 288-293. DOI:10.1016/j.fm.2007.10.009.
[9] MICHÈLE M, SONGMING Z, FADIA N, et al. High-pressure destruction kinetics of Clostridium sporogenes spores in ground beef at elevated temperatures[J]. International Journal of Food Microbiology, 2008, 126(4): 86-92. DOI:10.1016/j.ijfoodmicro.2008.05.009.
[10] CHUNG Y W, CHIAO P H, BINGHUEI B Y. The relationship between inactivation and morphological damage of Salmonella enterica treated by high hydrostatic pressure[J]. Food Research International, 2013, 54(8): 1482-1487. DOI:10.1016/j.foodres.2013.08.004.
[11] EDYTA M, ILONA K, MAGDALENA S. Changes in bacteria cells induced by high pressure at subzero temperature[J]. Systematic and Applied Microbiology, 2011, 34(3): 139-147. DOI:10.1016/ j.syapm.2010.09.007.
[12] BERNADETTE K, PILAR M, BERNARD M M. The relationship between membrane damage, release of protein and loss of viability in Escherichia coli exposed to high hydrostatic pressure[J]. International Journal of Food Microbiology, 2010, 137(4): 214-220. DOI:10.1016/ j.ijfoodmicro.2009.11.020.
[13] CHILTON P, ISAACS N S, MACKEY B M. Biosynthetic requirements for the repair of membeane damage in pressure-treated Escherichia coli[J]. International Journal of Food Microbiology, 2001, 71(8): 101-104. DOI:10.1016/S0168-1605(01)00566-9.
[14] MICHAEL G, GANZLE R F. On-line fi uorescence determination of pressure mediated outer membrane damage in Escherichia coli[J]. Systematic and Applied Microbiology, 2011, 24(1): 477-485. DOI:10.1078/0723-2020-00069.
[15] HONG S I, PYUN Y R. Memb rane damage and enzyme inactivation of Lactobacillus plantarum by high pressure CO2treatment[J]. International Journal of Food Microbiology, 2001, 63(7): 19-28. DOI:10.1016/S0168-1605(00)00393-7.
[16] CHUNG Y W, HSIAO W H, YUAN T S. Inactivation and morphological damage of Vibrio parahaemolyticus treated with high hydrostatic pressure[J]. Food Control, 2013, 32: 348-353. DOI:10.1016/j.foodcont.2012.12.023.
[17] LAUREN M T, STEPHEN A F, RONALD E V. Escherichia coli O157:H7 outbreak associated with restaurant beef grinding[J]. Journal of Food Protection, 2015, 78(6): 1272-1279. DOI:10.4315/0362-028X. JFP-14-545.
[18] SANDER K G, ABRAM A. Impact of high hydrostatic pressure processing on individual cellular resuscitation times and protein aggregates in E scherichia coli[J]. International Journal of Food Microbiology, 2015, 213(8): 17-23. DOI:10.1016/ j.ijfoodmicro.2015.04.039.
[19] 水新云, 王虎虎, 高峰, 等. 4 株E. coli O157:H7毒力基因检测及其冷应激损伤[J]. 食品科学, 2016, 37(4): 176-180.
[20] K RISTINA A, ULF R, ELISABETH B. Inactivation of Escherichia coli, Listeria innocua and Saccharomyces cerevisiae in relation to membrane permeabilization and subsequent leakage of intracellular compounds due to pulsed electric field processing[J]. International Journal of Food Microbiology, 2005, 99(9): 19-32. DOI:10.1016/ j.ijfoodmicro.2004.07.012.
[21] GARCIA G L, GEERAERD A H, MAST J, et al. Membrane permeabilization and cellular death of Escherichia coli, Listeria monocytogenes and Sacc haromyces cerevisiae as induced by high pressure carbon dioxide treatment[J]. Food Microbiology, 2010, 27(4): 541-549. DOI:10.1016/j.fm.2009.12.004.
[22] NIVEN G W, MILES C A, MACKEY B M. The effects of hydrostatic pressure on ribosome conformation in Escherichia coli: and in vivo study using differential scanning calorimetry[J]. Microbiology, 1999, 145(2): 419-425. DOI:10.1099/13500872-145-2-419.
[23] 高瑀珑, 鞠兴荣, 吴定. 超高压对单核细胞增生李斯特氏菌细胞膜损伤及其氧化磷酸化的影响[J]. 中国农业科学, 2011, 44(11): 2325-2333. DOI:10.3864/j.issn.0578-1752.2011.11.015.
[24] MILILLO S R, MARTIN E, MUTHAIYAN A, et al. Immediate reduction of Salmonella enterica serotype typhimurium viability via membrane destabilization following exposure to multiple-hurdle treatments with heated, acidified organic acid salt solutions[J]. Applied and Environment Microbiology, 2011, 77(11): 3765-3772. DOI:10.1128/AEM.02839-10.
[25] RITZ M, THOLOZAN J L, FEDERIGHI M, et al. Physiological damages of Listeria monocytogenes treated by high hydrostatic pressure[J]. International Journal of Food Microbiology, 2002, 79(2): 47-53. DOI:10.1016/S0168-1605(02)00178-2.
[26] MACKEY B M, MAÑAS P, MICHIELS C, et al. Inactivation of Escherichia coli by high pressure[M]. High-Pressure Microbiology: Charpter 4, 2008: 53-85.
[27] 陆海霞, 黄小鸣, 朱军莉. 超高压对单增李斯特菌细胞膜的损伤和致死机理[J]. 微生物学报, 2014, 54(7): 746-753. DOI:10.13343/ j.cnki.wsxb.2014.07.004.
[28] ANANTA E, KNORR D. Comparison of inactivation pathways of thermal or high pressure inactivated Lactobacillus rhamnosus ATCC 53103 by fi ow cytometry analysis[J]. Food Microbiology, 2009, 26(5): 542-546. DOI:10.1016/j.fm.2009.01.008.
[29] GONZALEZ M E, BARRETT D M. Thermal, high pressure and electric fi eld processing effects on plant cell membrane integrity and relevance to fruit and vegetable quality[J]. Journal of Food Science, 2010, 75(7): 121-130. DOI:10.1111/j.1750-3841.2010.01763.x.
[30] MICHIKO K, RIKIMARU H, TAKEO T. High pressure-induced changes of biological membrane study on the membrane-bound Na+/ K+-ATPase as a model system[J]. European Journal of Biochemistry, 2002, 267(1): 110-118. DOI:10.1046/j.0014-2956.2002.02621.x.
[31] RITZ M, FREULET M, ORANGE N, et al. Effects of high hydrostatic pressure on membrane proteins of Salmonella typhimurium[J]. International Journal of Food Microbiology, 2000, 55(3): 115-119. DOI:10. 1016/S0168-1605(00)00165-3.
[32] ULMER H M, HERBERHOLD H, FAHSEL S, et al. Effect of pressure-induced membrane phase transitions on inactivation of HorA, an ATP-dependent multidrug resistance transporter, in Lactobacillus plantarum[J]. Applied and Environmental Microbiology, 2002, 68(6): 1088-1095. DOI:10.1128/AEM.68.3.1088-1095.2002.
Cell Membrane Injury of Escherichia coli O157:H7 Caused by Hydrostatic Pressure
KONG Xiaoxue1, FU Yong1, JI Saisai1, JIANG Yun1,*, ZHANG Zhiguo2,*
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China; 2. College of Food Science and Engineering, Qilu University of Technology, Jinan 250353, China)
Abstract:This study investigated the membrane injury of Escherichia coli O157:H7 cells exposed to high hydrostatic pressure. Different pressure levels (200, 400 and 500 MPa) were used to evaluate the inactivation of the bacteria. The leakage of nucleic acids, K+and Mg2+, and propidium iodide (PI) intake of the cells, as well as changes in Na+/K+-ATPase and Ca2+/Mg2+-ATPase activities were determined after pressure treatment. Results indicated that, after 200 and 400 MPa treatments for 5 min, the number of viable cells decreased from an initial level of 8.8 to 8.2 and 6.3 (lg(CFU/mL)), respectively. When treated at 500 MPa, no viable cells were detected on plate count agar. As the pressure level rose, the leakage of intratracellular constituents and the fluorescence (OD) of PI intake increased significantly and both enzyme activities significantly decreased. Ca2+/Mg2+-ATPase was more sensitive to pressure than Na+/K+-ATPase, and the enzyme activities were almost completely inactivated after pressurization at 500 MPa. High pressure treatment caused obvious damage to the membrane of E. coli O157:H7 cells. The major cause of E. coli O157:H7 death after high hydrostatic pressure treatment was the inactivation of Ca2+/Mg2+-ATP ase.
Key words:high hydrostatic pressure; Escherichia coli O157:H7; cell membrane
DOI:10.7506/spkx1002-6630-201708001
中图分类号:Q93-334
文献标志码:A
文章编号:1002-6630(2017)08-0001-05
引文格式:
孔晓雪, 付勇, 姬赛赛, 等. 超高压对大肠杆菌O157:H7细胞膜的损伤效应[J]. 食品科学, 2017, 38(8): 1-5. DOI:10.7506/ spkx1002-6630-201708001. http://www.spkx.net.cn
KONG Xiaoxue, FU Yong, JI Saisai, et al. Cell membrane injury of Escherichia coli O157:H7 caused by hydrostatic pressure[J]. Food Science, 2017, 38(8): 1-5. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201708001. http://www.spkx.net.cn
收稿日期:2016-05-09
基金项目:国家自然科学基金面上项目(31371861)
作者简介:孔晓雪(1985—),女,实验师,硕士,研究方向为食品科学。E-mail:kongxiaoxue@163.com
*通信作者:江芸(1971—),女,教授,博士,研究方向为肉品安全与质量控制。E-mail:jiangyun@njnu.edu.cn张志国(1974—),男,副教授,博士,研究方向为食品质量安全。E-mail:dnzzg@126.com