表1 特异性引物对enterocin结构基因的PCR检测
Table 1 Specifi c primers used for PCR detection of enterocin structural genes

注:F.上游引物;R.下游引物。
荣梓娴,王蓉蓉,肖 茜,刘成国,周 辉*
(湖南农业大学食品科学技术学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
摘 要:屎肠球菌TRS5在37 ℃、pH 6.5的MRS培养基中经过24 h的培养后,其细菌素生成量达到最大。培养基中添加胰蛋白胨或葡萄糖有利于促进TRS5细菌素的生成,而添加麦芽糖、乳糖或甘露糖(20 g/L)后细菌素活性减少50%。外源添加5 g/L的甘油和吐温-80会抑制TRS5细菌素的产生,而添加K2HPO4或VB1、VB2、VB6、VC则对细菌素的生成没有影响。药敏实验证实屎肠球菌TRS5对红霉素、氯霉素、万古霉素、替考拉宁、四环素、青霉素敏感。聚合酶链式反应及测序结果证实屎肠球菌TRS5含有肠球菌素enterocin P和类L50的结构基因。
关键词:细菌素;屎肠球菌;细菌素的生成;扩增
细菌素是核糖体合成具有抗菌活性的抗菌肽,对细胞本身具有自身免疫[1-3]。许多革兰氏阳性菌(主要是乳酸菌)所产细菌素已在实验室中被分离和鉴定。肠球菌广泛存在于食品中,尤其是来自动物的食品,如乳制品和肉类产品[4-6]。肠球菌所产生的细菌素——肠球菌素能有效抵抗单核增生李斯特氏菌[5],作为生物保鲜剂已被用于发酵乳制品和肉制品。然而截止目前,对肠球菌产细菌素影响因素的研究相对较少。本研究以前期实验中分离到的一株产细菌素的屎肠球菌TRS5为实验菌株,对屎肠球菌TRS5产细菌素的特性进行研究,同时对细菌素的编码基因进行扩增,以期为将其应用于食品的防腐保鲜中奠定一定理论基础。
1.1 菌种、培养基与试剂
屎肠球菌TRS5菌株分离自发酵香肠;指示菌菌株均为食品微生物实验室保存。
屎肠球菌培养基:MRS(de Man-Rogosa-Sharpe)培养基(胰蛋白胨10.0 g、牛肉膏10.0 g、酵母浸粉5.0 g、柠檬酸三铵2.0 g、葡萄糖20.0 g、吐温-80 1.0 mL、乙酸钠5.0 g、磷酸氢二钾2.0 g、硫酸镁0.5 g、硫酸锰0.25 g、琼脂15.0 g、水1 L,pH 6.0~7.0);
指示菌培养基:脑心浸液(brain heart infusion,BHI)培养基(胰蛋白胨17.0 g、大豆胨3.0 g、酵母浸粉6.0 g、氯化钠5.0 g、磷酸氢二钾2.5 g、葡萄糖2.5 g、琼脂7.5 g、水1 L)。
药敏纸片 杭州微生物试剂有限公司;聚合酶链式反应(polymerase chain reaction,PCR)试剂 天根生化科技(北京)有限公司。
1.2 仪器与设备
DNP-9272BS-Ⅲ生化培养箱 上海新苗医疗器械制造有限公司;SW-CJ-1FD型净化工作台 苏州净化设备有限公司;普光HH-8数显恒温水浴锅 上海浦东物理光学仪器厂;LDZX-50FBS立式压力蒸汽灭菌器 上海申安医疗器械厂;TGL-20M离心机 长沙英泰仪器有限公司;雷磁PHS-3C pH计 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 抑菌实验及细菌素效价测定
参照文献[2]用琼脂扩散法测定细菌素活性,以单核增生李斯特氏菌54002作为指示菌。为了排除乳酸的抑制作用,用1 mol/L NaOH溶液将屎肠球菌TRS5培养液调节pH值至6。抑菌活性单位为AU/mL[3]。
1.3.2 抑菌谱测定
对屎肠球菌TRS5所产细菌素进行抑菌谱的测定,指示菌包括革兰氏阳性菌和阴性菌,采用琼脂扩散实验来确定细菌素对指示菌的抑制情况。
1.3.3 细菌素的生成曲线
将活化后的TRS5菌液以体积分数2%接种于MRS培养基中,37 ℃静置培养。每3 h测定一次pH值与OD600nm值,同时测定细菌素的抑菌活性。
1.3.4 培养基初始生长pH值对细菌素合成的影响
使用6 mol/L HCl或者1 mol/L NaOH分别将MRS培养基的起始pH值调整至5.0、5.5、6.0、6.5,然后高压蒸汽灭菌。分别以体积分数2%接种活化后的屎肠球菌TRS5,37 ℃培养24 h测定发酵液的抑菌活性。
1.3.5 已知肠球菌素基因的PCR扩增
首先提取屎肠球菌TRS5的基因组DNA,按照细菌基因组DNA提取试剂盒说明书进行。
表1 特异性引物对enterocin结构基因的PCR检测
Table 1 Specifi c primers used for PCR detection of enterocin structural genes

注:F.上游引物;R.下游引物。
采用PCR技术检测屎肠球菌TRS5中是否含有肠球菌素编码基因[3],特异性寡核苷酸引物见表1。PCR产物送交上海生工生物工程技术服务有限公司进行纯化测序。将测序结果登录NCBI网站进行BLAST比对。
1.3.6 药敏实验
采用不同质量浓度的抗生素对TRS5菌株进行药敏实验[3](红霉素、氯霉素、万古霉素、替考拉宁、四环素、青霉素G)。将活化后的TRS5以体积分数2%接种于MRS培养基中,37 ℃培养4~6 h(OD600nm为0.5),取0.1 mL菌液涂布于MRS平板上,取抗生素药片,轻轻置于MRS平板表面。平板置于37 ℃条件下培养12 h,观察抗生素药片周围是否出现抑菌圈。
1.3.7 培养基组成对细菌素的生成的影响
为确定碳源和氮源对TRS5细菌素的生成的影响,将不同碳源(葡萄糖、乳糖、果糖、半乳糖、蔗糖、麦芽糖、可溶性淀粉)和氮源(蛋白胨、牛肉膏、酵母膏)以2 g/100 mL添加至MRS基础培养基中。
磷酸盐、甘油和维生素以不同比例添加至MRS基础培养基中,接入TRS5以后,37 ℃培养24 h测定发酵液的抑菌活性。
2.1 细菌素的抑菌谱
表2 TRS5细菌素的抑菌谱
Table 2 Spectrum of antimicrobial activity of bacteriocin from TRS5

注:+++.抑菌圈直径15~25 mm;++.抑菌圈直径8~14 mm;+.抑菌圈直径1~7 mm;-.无抑菌圈。
为研究细菌素的抑菌谱,对一些实验室保存菌株和食源性致病菌,包括革兰氏阳性和革兰阴性的菌株进行了抑菌实验(表2)。TRS5细菌素对大多数受试菌,包括沙门氏菌、志贺氏菌、金黄色葡萄球菌、枯草芽孢杆菌,尤其对单增李斯特菌(食源性致病菌)具有较强的抑制作用。而细菌素对乳杆菌属的几株受试菌没有抑制作用。抑菌谱的结果与肠球菌素LM-2[3]、肠球菌素C[4]、肠球菌素416K1[16]类似。
2.2 生长过程中细菌素产量的变化
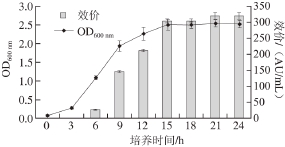
图1 屎肠球菌TRS5生长曲线及效价曲线的测定
Fig. 1 Bacteriocin production during the growth of E. faecium TRS5 in MRS broth at 37 ℃
由图1可知,屎肠球菌TRS5在生长3~12 h时处于对数生长期,此时细菌素开始大量合成。在生长至12 h时,细菌素达到(212.61±4.29) AU/mL,生长进入平台期以后,细菌素的产量基本维持不变。在生长至21 h时,细菌素产量达到最大,达到(319.06±19.06) AU/mL。
2.3 培养基初始生长pH值对细菌素合成的影响
表3 培养基初始pH值对TRS5细菌素的抑菌作用
Table 3 Effect of initial medium pH on antimicrobial activity of bacteriocin from TRS5

由表3可知,初始pH值为6.5时,细菌素的产量达到最大,随着起始pH值的不断降低,细菌素产量也随之降低。但各组培养基的最终pH值都在4.4左右,说明酸性环境不影响屎肠球菌的生长。
2.4 已知肠球菌素基因的PCR扩增

图2 屎肠球菌TRS5中肠球菌素编码基因的PCR扩增
Fig. 2 Electrophoretogram of PCR products from E. faecium TRS5
obtained using enterocins specifi c primers
提取屎肠球菌TRS5的基因组DNA,进行肠球菌素编码基因的扩增,扩增结果见图2。PCR扩增出一条约500 bp的片段基因entP,以及一条约280 bp的片段entl50aentl50b,其他编码基因均未扩增出。测序结果证实了屎肠球菌TRS5包含了肠球菌素entP和ent50A-entL50B基因。
2.5 药敏实验结果
药敏实验证实屎肠球菌TRS5对测试的6 种抗生素均敏感,6 种抗生素的最小抑菌浓度均低于2 g/mL(结果未显示)。
2.6 培养基组成对细菌素生成的影响
由表4可知,在MRS基础培养基中添加20 g/L葡萄糖时,细菌素生物效价为(304.65±12.37) AU/mL。而在添加更高质量浓度葡萄糖时,细菌素的效价反而下降,说明高质量浓度的葡萄糖可能抑制了细菌素的合成[17]。在添加20 g/L的麦芽糖、蔗糖或果糖时,细菌素效价分别为(262.04±10.40)、(271.86±23.97)、(244.44±9.70) AU/mL。
表4 外源添加成分对细菌素生成的影响
Table 4 Infi uence of exogenous nutrients on bacteriocin production by E. faecium TRS5
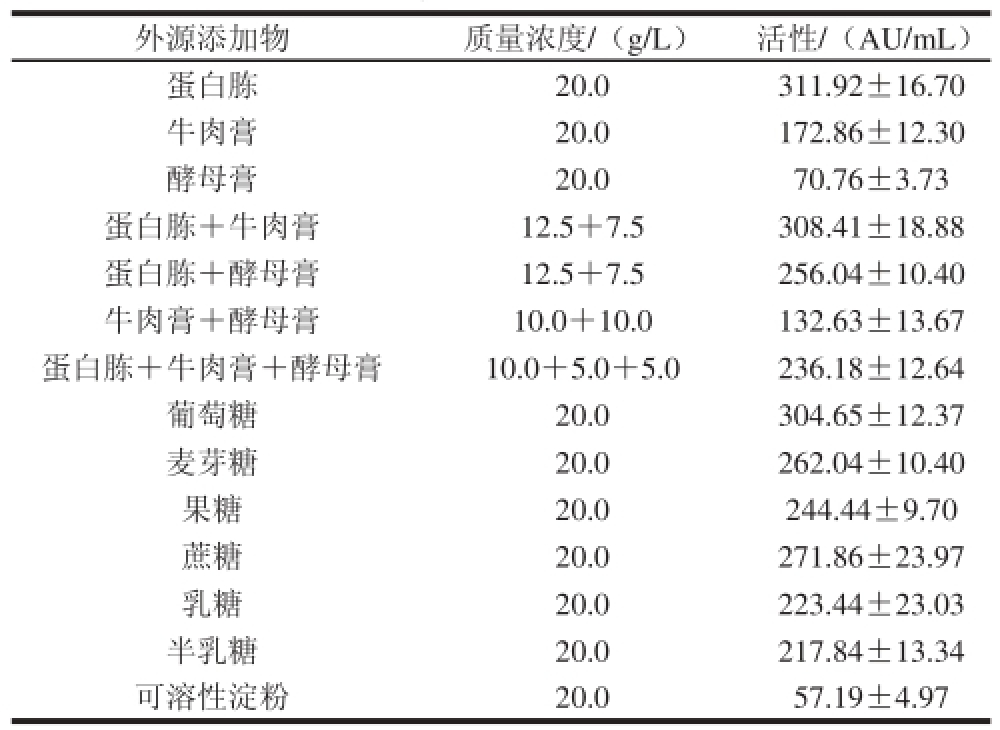
屎肠球菌TRS5在单独加入蛋白胨作为氮源时,细菌素效价为(311.92±16.70) AU/mL,而蛋白胨和牛肉膏同时存在时,细菌素效价可达(308.41±18.88) AU/mL。此外,实验结果还证实外源添加磷酸盐对细菌素的生成没有明显影响。而添加较高质量浓度的甘油(5.0 g/L或更高质量浓度)则抑制细菌素的生成。MRS培养基中添加1 g/L不同维生素(VC、VB1、VB2和VB6)对细菌素的生成没有影响(结果未显示)。
本实验对从发酵香肠中分离的产细菌素屎肠球菌TRS5进行了细菌素的特性研究。结果证实肠球菌素TRS5对包括沙门氏菌、志贺氏菌、单增李斯特氏菌、金黄色葡萄球菌、枯草芽孢杆菌具有较强的抑制作用。目前在许多发酵食品中均发现了肠球菌,特别是那些动物来源的食品,如奶制品和肉制品。研究已经证实,肠球菌可作为益生菌来治疗腹泻[18]、肠易激综合征[19]、降低血清胆固醇[20]、免疫调节[21]等。但与其他乳酸菌不同,肠球菌被认为不属于“公认安全”的乳酸菌,对肠球菌的应用需要事先经过严格的安全评价[22]。对肠球菌的安全性评价中,抗生素抗性和毒力因子是最重要的评价指标,且具有菌株的专一性[23-25]。本研究证实屎肠球菌TRS5对多种抗生素具有敏感性,但要证明它的安全性,还需要进一步确定TRS5是否具有毒力因子编码基因、能否形成生物被膜等。通过对肠球菌素编码基因进行PCR扩增及序列测序,显示屎肠球菌TRS5包含肠球菌素entP和ent50A-entL50B基因。但是否同时能合成2种不同的细菌素,还需要进一步通过细菌素的分离纯化来进行确定。
参考文献:
[1] HUANG Ying, LUO Yunbo, ZHAI Zhengyuan, et al. Characterization and application of an anti-Listeria bacteriocin produced by Pediococcus pentosaceus 05-10 isolated from Sichuan Pickle, a traditionally fermented vegetable product from China[J]. Food Control, 2009, 20(11): 1030-1035. DOI:10.1016/j.foodcont.2008.12.008.
[2] de KWAADSTENIET M, FRASER T, van REENEN C A, et al. Bacteriocin T8, a novel class Ⅱ a sec-dependent bacteriocin produced by Enterococcus faecium T8, isolated from vaginal secretions of children infected with human immunodefi ciency virus[J]. Applied and Environmental Microbiology, 2006, 72(7): 4761-4766. DOI:10.1128/ AEM.00436-06.
[3] LIU Guorong, GRIFFITHS M W, WU Pengpeng, et al. Enterococcus faecium LM-2, a multi-bacteriocinogenic strain naturally occurring inByaslag, a traditional cheese of Inner Mongolia in China[J]. Food Control, 2011, 22(2): 283-289. DOI:10.1016/j.foodcont.2010.07.023.
[4] MALDONADO-BARRAGÁN A, CABALLERO-GUERRERO B, JIMÉNEZ E, et al. Enterocin C, a class Ⅱb bacteriocin produced by E. faecalis C901, a strain isolated from human colostrum[J]. International Journal of Food Microbiology, 2009, 133(1/2): 105-112. DOI:10.1016/ j.ijfoodmicro.2009.05.008.
[5] PINGITORE E V, TODOROV S D, SESMA F, et al. Application of bacteriocinogenic Enterococcus mundtii CRL35 and Enterococcus faecium ST88Ch in the control of Listeria monocytogenes in fresh Minas cheese[J]. Food Microbiology, 2012, 32(1): 38-47. DOI:10.1016/j.fm.2012.04.005.
[6] REHAIEM A, MARTÍNEZ B, MANAI M, et al. Production of enterocin A by Enterococcus faecium MMRA isolated fromRayeb, a traditonal Tunisian dairy beverage[J]. Journal of Applied Microbiology, 2010, 108(5): 1685-1693. DOI:10.1111/j.1365-2672.2009.04565.x.
[7] AYMERICH T, HOLO H, HÅVARSTEIN L S, et al. Biochemical and genetic characterization of enterocin A from Enterococcus faecium, a new antilisterial bacteriocin in the pediocin family of bacteriocins[J]. Applied and Environmental Microbiology, 1996, 62(5): 1676-1682.
[8] ENNAHAR S, ASOU Y, ZENDO T, et al. Biochemical and genetic evidence for production of enterocins A and B by Enterococcus faecium WHE 81[J]. International Journal of Food Microbiology, 2001, 70(3): 291-301. DOI:10.1016/S0168-1605(01)00565-7.
[9] MARTÍNEZ-BUENO M, MAQUEDA M, GÁLVEZ A, et al. Determination of the gene sequence and the molecular structure of the enterococcal peptide antibiotic AS-48[J]. Journal of Bacteriology, 1994, 176(20): 6334-6339. DOI:10.1128/jb.176.20.6334-6339.1994.
[10] TOMITA H, FUJIMOTO S, TANIMOTO K, et al. Cloning and genetic organization of the bacterocin 31 determinant encoded on the Enterococcus faecalis pheromone-response conjugative plasmid pYI17[J]. Journal of Bacteriology, 1996, 178(12): 3585-3593. DOI:10.1128/jb.178.12.3585-3593.1996.
[11] CINTAS L M, CASAUS P, HERRANZ C, et al. Biochemical and genetic evidence that Enterococcus faecium L50 produces enterocins L50A and L50B, the sec-dependent enterocin P, and a novel bacteriocin secreted without an N-terminal extension termed enterocin Q[J]. Journal of Bacteriology, 2000, 182(23): 6806-6814. DOI:10.1128/JB.182.23.6806-6814.2000.
[12] GILMORE M S, SEGARRA R A, BOOTH M C, et al. Genetic structure of the Enterococcus faecalis plasmid pAD-1-encoded cytolytic toxin system and its relationship to lantibiotic determinants[J]. Journal of Bacteriology, 1994, 176(23): 7335-7344. DOI:10.1128/jb.176.23.7335-7344.1994.
[13] BALLA E, DICKS L M, DU T M, et al. Characterization and cloning of the genes encoding enterocin 1071A and enterocin 1071B, two antimicrobial peptides produced by Enterococcus faecalis BFE 1071[J]. Applied and Environmental Microbiology, 2000, 66(4): 1298-1304. DOI:10.1128/AEM.66.4.1298-1304.2000.
[14] CINTAS L M, CASAUS P, HÅVARSTEIN L S, et al. Biochemical and genetic characterization of enterocin P, a novel sec-dependent bacteriocin from Enterococcus faecium P13 with a broad antimicrobial spectrum[J]. Applied and Environmental Microbiology, 1997, 63(11): 4321-4330. DOI:10.1128/AEM.63.11.4321-4330.
[15] CINTAS L M, CASAUS P, HOLO H, et al. Enterocins L50A and L50B, two novel bacteriocins from Enterococcus faecium L50, are related to Staphylococcal hemolysins[J]. Journal of Bacteriology, 1998, 180(8): 1988-1994.
[16] SABIA C, MANICARDI G, MESSI P, et al. Enterocin 416K1, an antilisterial bacteriocin produced by Enterococcus casseliflavus IM 416K1 isolated from Italian sausages[J]. International Journal of Food Microbiology, 2002, 75(1/2): 163-170. DOI:10.1016/S0168-1605(01)00741-3.
[17] DROSINOS E H, MATARAGAS M, NASIS P, et al. Growth and bacteriocin production kinetics of Leuconostoc mesenteroides E131[J]. Journal of Applied Microbiology, 2005, 99(6): 1314-1323. DOI:10.1111/j.1365-2672.2005.02735.x.
[18] CHEN C C, KONG M S, LAI M W, et al. Probiotics have clinical, microbiological, and immunologic efficacy in acute infectious diarrhea[J]. The Journal of Pediatric Infectious Disease, 2010, 29: 135-138. DOI:10.1097/INF.0b013e3181b530bf.
[19] FAN Y J, CHEN S J, YU Y C, et al. A probiotic treatment containing Lactobacillus, Bifidobacterium and Enterococcus improves IBS symptoms in an open label trial[J]. Journal of Zhejiang University Science B, 2006, 7: 987-991. DOI:10.1631/jzus.2006.B0987.
[20] AGERHOLM-LARSEN L, BELL M L, GRUNWALD G K, et al. The effect of a probiotic milk product on plasma cholesterol: a metaanalysis of short-term intervention studies[J]. European Journal of Clinical Nutrition, 2000, 54: 856-860. DOI:10.1038/sj.ejcn.1601104.
[21] STOCKERT K, SCHNEIDER B, PORENTA G, et al. Laser acupuncture and probiotics in school age children with asthma: a randomized, placebo-controlled pilot study of therapy guided by principles of Traditional Chinese Medicine[J]. Pediatric Allergy and Immunology, 2007, 18: 160-166. DOI:10.1111/j.1399-3038.2006.00493.x.
[22] OGIER J C, SERROR P. Safety assessment of dairy microorganisms: the Enterococcus genus[J]. International Journal of Food Microbiology, 2008, 126: 291-301. DOI:10.1016/j.ijfoodmicro.2007.08.017.
[23] VALENZUELA A S, OMAR N B, ABRIOUEL H, et al. Risk factors in enterococci isolated from foods in Morocco: determination of antimicrobial resistance and incidence of virulence traits[J]. Food and Chemical Toxicology, 2008, 46(8): 2648-2652. DOI:10.1016/ j.fct.2008.04.021.
[24] BARBOSA J, GIBBS P A, TEIXEIRA P. Virulence of factors among enterococci isolated from traditional fermented meat products produced in the North of Portugal[J]. Food Control, 2010, 21: 651-656. DOI:10.1016/j.foodcont.2009.10.002.
[25] FRANZ C M A P, HUCH M, ABRIOUEL H, et al. Enterococci as probiotics and their implications in food safety[J]. International Journal of Food Microbiology, 2011, 151(2): 125-140. DOI:10.1016/ j.ijfoodmicro.2011.08.014.
Characterization of Enterococcus faecalis TRS5, a Strain Able to Produce Bacteriocin and PCR Amplifi cation of Its Bacteriocin-Encoding Genes
RONG Zixian, WANG Rongrong, XIAO Qian, LIU Chengguo, ZHOU Hui*
(Hunan Provincial Key Laboratory of Food Science and Biotechnology, College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China)
Abstract:The production of bacteriocin by Enterococcus faecium TRS5 was found to be maximum at 37 ℃ and pH 6.5 after 24 h of incubation in MRS broth. The presence of tryptone or glucose in the medium stimulated the bacteriocin production. Added maltose, lactose or mannose (20 g/L) resulted in a 50% reduction of bacteriocin activity. High levels of glycerol and Tween-80 (5 g/L) also repressed the bacteriocin production. The presence of K2HPO4or vitamins VB1, VB2, VB6, or VC in the medium had no effect on the bacteriocin production. E. faecalis TRS5 was sensitive to erythromycin, chloramphenicol, vancomycin, teicoplanin, tetracycline and penicillin G. PCR amplification and sequencing demonstrated that E. faecalis TRS5 harbored enterocin P and L50-like structural genes.
Key words:bacteriocin; Enterococcus faecalis; bacteriocin production; amplifi cation
DOI:10.7506/spkx1002-6630-201708002
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)08-0006-05
引文格式:
荣梓娴, 王蓉蓉, 肖茜, 等. 产细菌素屎肠球菌TRS5特性分析及其编码基因的扩增[J]. 食品科学, 2017, 38(8): 6-10.
DOI:10.7506/spkx1002-6630-201708002. http://www.spkx.net.cn
RONG Zixian, WANG Rongrong, XIAO Qian, et al. Characterization of Enterococcus faecalis TRS5, a strain able to produce bacteriocin and PCR amplification of its bacteriocin-encoding genes[J]. Food Science, 2017, 38(8): 6-10. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201708002. http://www.spkx.net.cn
收稿日期:2016-06-21
基金项目:国家自然科学基金面上项目(31571811);湖南省教育厅科学研究项目(16K043)
作者简介:荣梓娴(1992—),女,硕士研究生,研究方向为食品微生物。E-mail:347325338@qq.com
*通信作者:周辉(1980—),男,副教授,博士,研究方向为食品微生物。E-mail:paradise917@163.com