赵秀丽,张 珊,宋 璐,王 檬,侯丽华*
(天津科技大学新农村发展研究院,天津 300457)
摘 要:在酱油高盐稀态发酵过程中通常添加假丝酵母(T酵母)和鲁氏酵母(S酵母)来增强酱油的风味品质。但是目前对T酵母和S酵母进行遗传操作没有相应的营养缺陷型菌株。因此,对T酵母和S酵母分别进行甲基磺酸乙酯(ethylmethane sulfonate,E MS)诱变和紫外诱变,以酵母的致死率为诱变标准做单因素试验,得到最佳的EMS质量分数、EMS作用时间,紫外照射距离、紫外照射时长,酵母菌浓度。通过筛选、测序获得尿嘧啶营养缺陷型菌株,为后续耐盐酵母的分子生物学研究提供理论依据。
关键词:S酵母;T酵母;EMS诱变;紫外诱变;尿嘧啶营养缺陷型
酱油在高盐稀态发酵过程中往往添加假丝酵母[1-3](Candida versatilis,T酵母)和鲁氏酵母[4-5](Zygosaccharomyces rouxii,S酵母)来增强酱油的风味品质。其中T酵母和S酵母在酿造过程中,以酿造材料为养分源,能够很好地发酵,不用 添加其他养分源来维持。T酵母和S酵母在酱油里面主要起的作用是增酯增香,在酱油发酵过程中形成的香气成分包括醇类、酯类、酸类、醛类及缩醛类、酚类、呋喃酮类和含硫化合物等。目前T酵母和S酵母主要用于酱油高盐稀态发酵,为了改善酱油的风味提高酱油的质量,则需构建T酵母和S酵母的优良发酵菌种。但是目前对T酵母和S酵母进行转化、转导、原生质体融合、转座因子和质粒等遗传学研究的过程中没有相应的营养缺陷型标记菌株[6-8]。
URA3[9-11]是酵母V号染色体上的一个基因,能编码乳清苷5-磷酸脱羧酶,在酵母RNA嘧啶核苷酸的合成过程中,该酶能催化其中的一个关键的反应。同时也是工业菌株可供使用的选择标记,诱变后使其失活可得到酵母尿嘧啶营养缺陷型菌株[9]。
诱变育种常分为物理诱变和化学诱变[12-13],物理诱变常用各种射线、微波或激光等,最常用的有紫外诱变[14-16];化学诱变[17]是运用一些化学药物导致遗传物质的改变,已知的有烷化剂、碱基类似物,羟胺,吖啶色素等,其中烷化剂主要有亚硝基胍、甲基磺酸乙酯(ethylmethane sulfonate,EMS)[17-19]、乙烯亚胺等。本实验分别对T酵母和S酵母进行EMS诱变[19-20]和紫外诱变[21],并通过菌种筛选获得T酵母和S酵母的尿嘧啶营养缺陷型菌株。
1.1 材料与试剂
T酵母、S酵母、酿酒酵母尿嘧啶缺陷型菌株UL4和W303、质粒YEplac195 天津科技大学。
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、尿嘧啶缺陷型极限(CM-URA)培养基、磷酸缓冲液、甲基磺酸乙酯 索莱宝生物科技有限公司。
1.2 仪器与设备
721紫外-可见分光光度计 上海天宇恒平科学仪器公司;高速冷冻离心机 美瑞泰克科技有限公司。
1.3 方法
1.3.1 酵母细胞悬浮液的制备
将活化好的酵母菌接种于20 mL YPD液体培养基中,30 ℃、180 r/min振荡过夜培养,取0.1 mL接入另一20 mL YPD液体培养基中,30 ℃、180 r/min振荡培养,测定OD值,在OD660nm为1.0时取酵母菌液,以7 000 r/min离心5 min收集菌体,并用适量生理盐水洗涤。用生理盐水调整细胞浓度至每毫升107个。
1.3.2 EMS诱变
取1 mL酵母菌液于离心管中,7 000 r/min离心5 min,收集细胞,无菌水离心洗涤2 次,悬浮细胞于0.1 mol/L无菌磷酸缓冲溶液(pH 7.0)中,加入EMS溶液,使诱变剂终质量分数分别为1%、2%、3%、4%、5%,以不加EMS溶液的磷酸缓冲液组作为对照。振荡分散细胞,置于30 ℃恒温培养箱中培养15、30、45、60、75、90 min;3 500 r/min离心5 min,弃上清液,1 mL 5% Na2S2O3溶液洗涤2次,无菌水洗涤2 次,再悬浮细胞于1 mL生理盐水中,稀释至10-5~10-8涂平板,确定80%~90%的致死剂量。
1.3.3 紫外线照射
取5 mL菌悬液移入无菌培养皿中,至距离紫外线10、15、20、25、30 cm处照射,在20、40、60、80、100 s时取样。用十倍稀释法把经过照射的菌悬液在无菌水中稀释,对照组稀释10-2、10-3、10-4,诱变组稀释10-1、10-2、10-3,取0.2 mL涂平板,每一处理涂3 套平板。紫外线照射以后的操作均避光进行。将涂匀的平板用牛皮纸裹好,倒置于30℃培养箱中培养36 h,确定80%~90%的致死剂量。
1.3.4 酵母诱变致死率的测定
经诱变处理后和未经诱变处理的样品,分别适当稀释后,从不同稀释度的样品中取0.2 mL悬液涂布于初筛培养基,30 ℃恒温培养36 h后,统计存活细胞数,计算致死率。同时挑取诱变处理组的单菌落接种到YPD固体培养基中,30 ℃倒置培养,3~6 d待长出单菌落,备用。致死率按以下公式计算。
1.3.5 尿嘧啶缺陷型酵母的筛选
将长有诱变组菌落的YPD固体培养基中的单菌落用无菌牙签分别在CM-URA培养基和YPD培养基中对诱变后每个菌落进行点接,牙签先划CM-URA培养基,然后迅速划YPD培养基,每个培养皿中的菌株一一对应、排列整齐,并给每对培养基编号。
1.3.6 遗传稳定性实验
挑取保存在YPD固体培养基中的突变株转接至新的YPD培养基中,共传10 代,对第10代突变菌株进行液体培养,评价突变株的突变稳定性。
1.3.7 电转化实验
测酵母OD值,确定菌体浓度,制备酵母感受态细胞,通过电转化[22-24]的方法将带有URA标记基因的YEplac195载体分别导入筛选的菌株中。未导入YEplac195载体的诱变酵母菌为对照组,取适量菌液分别涂布于尿嘧啶缺陷型培养基中,置于30 ℃培养箱,培养3~6 d。观察诱变菌株能否在CM-URA培养基中生长。
1.3.8 URA3基因的获取
上游引物:5-GCGTCGACATGAGCCATCTCACCT ATCA-3,下游引物:5-GCCTGCAGTTATTTACTGCAT CTTTTTA-3,目标片段大小为798 bp。PCR条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 min,循环29 次;72 ℃延伸2 min;4 ℃保存。
2.1 EMS和紫外照射的优化结果
2.1.1 EMS最佳诱变条件
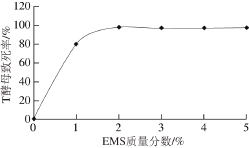
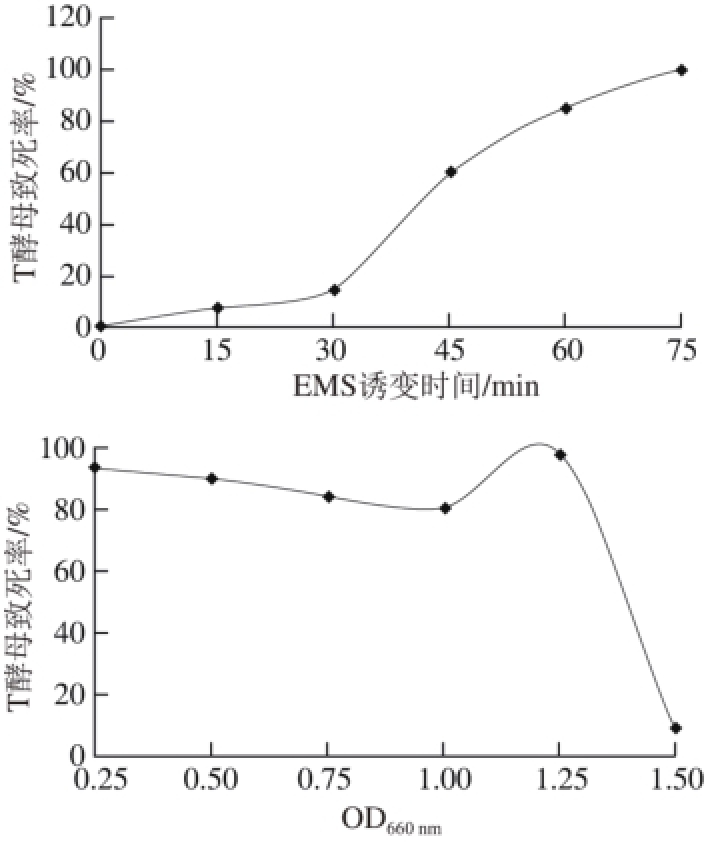
图1 EMS诱变下T酵母的致死率
Fig. 1 Mortality rate of C. versatilis after EMS mutagenesis
T酵母EMS诱变分别从EMS质量分数、诱变时间、菌体浓度3 个变量进行优化。由图1可知,酵母的存活率随处理时间的延长和EMS质量分数的增大而降低。用1% EMS处理45 min以下时,对酵母的杀伤力较弱,酵母的致死率在40%以下,而处理70 min左右时,酵母菌的致死率接近100%,诱变率太低。依据致死率在80%~90%左右获得正突变菌株的机率最高,得出T酵母在OD660nm为1、1% EMS、55 min处理条件下致死率在80%~90%范围内。同理可得S酵母在OD660nm为1、1%~2% EMS处理55 min条件下最佳。
2.1.2 紫外照射最佳诱变条件
T酵母紫外诱变分别从紫外照射距离、诱变时间和菌体浓度3 个方面进行优化。由图2可知,经小剂量辐射的酵母细胞致死率较低,而大剂量的辐射会使酵母细胞的致死率明显升高。随着辐射时间的累计,辐射剂量的增加,突变率逐渐提高,但当紫外照射剂量到一定程度时,菌株致死率几乎100%,正突变率会降低。由图可知,T酵母最佳紫外诱变条件为:OD660nm为1、照射距离25 cm、照射时间55 s,此时的酵母致死率在80%~90%范围内。同理可得S酵母最适紫外诱变条件为:OD660nm为1、照射距离25 cm、照射时间为65 s,此时的酵母致死率在80%~90%范围内。
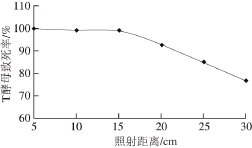
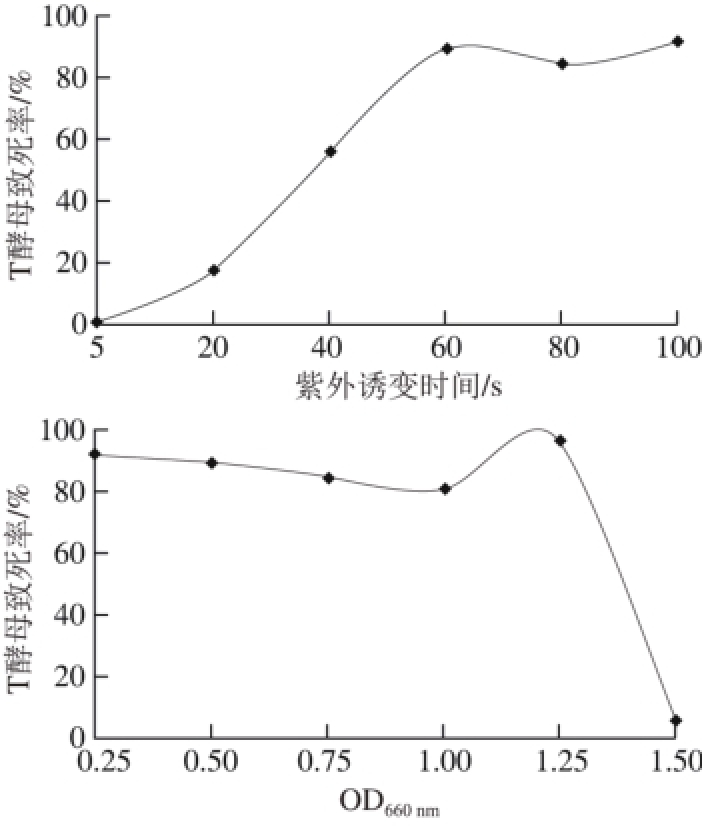
图2 紫外诱变下T酵母的致死率
Fig. 2 Mortality rate of C. versatilis after UV mutagenesis
2.2 诱变结果及突变株的分析
2.2.1 尿嘧啶缺陷型菌株筛选
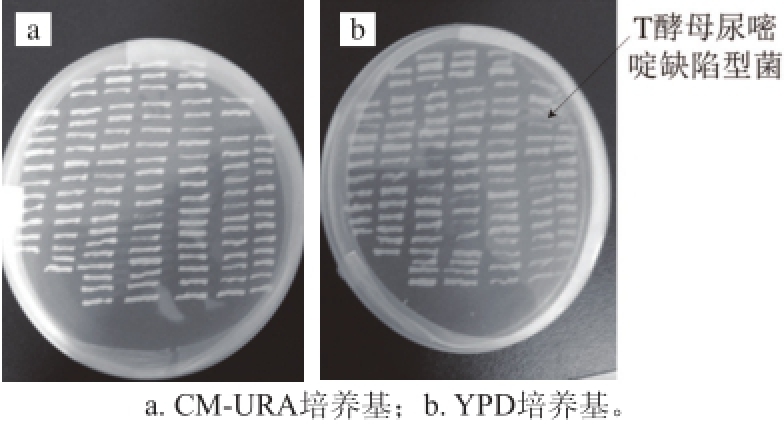
图3 尿嘧啶缺陷型T酵母的初始筛选培养基
Fig. 3 Primary screening of uracil-defi cient C. versatilis
在最佳甲基磺酸乙酯诱变剂量作用后,从YPD固体培养基中长出的单菌落中随机挑取,先划CM-URA平板(图3a),后迅速划YPD固体培养基,经初筛得到1株尿嘧啶缺陷型T酵母(图3b),为顺利传代的尿嘧啶缺陷型T酵母,称T1。
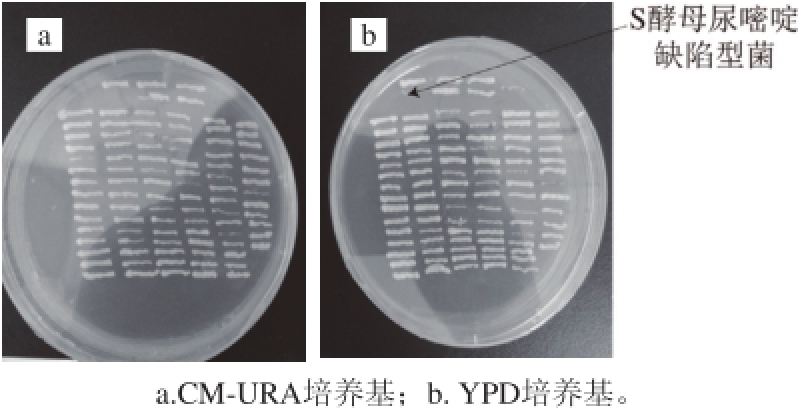
图4 尿嘧啶缺陷型S酵母的初始筛选培养基
Fig. 4 Primary screening of uracil-defi cient Z. rouxii
在最佳甲基磺酸乙酯最佳剂量作用后,经初筛得到5 株尿嘧啶缺陷型S酵母(图4a),其中只有一株传代稳定,图4b为顺利传代的尿嘧啶缺陷型S酵母,称S3。
2.2.2 尿嘧啶缺陷型菌株遗传稳定性验证
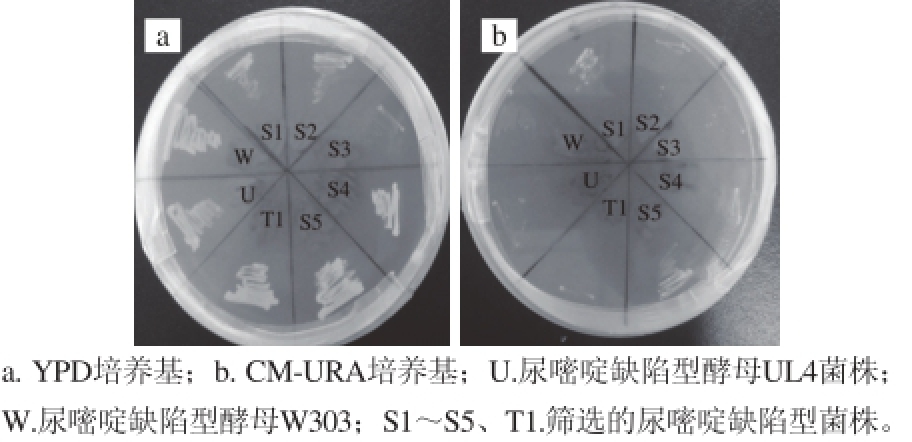
图5 耐盐酵母菌的传代与验证
Fig. 5 Generation and verifi cation of salt tolerant yeast
在进行传代(10 代)与验证之后,将诱变菌株同时与尿嘧啶缺陷型酵母UL4和W303作为参照,得到尿嘧啶缺陷型酵母T1和S3,见图5。将所得尿嘧啶营养缺陷型菌株T1和S3,通过电转化的方法,将含有URA标记基因的载体YEplac195导入T1和S3,此转化后的菌株均在尿嘧啶缺陷固体培养基中生长,而未导入YEplac195的对照组在尿嘧啶缺陷平板中未长出。由此尿嘧啶缺陷菌株得到验证。2.2.3 电转化结果验证
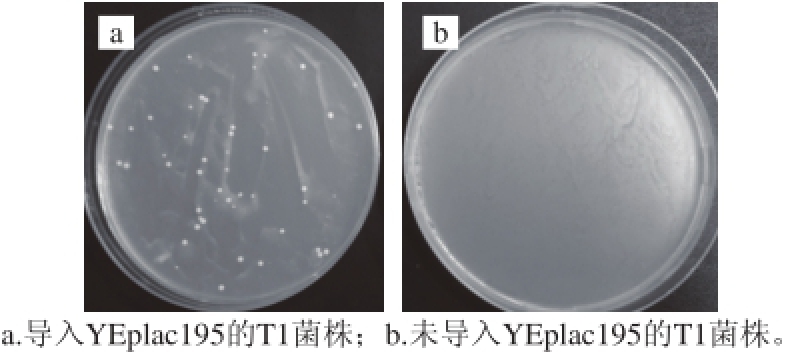
图6 T1菌株的电转化结果验证
Fig. 6 Verifi cation of electroporation-induced transformation of T1 yeast
通过电转化的方法将带有URA标记基因的YEplac195载体分别导入筛选的菌株中,未导入YEplac195载体的诱变酵母菌为对照组。从图6可以看出,导入带有URA标记基因的YEplac195质粒的T1菌株可以在CM-URA培养基中生长,未导入YEplac195质粒的T1菌株不能在CM-URA培养基上生长。

图7 S3的电转化结果验证
Fig. 7 Verifi cation of electroporation-induced transformation of S3
从图7可以看出,导入带有U R A标记基因的YEplac195质粒的S3菌株可以在CM-URA培养基中生长,未导入YEplac195质粒的S3菌株不能生长。
2.2.4 酵母尿嘧啶缺陷型菌株的URA3基因分析
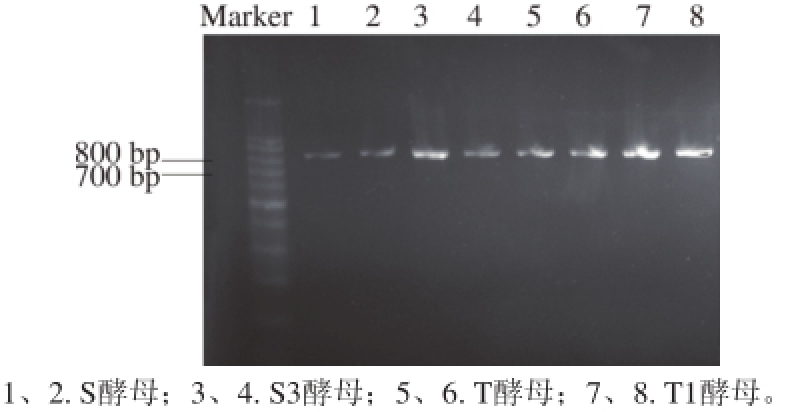
图8 S酵母、S3、T酵母、T1菌株URA3基因PCR产物凝胶电泳图
Fig. 8 Gel electrophoresis of PCR products of the URA3 gene of S, S3, T and T1
分别提取T、T1、S、S3四种酵母DNA,进行PCR反应,其PCR产物进行凝胶电泳,所得电泳图见图8。
2.2.5 PCR产物测序结果分析
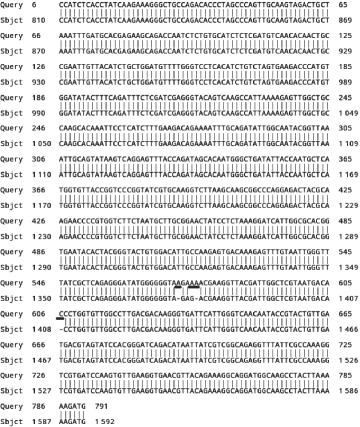
图9 T1酵母与T酵母URA3基因比较
Fig. 9 Comparison of URA3 genes of T and T1 yeast
T1酵母与野生型T酵母URA3基因的比较(图9)。T1突变株的突变方式为2 个腺嘌呤和1 个胞嘧啶的添加,1 个鸟嘌呤被替换成1 个腺嘌呤。突变型菌株突变位置较集中,产生3 个碱基的增加和1 个碱基的改变,导致1 375 bp之后的碱基发生错位,因此,直接导致T1酵母营养缺陷性状由大约1 375 bp之后的密码子调控。本实验所得T1酵母基因的PCR产物的测序范围810~1 592 bp:突变位置发生在1 375 bp之后,因此1 375~1 592 bp之间的217 个密码子都有可能直接决定着营养缺陷性状。

图10 S3酵母与S酵母URA3基因比较
Fig. 10 Comparison of URA3 genes of S3 and S yeast
S3酵母与S酵母URA3基因测序结果对比,如图10所示。S3突变株的突变方式为1 个腺嘌呤和1 个胞嘧啶的连续添加。在最佳诱变条件下,此菌株产生连续2 个碱基的增加,导致1 382 bp之后的碱基发生错位,因此,直接导致T酵母营养缺陷性状由大约1 382 bp之后的密码子调控。本实验所得S3酵母基因的PCR产物的测序范围为810~1 592 bp:突变位置发生在1 382 bp之后,因此1 382~1 592 bp中的210 个密码子都有可能直接决定着营养缺陷性状。
依据EMS和紫外诱变可以使酵母细胞发生正突变和负突变这一方法,本研究分别对T酵母和S酵母的EMS诱变和紫外照射诱变最佳剂量进行优化。用EMS处理40 min左右时,其菌体的致死率在40%以下,此时不利于突变体的产生。当处理时间在大于75 min时,活菌数几乎为零,此时的诱变率太低。经计算、比较得出T酵母在1% EMS、55 min处理条件下致死率在80%~90%范围内;S酵母在1%~2% EMS、55 min条件下最佳;得出T酵母最佳紫外诱变剂量为照射距离25 cm、照射时间55 s,S酵母最适紫外诱变条件为照射距离25 cm、照射时间65 s。
通过EMS最佳诱变剂量,以S酵母为出发菌株,成功构建了尿嘧啶营养缺陷型菌株S3;以T酵母为出发菌株,成功构建了尿嘧啶营养缺陷型菌株T1。并且2 个诱变菌株都具有较好的遗传稳定性。由基因分析知,EMS作为诱变剂使得T1突变株2 个腺嘌呤和1 个胞嘧啶的添加,1 个鸟嘌呤被替换成1 个腺嘌呤,S3突变株1 个腺嘌呤和1 个胞嘧啶的连续添加。经分析,EMS诱变对S酵母和T酵母URA3基因中乳清核苷酸-5-磷酸脱羧酶基因的破坏直接影响了生长过程中尿嘧啶的合成。因此,耐盐酵母的转基因靶向诱变可以以损伤该基因片段为目标获得所需工程菌株。
参考文献:
[1] SILVA-GRAÇA M, NEVES L, LUCAS C. Outlines for the defi nition of halotolerance/halophily in yeasts: Candida versatilis (halophila) CBS4019 as the archetype[J]. FEMS Yeast Research, 2003, 3(4): 347-362. DOI:10.1016/S1567-1356(02)00200-3.
[2] HOU L H, GUO L, WANG C L, et al. Genome sequence of Candida versatilis and comparative analysis with other yeast[J]. Journal of Industrial Microbiology and Biotechnology, 2016, 43(8): 1131-1138. DOI:10.1007/s10295-016-1764-4.
[3] 王聪, 王檬, 赫景钰, 等. 酱油酿造风味菌株T酵母耐盐机理的初步研究[J]. 中国酿造, 2015, 34(2): 26-30. DOI:10.11882/ j.issn.0254-5071.2015.02.006.
[4] 许静, 王锦辉, 周锡龙, 等. 添加S酵母对牛肉酱基质的影响[J]. 中国酿造, 2014, 33(11): 30-36. DOI:10.11882/ j.issn.0254-5071.2014.11.007.
[5] CAO X H, HOU L H, LU M F, et al. Genome shuffling of Zygosaccharomyces rouxii to accelerate and enhance the flavor formation of soy sauce[J]. Science of Food and Agriculture, 2010, 90(2): 281-285. DOI:10.1002/jsfa.3810.
[6] KAWAI S, HASHIMOTO W, MURATA K. Transformation of Saccharomy cescerevisiae and other fungi; methods and possible underlying mechanism[J]. Bioengineered Bugs, 2010, 1(6): 395-403. DOI:10.4161/bbug.1.6.13257.
[7] LENKA P, JACKY D, HANA S. Tools for the genetic manipulation of Zygosaccharomyces rouxii[J]. FEMS Yeast Research, 2007, 7(8): 1285-1294. DOI:10.1111/j.1567-1364.2007.00308.x.
[8] REISER J, GLUMOFF V, KALIN M, et al. Transfer and expression of heterologous genes in yeasts other than Saccharomyces cerevisiae[J]. Advances in Biochemical Engineering/Biotechnology, 1990, 43: 75-102. DOI:10.1007/BFb0009080.
[9] 陈永, 林良才. 里氏木霉RL-P37尿嘧啶营养缺陷型菌株的构建[J]. 中国酿造, 2014, 33(12): 58-62. DOI:10.11882/ j.issn.0254-5071.2014.12.011.
[10] 穆大帅, 师亮, 任昂, 等. 灵芝中基于内源ura3基因的多基因沉默系统的建立及其应用[J]. 菌物研究, 2013, 11(2): 145. DOI:10.13341/ j.jfr.2013.02.027.
[11] 项峥, 陈献忠, 张利华, 等. 利用可重复使用的URA3标记基因建立热带假丝酵母基因敲除系统[J]. 遗传, 2014, 36(10): 1053-1061. DOI:10.3724/SP.J.1005.2014.1053.
[12] HARA A, ARIE M, KANAI T, et al. Novel and convenient methods for Candida tropicalis gene disruption using a mutated hygromycin B resistance gene[J]. Archives of Microbiology, 2001, 176(5): 364-369. DOI:10.1007/s002030100338.
[13] WANG X C, ZHAO H Y, LIU G, et al. Improving production of extracellular proteases by random mutagenesis and biochemical characterization of a serine protease in Bacillus subtilis S1-4[J]. Genetics and Molecular Research Gmr, 2016, 15(2). DOI:10.4238/ gmr.15027831.
[14] MAO P, WYRICK J J, ROBERTS S A, et al. UV-induced DNA damage and mutagenesis in chromatin[J]. Photochemistry and Photobiology, 2016, 93: 216-228. DOI:10.1111/php.12646.
[15] 胡艳丽, 钟添华, 产竹华, 等. 原生质体紫外诱变选育可利用廉价碳源的高产油新菌株[J]. 微生物学通报, 2014, 41(5): 881-890. DOI:10.13344/j.microbiol.china.130182.
[16] 刘翔. EMS诱变技术在植物育种中的研究进展[J]. 激光生物学报, 2014, 21(3): 197-201. DOI:10.3969/j.issn.1007-7146.2014.03.002.
[17] MISHRA A, SINGH A, SHAMNA M, et al. Development of EMS-induced mutation population for amylose and resistant starch variation in bread wheat (Triticum aestivum) and identification of candidate genes responsible for amylose variation[J]. BMC Plant Biology, 2016, 16(1): 217. DOI:10.1186/s12870-016-0896-z.
[18] SMITH J, PETER Q. Elevated ethyl methanesulfonate (EMS) in nelfinavir mesylate (Viracept, Roche): overview[J]. AIDS Research and Therapy, 2009, 6: 18. DOI:10.1186/1742-6405-6-18.
[19] PANG X W, ZHENG Y T, QIAO X T, et al. Improvement of lincomycin production by mutant selection and metabolic regulation[J]. Preparative Biochemistry and Biotechnology, 2016. DOI:10.1080/108 26068.2016.1207083.
[20] 杨富军, 王绍伦, 高华援, 等. 不同基因型花生EMS诱变条件分析及突变系筛选[J]. 安徽农业科学, 2014, 42(33): 11778-11781. DOI:10.13989/j.cnki.0517-6611.2014.33.061.
[21] 崔铁忠, 卢康荣, 李银霞, 等. 酿酒酵母遗传缺陷型菌株化学转化方法研究[J]. 现代生物医学进展, 2016, 16(8): 1420-1423. DOI:10.13241/j.cnki.pmb.2016.08.005.
[22] RHEE M S, KIM J W, QIAN Y L, et al. Development of plasmid vecor and electropotation condition for gene transfer in sporogenic lactic acid bacterium, Bacillus coagulans[J]. Plasmid, 2007, 58(1): 13-22. DOI:10.1016/j.plasmid.2006.11.006.
[23] YUAN X P, CHEN X, YANG M J, et al. Effi cient construct of a large and functional scFv yeast display library derived from the ascites B cells of ovarian cancer patients by three-fragment transformationassociated recombination[J]. Applied Microbiology and Biotechnology, 2016, 100(9): 4051-4061. DOI:10.1007/s00253-016-7303-4.
[24] MIKLENIĆ M, UNAR B, TAFA A, et al. Improved electroporation procedure for genetic transformation of Dekkera/Brettanomyces bruxellensis[J]. FEMS Yeast Research, 2015, 15(8): 96. DOI:10.1093/ femsyr/fov096.
Construction of Uracil Auxotrophic Strains of Salt Tolerant Yeasts
ZHAO Xiuli, ZHANG Shan, SONG Lu, WANG Meng, HOU Lihua*(Research Institute of New Rural Development, Tianjin University of Science and Technology, Tianjin 300457, China)
Abstract:Candida versatilis (called T yeast) and Zygosaccharomyces rouxii (called S yeast) are often used as starter cultures to enhance the fi avor quality of high-salt liquid-state soy sauce. However, there are currently no auxotrophic strains available for the genetic manipulation of S yeast and T yeast. Therefore, ethylmethane sulfonate (EMS) and ultraviolet (UV) irradiation were used to mutagenize the yeasts obtain uracil auxotrophic strains. On the basis of mortality rate, the optimal concentration of EMS, EMS treatment time, UV irradiation distance, UV irradiation time, and yeast concentration were determined. In the end, the uracil auxotrophic strains were screened out and identifi ed by gene sequencing, which will lay the foundation for molecular biology studies of salt tolerant yeast.
Key words:Candida versatilis; Zygosaccharomyces rouxii; ethylmethane sulfonate (EMS); ultraviolet mutagenesis; uracil auxotrophic
DOI:10.7506/spkx1002-6630-201708003
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)08-0011-06
引文格式:
赵秀丽, 张珊, 宋璐, 等. 耐盐酵母尿嘧啶营养缺陷型菌株的构建[J]. 食品科学, 2017, 38(8): 11-16. DOI:10.7506/ spkx1002-66 30-201708003. http://www.spkx.net.cn
ZHAO Xiuli, ZHANG Shan, SONG Lu, et al. Construction of uracil auxotrophic strains of salt tolerant yeasts[J]. Food Science, 2017, 38(8): 11-16. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201708003. http://www.spkx.net.cn
收稿日期:2016-07-18
基金项目:国家自然科学基金面上项目(31371819);天津市科技特派员项目(15JCTPJC62500)
作者简介:赵秀丽(1989—),女,硕士研究生,研究方向为食品生物技术。E-mail:zilinghuadu@126.com
*通信作者:侯丽华(1974—),女,副教授,博士,研究方向为食品微生物。E-mail:lhhou@tust.edu.cn