表1 半制备型RP-HPLC梯度洗脱条件
Table 1 Semi-preparative RP-HPLC gradient elution conditions

张 楠1,刘 洋1,于宏伟1,柯晓静1,郭润芳1,*,贾英民1,2
(1.河北农业大学食品科技学院,河北 保定 071000;2.河北科技大学生物科学与工程学院,河北 石家庄 050018)
摘 要:侧孢短芽孢杆菌抗菌肽具有高效、广谱、稳定的抗菌活性,该抗菌活性与其内源质粒密切相关。为研究侧孢短芽孢杆菌含抗菌肽基因质粒异源表达的可行性,本研究中将侧孢短芽孢杆菌S62-9的天然质粒电转枯草芽孢杆菌Wb800受体细胞,筛选阳性转化子并对其表达产物性质进行研究。得到了产生抗菌活性产物菌株Z4,发酵6 h后开始产生抗菌物质,12~20 h产量达到最大,达620.96 AU/mL。Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳看到S62-9质粒在枯草芽孢杆菌中得到了成功的表达,反相高效液相色谱分析Z4表达产物含有与侧孢短芽孢杆菌抗菌肽相同物质。该物质抑菌谱广,稳定性好:对于G+、G-和真菌均有抑菌活性,而且对于G+菌株的抑菌效果优于G-菌株和真菌,121 ℃处理20 min后的效价保留率约为90%,100 ℃处理60 min后仍有81%的活性保留;pH 2~12的范围内效价保留 率基本不发生变化;对蛋白酶较为敏感,胰蛋白酶和蛋白酶K处理后抗菌肽的效价保留率为60%左右,其他3 种蛋白酶处理后也有一定程度的降低。本研究获得了抗菌肽的异源表达菌株Z4,为进一步工业生产抗菌肽提供支持,而且为该抗菌肽遗传基因定位于质粒上提供了证明。
关键词:侧孢短芽孢杆菌;天然质粒;异源表达;抗菌肽;抑菌效价
抗菌肽又称抗微生物肽或肽类抗生素,是生物体内诱导表达的具有广谱抗菌作用的小分子多肽。抗菌肽一般带正电荷、具有强酸碱稳定性、热稳定性以及广谱抗菌等特点,更重要的是产生耐药性几率小,因而成为理想的抗生素替代品[1-2]。
侧孢短芽 孢杆菌(Brevibacillus laterosporus)是多功能菌株[3-4],能够产生多种抑菌物质[5-11]。2009年,课题组从全国不同地区采集的156 个土壤样品中筛选得到一株产生高效广谱抑菌物质的侧孢短芽孢杆菌S62-9[12]。2010年杨倩等[13]对其产的抗菌物质进行分离纯化、结构鉴定和生物学特性研究,判断该抗菌物质为多肽。随后对该侧孢短芽孢杆菌抗菌肽进行了毒理和抑菌效应研究,发现该物质在饲料添加剂或食品天然防腐剂方面极具应用前景。2012年赵璟等[14]对侧孢短芽孢杆菌A60的抗菌肽进行分离纯化与功能分析,之后,陈杰等[15]报道海洋芽孢杆菌B-9987产生一种具有抗真菌活性的新结构环脂肽类化合物。王岩等[16]也分离到一株海洋侧孢短芽孢杆菌,产生具有抗菌活性的直链肽类物质。
在侧孢短芽孢杆菌S62-9发酵生产中发现,对其进行的发酵优化始终不能达到高密度发酵的要求,抗菌肽产量较低。因此对侧孢短芽孢杆菌抗菌肽的编码基因进行定位、寻找,希望在分子水平对其进行改造以提高产量。前期研究中,通过质粒消除发现,侧孢短芽孢杆菌S62-9的天然质粒消除后获得的突变菌株不再具备产抗菌物质的能力,初步推测与该抗菌肽合成相关的基因和质粒有密切关系。但将质粒进行限制性酶切和亚克隆以求获得产生抗菌活性的克隆一直未能成功。根据文献报道,细菌的抗菌肽基因通常都在操纵子簇上,除了编码抗菌肽的基因,还包括参与转录后修饰,转运及免疫相关的基因,因此一个有活性的抗菌肽的分泌表达取决于其完整的遗传决定子[17-18]。推测侧孢短芽孢杆菌S62-9抗菌肽的活性表达也可能需要多个相关基因的共同参与,甚至整个操纵子序列。为此,本研究将侧孢短芽孢杆菌S62-9完整的天然质粒转入枯草杆菌Wb800中,以探讨抗菌肽质粒异源表达的可行性,并试图获得分泌表达抗菌肽的工程菌株,为抗菌肽产量的提高提供一定理论依据。
1.1 菌株与试剂
抗菌肽的生产菌株:侧孢短芽孢杆菌S62-9;质粒转化的受体菌株:枯草芽孢杆菌(Bacillus subtilis)Wb800;G+指示菌:金黄色葡萄球菌(Staphylococcus aureus)SA137、单核细胞增生李斯特氏菌(Listeria monocytogenes)、苏云金芽孢杆菌(Bacillus thuringiensis)、蜡状芽孢杆菌(Bacillus cereus)、保加利亚乳杆菌(Lactobacillus acidophilus);G-指示菌:大肠埃希氏菌(Escherichia coli)、黏质沙雷氏菌(Serratia marcescens)、副溶血性弧菌(Vibrio parahemolyticus)、宋内氏志贺氏菌(Shigella sonnei)、铜绿假单胞菌(Pseuduinonas aeniginasa)、甲型副伤寒沙门氏菌(Salmonella paratyphi)、阪崎肠杆菌(Bntorobater sakazakii);真菌指示菌:酿酒酵母(Saccharomyces cerevisiae)、巴斯德毕赤酵母(Pichia pastoris)、黑曲霉(Aspergillus niger)、黄曲霉(Aspergillus flavus)。以上菌株均保存于河北农业大学酶工程实验室。
营养肉汤、胰蛋白胨 北京奥博星生物技术有限责任公司;溶菌酶 德国Sigma公司;Tris平衡酚 北京索莱宝科技有限公司;λ-HindⅢ DNA Marker 大连宝生物有限公司;彩色预染超低分子蛋白分子质量标准 上海奥威生物科技有限公司;甲叉双丙烯酰胺、Tricine 北京Biotopped有限公司。
1.2 仪器与设备
ZWY-2102C恒温培养振荡器 上海智城仪器公司;3-15台式离心机 美国Sigma公司;DYY-6C型电泳仪北京六一仪器厂;凝胶成像系统 英国Uvitec公司;2489高效液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 侧孢短芽孢杆菌S62-9天然质粒的提取
采用十二烷基硫酸钠(sodium dodecyl sulfate,SDS)法[19]提取质粒。
1.3.2 质粒的转化和筛选
枯草芽孢杆菌感受态的制备及转化采用高渗透法[20]。电转后稀释涂布于含侧孢短芽孢杆菌抗菌肽(80 AU/mL)的选择培养平板上,37 ℃过夜培养。挑取单菌落,接种到营养肉汤培养基中37 ℃振荡培养过夜。取1 mL菌液12 000 r/min离心2 min收集菌体,用SDS法提取质粒,1%琼脂糖凝胶电泳检测有无质粒。同时对各转化子发酵液进行抑菌活性的测定。既有质粒,又具抑菌活性的为阳性转化子。
1.3.3 抑菌活性的测定
抑菌活性测定采用琼脂平板扩散法[21]。取1 mL指示菌菌悬液(2×108CFU/mL)与冷却至40~50 ℃的25 mL营养琼脂混匀后倒入无菌平皿(直径90 mm),冷却凝固后用打孔器打孔(直径6 mm),加入发酵液50 μL,37 ℃恒温正置培养20 h,用游标卡尺测量抑菌圈直径。
1.3.4 转化子Z4的发酵曲线和效价的测定
将活化好的Z4种子液取1 mL(1×108CFU/mL)接种到100 mL营养肉汤培养基中,37 ℃振荡培养,共设3 个平行。每隔4 h取2 mL菌液加入比色杯中,在600 nm波长处测量吸光度。同时12 000 r/min离心1 min收集发酵液按1.3.3节的方法进行抑菌圈的测定,绘制转化子Z4的生长曲线和效价的变化曲线。
效价的测定采用二倍稀释法[23],以不产生肉眼可见的抑菌圈为终点,计算表达产物对指示菌SA137的抑菌效价。效价与抑菌圈直径之间的线性关系为y=0.171 4x+0.753 4,式中x为抑菌圈直径,y为效价对数值,R2=0.991 6。
1.3.5 S62-9、Z4、Wb800发酵液的Tricine-SDS-PAGE
将原始菌株S62-9、转化子Z4和受体Wb800接种于营养肉汤培养基,37 ℃条件下培养过夜,取菌液煮沸5 min后12 000 r/min离心1 min,取上清液进行Tricine-SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE),电泳方法参照文献[22]。
1.3.6 反相高效液相色谱(reverse phase-high performance liquid chromatography,RP-HPLC)分析Z4表达产物
首先参照专利[24]采用活性炭吸附-乙醇解吸附的方法对Z4表达产物进行提取。将提取后的Z4表达产物用0.22 μm膜过滤,以除去不溶杂质和细菌等物质,装入RP-HPLC样品专用小管备用。以自制的来源于原始菌株S62-9的抗菌肽纯品为标准对照。流动相A:0.1%三氟乙酸的5%乙腈溶液;流动相B:0.1%三氟乙酸的70%乙腈溶液。
表1 半制备型RP-HPLC梯度洗脱条件
Table 1 Semi-preparative RP-HPLC gradient elution conditions

RP-HPLC制备条件:流速3 mL/min;检测波长220 nm;柱温30 ℃;上样量400 μL;洗脱方法见表1。
1.3.7 表达产物抑菌谱的测定
使用适宜的培养基和温度活化培养各个指示菌,制备成菌悬液,其中霉菌制备为孢子悬液。抑菌活性测定方法同1.3.3节。
1.3.8 温度对表达产物抑菌活性的影响
取100 μL发酵液,分别在20、40、60、80、100、121 ℃保温20 min,用冰水迅速冷却,测定其抑菌活性,反应共设3 个平行,以20 ℃条件下的处理作为对照。
取100 μL发酵液,在100 ℃沸水浴中分别处理10、20、40、60 min。用冰水迅速冷却,测定其抑菌活性,反应共设3 个平行,以未加热的发酵液作为对照。
1.3.9 pH值对表达产物抑菌活性的影响
取100 μL发酵液,分别与pH 2~12的HCl和NaOH溶液等体积混合,37 ℃保温1 h,反应结束后加入100 μL 0.2 mol/L pH 8.5的Tris-HCl调回原始pH值,测定其抑菌活性,反应共设3 个平行,以加等体积水的作为对照。
1.3.10 蛋白酶对表达产物抑菌活性的影响
取100 μL发酵液,分别加入100 μL 1 mg/mL的酶液(胃蛋白酶溶于pH 2.5的Na2HPO4-柠檬酸缓冲液,蛋白酶K、胰蛋白酶、酸性蛋白酶、中性蛋白酶等溶于0.05 mol/L pH 7.5 Tris-HCl缓冲液中),在37 ℃条件下反应1 h。反应结束后100 ℃沸水浴5 min灭活,用0.1 mol/L NaOH溶液调回原始pH 8.5后定容至相同体积,测定其抑菌活性,反应共设3 个平行,以不加酶的相同处理为对照。
2.1 侧孢短芽孢杆菌S62-9质粒的转化与筛选
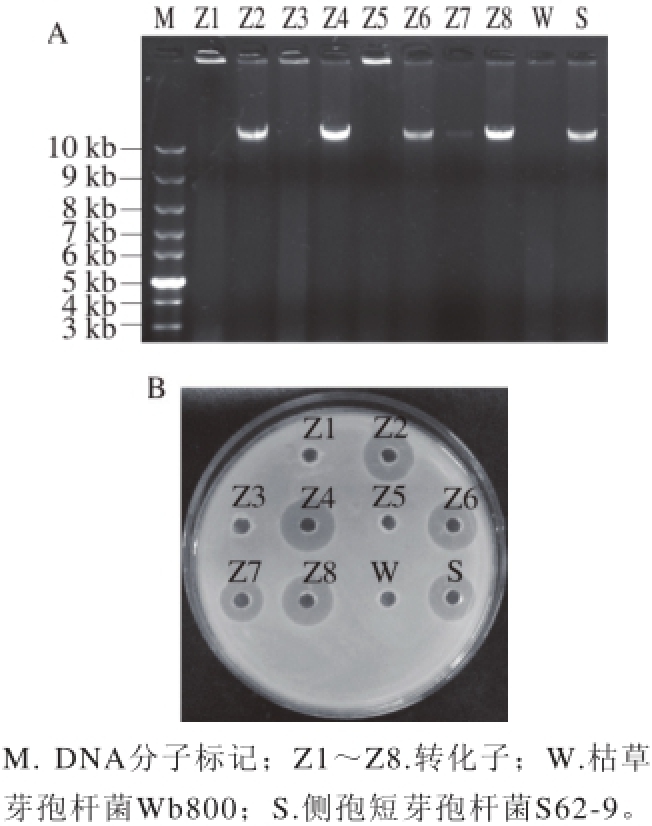
图1 转化子的质粒提取结果(A)和抑菌圈鉴定(B)
Fig. 1 Plasmid identifi cation (A) and inhibition zones of transformants (B)
用SDS法提取侧孢短芽孢杆菌S62-9的天然质粒,经1%琼脂糖凝胶电泳检测得到一条清晰明亮的条带,大于10 kb,将其电击转化到枯草芽孢杆菌Wb800中,对选择培养基筛选得到的部分转化子进行培养,提取质粒和发酵液的抑菌圈测定。电泳检测结果如图1,其中W为枯草芽孢杆菌Wb800,S为侧孢短芽孢杆菌S62-9,发现其中5 株已成功转入S62-9的天然质粒(泳道Z2、Z4、Z6~Z8),同时这些阳性转化菌株也表现出抑菌活性(图1B),而受体菌株Wb800无质粒也无抑菌活性(泳道W,孔W),随机选择泳道Z4的菌株命名为Z4做后续发酵液的性质研究。
2.2 转化子Z4的发酵曲线
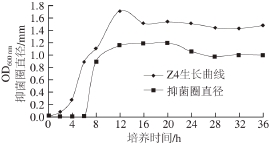
图2 转化子Z4的生长曲线及抑菌活性
Fig. 2 Growth curve and antibacterial activity of transformant Z4
由图2可知,发酵4 h后细胞进入对数生长期,12 h后生长趋于平缓。抑菌圈在6 h后开始出现, 在12~20 h内抑菌圈直径达到最大并稳定,抑菌物质产量达到620.96 AU/mL,20 h后抑菌圈直径有所下降。
2.3 S62-9、Z4和Wb800发酵液的Tricine-SDS-PAGE

图3 原始菌株S62-9(S)、转化子Z4(Z)和Wb800(W)发酵液的Tricine-SDS-PAGE
Fig. 3 Tricine-SDS-PAGE of fermentation products from S62-9 (S), Z4 (Z) and Wb800 (W)
由图3可知,Wb800的发酵液基本没有条带存在,S62-9发酵液有的条带在Z4发酵液中基本都有,结果表明S62-9质粒在枯草杆菌Wb800成功得到表达,且胞外产物代谢条带相同。
2.4 Z4表达产物的RP-HPLC分析
随机选择Z4转化子进行发酵培养,并利用RP-HPLC技术分析了转化子Z4的表达产物(图4B)及原始菌株B. laterosporus S62-9的侧孢短芽孢杆菌抗菌肽标品(图4A)的色谱峰。通过对待测样品(图4D)和标品(图4C)的色谱峰进行局部放大,可以看出待测样品的样品保留时间和色谱峰形状与标品基本一致,推断转化子Z4表达的抗菌物质与原始菌株S62-9的抗菌肽为同种物质。这也说明了原始菌株S62-9的抗菌肽基因是位于质粒上。
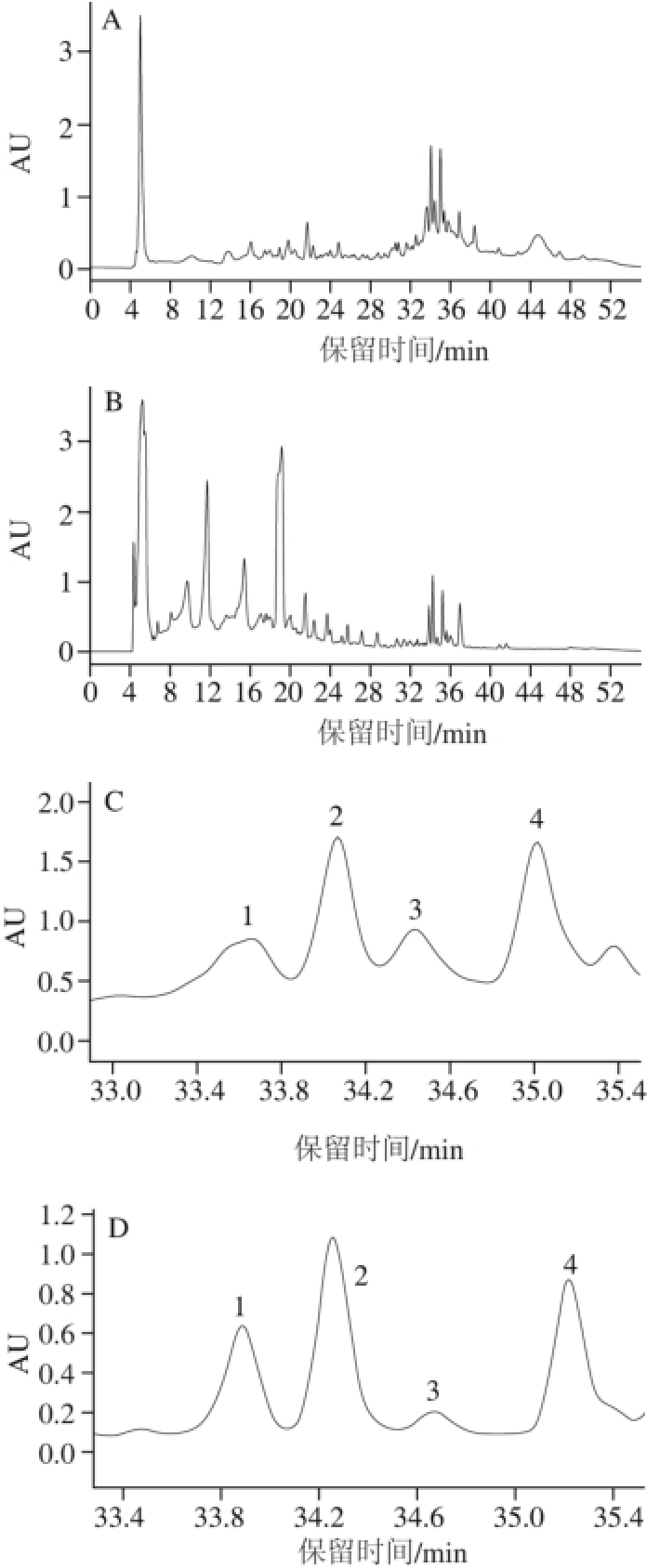
图4 S62-9标品(A)与Z4表达产物(B)的色谱分析图及其局部放大图(C、D)
Fig. 4 Chromatograms of standard S62-9 (A) and expression products from strain Z4 (B) and their partial enlarged views (C, D)
2.5 Z4表达产物的抑菌谱
由表2可知,Z4菌株发酵液对供试的5 株G+菌株均有明显的抑菌活性;7 株G-细菌中,除了黏质沙雷氏菌外,对其余6 种指示菌株的效果明显;在4 株真菌中只有酿酒酵母没有抑菌圈,其余3 株均有抑菌效果。总体来看,该物质广谱抗菌,对于G+、G-和真菌均有抑菌活性而且对于G+菌株的抑菌效果优于G-菌株和真菌。
表2 转化子Z4的抑菌谱
Table 2 Antimicrobial spectrum of transformant Z4
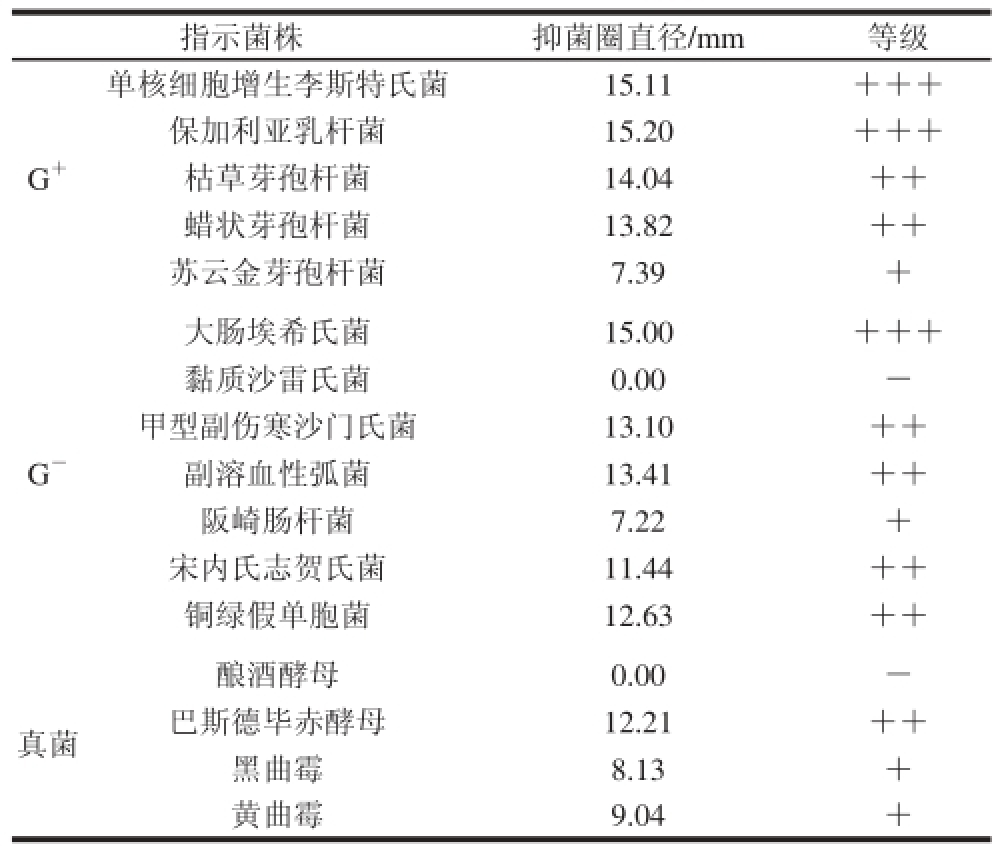
注:+.抑菌圈直径≤10 mm;++. 10 mm<抑菌圈直径<15 mm;++
+.抑菌圈直径≥15 mm;-.无抑菌圈。
2.6 温度对表达产物抑菌活性的影响
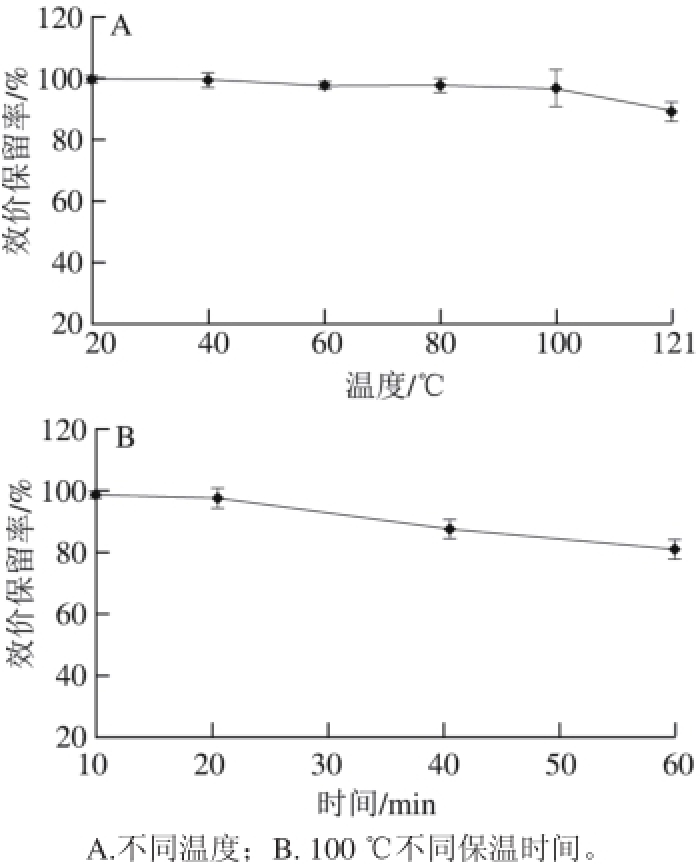
图5 温度对表达产物抑菌活性的影响
Fig. 5 Infi uence of temperature on the antibacterial activity of the expression products
由图5A可知,100 ℃条件下处理后,表达产物的效价保留率为97%,121 ℃条件下处理后的效价保留率约为90%。在100 ℃条件下保温10~60 min的效价保留率随时间的延长而降低,保温60 min后仍有81%的活性(图5B)。结果表明该物质对于高温的耐受性很强,有良好的热稳定性。
2.7 pH值对表达产物抑菌活性的影响
由图6可知,经酸碱溶液处理后的表达产物效价保留率没有明显变化,均在95%以上。结果说明该抑菌物质的酸碱稳定性好,可以耐受不同pH值作用的影响。
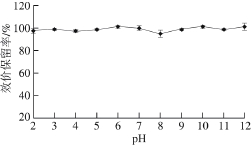
图6 pH值对表达产物抑菌活性的影响
Fig. 6 Infi uence of pH on the antibacterial activity of the expression products
2.8 蛋白酶对表达产物抑菌活性的影响
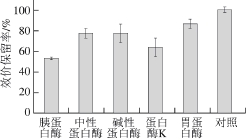
图7 不同蛋白酶对表达产物抑菌活性的影响
Fig. 7 Infi uence of different proteases on the antibacterial activity of the expression products
由图7可知,与对照相比,蛋白酶处理后效价保留率均有所降低,其中胰蛋白酶和蛋白酶K处理后对抑菌活性的影响较大,效价保留率减小了40%左右,胃蛋白酶的影响较小,效价保留率在85%以上。结果说明发酵液中的抑菌物质中含有肽或者是蛋白质,也说明S62-9天然质粒异源表达后产生的抑菌物质与出发菌株的抑菌物质性质相同,均为肽类抗菌物质。
本研究将包含侧孢短芽孢杆菌抗菌肽基因的天然质粒进行转化不具抗菌活性的枯草芽孢杆菌Wb800受体,转化子Z4在营养肉汤培养基中培养12~20 h后抑菌物质产量最大且稳定,达620.96 AU/mL。转化子Z4与原始菌株S62-9发酵液的Tricine-SDS-PAGE显示产生相似的蛋白质条带,发酵液粗提物的高效液相色谱分析得到了与原始菌株相同的保留时间和色谱峰图。且突变株产抑菌物质性质与原始菌株相同,抑菌谱广,对不同温度、pH值的耐受性好,对蛋白酶敏感,因此能够断定侧孢短芽孢杆菌抗菌肽在枯草杆菌中实现了表达。实验得到了侧孢短芽孢杆菌抗菌肽的表达菌株,可以用于发酵生产,并为侧孢短芽孢杆菌S62-9抗菌肽的遗传基因定位于质粒上提供了证明。
参考文献:
[1] CHAWAWISIT K, LERTCANAWANICHAKUL M. Minimum inhibitory concentration (MIC) of crude preparations of Brevibacillus laterosporus SA14 bioactive material compared to vancomycin and oxacillin, against clinical isolates of methicillin-resistant Staphylococcus aureus[J]. World Journal of Microbiology and Biotechnology, 2008, 24(10): 2199-2204. DOI:10.1007/s11274-008-9730-6.
[2] DONNER S C, JONES D A, MCCLURE N C, et al. Agrocin 434, a new plasmid encoded agrocin from the biocontrol Agrobacterium strains K84 and K1026, which inhibits biovar 2 agrobacteria[J]. Physiological and Molecular Plant Pathology, 1993, 42(3): 185-194. DOI:10.1006/pmpp.1993.1017.
[3] TIEJING L, JIN T, FU H. Study on the inhibition effect of Nisin[J]. The Journal of American Science, 2005, 1(2): 33-37.
[4] KURADE M B, WAGHMODE T R, GOVINDWAR S P. Preferential biodegradation of structurally dissimilar dyes from a mixture by Brevibacillus laterosporus[J]. Journal of Hazardous Materials, 2011, 192(3): 1746-1755. DOI:10.1016/j.jhazmat.2011.07.004.
[5] GOMARE S S, JADHAV J P, GOVINDWAR S P. Degradation of sulfonated azo dyes by the purified lignin peroxidase from Brevibacillus laterosporus MTCC 2298[J]. Biotechnology and Bioprocess Engineering, 2008, 13(2): 136-143. DOI:10.1007/s12257-008-0008-5.
[6] DU R N, LAING M D. Sodium dodecyl sulphate polyacrylamide gel electrophoresis (SDS-PAGE) of crude extracted insecticidal crystal proteins of Bacillus thuringiensis and Brevibacillus laterosporus[J]. African Journal of Biotechnology, 2011, 10(66): 15094-15099. DOI:10.5897/AJB11.026.
[7] SAIKIA R, GOGOI D K, MAZUMDER S, et al. Brevibacillus laterosporus strain BPM3, a potential biocontrol agent isolated from a natural hot water spring of Assam, India[J]. Microbiological Research, 2011, 166(3): 216-225. DOI:10.1016/j.micres.2010.03.002.
[8] ZUBASHEVA M V, GANUSHKINA L A, SMIRNOVA T A, et al. Larvicidal activity of crystal-forming strains of Brevibacillus laterosporus[J]. Applied Biochemistry and Microbiology, 2010, 46(8): 755-762. DOI:10.1134/S0003683810080041.
[9] PESSANHA R R, CARRAMASCHI I N, dos SANTOS MALLET J R, et al. Evaluation of larvicidal activity and effects on post embrionary development of laboratory reared Lucilia cuprina (Wiedemann, 1830) (Diptera: Calliphoridae), treated with Brevibacillus laterosporus[J]. Journal of Invertebrate Pathology, 2015, 128: 44-46. DOI:10.1016/ j.jip.2015.04.006.
[10] de OLIVEIRA E J, RABINOVITCH L, MONNERAT R G, et al. Molecular characterization of Brevibacillus laterosporus and its potential use in biological control[J]. Applied and Environmental Microbiology, 2004, 70(11): 6657-6664. DOI:10.1128/ AEM.70.11.6657-6664.2004.
[11] KURADE M B, WAGHMODE T R, KHANDARE R V, et al. Biodegradation and detoxification of textile dye Disperse Red 54 by Brevibacillus laterosporus and determination of its metabolic fate[J]. Journal of Bioscience and Bioengineering, 2016, 121(4): 442-449. DOI:10.1016/j.jbiosc.2015.08.014.
[12] 剧建格, 于宏伟, 韩军, 等. 广谱高效抑菌物质产生菌的筛选及鉴定[J].微生物学通报, 2009, 36(5): 689-693. DOI:10.13344/j.microbiol. china.2009.05.005.
[13] 杨倩, 于宏伟, 郭润芳, 等. 侧孢短芽孢杆菌S62-9产抗菌物质的分离纯化及部分特性的研究[J]. 河北农业大学学报, 2010, 33(2): 74-78.
[14] 赵璟. 侧孢短芽孢杆菌A60抗菌肽分离纯化与功能分析[D]. 北京:中国农业科学院, 2012: 9-20.
[15] 陈杰, 魏鸿刚, 罗远婵, 等. 海洋芽胞杆菌B-9987产新型抗菌环脂肽Marinhysin A的培养基优化[J]. 中国生物工程杂志, 2013, 33(1): 84-89. DOI:10.13523/j.cb.20130114.
[16] 王岩, 王红英, 钱斯日古楞, 等. 海洋侧孢短芽孢杆菌的分离鉴定及其抗菌活性物质初步研究[J]. 工业微生物, 2014, 44(6): 28-33. DOI:10.3969/j.issn.1001-6678.2014.06.005.
[17] 吴清平, 黄静敏, 张菊梅, 等. 细菌素的合成与作用机制[J]. 微生物学通报, 2010, 37(10): 1519-1524. DOI:10.13344/j.microbiol. china.2010.10.018.
[18] PAN S J, CHEUNG W L, LINK A J. Engineered gene clusters for the production of the antimicrobial peptide microcin J25[J]. Protein Expression and Purification, 2010, 71(2): 200-206. DOI:10.1016/ j.pep.2009.12.010.
[19] 宫占元, 王艳杰. 侧孢芽孢杆菌质粒提取方法的探究[J]. 黑龙江八一农垦大学学报, 2005, 17(6): 9-12. DOI:10.16519/j.cnki.1004-311x.2005.06.018.
[20] XUE G P, JOHNSON J S, DALRYMPLE B P. High osmolarity improves the electro-transformation efficiency of the gram-positive bacteria Bacillus subtilis and Bacillus licheniformis[J]. Journal of Microbiological Methods, 1999, 34(3): 183-191. DOI:10.1016/S0167-7012(98)00087-6.
[21] VALGAS C, de SOUZA S M, SMÂNIA E F A, et al. Screening methods to determine antibacterial activity of natural products[J]. Brazilian Journal of Microbiology, 2007, 38: 369-380. DOI:10.1590/ S1517-83822007000200034.
[22] SCHÄGGER H. Tricine-SDS-PAGE[J]. Nature Protocols, 2006, 1(1): 16-22. DOI:10.1038/nprot.2006.4.
[23] 柯芳芳. 清酒乳杆菌素LSJ618对藤黄微球菌及鸡白痢沙门氏菌的抑菌机理[D]. 合肥: 安徽农业大学, 2013: 45-54.
[24] 贾英民, 李兴峰, 王志新, 等. 一种从发酵液中快速提取食用抗菌肽的方法: CN201210019936[P]. 2012-07-11.
Expression of Natural Plasmid Harboring an Antimicrobial Peptide Gene in Bacillus subtilis
ZHANG Nan1, LIU Yang1, YU Hongwei1, KE Xiaojing1, GUO Runfang1,*, JIA Yingmin1,2
(1. College of Food Science and Technology, Agricultural University of Hebei, Baoding 071000, China; 2. College of Bioscience and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China)
Abstract:The antimicrobial peptide produced by Brevibacillus laterosporus shows effi cient, broad-spectrum, and stable antimicrobial activities, which are closely associated with the endogenous plasmid in B. laterosporus S62-9. In order to study the feasibility of heterologous expression of B. laterosporus plasmid with antimicrobial peptide genes, B. laterosporus S62-9 plasmid was transferred into Bacillus subtilis Wb800 by electroporation. The positive transformants were screened and the expression products were characterized. The results showed that strain Z4 showed an antimicrobial activity after fermentation for 6 h, reaching the highest titer (620.96 AU/mL) during 1220 h. Tricine-SDS-PAGE indicated that B. laterosporus plasmid was successfully expressed in B. subtilis. Reversed-phase high performance liquid chromatography (RP-HPLC) analysis showed that the expression products of strain Z4 and B. laterosporus antimicrobial peptide cont ained the same substances, which showed broad-spectrum antimicrobial activities with high stability. Both of them displayed strong antimicrobial activities against Gram-positive bacteria, Gram-negative bacteria and fungi, especially against Gram-positive bacteria. About 90% and 81% of the titer was retained after 20 min at 121 ℃ and after 60 min at 100 ℃, respectively. The antimicrobial activity showed a slight change in the pH range of 212. However, the antimicrobial peptide was more sensitive to proteases and the titer was reduced by about 40% after treatment with trypsin or proteinase K, and was also reduced after treatment with three other proteases. The establishment of strain Z4 may lay a foundation for the industrial production of antimicrobial peptide in the future, and provide evidence for positioning the B. laterosporus antimicrobial peptide gene on plasmid.
Key words:Brevibacillus laterosporus; natural plasmid; heterologous expression; antimicrobial peptide; inhibitory titers
引文格式:
引文格式:
张楠, 刘洋, 于宏伟, 等. 含抗菌肽基因的天然质粒在枯草杆菌中的表达[J]. 食品科学, 2017, 38(8): 24-29. DOI:10.7506/ spkx1002-6630-201708005. http://www.spkx.net.cn
ZHANG Nan, LIU Yang, YU Hongwei, et al. Expression of natural plasmid harboring an antimicrobial peptide gene in Bacillus subtilis[J]. Food Science, 2017, 38(8): 24-29. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201708005. http://www.spkx.net.cn
DOI:10.7506/spkx1002-6630-201708005
中图分类号:Q785
文献标志码:A
文章编号:1002-6630(2017)08-0024-06
收稿日期:2016-06-12
基金项目:“十二五”国家科技支撑计划项目(2013BAD10B03);河北省教育厅项目(QN2015029);河北省研究生创新项目
作者简介:张楠(1992—),女,硕士研究生,研究方向为微生物。E-mail:zhangnan_e@sina.cn
*通信作者:郭润芳(1969—),女,教授,博士,研究方向为食品微生物。E-mail:runfangg@163.com