
图1 窖泥的理化指标
Fig. 1 Physicochemical indicators of pit muds with different ages
邓 杰,卫春会,边名鸿,黄治国*
(四川理工学院 酿酒生物技术及应用四川省重点实验室,四川 自贡 643000)
摘 要:用高通量测序技术对浓香型白酒不同窖龄窖池窖泥中古菌群落结构进行研究,找出其差异性,并利用古菌群落结构信息对不同窖龄窖泥进行聚类分析,同时分析环境因子对各个窖龄段窖泥古菌的影响。结果表明,窖泥中的古菌群落主要分布于Euryarchaeota(占99% OTU数目),分布于7 个属;窖泥中古菌的多样性与窖龄呈负相关,Methanobacterium和Methanocorpusculum的优势度与窖龄呈正相关,Thermoplasmatales的优势度与窖龄呈负相关;5 a窖龄的不同窖池窖泥和100 a窖龄不同窖池窖泥微生物群落相似性较高,30 a窖龄的不同窖池窖泥微生物群落差异性较大,对各窖龄段窖泥中古菌群落影响最大的环境因子各不相同。浓香型白酒不同窖龄窖池窖泥古菌群落结构差异性明显,这可能是不同窖龄窖池发酵产酒存在差异性的重要原因之一。
关键词:古菌群落;高通量测序;聚类分析;浓香型白酒;窖泥
中国白酒酿造有上千年的历史,是我国最具特色的地域性产品之一,被誉为世界六大蒸馏酒之一,浓香型白酒是中国白酒的典型代表香型之一,具有绵柔甘洌、芳香浓郁、香味协调、尾净余长、入口甜、落口绵等特点[1]。浓香型白酒的发酵是以酒醅作为原料,窖池为载体,经过一系列复杂的物质能量代谢,大量的微生物是这个过程的主要实施者[1-2]。窖池对浓香型白酒生产过程十分重要,俗称“千年窖池万年糟,老窖产好酒”,在酒醅入窖后,窖泥中大量微生物参与这一发酵过程,老窖池中的窖泥经过几十年甚至上百年的发酵驯化,有利于白酒发酵的微生物适应了窖池环境[3],这可能是优质老窖池能生产高质量白酒的重要原因之一。
近年来,随着科技的发展涌现出了许多研究窖池环境微生物的新方法[4-6],通过对窖泥微生物的研究发现古菌是窖池中一类重要的原核微生物。早在上世纪八十年代研究者提出窖泥中的古菌与其他原核生物有共生关系[2],如布氏甲烷杆菌利用己酸菌的次级代谢产物产甲烷,而解除己酸菌的代谢抑制[3]。但由于窖泥微生物是一个复杂的群体,窖泥中的古菌难以利用现有方法筛选出来,所以研究人员利用分子生物学的手段对窖泥中古菌群落加以认识,但浓香型白酒不同窖龄窖池窖泥古菌群落结构差异性分析较少。前期对浓香型白酒窖池窖泥古菌群落结构做了简单的剖析[7],随着研究的深入,发现在不同窖龄窖泥中古菌的群落存在一定的差异性,浓香型白酒窖池窖泥中古菌群落存在空间差异性[8],不同质量窖泥中古菌群落结构有所差异,不同窖龄窖泥中的Methanobrevibacter和Methanosarcina的丰度存在差异性[9-10]。为了更加全面地了解窖泥中古菌的群落组成,利用高通量测序技术对窖泥中古菌群落进一步解析,已有研究者对浓香型白酒窖泥20、50、150 a窖龄段窖泥中的古菌进行了解析[3],本实验对泸洲某浓香型酒厂5、30、100 a窖龄段窖泥中古菌群落结构利用高通量测序进行分析,比较相同窖龄段的窖泥古菌群落结构,找到其相似性,比较不同窖龄窖泥中古菌群落结构,找到其差异性,为更好地认识浓香型白酒窖池窖泥中古菌的结构提供理论基础。
1.1 材料与试剂
窖泥样品采自四川泸州某公司白酒生产窖池,包括1号生产基地的3 口5 a窖池窖泥(分别标号为1、2、3号)和3 口30 a窖池窖泥(分别标号为4、5、6号),2号生产基地的3 口100 a窖池窖泥(分别标号为7、8、9号)。于窖池壁(采5 点样品混合,距窖壁四角50 cm的4 个点和中心1 个点)和窖池底(采5 点样品混合,距窖底四角50 cm的4 个点和中心1 个点)分别取样,迅速置于冰盒运回,-20 ℃条件下保藏。
TaqDNA聚合酶、dNTPs、DL2000TMDNA Marker宝生物工程(大连)有限公司;蛋白酶K 德国Merck公司;溶菌酶 美国Sigma公司;琼脂糖、丙烯酰胺、N,N′-亚甲基双丙烯酰胺、去离子甲酰胺 北京Solarbio公司;引物 上海英潍捷基生物技术公司;QIAquick Gel Extraction Kit 德国Qiagen公司;MIBIO UltraCleanSoilDNA Isolation Kit 美国Mobio公司;Quant-iTPicoGreen定量试剂盒 美国Thermo Fisher Scientifi c公司;其他常规试剂购自成都科龙化工试剂厂。
1.2 仪器与设备
水平电泳仪、凝胶成像分析系统、Thermal Cycler S1000聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;X1R高速冷冻离心机、酶标仪 美国Thermo公司;MX-S型可调式混匀仪 美国赛洛捷克公司;GS junior测序平台 美国Roche公司;电感耦合等离子体发射光谱(inductively coupled plasma optical emission spectrometer,ICP-OES)仪 美国PerkinElmer公司。
1.3 方法
1.3.1 窖泥环境因子的检测
烘干法测定水分,滴定法测定酸度,凯氏定氮法测定总氮,纳氏试剂比色法测定铵态氮,油浴法测定腐殖质,钼酸钠比色法测定有效磷[11];利用ICP-OES检测窖泥中的矿质元素[12]。
1.3.2 总DNA提取及文库构建
采用MIBIO UltraCleanSoilDNA Isolation Kit[13]试剂盒提取窖泥中微生物总宏基因组,然用利用核酸蛋白仪检测DNA的提取效果,Quant-iTPicoGreen定量试剂盒检测DNA的浓度,置于-20 ℃备用。
选用通用引物109F-518RMID[14]进行扩增。PCR体系(25 μL)包括:2.5 μL 10×buffer,2 μL 25 mmol/L dNTP,2 μL MgCl2,正反向引物10 μmol/L各0.5 μL,0.5 μL 5 U/μL Ex Taq DNA 聚合酶,DNA模板用量为1 μL(原液DNA稀释20 倍),16 μL ddH2O;PCR程序为:Touch Down PCR,94 ℃预变性4 min;94 ℃变性15 s,55 ℃退火30 s,72 ℃延伸80 s;72 ℃延伸10 min。PCR结果于1%琼脂糖凝胶上电泳,取3 μL DL2000TMDNA Marker为对照,电泳电压140 V,电泳时间30 min,溴化乙锭染色,凝胶成像观察,拍照保存。
采用QIAquick Gel Extraction Kit[15]胶回收试剂盒对PCR扩增产物进行切胶回收,然后按照PCR产物的检测方法检测。采用Quant-iTPicoGreen定量试剂盒对胶回收之后的PCR产物进行定量。
1.3.3 高通量测序
将定量的DNA文库样本进行扩增子浓度计算,然后设计制定emPCR体系[16],emPCR程序为:94 ℃预变性4 min;94 ℃变性30 s,58 ℃退火4.5 min,68 ℃延伸30 s,50 个循环;10 ℃保存。扩增完成后经过处理检测emPCR扩增结果。将扩增子按要求稀释[16],然后将稀释之后的扩增子采用GS Junior测序仪进行测序。
1.4 数据分析
高通量测序数据分析:利用Mothur软件对测序数据进行总体分析后[17],再利用Silva数据库进行16S rRNA基因序列的比对[18],获得可操作分类单元(operational taxonomic unit,OTU)分类,确定序列对应微生物的分类学地位。同时对处理好的数据使用统计学的分析方法,利用SPSS软件对数据进行方差分析,观测样本在门和属分类水平上的群落结构[19],所得数据在Excel中编辑作图,利用Canoco软件进行冗余分析(redundancy analysis,RDA)并作图。
2.1 窖泥的理化指标

图1 窖泥的理化指标
Fig. 1 Physicochemical indicators of pit muds with different ages
共测定7 个窖泥的理化指标,其中在3 个窖龄段中有显著性差异的指标有总氮含量和铵态氮含量,这2 个指标与窖龄的变化呈正相关;水分和有效磷含量与窖龄的变化也呈现正相关,但其差异性不显著;酸度、腐殖质含量和Ca含量在3 个窖龄段中没有明显的相关性。
2.2 样品文库构建
表1 窖泥样品DNA质量检测
Table 1 Purity of bacterial DNA from different pit mud samples
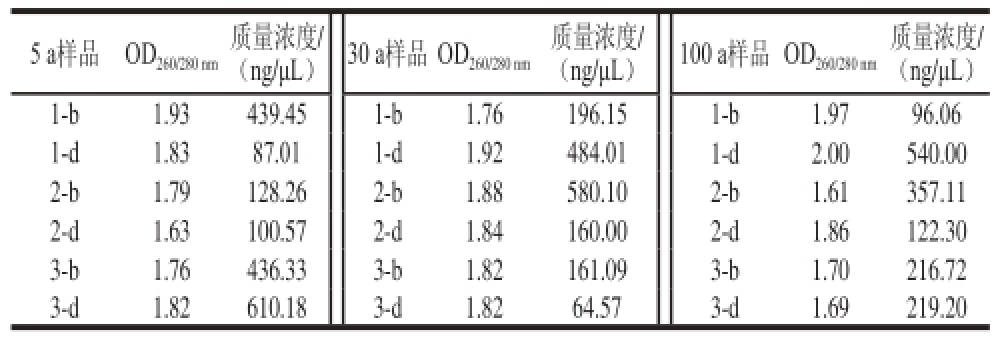
注:b.代表窖池壁;d.代表窖池底部,如1-b代表1号窖池壁部窖泥样,1-d代表1号窖池底部窖泥样;OD260nm代表核酸的光密度;OD280nm代表蛋白质的光密度。
表2 PCR产物质量浓度
Table 2 Concentration of PCR products
DNA质量浓度标准曲线R2均大于0.98,标准曲线合格。由表1可知,30 a窖龄段窖泥效果较好,OD260/280nm均接近于1.8,同时质量浓度较高,100 a窖龄段样品所提取DNA效果较差,一口窖池的DNA的OD260/280nm检测在1.9~2.0范围内,表明RNA较多,其余两口DNA的OD260/280nm检测大多数在1.7左右,表明蛋白或酚类杂质较多,对于每口窖池将窖池壁样品和窖池底样品分别提取DNA,然后相同质量浓度混合进行PCR扩增;由表2可知,各个样品PCA扩增较好,样品质量浓度均在20~100 ng/μL,满足测序要求。
2.3 不同窖龄窖泥中古菌群落结构分析
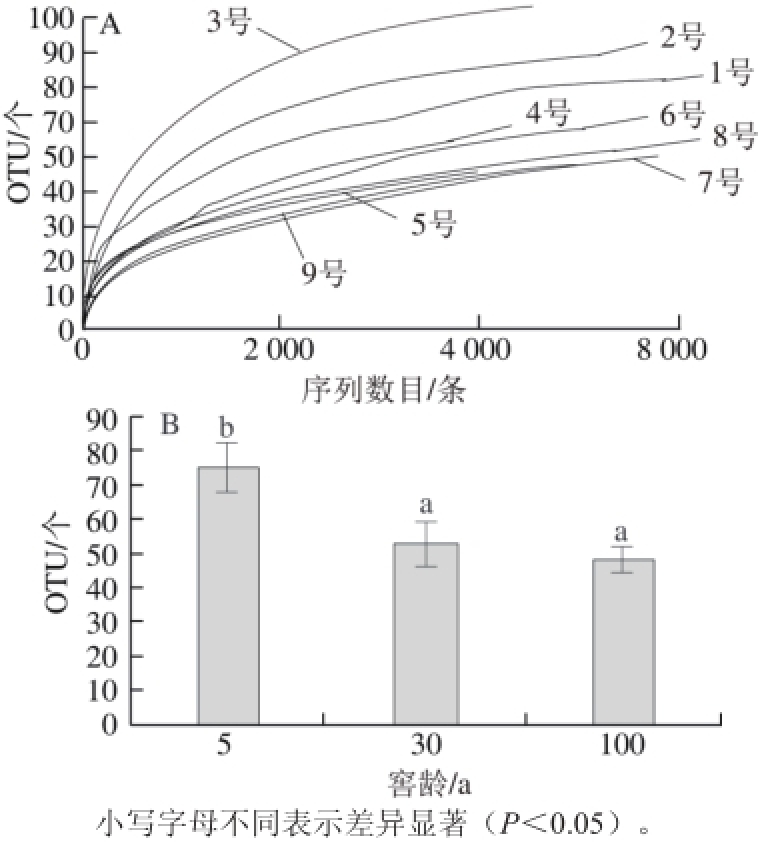
图2 稀释曲线(A)和窖泥中古菌OTU数量(B)
Fig. 2 Rarefaction curve and OTU classifi cation of archaea in pit muds with different ages
对测序数据利用Mothur软件进行分析(图2A),3 个窖龄段的9 个样品共获得序列70 000 条左右,平均测序长度为410 bp左右,有效序列达到总测序序列的85.75%,获得序列最少的样品为8号窖池,共有4 800 条序列,获得序列最多的样品为6号窖池,共有9 400 条序列,各个窖龄段样品获得序列的平均数随着窖龄的增加而减少。
3 个窖龄段9 口窖池窖泥中古菌共发现137 个OTU,获得OTU分类最少的样品为9号窖池,共有36 个OTU,获得OTU分类最多的样品为3号窖池,共有93 个OTU,3 个窖龄段窖泥中古菌OTU分布随窖龄的增加呈现递减的规律,5 a窖龄段窖泥中古菌共获得75 个OTU,占总OTU的54.7%,30 a窖龄段窖泥中古菌共获得53 个OTU,占总OTU的38.7%,100 a窖龄段窖泥中古菌共获得49 个OTU,占总OTU的35.8%(图2B)。

图3 不同窖龄窖泥中各古菌种类数量
Fig. 3 Relative archaea quantities in pit muds with different cellar ages
窖泥样品中古菌均属于Euryarchaeota,分布于3 个纲,分别是Thermoplasmata、Methanobacteria和Methanomicrobia,占已知菌群的7%左右。由图3可知,5 a窖龄段窖泥中OTU数目最多的菌是Thermoplasmata(38 个OTU,占50%),其余纲类Methanobacteria(19 个OTU,占25%)和Methanomicrobia(14 个OTU,占19%),共有7 个OTU,占8%;30 a窖龄段窖泥中OTU数目最多的菌是Thermoplasmata(22 个OTU,占42%),其余纲类Methanobacteria(17 个OTU,占32%)和Methanomicrobia(11 个OTU,占20%),共有3 个OTU,占5%;100 a窖龄段窖泥中OTU数目最多的菌是Methanobacteria(18 个OTU,占37%),其余纲类Thermoplasmata(18 个OTU,占37%)和Methanomicrobia(9 个OTU,占18%),共有3 个OTU,占6%。随着窖龄的增加窖泥中的古菌的多样性有所减少,Thermoplasmata和Methanomicrobia的多样性随窖泥窖龄的增加而减少,Methanobacteria在各个窖龄窖泥中的多样性保持稳定,所占比例随窖龄的增加而增加。
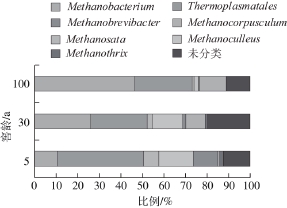
图4 不同窖龄窖泥样品古菌科属分布
Fig. 4 Genus distribution of archaea in pit muds with different cellar ages
以占1%的测序数量为优势菌属进行划分,窖泥样品中共检出7 个优势古菌属,分别是Thermoplasmatales、Methanobrevibacter、Methanosata、Methanoculleus、Methanobacterium、Methanocorpusculum和Methanothrix类群。由图4可知,在5 a窖龄段窖泥中主要的占比最高的属为Thermoplasmatales,达到40%,Methanobrevibacter、Methanosata、Methanoculleus、Methanobacterium、Methanocorpusculum和Methanothri占比分别为12%、7%、16%、10%、1%和2%,在30 a窖龄段窖泥中Thermoplasmatales和Methanobacterium所占比例比相当,分别为29%和28%,Methanoculleus所占比例为15%,Methanocorpusculum、Methanobrevibacter和Methanothrix占比分别为9%、2%和1%;在100 a窖龄段窖泥中主要的占比最高的属为Methanobacterium,达到47%,Thermoplasmatales、Methanocorpusculum和Methanoculleus所占比例分别为27%、12%和2%,Methanobrevibacter、Methanosata和Methanothrix占比例均低于1%。综上可知,窖泥中古菌的群落结构随着窖龄的增加更加简单化,Thermoplasmatales在古菌群落中所占比例随窖龄的增加呈现减少的趋势,Methanobacterium在古菌群落中所占比例随窖龄的增加呈现增加的趋势。
2.4 不同窖龄窖泥中古菌群落的相似性分析

图5 不同窖龄窖泥古菌进化树
Fig. 5 Phylogenetic tree of archaea in pit mud with different cellar ages

图6 不同窖龄窖泥古菌优势菌属聚类分析
Fig. 6 Cluster analysis of the main archaeal genera in pit muds with different cellar ages
通过Mothur软件对测序各个窖池数据进行进化树(phylogenetic tree)分析,得到所测样品的聚类树,然后对树进行整理,得到所测样品细菌和古菌的聚类树。同时,对各个不同窖龄样品中古菌以占1%的测序数量为优势菌属,利用SPSS软件进行聚类分析,选用ward法。从phylogenetic tree(图5)可以看出3 个窖龄段的9 个样品整体聚为2类,100 a窖龄段3 个样品和30 a 6号4 个样品聚为一类,5 a窖龄段3 个样品、30 a 4号和5号5 个样品聚为一类;从优势微生物聚类树分析(图6)可知100 a窖龄段3 个样品和30 a 4号和5号距离较近,5 a窖龄段3 个样品和30 a 6号距离较近。综合phylogenetic tree和优势菌的聚类树分析可以看出,两种分析结果较为一致,5 a窖龄的3 口窖池和100 a窖龄的3 口窖池根据古菌群落结构能较好进行聚类,说明其古菌群落较为相似,相之,说明30 a窖龄的3 口窖池古菌群落结构有较大的差异性。
2.5 不同窖龄窖泥古菌群落多样性的环境影响因子

图7 古菌群落与环境指标的RDA
Fig. 7 RDA of archaeal community structure and environmental factors
将群落结构信息做去趋势对应分析(图7),轴中梯度最长为2.11,小于3,选择对窖泥古菌菌落和环境因子做RDA,其分析结果蒙特卡洛检验值P为0.11。RDA结果可以看出对于5 a窖龄(1~3号样品)窖泥古菌群落结构,酸度对其有相关性;对于30 a窖龄(4~6号)窖泥古菌群落结构,酸度、腐殖质和Ca2+对其有相关性;对于100 a窖龄(7~9号)窖泥古菌群落结构,水分、总氮、铵态氮和有效磷对其有相关性。同时从物种距离也可以看出5 a窖龄的不同窖池窖泥和100 a窖龄不同窖池窖泥微生物群落相似性较高,30 a窖龄的不同窖池窖泥微生物群差异性较大。
生物多样性是生态系统稳定性的基础,窖池中较高水平的生物多样性有利于窖池生态系统功能的发挥[20],对100 a内的3 个窖龄段的窖池窖泥古菌多样性进行分析,发现随着窖龄的增加,窖池中古菌多样性指数呈下降趋势,30 a窖龄窖池中古菌群落的稳定性较差,100 a窖龄窖池古菌群落结构保持相对稳定。许多研究发现窖泥中的原核生物多样性是呈现下降后略有上升然后再下降,最后趋于平稳[21],但是在多样性下降和稳定的时间点有所差异,有研究窖池原核生物多样性认为在10~20 a之间下降期[3],30 a窖龄古菌群落多样性并没有趋于稳定,造成这种差异性原因可能是由于窖池的地域性差异,也有可能是由于窖池本身的古菌群落趋于稳定的过程是一个动态的,窖池中窖泥微生物在发酵过程中受到发酵产生的乙醇以及酸类物质的影响,细菌多样性短时间就有较大的变化,波动较为明显,古菌可以承受高热、高盐度、缺氧的极端环境[21],所以短时间古菌多样性指数波动较小,但由于长时间的发酵驯化,对窖泥中古菌进行筛选(特别是高酸度的环境条件),虽然古菌的属的种类变化较小,但其各个属的优势度变化较大,适应于窖池发酵环境和能发挥相关功能的菌种优势度增加[20],综上可知,可能30 a左右窖龄是窖泥古菌群落达到相对成熟一个窖龄分界线,这也为窖池中窖泥古菌多样性变化规律为窖池连续性使用做评价提供参考,同时也可以说明窖池古菌的多样性越高不一定就能有利于白酒发酵,稳定的生物多样性系统和有利白酒发酵的菌优势度的提高可能是提高窖池发酵质量的条件。窖泥中多样性变化最大的菌属是Thermoplasmatales,虽然相关研究表明Thermoplasmatales耐热,可能也参与了甲烷的厌氧氧化作用[3],白酒酿造过程中该菌种作用相关报道较少,鉴于在各个窖龄段中的Thermoplasmatales占有比例在25%以上,有必要进一步对其研究,窖池中Thermoplasmatales的多样性随着窖龄的增加有所下降,可能是由于窖池高pH和高氨氮等环境可能对Thermoplasmatales的影响;在5 a窖龄段窖泥中甲烷菌类Methanobrevibacter、Methanosata、Methanoculleus和Methanobacterium比例较高,均大于5%,在30 a窖龄段窖泥中Methanobrevibacter和Methanoculleus比例较高,100 a窖龄段窖泥中Methanobacterium和Methanocorpusculum比例较高,在5 a窖龄段中乙酸营养型产甲烷菌比例较高,而在30 a和100 a窖龄段氢营养型产甲烷菌比例较高,而乙酸营养型产甲烷菌显著减少,这可能是窖池在5~30 a左右的这段时间为窖池进一步老熟的过程,许多研究表明这个阶段可能乙酸营养型产甲烷菌在这个过程中起到非常关键的作用[3]。同时,浓香型白酒中是以己酸乙酯和丁酸乙酯为主体香[3],而前人研究表明,在老窖泥中Clostridiales中的多个菌属(如Clostridium、Syntrophomonas和Bacillus等)比例升高[9],这些生香的功能菌(丁酸菌和己酸菌)与甲烷菌有共生关系[22],从代谢过程研究表明,窖泥中的丁酸菌和己酸菌能转化乙酸,放出大量的H2和CO2,这些物质为氢营养型产甲烷菌的生存创造了有利条件,但由于乙酸含量减少,导致乙酸营养型产甲烷菌营养成分减少[3],可能导致其数量减少,这可能就是在30 a或100 a窖泥中氢营养型产甲烷菌比例较高,而乙酸营养型产甲烷菌显著减少的原因。这也可能是甲烷菌在窖池成熟过程中的作用,对阐述老窖产好酒的机理有一定的启示作用。Clostridia和Methanobacteria纲主要存在于优质和正常窖泥样品中[23],而在100 a窖泥中Methanobacteria下的Methanobacterium有较高比例,Methanobacterium与Clostridiales中的生香的功能菌有共生关系,同时存在对酒醅发酵生香产生重要作用。由于这两类菌是厌氧或兼型厌氧,这位后续研究窖泥中古菌和Clostridiales的共生对白酒发酵生香提供参考。从环境因子对窖池古菌群落影响的分析,各窖龄段窖泥中古菌群落影响最大的环境因子各不相同,但在对5 a和30 a窖泥中古菌影响最大的是非营养环境因子,而对100 a窖泥影响最大的是营养环境因子,这种现象与施肥与覆膜对棕壤微生物多样性的影响的例子相似[24],在此非营养因子就如施肥与覆膜对土壤的微生物的影响,是一个外力驯化的过程,在这个过程中营养因子的变化也对窖泥的古菌群落多样性有影响,但不是主要的影响因子,在非营养因子趋于相对稳定时(如100 a窖泥),营养因子的变化成为窖泥的古菌群落多样性变化的主要影响因子。由于现在窖泥的没有相关标准和评价指标,不同窖龄窖泥中的古菌多样性、优势菌属和主要的环境影响因子都不同,这些指标可以供窖泥制作标准和评价指标作参考。本实验在对不同窖龄窖池古菌群落结构的分析中发现了不同的古菌种属随窖龄变化的变化情况,一些古菌种属可能在窖池的老熟过程中起关键作用,有些古菌种属对白酒的香味生成有重要作用,为了进一步获得窖池古菌对白酒生产的相关信息,下一步将围绕两个方向展开研究,一方面是古菌与窖池中其他微生物的作用开展相关研究,另一方面是研究影响窖泥质量的评价指标,为窖池退化的评估和护理提供参考。
参考文献:
[1] 张宿义. 泸型酒技艺大全[M]. 北京: 中国轻工业出版社, 2011: 1-2.
[2] 沈怡方. 白酒生产技术全书[M]. 北京: 中国轻工业出版社, 2013: 8-10.
[3] 王明跃, 张文学, 王海英, 等. 不同窖龄窖泥古菌的系统发育多样性分析[J]. 应用与环境生物学报, 2012, 18(6): 1043-1048. DOI:10.3724/SP.J.1145.2012.01043.
[4] MUYZER G, de WALL E C, UITIERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplifi ed genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3): 695-700.
[5] YAN H, CAI Z C, ZHONG W H. PLFA analysis and its applications in the study of soil microbial diversity[J]. Acta Pedologica Sinica, 2006, 43(5): 851-859.
[6] EICKHORST T, TIPPKTTER R. Improved detection of soil microorganisms using fluorescence in situ hybridization (FISH) and catalyzed reporter deposition (CARD-FISH)[J]. Soil Biology Biochemistry, 2008, 40(7): 1883-1891. DOI:10.1016/ j.soilbio.2008.03.024.
[7] 邓杰, 黄治国, 卫春会, 等. 基于高通量测序的浓香型白酒窖池古菌群落结构分析[J]. 现代食品科技, 2015, 31(7): 50-55. DOI:10.13982/ j.mfst.1673-9078.2015.8.033.
[8] 王明跃, 张文学. 浓香型白酒两个产区窖泥微生物群落结构分析[J].微生物学通报, 2014, 41(8): 1498-1506. DOI:10.13344/j.microbiol. china.130640.
[9] 陶勇, 芮俊鹏, 李家宝, 等. 浓香型白酒窖泥中细菌和古菌的组成与多样性[J]. 化工学报, 2014, 65(5): 1800-1807. DOI:10.3969/ j.issn.0438-1157.2014.05.034.
[10] 黄治国, 甄攀, 罗惠波. 浓香型白酒窖池古菌群落研究[J]. 西南大学学报(自然科学版), 2012, 32(12): 91-96. DOI:1673-9868(2010)12-0091-06.
[11] 王福荣. 酿酒分析与检测[M]. 北京: 化学工业出版社, 2012: 27-28.
[12] 刘烨, 柳小明, 胡兆初, 等. ICP-MS检测地质样品中37 个元素的准确度和长期稳定性分析[J]. 岩石学报, 2007, 23(5): 1203-1210. DOI:1000-0569/2007/023(05)-1203-10.
[13] XIA W, ZHANG C, ZENG X, et al. Autotrophic growth of nitrifying community in an agricultural soil[J]. The ISME Journal, 2011, 5(7): 1226-1236. DOI:10.1038/ismej.2011.5.
[14] ACOSTA-MARTMEZ V, DOWD S E, SUN Y, et al. Pyrosequencing analysis for characterization of soil bacterial populations as affected by an integrated livestock-cotton production system[J]. Applied Soil Ecology, 2010, 45(1): 13-25. DOI:10.1016/j.apsoil.2010.01.005.
[15] SÁNCHEZ O, GASOL J M, MASSANA R, et a1. Comparison of different denaturing gradient gel electrophoresis primer sets for the study of marine bacterioplankton communities[J]. Applied and Environmental Microbiology, 2007, 73(18): 5962-5967. DOI:10.1128/ AEM.00817-07.
[16] MARGULIES M, EGHOLM M, ALTMAN W E, et a1. Genome sequencing in open microfabricated high density picoliter reactors[J]. Nature, 2005, 437(7057): 376-380. DOI:10.1038/nature03959.
[17] XU Chunlan, SUN Rui, QIAO Xiangjin, et al. Protective effect of glutamine on intestinal injury and bacterial community in rats exposed to hypobaric hypoxia environment[J]. World Journal of Gastroenterology, 2014, 20(16): 4662-4674. DOI:10.3748/wjg.v20. i16.4662.
[18] QUAST C, PRUESSE E, YILMAZ P, et al. The SILVA ribosomal RNA gene database project: improved data processing and webbased tools[J]. Nucleic Acids Research, 2013, 41(D1): 590-596. DOI:10.1093/nar/gks1219.
[19] OBERAUNER L, ZACHOW C, LACKNER S, et al. The ignored diversity: complex bacterial communities in intensive care units revealed by 16S pyrosequencing[J]. Scientifi c Reports, 2013, 3: 1403-1413. DOI:10.1038/srep01413.
[20] 张坚超, 徐镱钦, 陆雅海. 陆地生态系统甲烷产生和氧化过程的微生物机理[J]. 生态学报, 2015, 20(35): 6592-6601. DOI:10.5846/ stxb201507091459.
[21] 黄治国, 赵斌, 卫春会, 等. 浓香型白酒窖泥古菌群落结构研究及其系统发育学分析[J]. 现代食品科技, 2014, 30(3): 28-32. DOI:10.13982/j.mfst.1673-9078.2015.8.033.
[22] 叶光斌, 罗惠波, 杨晓东, 等. 基于免培养法研究泸州地区浓香型白酒窖泥原核微生物群落结构[J]. 食品科学, 2013, 34(17): 176-181. DOI:10.7506/spkx1002-6630-201317038.
[23] 胡晓龙. 浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D]. 无锡: 江南大学, 2015: 20-28.
[24] 李双异. 长期施肥与覆膜对栋壤微生物多样性的影响[D]. 沈阳: 沈阳农业大学, 2015: 60-61.
Archaeal Community Analysis of Pit Mud from Cellars of Different Ages for Luzhou-Flavor Liquor
DENG Jie, WEI Chunhui, BIAN Minghong, HUANG Zhiguo*
(Liquor Making Biological Technology and Application of Key Laboratory of Sichuan Province, Sichuan University of Science & Engineering, Zigong 643000, China)
Abstract:In this study, the archaeal community structure in pit mud from cellars of different ages used for the production of Luzhou-fi avor liquor was researched by high-throughput sequencing technology. The diversity of archaeal community was analyzed and cluster analysis of pit mud with different cellar ages was performed based on the obtained data. Also, we investigated the effect of environmental factors on the archaeal community structure of pit mud with different cellar ages. The results were obtained as follows. The main archaeal phylum in the pit mud samples was Euryarchaeota (99% of OTU), consisting of 7 genera. The diversity of archaeal community showed a decreasing trend with increasing age of pit mud. Similarly, the dominance of Methanobacterium and Methanocorpusculum showed a decreasing trend with increasing age of pit mud, contrary to Thermoplasmatales. Similarity of archaeal community structure between pit mud from 5-year-old cellars and pit mud from 100-year-old cellars was higher, while the diversity of archaeal community in pit mud from 30-year-old cellars was higher. The environmental factors with the greatest effect on the archaeal community structure of pit mud from different aged cellars were different. In summary, the archaeal community structure in pit mud with different cellar ages showed a signifi cant difference, which might be part of what causes the different qualities of Luzhou-fi avor liquor produced from pit mud with different cellar ages.
Key words:archaeal community structure; high-throughput sequencing; cluster analysis; Luzhou-fi avor liquor; pit mud
DOI:10.7506/spkx1002-6630-201708007
中图分类号:TS261.1
文献标志码:A
文章编号:1002-6630(2017)08-0037-06
引文格式:
邓杰, 卫春会, 边名鸿, 等. 浓香型白酒不同窖龄窖池窖泥中古菌群落结构分析[J]. 食品科学, 2017, 38(8): 37-42.
DOI:10.7506/spkx1002-6630-201708007. http://www.spkx.net.cn
DENG Jie, WEI Chunhui, BIAN Minghong, et al. Archaeal community analysis of pit mud from cellars of different ages for Luzhou-fi avor liquor[J]. Food Science, 2017, 38(8): 37-42. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201708007. http://www.spkx.net.cn
收稿日期:2016-06-07
基金项目:国家固态酿造工程技术研究中心开放课题(2015k-246);
固态酿造关键技术研究四川省院士(专家)工作站项目(GY2014-02);酿酒生物技术及应用四川省重点实验室项目(NJ2013-08)
作者简介:邓杰(1988—),男,硕士,研究方向为发酵工程。E-mail:380553839@qq.com
*通信作者:黄治国(1978—),男,教授,博士,研究方向为发酵工程。E-mail:hzguo@suse.edu.cn