表1 免疫周期与免疫剂量
Table 1 Immunization cycles and corresponding doses

谢曼曼1,李建武1,王广彬2,曾海娟1,翟绪昭1,丁承超1,刘武康1,刘 箐1,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.徐州绿健乳品饮料有限公司,江苏 徐州 221006)
摘 要:为制备特异性强的副溶血性弧菌的单克隆抗体,解决 单克隆抗体对免疫学检测产品研发的制约,以副溶血性弧菌(Vibrio parahaemolyticus)ATCC 17802标准菌株免疫Balb/c小鼠,经细胞融合、间接酶联免疫吸附测定法筛选,获得稳定分泌抗副溶血性弧菌(ATCC 17802)菌株的单克隆杂交瘤细胞株3F7D7E8C4,通过体内诱生腹水大量制备抗体,用亚类试剂盒测定抗体亚类为 IgG1;采用辛酸硫酸铵沉淀法以及亲和层析柱对腹水进行纯化,聚丙烯酰胺凝胶电泳实验鉴定单克隆抗体的纯度。制备得到腹水抗体效价为1∶16 000,纯化后抗体效价为1∶8 000,抗体敏感性IC50达到106CFU/mL。纯化后的抗体与12 株副溶血性弧菌均能特异性结合,与其他9 种非副溶血性弧菌的食源性致病菌均无交叉反应。
关键词:副溶血性弧菌;单克隆抗体;酶联免疫吸附测定
副溶血性弧菌(Vibrio parahaemolyticus,Vp)是革兰氏阴性菌、嗜盐菌,海产品中常见的食源性致病菌[1],被认为是食用海鲜者患胃肠炎的主要原因,海产品中最主要的病原体[2-3]。人们食用被Vp污染的食物很可能会引起急性肠胃炎,重症患者则表现为脱水、休克昏迷甚至死亡[4]。为减少Vp相关的食源性疾病的风险,需要对食品中Vp密切监测。传统的食品中检测弧菌的方法是使用选择性培养基如硫柠胆蔗琼脂(thiosulfate citrate bile salts sucrose agar,TCBS)培养基、科玛嘉弧菌显色培养基富集培养[5-6],但某些弧菌如创伤弧菌、拟态弧菌、哈氏弧菌或坎氏弧菌形成的菌落与副溶血弧菌类似[7],需要生化实验进一步检测识别,消耗的时间较长。基于分析生物学技术的检测方法如聚合酶链式反应(polymerase chain reaction,PCR)技术、环介导等温扩增技术、基因探针技术提供了快速、特异性强、灵敏度高的检测手段,但对于技术人员 和检测设备有较高的要求[8]。因此,需要一种能检测Vp的快速简单的方法。
与传统的培养方法和分子生物学方法相比,利用单克隆抗体检测细菌是一种快速、简单的方法[9]。但遗憾的是,由于Vp血清型复杂、同属弧菌种类较多,加之弧菌属基因组研究滞后,其特异性靶抗原至今未知[10],因此获得能涵盖所有副溶血弧菌血清型,又和其他同属弧菌没有交叉反应的单克隆抗体,成为包括免疫层析试纸条、免疫色谱系统、免疫传感器在内的免疫学检测产品研制的主要障碍[11-13]。与Vp相关的研究报道很少,有Guo Ailing[5]、Anand[6]等利用多克隆抗体进行Vp的免疫层析试纸条,检测灵敏度达到106~107CFU/mL,但特异性较差。Sakata等[16]研究出的一种免疫层析试纸,使用两种针对Vp F0F1ATP合成酶的单克隆抗体,用于Vp的检测,检测覆盖率高,但存在交叉反应。本研究通过传统的杂交瘤技术,以期制备出具有较强特异性的单克隆抗体,为Vp的快速检测提供参考依据。
1.1 材料与试剂
1.1.1 动物、细胞与菌株
6~8 周龄SPF级Balb/c雌性小鼠上海市第二军医大学动物实验中心;SP2/0细胞由本实验室保藏;Vp标准株(ATCC 17802)、Vp(ATCC 33847)、创伤弧菌(ATCC 27562)、霍乱弧菌非O1(V 80)、出血性大肠杆菌O157:H7(ATCC 43895)、单核细胞增生李斯特菌(ATCC 43251)、阪崎肠杆菌(ATCC 29004)、肠炎沙门氏菌(ATCC 13076)、蜡样芽孢杆菌(ATCC 11778)空肠弯曲菌(ATCC 33560)、宋氏志贺氏菌(ATCC 9290)、肺炎链球菌(ATCC 49619)、变形杆菌(ATCC 12453)由医疗器械与食品学院实验室保藏;10 株野生型Vp(A~J)由本实验室从常见海产品中分离保藏;溶藻弧菌(R 5)、鳗弧菌(M 1)由上海海洋大学微生物菌种保藏中心保藏。
1.1.2 试剂
聚乙二醇(polyethylene glycol,PEG)、羟乙基哌嗪乙硫磺酸、十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)、考马斯亮蓝G250染色液、四乙基乙二胺、过硫酸铵、巯基乙醇、四甲基联苯胺盐酸盐二水显色液、过氧化脲国药集团化学试剂有限公司;杜尔伯科极限必需培养基(dulbecco minimum essential medium,DMEM) 美国Gibco公司;50×HAT(次黄嘌呤(hypoxanthine)、氨喋呤(aminopterin)、胸腺嘧啶核苷(thymidine))培养基、50×HT 美国Sigma公司;牛血清白蛋白(bovine serum albumin,BSA)、青链霉素混合液(双抗) 美国Hyclone公司;其余常规试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
SpectraMax/n2酶标仪 美国Molecular Devices公司;PCR system 9700 PCR仪 美国Applied Biosystems公司;G:BOX Chemi XR5凝胶成像仪 英国Syngen公司;NanoDrop 2000c微量紫外分光光度计 美国Thermo公司;Biologic LP蛋白纯化仪、JY1000C电泳仪、1658001SevenEasy电泳槽 美国Bio-Rad公司;Protein G亲和层析柱 美国GE公司。
1.3 方法
1.3.1 Vp的鉴定
取Vp(ATCC 17802)干粉少许加入到3%氯化钠碱性蛋白胨水,置于摇床37 ℃培养12 h,菌液于TCBS培养基上划线,37 ℃培养箱培养12 h,挑取单菌落进行摇床扩大培养,培养条件为200 r/min、37 ℃、12 h。得到的菌液进行PCR鉴定,引物由生工生物工程(上海)股份有限公司合成,序列为5-AAAGCGGATTATGCAGAAGCACTG-3,5-GCTACTTTCTAGCATTTTCTCTGC-3;目标条带大小约为450 bp;并将PCR的产物进行1%琼脂糖电泳鉴定。
1.3.2 免疫小鼠及小鼠血清效价测定
免疫小鼠使用6 只8 周龄,体质量约20 g的Balb/c雌鼠,Vp鉴定后用0.3%的甲醛灭活24 h,4 000 r/min离心10 min,使用生理盐水将其配制到浓度约108CFU/mL(OD600nm≈0.6)。首次免疫使用免疫原与等体积的弗氏完全佐剂充分乳化后免疫,2、3次以及冲击免疫使用同剂量免疫原与弗氏不完全佐剂乳化后免疫,免疫方式为背部皮下多点注射。冲击免疫在细胞融合前3 d进行。剂量如表1所示。3 次免疫7 d后小鼠尾部静脉取血,采用间接酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测小鼠抗血清的效价。间接ELISA条件参考文献[8]进行。
表1 免疫周期与免疫剂量
Table 1 Immunization cycles and corresponding doses

1.3.3 杂交瘤细胞株的建立
1.3.3.1 细胞融合
加入8-氮鸟嘌呤20 μg/mL的DMEM完全培养液培养SP2/0三代后备用。细胞融合过程参考文献[18]进行。将正常的未处理的Balb/c小鼠颈椎脱臼致死,无菌条件下制备饲养层细胞并分装到96 孔细胞培养板中,每孔100 μL,每孔含有4×103个细胞;细胞培养板置于37 ℃、5% CO2培养箱中备用。
取冲击免疫3 d后的Balb/c小鼠,摘除眼球采血,4 ℃放置2 h后离心分离血清,-20 ℃保存供检测抗体效价时作为阳性对照;无菌条件下将脾摘除,研磨得到脾细胞。经计数后,将骨髓瘤细胞及脾细胞按照数量比为1∶5于充分混匀,缓慢加入1 mL的PEG再缓慢加入10 mL 37 ℃预温含10%血清的DMEM培养基,混匀、离心、重悬细胞后将细胞液转入到含有饲养层细胞的96 孔培养板中每孔100 μL,37 ℃,5% CO2细胞培养箱中培养24 h后,补加50 μL含20%胎牛血清和5×HAT的完全培养液。
1.3.3.2 杂交瘤细胞的筛选克隆
融合细胞培养5 d后,HAT培养液隔天换液,培养14 d后,改用HT培养液培养。当细胞铺满70%~80%的孔底时,取细胞培养板的培养上清液进行间接ELISA实验测定阳性率。选择阳性强、细胞生长旺盛的孔进行有限稀释克隆化。得到的单克隆扩大培养、冻存、建株。
1.3.4 小鼠腹水制备、纯化及效价测定
取B a l b/c雌性小鼠腹腔注射灭菌液体石蜡(0.5 m L/只),1 周后腹腔注射单克隆细胞株(106个/只),诱导腹水产生,12 d后采集腹水。腹水抗体使用小鼠单克隆抗体试剂盒进行亚类鉴定后,使用辛酸硫酸铵沉淀法进行粗提,选择protein G柱亲和层析系统进一步纯化。纯化后的单克隆抗体于4 ℃磷酸盐缓冲液中进行透析,每4 h换一次透析液,得到腹水单克隆抗体,使用Nanodrop测定浓度后,SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析纯化的效果。效价测定采用间接ELISA法,实验组OD450nm(P)与阴性对照组OD450nm(N)的比P/N不小于2.1的抗体最大稀释倍数为该单克隆抗体的效价。
1.3.5 单克隆抗体的特异性分析
采用间接ELISA法鉴定单克隆抗体的敏感性,以抗体对Vp菌悬液的半数抑制浓度(half maximal inhibitory concentration,IC50)作为敏感度。采用间接ELISA法鉴定单克隆抗体与其他菌株的交叉反应即单抗的特异性。
2.1 免疫原PCR鉴定结果
利用PCR对实验用Vp菌株进行鉴定,鉴定的结果如图1所示,在450 bp处出现明显电泳条带,与Vp特异性基因条带大小一致,说明该菌株为Vp。
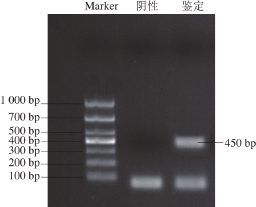
图1 Vp菌株PCR鉴定
Fig. 1 PCR identifi cation of Vp
2.2 小鼠血清效价
小鼠3 次免疫后采用间接ELISA法测定小鼠血清效价,结果如表2所示。以实验组P/N不小于2.1判定为阳性,其中阴性对照OD450nm为0.090。1、3、4、5、6号小鼠血清效价达1∶16 000,2号小鼠血清效价达到1∶32 000。本实验选择2号小鼠进行细胞融合。
表2 小鼠血清效价
Table 2 Serum titers of mice
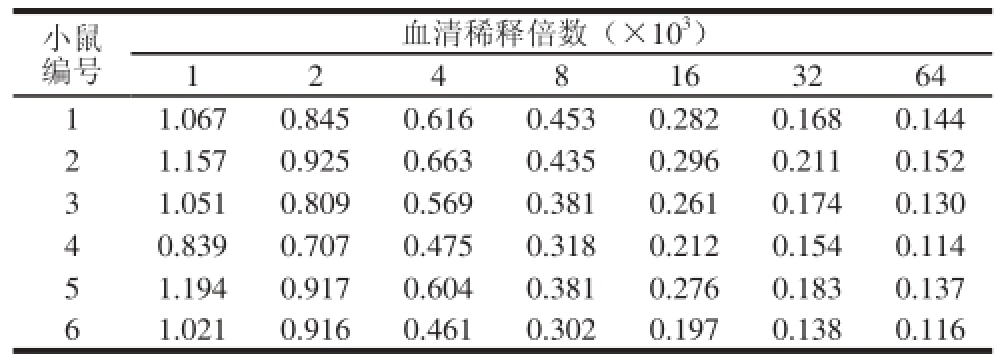
注:表中数据为OD450nm。
2.3 杂交瘤细胞筛选
细胞融合14 d后在倒置显微镜下观察细胞融合效果,10 块细胞培养板960 孔中,均存在杂交瘤细胞克隆,即融合率为100%;通过间接ELISA筛选出1 株高特异性杂交瘤3F7D7E8C4。经多次传代建株检测显示此株杂交瘤分泌抗体性能稳定。
2.4 腹水亚型的鉴定及纯化后效价
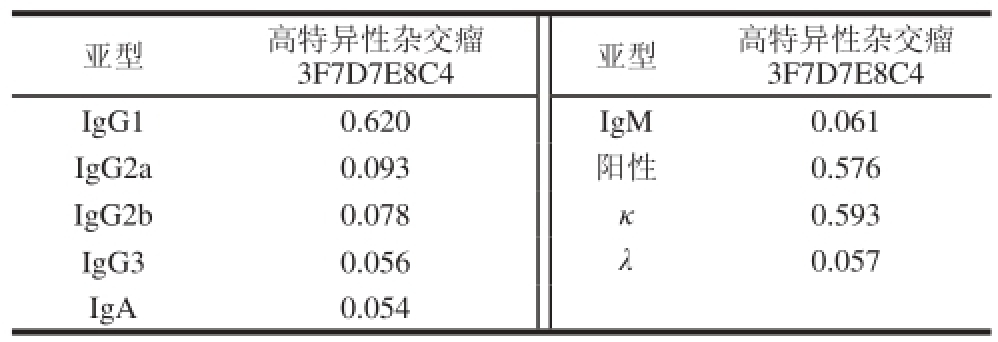
得到的单克隆杂交瘤细胞株在腹腔注射液体石蜡7 d后腹腔注射小鼠制备腹水,采集腹水进行3F7D7E8C4抗体亚类鉴定,结果如表3所示,说明得到的抗体属于IgG1亚型,轻链类型为κ型。
表3 抗体亚型测定结果
Table 3 Identifi cation of antibody subtypes
经辛酸-硫酸铵沉淀初步纯化和Protein G亲和层析纯化后采用SDS-PAGE进行单克隆抗体纯度鉴定,如图2所示。3F7D7E8C4单克隆抗体经辛酸硫酸铵沉淀法和亲和层析柱后无明显杂蛋白,抗体只有两条清晰的条带,大的条带为重链约50 kD,小的条带为轻链约26 kD,纯化效果明显,抗体蛋白纯度较高。
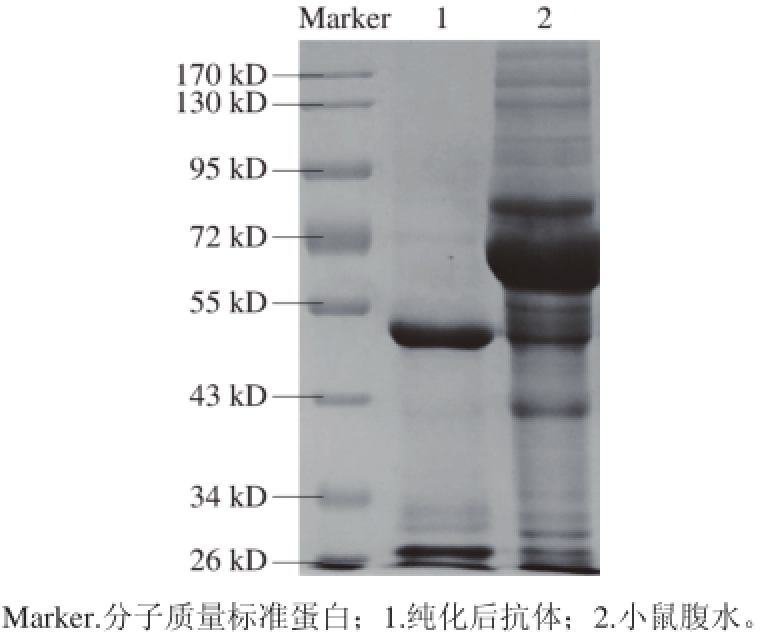
图2 单克隆抗体SDS-PAGE结果
Fig. 2 SDS-PAGE result of mouse ascites and purifi ed antibodies
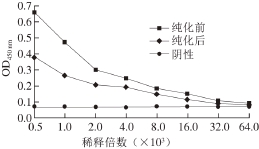
图3 抗体纯化前后效价测定结果
Fig. 3 Titers of aseites and purifi ed antibodies
纯化前后单克隆抗体效价测定结果如图3所示,腹水抗体纯化后,效价从1∶16 000降低到1∶8 000,纯化后的抗体质量浓度为2.037 mg/mL。
2.5 单克隆抗体敏感性鉴定结果
采用间接竞争ELISA法测定抗体对Vp菌悬液的IC50, P/N为0.5时所对应的菌浓度为IC50。IC50值越小抗体的敏感性越高。本实验对照组OD450nm为1.0,对应的抗体使用量为25 ng。从图4可知,菌浓度为106CFU/mL时,OD450nm达到0.5,即106CFU/mL为3F7D7E8C4细胞株产生抗体的检测限。
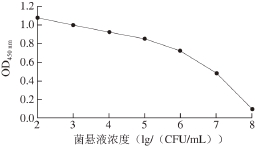
图4 单克隆抗体敏感性
Fig. 4 Sensitivity of monoclonal antibodies
2.6 单克隆抗体的特异性
用间接ELISA方法检测所得抗体与常见25 株致病菌的交叉反应,其中包括本实验室从常见水产品中分离保藏的10 株野生型副溶血弧菌及2 株标准菌株,结果如表4所示,所得抗体与12 株副溶血弧菌均能结合,与其他致病菌株均无交叉反应,表明该抗体具有较高的特异性。
表4 抗体与细菌反应谱
Table 4 Specifi city of monoclonal antibodies

注:+.有交叉反应;-.无交叉反应。
单克隆抗体能够识别抗原的特异性结构,已经作为重要工具应用在检测和医学等领域[19]。基于单克隆抗体的检测技术不断发展,新的单克隆抗体制备方法也被不断开发,如使用特异性蛋白制备单克隆抗体[20-21]、蛋白嵌合单克隆抗体制备技术[22]、通过转基因技术制备单克隆抗体[23-24]、噬菌体技术等新技术[25]。本实验选择传统的杂交瘤技术有以下几点原因,首先,至今还未找到Vp的特异性靶抗原[9],采用全菌免疫方式能够得到特异、稳定的高亲和力抗体;其次,杂交瘤细胞注射到小鼠体内诱生腹水能大量产生单克隆抗体,此外,这种杂交瘤技术耗时较短,成本低。
制备单克隆抗体核心的技术是细胞融合技术,本实验融合细胞初次筛选出现15 个阳性孔,但部分杂交瘤细胞株不稳定,经克隆,筛选最终得到的杂交瘤细胞较少,但得到的杂交瘤细胞的特异性强。研究证明,具有高纯度与强特异性的单克隆抗体能准确与目标抗原相结合发挥效用[26]。本实验获得单克隆抗体的与10 株Vp反应呈阳性,与其他常见的非Vp食源性致病菌均无交叉反应,抗体的特异性强。
本实验以Vp为抗原免疫Balb/c小鼠,使用不同的免疫剂量与免疫周期,以期优化免疫方法,但免疫结果中除2号小鼠血清效价较高外,其余并未体现出差异。一般制备单克隆抗体的方法采用每两周注射,剂量按照致病菌的半致死剂量定,实验采用统一免疫方法[27-28]。本实验免疫小鼠的血清效价结果,可能是因为小鼠个体的差异导致。经克隆获得一株能稳定分泌抗体的细胞株3F7D7E8C4,使用操作简单、纯化和回收效果较好的辛酸硫酸铵法[29]对腹水进行粗提,后经Protein G亲和层析进一步纯化,除去杂蛋白,透析过程去除小分子杂蛋白和盐离子,得到纯度较高的抗体蛋白。抗体亚型为IgG1型,具有生物活性,半衰期较长[30],可用于建立免疫试纸条等快速、简便的快速检测产品研发。
参考文献:
[1] SU Y C, LIU C. Vibrio parahaemolyticus: a concern of seafood safety[J]. Food Microbiology, 2007, 24(6): 549-558.
[2] YEUNG P S, BOOR K J . Epidemiology, pathogenesis, and prevention of foodborne Vibrio parahaemolyticus infections[J]. Foodborne Pathogens and Disease, 2004, 1(2): 74-88.
[3] XIE T F, WU Q P, ZHANG J M, et al. Comparison of Vibrio parahaemolyticus, isolates from aquatic products and clinical by antibiotic susceptibility, virulence, and molecular characterisation[J]. Food Control, 2016, 71: 315-321. DOI:10.1016/j.fm.2007.01.005.
[4] 陈炳卿. 营养与食品卫生学[M]. 北京: 人民卫生出版社, 2001: 212-214.
[5] GOMEZ-GIL B, ROQUE A. Isolation, enumeration, and preservation of the Vibrionaceae[M]. Washington, DC: ASM Press, 2006: 15-26. DOI:1128/9781555815714.ch2.
[6] 陈瑞英, 鲁建章, 苏意诚, 等. 食品中副溶血性弧菌的危害分析、检测与预防控制[J]. 食品科学, 2007, 28(1): 341-347.
[7] SHIMA T, ISOBE J, KIMATA K, et al. Evaluation of a rapid test for determination of most probable number of viable Vibrio parahaemolyticus by using etidium monoazide[J]. Japanese Journal of Food Microbiology, 2011, 28(1): 21-28.
[8] 刘程, 刘芳, 刘箐, 等. 出血性大肠杆菌O157:H7单克隆抗体制备及免疫胶体金试纸条的研制[J]. 食品与发酵工业, 2014(5): 199-205. DOI:10.13995/j.cnki.11-1802/ts.2014.05.004.
[9] QIAN H L, ERVINNA P, DU Q Y, et al. Production of a monoclonal antibody specific for the major outer membrane protein of Campylobacter jejuni and characterization of the epitope[J]. Applied and Environmental Microbiology, 2008, 74(3): 833-839. DOI:10.1128/ AEM.01559-07.
[10] BISHA B, SIMONSON J, JANES M, et al. A review of the current status of cultural and rapid detection of Vibrio parahaemolyticus[J]. International Journal of Food Science and Technology, 2012, 47(5): 885-899. DOI:10.1111/j.1365-2621.2012.02950.x.
[11] LIU X, GUAN Y, CHENG S, et al. Development of a highly sensitive lateral immunochromatographic assay for rapid detection of Vibrio parahaemolyticus[J]. Journal of Microbiological Methods, 2016, 131: 78-84. DOI:10.1016/j.mimet.2016.10.007.
[12] SHA Yuhong, ZHANG Xuan, LI Wenrou, et al. A label-free multifunctionalized graphene oxide based electrochemiluminscence immunosensor for ultrasensitive and rapid detection of Vibrio parahaemolyticus in Seawater and seafood[J]. Talanta, 2016, 147: 220-225. DOI:10.1016/j.talanta.2015.09.058.
[13] LIU Y Y, ZHANG Z H, WANG Y L, et al. A highly sensitive and flexible magnetic nanoprobe labeled immunochromatographic assay platform for pathogen Vibrio parahaemolyticus[J]. International Journal of Food Microbiology, 2015, 211: 109-116. DOI:10.1016/ j.ijfoodmicro.2015.07.005.
[14] GUO A L, SHENG H L, ZHANG M, et al. Development and evaluation of a colloidal gold immunochromatography strip for rapid detection of Vibrio parahaemolyticus in food[J]. Journal of Food Quality, 2012, 35(5): 366-371. DOI:10.1111/j.1745-4557.2012.00449.x.
[15] ANAND P S S, SOBHANA K S, GEORGE K C, et al. Selection of specifi c cell wall antigen for rapid detection of fi sh pathogenic Vibrio parahaemolyticus by enzyme immunoassay[J]. Indian Journal of Fisheries, 2016, 63(2). DOI:10.21077/ijf.2016.63.2.44334-11.
[16] SAKATA J, KAWATSU K, IWASAKI T, et al. Development of a rapid and simple immunochromatographic assay to identify Vibrio parahaemolyticus[J]. Journal of Microbiological Methods, 2015, 116: 23-29. DOI:10.1016/j.mimet.2015.06.009.
[17] 曾海娟, 王广彬, 郭慧琴, 等. 抗瓜类细菌性果斑病菌单克隆抗体的制备及特性鉴定[J]. 食品科学, 2015, 36(23): 228-232. DOI:10.7506/ spkxl002-6630-201523042.
[18] FASIHI R M, NEDJAD M A, ARABSALMANY F, et al. Production and characterization of monoclonal and polyclonal antibody against recombinant outer membrane protein[J]. American Journal of Immunology, 2014, 105662(10): 56-62. DOI:10.3844/ajisp.2014.56.62.
[19] MEIBOHM B. Protein engineering for improved pharmacologic characteristics of established monoclonal antibody-based therapeutics[J]. Clinical Pharmacokinetics, 2014, 53(10): 863-864. DOI:10.1007/s40262-014-0186-6.
[20] KAUSHAL N A, KAUSHAL D C. Production and characterization of monoclonal antibodies against substrate specific loop region of Plasmodium falciparum lactate dehydrogenase[J]. Immunological Investigations, 2014, 43(6): 1118-1123. DOI:10.3109/08820139.2014.892962.
[21] LIU B H, CHU K, YU F Y. Novel monoclonal antibodybased sensitive enzyme-linked immunosorbent assay and rapid immunochromatographic strip for detecting aflatoxin M1in milk[J]. Food Control, 2016, 66: 1-7. DOI:10.1016/j.foodcont.2016.01.036.
[22] MARCOSSILVA L, NARIMATSU Y, HALIM A, et al. Characterization of binding epitopes of CA125 monoclonal antibodies[J]. Journal of Proteome Research, 2014, 13(7): 3349-3359. DOI:10.1021/pr500215g.
[23] FUJIMOTO Y, OZAKI K, MAEDA M, et al. Resistance to infi uenza A virus infection in transformed cell lines expressing an anti-PB2 monoclonal antibody[J]. Veterinary Journal, 2013, 198(2): 487-493. DOI:10.1016/j.tvjl.2013.09.019.
[24] KIM S H, KIM Y N, TRUONG T T, et al. Development of a monoclonal antibody specific to envelope domain Ⅲ with broadspectrum detection of all four dengue virus serotypes[J]. Biochemical and Biophysical Research Communications, 2016, 473(4): 894-898. DOI:10.1016/j.bbrc.2016.03.146.
[25] 张蕾, 张西萌, 张海予, 等. 副溶血性弧菌鞭毛蛋白单克隆抗体的制备及其活性分析[J]. 细胞与分子免疫学杂志, 2013, 29(7): 734-738.
[26] HAN L N, HE S, WANG Y T, et al. Advances in monoclonal antibody application in myocarditis[J]. Journal of Zhejiang University: Science B, 2013, 14(8): 676-687. DOI:0.1631/jzus.BQICC711.
[27] LI G P, ZHAO L, ZHOU F, et al. Monoclonal antibody production and indirect competitive enzyme-linked immunosorbent assay development of 3-methyl-quinoxaline-2-carboxylic acid based on novel haptens[J]. Food Chemistry, 2016, 209: 279-285. DOI:10.1016/ j.foodchem.2016.04.083.
[28] K A R O O N U T H A I S I R I N, C H A R L E R M R O J R, TEERAPORNOUNTAKIT J, et al. Bead array for Listeria monocytogenes, detection using specific monoclonal antibodies[J]. Food Control, 2015, 47: 462-471. DOI:10.1016/j.foodcont.2014.07.049.
[29] 周玉, 李岩松, 潘风光, 等. 小鼠腹水IgG类单克隆抗体纯化方法的研究[J]. 黑龙江畜牧兽医, 2006(10): 14-16.
[30] KEIZER R J, HUITEMA A D R, SCHELLENS J H M, et al. Clinical pharmacokinetics of therapeutic monoclonal antibodies[J]. Clinical Pharmacokinetics, 2010, 49(8): 493-507. DOI:2165/11531280-000000000-00000.
Preparation and Immunological Characteristics of Monoclonal Antibodies against Vibrio parahaemolyticus
XIE Manman1, LI Jianwu1, WANG Guangbin2, ZENG Haijuan1, ZHAI Xuzhao1, DING Chengchao1, LIU Wukang1, LIU Qing1,*
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. Xuzhou Lüjian-Dairy Bever age Co. Ltd., Xuzhou 221006, China)
Abstract:Th is study ai med to prepare a highly specifi c monoclonal antibody (mAb) against Vibrio parahaemolyticus for the purpose of solving the constraints on the development of immunological assays for this pathogenic microorganism. We injected Balb/c mice with V. parahaemolyticus ATCC 17802. The hybridoma cell line 3F7D7E8C4, which could stably secret mAb against ATCC 17802, was obtained after cell fusion and screening by indirect ELISA. By using a commercial kit, the mAb was identifi ed to belong to the IgG1 subclass. The antibody titer of the ascites was 1:16 000. After purifi cation with saturated ammonium sulfate precipitation and protein G affinity chromatography and purity analysis by sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE), the titer of the antibody was 1:8 000 and the sensitivity (IC50) was 106 CFU/mL. The purifi ed antibody could specifi cally bind to 12 V. parahaemolyticus strains, and had no cross-reaction with 9 non-V. parahaemolyticus foodborne pathogens.
Key words:Vibrio parahaemolyticus; monoclonal antibody (mAb); enzyme linked immunosorbent assay (ELISA)
DOI:10.7506/spkx1002-6630-201708011
中图分类号:TS207.4
文献 标志码:A
文章编号:1002-6630(2017)08-0063-06
引文格式:
谢曼曼, 李建武, 王广彬, 等. 副溶血性弧菌单克隆抗体的制备及特性鉴定[J]. 食品科学, 2017, 38(8): 63-68.
DOI:10.7506/spkx1002-6630-201708011. http://www.spkx.net.cn
XIE Manman, LI Jianwu, WANG Guangbin, et al. Prepa ration and immunological characteristics of monoclonal antibodies against Vibrio parahaemolyticus[J]. Food Science, 2017, 38(8): 63-68. (in Chinese with En glish abstract) DOI:10.7506/ spkx1002-6630-201708011. http://www.spkx.net.cn
收稿日期:2016-05-12
基金项目:上海市科委“科技创新行动计划”长三角科技联合攻关领域项目(15395810900);
徐州绿健乳品饮料有限公司“乳制品生产体系致病菌快速检测”项目(3A15308006);上海理工大学研究生创新基金项目
作者简介:谢曼曼(1988—),女,博士研究生,研究方向为食品营养与安全。E-mail:xiemanman880224@163.com
*通信作者:刘箐(1970—),男,教授,博士,研究方向为食源性致病菌致病机理、疫苗及快速检测技术。E-mail:liuq@usst.edu.cnv