 表示。采用SPSS 18.0软件对数据进行统计学分析,采用Origin 8.0软件进行绘图。
表示。采用SPSS 18.0软件对数据进行统计学分析,采用Origin 8.0软件进行绘图。马欢欢1,吕欣然2,林 洋1,白凤翎1,*,励建荣1
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.北京林业大学生物科学与技术学院,北京 100083)
摘 要:哈维氏弧 菌是引起对虾和鱼弧菌病的主要病原菌,给海产养殖业造成重大的经济损失。利用1.0% CaCO3MRS琼脂从鲈鱼、刀鱼、牙鲆和大菱鲆等海水鱼肠道中分离到49 株乳酸菌,采用牛津杯琼脂扩散法从中筛选出对哈维 氏 弧菌具有较强拮抗作用的菌株YP4-5,抑菌直径为18.26 mm。通过蛋白酶、pH值和温度等因素对菌株YP4-5的无细胞上清液(cell free supernatant,CFS)抑菌物质进行初步分析,表明抑菌活性物质对蛋白酶敏感,pH 2.5~4.5时对哈维氏弧菌具有抑制作用,具有良好的热稳定性,初步判断YP4-5 CFS中抑菌活性物质为细菌素类。0.4倍最小抑菌浓度YP4-5 CFS可有效抑制74.74%哈维氏弧菌的生长,扫描电子显微镜观察结果表明YP4-5 CFS使哈维氏弧菌细胞完整性破坏,细胞膜溶解,胞内物质外泄。经生理生化和16S rRNA鉴定菌株YP4-5为清酒乳杆菌,为预防和控制水产 养殖中哈维氏弧菌感染研发微生态制剂提供良好的菌源。
关键词:海水鱼肠道;乳酸菌;拮抗;哈维氏弧菌;筛选与鉴定
哈维氏弧菌(Vibrio harveyi)广泛分布在海洋生态环境中,是引起海洋生物弧菌病的主要病原菌,包括虾养殖的“早期死亡综合征”和“急性肝胰腺坏死病”及牙鲆等鱼类的组织坏死等疾 病[1-4]。据估计,2013年在中国及东南亚国家和地区因弧菌病造成水产养殖业的经济损失高达10亿 美元[5-6]。
目前,控制水产养殖过程中哈维氏弧菌的有效方法包括使用乳酸诺氟沙星等抗微生物药物,利用五倍子和黄连等中草药制剂和缓释 微球疫苗等进行防治[7-10]。乳酸菌作为微生态制剂已在水产养殖疾病控制中得到应用,Barbosa等[11]应用添加植物乳杆菌的饲料喂食罗非鱼,养殖10 周后发现,鱼肠道中异养型细菌、弧菌属和假单孢菌属细菌数量明显降低,鱼体血液中血小板、白细胞和淋巴细胞增加。
乳酸菌广泛分布在传统发酵食品、动物肠道、饲料和淤泥等生态环境中,海产 品和海水鱼肠道也是拮抗性乳酸菌的重要来源[12-15]。Khouadja等[16]从传统咸鱼中分离获得嗜酸乳杆菌与副溶血弧菌共同培养,结果发现培养3 d后副溶血弧菌活细胞数从106CFU/mL下降到104CFU/mL。任士菊等[17]从额尔齐斯河的冷水鱼肠道中分离获得格氏乳球菌、乳酸乳球菌和粪肠球菌等6 株乳酸菌,对单增李斯特氏菌均具有显著的抑菌效果,初步分析可能为类细菌素或细菌素的抑菌物质。Zapata等[18]从罗非鱼肠道分离肠膜明串珠菌(Leuconostoc mesenteroides)能有效抑制水产养殖环境中哈维氏弧菌T34、铜绿假单胞(Pseudomonas aeroginosa)T3和海鱼分枝杆菌(Mycobacterium marinum)T217等鱼类病原菌的生长繁殖。 周海平等[19]利用乳酸杆菌LH培养24~96 h的代谢产物对哈维氏弧菌、海蛹弧菌(Vibrio nereis)、溶藻弧菌(Vibrio alginolyticus)和副溶血弧菌(Vibrio parahaemolyticus)等具有明显的抑制作用。
乳酸菌及其制剂应用于水产养殖过程中的疾病防控具有安全、绿色和环保的特点,而从海鱼肠道中筛选对哈维氏弧菌具有拮抗作用乳酸菌的研究鲜见报道。本研究从鲈鱼、刀鱼、牙鲆、大菱鲆等海水鱼肠道中筛选对哈维氏弧菌具有拮抗作用的乳酸菌菌株,并对抑菌活性及其作用机理进行初步分析,进而为研发一种控制水产养殖环境中哈维氏弧菌的微生态制剂奠定理论和应用基础。
1.1 材料
1.1.1 样品与菌株
鲈鱼、刀鱼、牙鲆、大菱鲆购自辽宁省锦州市金凌商场。
哈维氏弧菌BB170由渤海大学食品科学研究院保藏。
1.1.2 培养基与试剂
MRS琼脂培养基、LB肉汤、LB营养琼脂 北京奥博星生物技术有限公司;细菌基因组DNA快速抽提试剂盒、DNA Marker-D、Taq聚合酶链式反应(polymerase chain reaction,PCR)Master mix 上海生工生物工程有限公司;乳酸菌生化鉴定管 杭州天和微生物试剂有限公司;胃蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶 华蓝化学有限公司。
1.1.3 仪器与设备
DL-CJ-2N型超级洁净工作台 东联哈尔(北京)仪器制造有限公司;赛福智能生化培养箱 宁波海曙赛福实验仪器厂;BMM-408YSC显微镜 上海浍统光学仪器有限公司;5804R冷冻高速离心机、PCR仪德国Eppendorf公司;DYY-8C电泳仪 北京市六一仪器厂;Cheimdox XRS 凝胶成像仪 美国Bio-Rad公司;GI54DS立式高压蒸汽灭菌锅 致微(厦门)仪器有限公司;FreeZone 2.5台式真空冷冻干燥机 美国Labconco公司;E-1045镀金仪、S-4800扫描电子显微镜 日本日立公司。
1.2 方法
1.2.1 海鱼肠道中乳酸菌的分离
分别称取10 g海鲈鱼、刀鱼、牙鲆和大菱鲆的肠道,剪成长约2 cm片段,置于装有90 mL无菌水的三角瓶中,充分振荡,静置10 min。吸取100 μL在1% CaCO3MRS琼脂平板上涂布,37 ℃培养48 h,挑选有溶钙圈的白色菌落进行纯化。挑取纯化培养后的单个菌落进行过氧化氢酶实验和革兰氏染色初筛乳酸菌菌株。
1.2.2 抗哈维氏弧菌乳酸菌的筛选
取初筛乳酸菌菌株培养24 h发酵液10 mL,经4 ℃、8 000 r/min离心10 min,吸取上清液经0.45 μm滤器过滤获得乳酸菌无细胞上清液(cell free supernatant,CFS),参照alomskienė等[20]方法利用牛津杯琼脂扩散法应用发酵液和CFS对哈维氏弧菌进行抑菌实验。
1.2.3 乳酸菌生长与抗哈维氏弧菌活性曲线分析
取200 μL乳酸菌菌悬液接种于10 mL MRS液体培养基中,37 ℃静置培养。每隔4 h取样测定菌悬液OD600nm值和pH值,并按照1.2.2节方法测定菌株CFS的抑菌活性。
1.2.4 影响乳酸菌CFS抑制哈维氏弧菌的因素
酶敏感性实验:在菌株CFS中分别添加胃蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶和碱性蛋白酶,终浓度为1.0 mg/mL,37 ℃水浴中孵育2 h,参照1.2.2节方法进行抑菌实验。
pH值实验:用1.0 mol/L NaOH和1.0 mol/L HCl将乳酸菌CFS pH值分别调至2.5、3.5、4.0、4.5、5.0、5.5、6.0和6.5,同时用相同pH值的MRS液体培养基作相应的空白对照,按1.2.2节进行抑菌实验。
热稳定性实验:取乳酸菌CFS分别于50、80 ℃和100 ℃条件下处理30 min,同时以菌株CFS作对照,按1.2.2节方法进行抑菌实验。
1.2.5 乳酸菌CFS对哈维氏弧菌生长曲线的影响
1.2.5.1 乳酸菌最小抑菌浓度(minimal inhibitory concentration,MIC)的测定
按Manzoor等[21]的方法并稍加修改,用LB肉汤培养基将冷冻干燥的菌株CFS稀释至质量浓度分别为32.0、16.0、8.0、4.0、2.0、1.0、0.5、0.25 mg/mL。以LB肉汤为对照组,分别取5.0 mL稀释样液加入200 μL 106CFU/mL哈维氏弧菌菌悬液,37 ℃静置培养24 h,通过肉眼观察到无浑浊现象的最低质量浓度为乳酸菌CFS的MIC,每组重复3 次。
1.2.5.2 乳酸菌抑制哈维氏弧菌生长曲线分析
按Saraoui等[22]的方法并稍作修改,将培养12 h哈维氏弧菌稀释成106CFU/mL菌悬液,添加乳酸菌CFS,使其终质量浓度为0.4 MIC,以未添加乳酸菌CFS为对照,37 ℃恒温培养,每2 h测OD600nm值,连续至24 h。
1.2.6 乳酸菌CFS处理哈维氏弧菌细胞扫描电子显微镜分析
参考Hovnanyan等[23]的方法并稍作修改。在含有106CFU/mL哈维氏弧菌菌悬液分别加入0.4 MIC、1.0 MIC和3.0 MIC质量浓度乳酸菌CFS,以无菌水为对照,37 ℃静置培养12 h。5 000 r/min离心10 min收集哈维氏弧菌菌体。将菌体在2.5%戊二醛溶液中4 ℃条件下过夜培养,用0.1 mol/L pH 7.2 PBS 洗涤2 次,每次5 min,洗去残留的戊二醛。分别用40%、70%、90%、100%乙醇溶液对菌体细胞进行脱水处理15 min,将菌体滴加在盖玻片上,自然晾干,喷金,扫描电子显微镜观察。
1.2.7 乳酸菌菌株鉴定
1.2.7.1 生理生化鉴定
参照文献[24]和[26]中乳酸菌的鉴定方法进行生理生化实验[24-26]。
1.2.7.2 16S rRNA鉴定
吸取1.0 mL乳酸菌菌株12 h 菌悬液加入1.5 mL EP管中,12 000 r/min离心5 min,采用DNA快速抽提试剂盒提取菌株DNA,以16S rDNA通用引物进行PCR扩增。正向引物为27f(5-AGAGTTTGATCCTGGCTCAG-3),反向引物为1492r(5-TACGGYTACCTTTGTTACGACTT-3),引物由上海生工生物技术公司合成。PCR体系为 DNA模板1.0 μL、Taq PCR Master mix 12.5 μL、ddH2O 9.5 μL、上游引物1.0 μL、下游引物1.0 μL,总体积25 μL。PCR程序:94 ℃预变性2 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸90 s,72 ℃保持10 min,循环30 次,4 ℃保温[27]。
PCR产物经1%琼脂糖凝胶电泳,观察凝胶成像系统的扩增效果并照相。将扩增成功的PCR产物送至上海生物工程股份有限公司进行测序。测序结果经校对后与NCBI上GenBank数据库中的己有序列进行BLAST比对分析,运用MEGA 5.0软件构建菌株系统发育进化树。
1.3 数据处理
实验均重复测定3 次,数据采用 表示。采用SPSS 18.0软件对数据进行统计学分析,采用Origin 8.0软件进行绘图。
表示。采用SPSS 18.0软件对数据进行统计学分析,采用Origin 8.0软件进行绘图。
2.1 海水鱼肠道乳酸菌的分离
从鲈鱼、刀鱼、牙鲆和大菱鲆等鱼肠道中筛选出具有溶钙圈、过氧化氢酶阴性和革兰氏染色阳性的49 株乳酸菌,分别以鱼类中文首字母和分离顺序进行命名。
2.2 抗哈维氏弧菌乳酸菌菌株筛选
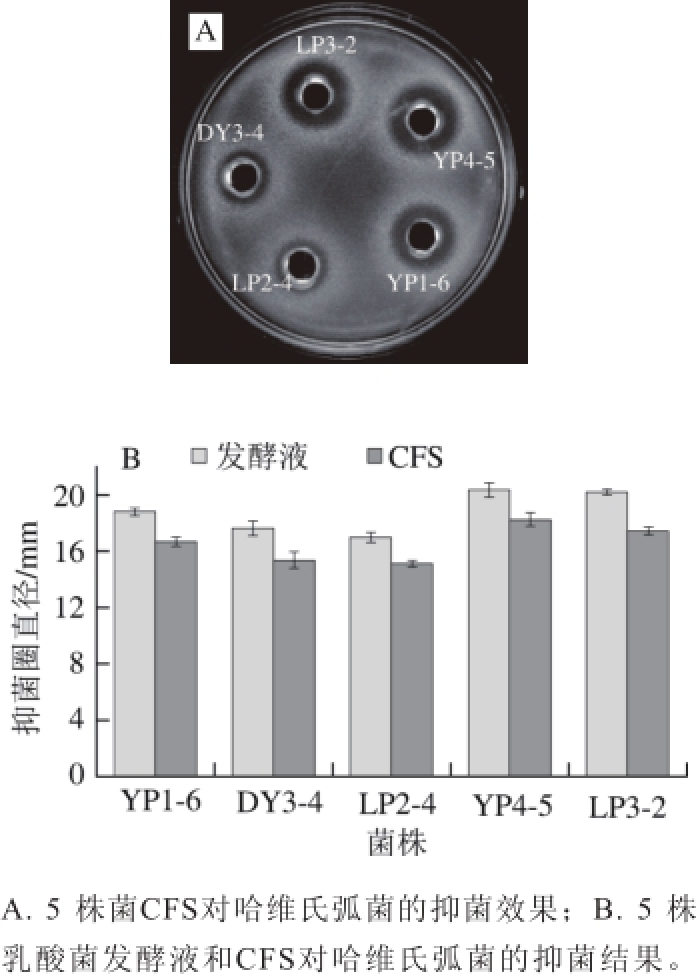
图1 乳酸菌对哈维氏弧菌的抑制效果和作用
Fig. 1 Antagonistic effects of LAB against V. harveyi
利用牛津杯琼脂扩散法从49 株菌株中筛选出5 株对哈维氏弧菌具有较强抑制活性的菌株,分别为DY3-4、YP4-5、YP1-6、LP3-2和LP2-4。由图1A可知,菌株YP4-5和LP3-2的抑菌圈较大,YP1-6次之,DY3-4和LP2-4抑菌圈较小。由图1B可知,发酵液抑菌直径大于其CFS,而菌株CFS抑菌活性均较强,菌株YP4-5 CFS抑菌直径高达18.26 mm。由于发酵液中菌体影响后期抑菌活性物质分离提纯,因此,选取菌株YP4-5 CFS进行下一步研究。
2.3 乳酸菌生长与抗哈维氏弧菌活性曲线分析

图2 菌株YP4-5的生长及拮抗活性曲线
Fig. 2 Growth and antagonistic activity curves of strain YP4-5
乳酸菌在生长过程中形成乳酸等酸性物质和一些拮抗性代谢产物,对细菌、霉菌等微生物生长具有抑制作用[15]。图2为菌株YP4-5经37 ℃条件下静置培养48 h的生长曲线及对哈维氏弧菌抑菌活性的动态变化结果。从中可以看出,随着培养时间的延长pH值呈现逐步下降趋势,在20 h呈水平发展态势。从培养至12 h时,YP4-5 CFS才表现出对哈维氏弧菌生长具有的抑菌作用,当细菌培养到24 h时抑菌活性达到最大值,后期呈稳定状态。结果表明乳酸菌生长至稳定期时,其拮抗性代谢产物已经形成。因此,选择24 h为菌株YP4-5抑菌活性研究的最佳时间。
2.4 影响乳酸菌CFS抑制哈维氏弧菌的因素分析
2.4.1 酶敏感性实验
表1 酶处理对菌株YP4-5 CFS抑菌活性的影响
Table 1 Effects of protease treatment on the antibacterial activity of the CFS of YP4-5

注:—.无抑菌作用。表2同。
乳酸菌代谢产物中的抑菌活性物质包括乳酸菌素、罗伊氏菌素和双乙酰等代谢产物,蛋白酶敏感性测定是影响抑菌活性物质的主要因素之一[28]。表1是YP4-5 CFS经胃蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶和碱性蛋白酶处理后对哈维氏弧菌抑菌结果,从中可以看出,经蛋白酶处理后抑菌活性出现不同程度的降低或丧失。胃蛋白酶和中性蛋白酶处理后抑菌活性丧失率分别为26.52%和33.76%,表明菌株YP4-5的抑菌作用对胃蛋白酶和中性蛋白酶具有一定的敏感性。经木瓜蛋白酶、胰蛋白酶和碱性蛋白酶处理后抑菌活性完全丧失,说明YP4-5对这3 种酶敏感。依据菌株YP4-5 CFS中对蛋白酶的敏感性实验结果,可初步判定其抑菌物质为细菌素类。
2.4.2 pH值和热稳定性实验由表2可知,抑菌圈直径随pH值上升高呈现下降趋势。当pH 4.5时,菌株YP4-5 CFS对哈维氏弧菌仍具有抑制作用,对照组的抑菌活性完全丧失,在pH 2.5~4.5范围内对哈维氏弧菌具有抑制作用。结果表明,菌株YP4-5 CFS中抑菌活性物质部分来自酸环境,同时还存在其他抗菌成分。50、80 ℃和100 ℃条件下处理30 min后的菌株YP4-5 CFS抑菌活性分别下降了0.83%、1.05%和
表2 不同pH值和温度处理对菌株YP4-5 CFS抑菌活性的影响
Table 2 Effects of pH and thermal treatment on the anti-bacterial activity of CFS of strain YP4-5

1.21 %,差异不显著(P>0.05)。结果表明,菌株YP4-5 CFS中的抑菌活性物质具有良好的热稳定性。Gómez等[29]
从鳕鱼、沙丁鱼和虹鳟鱼等水产品中分离获得产细菌素的乳酸片球菌(Pediococcus acidilactici)和清酒乳杆菌(Lactobacillus sakei)等乳酸菌菌株,乳酸菌CFS经65、
75、100 ℃和121 ℃处理后仍具有良好的热稳定性。
2.5 乳酸菌抑制哈维氏弧菌生长曲线分析

图3 YP4-5 CFS处理对哈维氏弧菌生长曲线的影响
Fig. 3 Effects of strain YP4-5 CFS on the growth of V. harveyi
测定结果表明菌株YP4-5对哈维氏弧菌的MIC值为8.0 mg/mL。从图3可以看出,未添加YP4-5 CFS的对照组哈维氏弧菌细胞生长量明显高于添加CFS的实验组。与对照组的典型生长曲线相比,经过菌株YP4-5 CFS处理的哈维氏弧菌生长曲线的对数期呈现平缓发展趋势,稳定期延迟。当哈维氏弧菌的菌量达到最大值时,实验组仅为对照组细菌数量的74.74%。表明YP4-5 CFS对哈维氏弧菌的细胞增殖具有抑制作用。
2.6 乳酸菌CFS处理哈维氏弧菌细胞扫描电子显微镜分析
拮抗性乳酸菌通过形成酸性物质、拮抗性次级代谢产物等以破坏细胞膜的完整性杀伤受试细菌,从而达到抑菌和杀菌的作用效果[30-31]。由图4可知,对照组的哈维氏弧菌细胞形态完整,胞膜平滑,两端圆钝。当加入0.4 MIC的YP4-5 CFS时,哈维氏弧菌细胞的形态完整,但细胞膜出现褶皱;当质量浓度达到1.0 MIC时,细胞完整性发生改变,细胞膜出现溶解现象;到3.0 MIC时,细胞完整性完全丧失,细胞发生溶解。表明随着菌株YP4-5 CFS中抑菌活性物质浓度的增加,对哈维氏弧菌细胞的结构具有破坏作用,其主要抑菌作用方式为杀菌,结果与Necima等[31]的研究一致。

图4 YP4-5 CFS对哈维氏弧菌细胞结构的影响
Fig. 4 Effects of YP4-5 CFS on the ultrastructure of V. harveyi cells revealed by scanning eletron microscopy
2.7 乳酸菌菌株鉴定结果
2.7.1 生理生化鉴定结果
表3 菌株YP4-5的生理生化鉴定结果
T
able 3 Physiological and biochemical results for the identifi cation of strain YP4-5
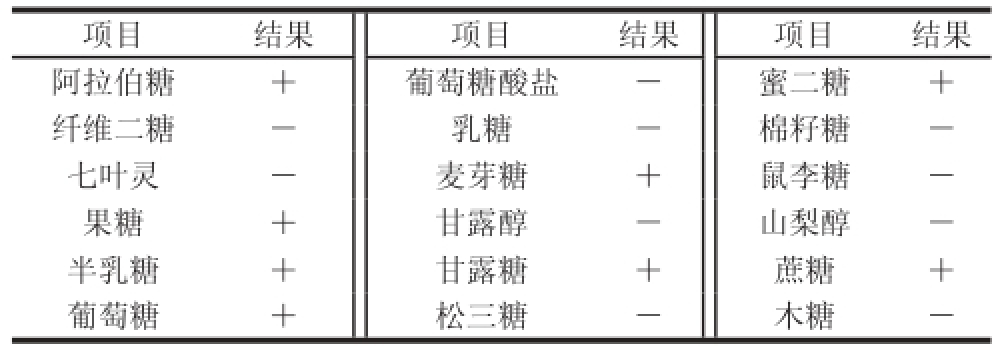
注:+.阳性;-.阴性。
表3为菌株YP4-5的生理生化鉴定结果,依照文献[12]可初步判定菌株YP4-5可能为清酒乳杆菌。
2.7.2 16S rRNA鉴定
图5是菌株YP4-5 16S rRNA基因扩增电泳图,从中可以看到菌株在1 500 bp左右出现一条亮带。经PCR产物测序分析,菌株YP4-5的16S rRNA基因序列长度为1 448 bp。
菌株同源性分析及系统发育树建立:应用MEGA5.05将菌株YP4-5的测序结果与GenBank数据库中乳杆菌属标准菌株的基因序列进行比对分析。由图6可知,菌株YP4-5与标准菌株清酒乳杆菌qz1196在同一分支上,同源性达到100%。因此,可确定菌株YP4-5为清酒乳杆菌。
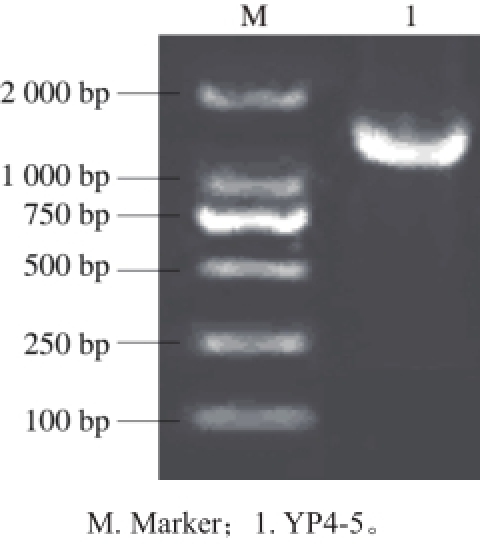
图5 菌株YP4-5的16S rRNA基因扩增电泳图
Fig. 5 PCR amplifi cation of 16S rRNA gene of strain YP4-5

图6 菌株YP4-5的系统发育树
Fig. 6 Phylogenetic tree for strain YP4-5
海鱼肠道中的乳酸菌对海洋生态环境具有良好的适应性,预计对生长在海洋环境的哈维氏弧菌引起的疾病防控将取得较好的效果。本研究从牙鲆肠道中筛选出对哈维氏弧菌具有较强抑制作用的清酒乳杆菌YP4-5,初步分析其抑菌活性成分为蛋白类物质,对酸性具有较好的耐受性和良好的热稳定性。应用该菌株研发一种微生态制剂控制海水养殖中的哈维氏弧菌导致的弧菌病具有一定的应用价值。
参考文献:
[1] PANDE G S J, SCHEIE A A, BENNECHE T, et al. Quorum sensing-disrupting compounds protect larvae of the giant freshwater prawn Macrobrachium rosenbergii from Vibrio harveyi infection[J]. Aquaculture, 2013, 406/407: 121-124. DOI:10.1016/ J.AQUACULTURE.2013.05.015.
[2] 王刚, 孙成波, 蔡传彬, 等. 哈维氏弧菌和白斑综合症病毒对墨吉明对虾仔虾的致病性[J]. 热带生物学报, 2016, 7(1): 1-9. DOI:10.15886/j.cnki.rdswxb.2016.01.001.
[3] DABU I M, LIM J J, ARABIT P M T, et al. The fi rst record of acute hepatopancreatic necrosis disease in the Philippines[J]. Aquaculture Research, 2015(22): 1-8. DOI:10.1111/are.12923.
[4] WON K M, PARK S I. Pathogenicity of Vibrio harveyi to cultured marine fishes in Korea[J]. Aquaculture, 2008, 285(1): 8-13. DOI:10.106/j.aquaculture.2008.08.013.
[5] Food and Agriculture Organization. Report of the FAO/Mard technical workshop on early mortality syndrome or acute hepatopancreatic necrosis syndrome of cultured shrimp Hanoi, Viet Nam[R]. Rome: FAD, 2013.
[6] de SCHRYVER P, DEFOIRDT T, SORGELOOS P. Early mortality syndrome outbreaks: a microbial management issue in shrimp farming?[J]. PLoS Pathogens, 2014, 10(4): 506-513. DOI:10.1371/ journal.ppat.1003919.
[7] 李洋, 李强, 张显昱. 哈维弧菌及其主要致病因子的研究进展[J]. 中国农业科技导报, 2014, 16(4): 159-166. DOI:10.13304/j.nykjdb.2014.031. [8] 李亚晨, 包永明, 吕建发, 等. 海洋水产动物弧菌病的生物防治[J]. 水产科学, 2004, 23(2): 35-38. DOI:10.3969/ j.issn.1003-1111.2004.02.011.
[9] 张欢欢, 王秀华, 李晨, 等. 对虾养殖池中一株弧菌拮抗菌的分离鉴定[J]. 渔业科学进展, 2016, 37(3): 85-92. DOI:10.11758/ yykxjz.20150417001.
[10] 王鑫磊, 李航, 黄旭雄, 等. 饲料中胆固醇含量对淡水养殖凡纳滨对虾生长性能、抗弧菌和抗亚硝态氮胁迫能力的影响[J]. 动物营养学报, 2016, 28(8): 2639-2649. DOI:10.3969/j.issn.1006-267x.2016.08037.
[11] BARBOSA M C, JATOBA A, do NASCIMENTO VIEIRA F, et al. Cultivation of juvenile jat snook (Centropomus parallelus poey, 1860) fed probiotic in laboratory conditions[J]. Brazilian Archives of Biology and Technology, 2011, 54(4): 795-801. DOI:10.1580/ s1516-8913201100040002.
[12] ANGMO K, KUMARI A, SAVITRI, et al. Probiotic characterization of lactic acid bacteria isolated from fermented foods and beverage of Ladakh[J]. LWT-Food Science and Technology, 2016, 66: 428-435. DOI:10.1016/j.lwt.2015.10.057.
[13] KAUR J, LEE S, PARK Y S, et al. RAPD analysis of Leuconostoc mesenteroides, strains associated with vegetables and food products from Korea[J]. LWT-Food Science and Technology, 2017, 77: 383-388. DOI:10.1016/j.lwt.2016.11.078.
[14] KIM E, CHO Y, LEE Y, et al. A proteomic approach for rapid identification of Weissella, species isolated from Korean fermented foods on MALDI-TOF MS supplemented with an in-house database[J]. International Journal of Food Microbiology, 2016, 243: 9-15. DOI:10.1016/j.ijfoodmicro.2016.11.027.
[15] CHEN Y S, WU H C, YU C R, et al. Isolation and characterization of lactic acid bacteria from xi-gua-mian (fermented watermelon), a traditional fermented food in Taiwan[J]. Italian Journal of Food Science, 2016, 28(1): 9-14. DOI:10.14674/1120-1770/ijfs.v451.
[16] KHOUSDJA S, HADDAJI N, HANCHI M, et al. Selection of lactic acid bacteria as candidate probiotics for Vibrio parahaemolyticus, depuration in pacific oysters (Crassostrea gigas)[J]. Aquaculture Research, 2016, 69(14): 1-10. DOI:10.1111/are.13026.
[17] 任士菊, 王俊钢, 周红, 等. 冷水鱼肠道抑菌活性乳酸菌的筛选及其生理特性分析[J]. 食品工业科技, 2014, 35(14): 178-181. DOI:10.13386/j.issn1002-0306.2014.14.031.
[18] ZAPATA A A, LARA-FLORES M. Antimicrobial activities of lactic acid bacteria strains isolated from Nile tilapia intestine (Oreochromis niloticus)[J]. Journal of Biology and Life Science, 2013, 4(1): 164-171. DOI:10.5296/jbls.v4i1.2408.
[19] 周海平, 李卓佳, 杨莺莺, 等. 乳酸杆菌LH对几种水产养殖病原弧菌的抑制作用[J]. 应用海洋学学报, 2006, 25(3): 388-395. DOI:1000-8160(2006)03-0388-08.
[20] ALOMSKIENÉ J, ABRAITIENÉ A, JONKUVIENÉ D, et al. Selection of enhanced antimicrobial activity posing lactic acid bacteria characterized by (GTG)5-PCR fingerprinting[J]. Journal of Food Science and Technology, 2014, 52(7): 4124-4134. DOI:10.1007/ s13197-014-1512-6.
[21] MANZOOR A, UI-HAQ I, BAIG S, et al. Effi cacy of locally isolated lactic acid bacteria against antibiotic-resistant uropathogens[J]. Jundishapur Journal of Microbiology, 2016, 9(1): 1-11. DOI:10.5812/ jjm.18952.
[22] SARAOUI T, FALL P A, LEROI F, et al. Inhibition mechanism of Listeria monocytogenes by a bioprotective bacteria Lactococcus piscium CNCM I-4031[J]. Food Microbiology, 2016, 53: 70-78. DOI:10.1016/j.fm.2015.01.002.
[23] HOVNANYAN K O, MARUTYAN S, PEPOYAN A, et al. Transmission and scanning electron microscopy of contacts between bacterial and yeast cells in biofilms on different surfaces[J]. Open Access Library Journal, 2015, 59(4): 423-435. DOI:10.13140/ RG.2.1.1318.3524.
[24] 凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 130-137.
[25] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 289-294.
[26] BUDANAN R E, GIBBONR N E. 伯杰细菌鉴定手册[M]. 北京: 中国科学出版社, 1984: 477-478.
[27] 缪璐欢, 杜静芳, 马欢欢, 等. 淡水鱼肠道中抗芽孢杆菌性乳酸菌的筛选与鉴定[J]. 食品工业科技, 2015, 36(16): 188-192. DOI:10.13386/j.issn1002-0306.2015.16.030.
[28] TATIANA M, ALZBETA M, LUBOMIR V. Production of antimicrobial substances by lactic acid bacteria[J]. Chemické Listy, 2016, 110: 179-184. DOI:10.1385/1-59259-766-1:337.
[29] GÓMEZ S B, MUÑOZ A E, SÁNCHEZ J, et al. Bacteriocin production by lactic acid bacteria isolated from fi sh, seafood and fi sh products[J]. European Food Research and Technology, 2015, 241(3): 1-16. DOI:10.1007/s00217-015-2465-3.
[30] BELGACEM Z B, FERCHICHI M, PRÉVOST H, et al. Screening for anti-listerial bacteriocin-producing lactic acid bacteria from Gueddida traditionally Tunisian fermented meat[J]. Meat Science, 2008, 78(4): 513-521. DOI:10.1016/j.meatsci.2007.07.021.
[31] NECIMA G, OLFA B B, HANI K, et al. Isolation and characterization of large spectrum and multiple bacteriocin-producing Enterococcus faecium strain from raw bovine milk[J]. Journal of Applied Microbiology, 2015, 118(2): 343-55. DOI:10.1111/jam.12699.
Screening and Identifi cation of Anti-Vibrio harveyi Lactic Acid Bacteria Derived from Marine Fish Intestine
MA Huanhuan1, LÜ Xinran2, LIN Yang1, BAI Fengling1,*, LI Jianrong1
(1. Food Safety Key Laboratory of Liaoning Province, National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, College of Food Science and Technology, Bohai University, Jinzhou 121013, China; 2. College of Biological Sciences and Technology, Beijing Forestry University, Bei jing 100083, China)
Abstract:Vibrio harveyi is a main pathogenic bacterium that can induce vibriosis of shrimp and fish in the marine environment, causing huge economic losses in aquaculture. In this paper, 49 strains of lactic acid bacteria (LAB) were isolated from the marine fish intestine by the use of 1.0% CaCO3MRS agar, including seabass, coilia ectenes, Paralichthys lethostigma and turbot. strain YP4-5 isolated from the intestine of Paralichthys lethostigma had strong antagonistic activity against V. harveyi using the method of Oxford cup agar diffusion, showing an inhibitory zone diameter of 18.26 mm. Antimicrobial substances of the cell-free supe rnatant (CFS) produced by strain YP4-5 were sensitive to protease, heat stable and effective within the pH range of 2. 54.5, and they were prelimin ary determined as bacteriocins. The growth curve indicated tha t 74.74% of V. harveyi was inhibited by treatment with the CFS at a concentration of 0.4 MIC. Furthermore, cell integrity damage, cell membrane dissolution and intracellular component leakage were observed by scanning electron microscope. Strain YP4-5 was identifi e d as Lactobacillus sakei according to phys iological and biochemical characteristics and 16S rRNA sequence analysis. This research can provide a good source of probiotics to preve nt and cont rol V. harveyi infection in aquacultu re.
Key words:marine fi sh intestine; lactic acid bacteria; inhibition; Vibrio harveyi; screening and identifi cation
DOI:10.7506/spkx1002-6630-201708016
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)08-0096-06
引文格式:
马欢欢, 吕欣然, 林洋, 等. 海水鱼肠道源性抗哈维氏弧菌乳酸菌的筛选与鉴定[J]. 食品科学, 2017, 38(8): 96-101.
DOI:10.7506/spkx1002-6630-201708016. http://www.spkx.net.cn
MA Huanhuan, LÜ Xinran, LIN Yang, et al. Screening and identifi cation of anti-Vibrio harveyi lactic acid bacteria derived from marine fi sh intestine[J]. Food Science, 2017, 38(8): 96-101. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201708016. http://www.spkx.net.cn
收稿日期:2016-06-16
基金项目:辽宁省科技厅攻关项目(2015103020);泰山学者蓝色产业领军人才团队支撑计划项目(鲁政办字(2015)19号)
作者简介:马欢欢(1991—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:mahuanhuan14@163.com
*通信作者:白凤翎(1964—),男,教授,博士,研究方向为食品安全与质量控制和食品微生物学。E-mail:baifi ing@163.com