高 涛,王 芳,别小妹,吕凤霞,赵海珍,张 充,陆兆新*
(南京农业大学食品科技学院,江苏 南京 210095)
摘 要:从某火山口的土壤样品中分离筛选得到了一株产耐热普鲁兰酶菌株T-10,酶活力为1.22 U/mL。经形态特征观察、生理生化特征实验以及16S rDNA序列同源性分析,确定该菌株为解淀粉芽孢杆菌。酶学性质研究表明:该普鲁兰酶的最适温度是60 ℃,在70 ℃保温4 h后活力残留60%以上;最适pH值为6.0,pH 3.0~8.0在室温保存4 h后相对酶活力大约为70%。目前,鲜有发现产耐热普鲁兰酶的菌株为解淀粉芽孢杆菌,其具备良好的应用前景。
关键词:普鲁兰酶;筛选;生理生化;16S rDNA;酶学性质
淀粉是一类重要的含碳有机化合物,在人们生产生活中广泛应用。淀粉是多分子聚合物,由直链淀粉和支链淀粉组成。谷物是淀粉原料最重要的来源,谷物中直链淀粉约占20%,支链淀粉约占80%[1]。支链淀粉每隔17~26 个葡萄糖单位就有一个支链点,整个淀粉约含4%~5%的α-1,6糖苷键[2-3]。在淀粉工业生产中,使用淀粉酶对淀粉进行水解,淀粉酶只能作用于α-1,4糖苷键,支链淀粉的存在会影响水解产物的产量和纯度。另一方面,受各种因素的影响,淀粉脱支酶的生产应用规模较小。普鲁兰酶是一种能够专一性切开支链淀粉分支点中的α-1,6糖苷键,从而剪下整个侧枝,形成直链淀粉的脱支酶[4]。显然普鲁兰酶能最大限度利用淀粉原料,因此在淀粉加工工业上具有重要用途。淀粉水解工业过程对温度要求较高,一般温度需要超过60 ℃,因此要将普鲁兰酶应用到实际生产中,就需要筛选产生耐高温的普鲁兰酶的菌株[5]。
嗜热菌主要存在于极端环境,大多数嗜热菌存在环境温度较高的地方,如火山口和温泉等;嗜热菌的最适生长温度为60~80 ℃,是产耐热酶原始菌的主要来源[6]。从嗜热菌富集环境中筛选产耐热普鲁兰酶的菌株是很多相关领域研究者的研究重点,与普通普鲁兰酶产生菌株相比,产耐热普鲁兰酶菌株具有很多优势,如提高转化率、改善底物溶解性、降低黏度和减少微生物污染等[7]。目前普鲁兰酶在高浓度麦芽糖[8-9]、抗性淀粉[10-13]、果葡糖浆[14]、啤酒[15]、饲料以及酒精生产中应用[16],并显示了巨大的应用价值。
本研究从某火山口的土壤样品中分离筛选菌株,获得产耐热普鲁兰酶的菌株,为耐热普鲁兰酶的发展应用提供了一个新的研究对象。
1.1 材料、培养基与试剂
1.1.1 样品
本研究所用的土样,取自某火山口。
1.1.2 培养基
分离培养基:糯米淀粉20.0 g、蛋白胨10.0 g、硫酸铵5.0 g、磷酸二氢钾1.0 g、七水合硫酸镁0.5 g、琼脂20.0 g,定容至1 000 mL,调节pH 6.0,121 ℃灭菌15 min。
鉴别培养基:红色普鲁兰糖3.0 g、蛋白胨5.0 g、磷酸二氢钾0.5 g、七水合硫酸镁0.1 g、琼脂20.0 g,定容至1 000 mL,调节pH 6.0,121 ℃灭菌15 min。
发酵培养基:可溶性淀粉20.0 g、蛋白胨10.0 g、硫酸铵5.0 g、磷酸二氢钾1.0 g、七水合硫酸镁0.5 g、琼脂20.0 g,定容至1 000 mL,调节pH 6.0,121 ℃灭菌15 min。
肉汤培养基:牛肉膏3 g、蛋白胨10 g、氯化钠5 g,定容至1 000 mL,调节pH 7.0~7.5,121 ℃灭菌15 min。
LB液体培养基:胰化蛋白胨10.0 g、酵母提取物5.0 g、NaCl 10.0 g,定容至1 000 mL,pH 7.0,121 ℃灭菌15 min。
菌株鉴定用培养基:糖发酵培养基、柠檬酸盐培养基等的配制参照文献[17-20]。
1.1.3 试剂
氨苄青霉素、细菌基因组提取试剂盒、柱式质粒提取试剂盒、pMD19-T连接试剂盒、Taq DNA聚合酶、琼脂糖 上海生工生物工程有限公司;酵母提取物、胰蛋白胨 英国Oxoid公司;普鲁兰糖 上海Aladdin公司;DNA Marker 南京金斯瑞公司;其他试剂均为国药集团化学试剂有限公司售分析纯。
1.2 仪器与设备
YXQ.SG41.280手提式压力蒸汽灭菌锅 上海医用核子仪器厂;SW-CJ-IBU超净工作台 苏净集团安泰公司;BCD-215YD冰箱 青岛海尔集团;Orion 3 STAR pH计美国Thermo公司;PYX-DHS-50X65隔水式电热恒温培养箱 上海跃进医疗器械厂;GXZ-9240 MBE鼓风干燥箱 上海博迅实业有限公司医疗设备厂;WFJ 7200可见光分光光度计 尤尼柯上海仪器公司;Eclipse 80i光学显微镜 日本Nikon公司;HYG-C全温摇瓶柜 太仓实验设备厂;AY120电子精密天平 日本Shimadzu公司;Centrifuge 5804R冷冻离心机 德国Eppendorf公司;PTC-100TM PCR仪 MJ Research公司;JS-380C全自动数码凝胶成像分析仪 上海培清科技有限公司;DYY 6B稳流恒压电泳仪 江苏南达生物技术开发公司;DK-8D型电热恒温水槽 上海森信实验仪器有限公司;SXZ型智能生化培养箱 宁波江南仪器厂。
1.3 方法
1.3.1 菌体富集
将少量土样无菌条件下加入至100 mL肉汤培养基中,37 ℃振荡培养48 h。取1 mL培养物于9 mL灭菌生理盐水中混匀,相同操作,将培养物稀释10-6、10-7、10-8,涂布于分离培养基固体平板上[21]。
1.3.2 平板初筛、复筛
取适当稀释浓度的培养液涂布于分离培养基,37 ℃恒温箱倒置培养48 h,在分离平板中滴加3 mL 1%碘液,挑取有透明圈者,划线分离纯化,37 ℃条件下倒置培养24 h。在分离平板中滴加3 mL 1%碘液,把有透明圈的菌株转入鉴别培养基,于37 ℃恒温箱中培养48 h。后加入10 mL无水乙醇,室温放置。观察菌落周围的透明圈情况,透明圈的大小可一定程度上反映菌株产普鲁兰酶活力的高低[22]。
将初筛得到的纯化后的菌种,用接种环挑取少量菌体,接种到装有100 mL发酵培养基的250 mL三角瓶中,置于37 ℃条件下,180 r/min摇床培养48 h。测定发酵上清液中普鲁兰酶活力。
1.3.3 菌种的保藏
从37 ℃条件下培养的LB平板上挑取细菌的单菌落,接种于分离培养基制作的斜面上,作菌种的初步保藏,并标上编号。
从发酵液中取600 μL菌液,加入200 μL 60%甘油到1.5 mL离心管中,并在离心管标上编号,-18 ℃条件下冻存保藏。
1.3.4 普鲁兰酶活力的测定
以葡萄糖为标准品,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定反应液中还原糖的量[23]。在试管中依次加入不同物质的量的葡萄糖溶液、800 μL DNS溶液,置于沸水中煮沸10 min后,立即冷却,用可见光分光光度计测定540 nm波长处的吸光度。用0号管调零点,测出1~6号管的吸光度。得到回归方程y=0.723 0x-0.010 54,R2=0.997 2,y表示A540nm,x表示葡萄糖的物质的量/μmol。
取发酵液5 000 r/min离心10 min后得到上清酶液,于洁净试管中依次加入0.5%普鲁兰糖溶液200 μL、pH 6.0磷酸盐缓冲液900 μL,60 ℃水浴预热5 min,然后加入100 μL酶液,水浴中保温10 min。取出加入DNS试剂800 μL,沸水浴显色,之后流水冷却,补充蒸馏水至4 mL,测定A540nm。
一个酶活力单位定义为在60 ℃、pH 6.0条件下,每分钟水解普鲁兰糖产生的相当于1 μmol葡萄糖的酶量。普鲁兰酶酶活力计算公式如下:
式中:X为试样普鲁兰酶的活力/(U/mL);A1、A0分别为反应后及对照的吸光度;n为试样的总稀释倍数;10为将0.1 mL酶稀释折算为1 mL中的普鲁兰酶酶活力;t为酶解反应时间/min;0.723 0为葡萄糖标准曲线斜率;0.010 54为葡萄糖标准曲线截距绝对值。
1.3.5 菌株鉴定
1.3.5.1 菌落形状及形态观察
挑取少量单菌落分别在筛选培养基和鉴别培养基上划线,置于37 ℃恒温箱中培养48 h后观察结果。主要记录形状和大小、颜色和光泽、表面是否隆起和边缘的形状等性状特点,并对菌株进行革兰氏染色和芽孢染色,在显微镜下观察其形态[18]。
1.3.5.2 生理生化鉴定
参照文献[18-20],研究了菌株T-10在运动性、耐盐性、接触酶、淀粉水解、VP实验、甲基红、硝酸盐还原、碳源利用和硫化氢等方面的情况 。
1.3.5.3 16S rDNA鉴定
以菌株T-10基因组DNA作为PCR扩增的模板,使用上海生工生物工程有限公司的细菌基因组DNA提取试剂盒提取菌株的T-10基因组DNA。通用引物为F(5-AGAGAGTTTGATCCTGGCTCAG-3)和R(5-CTACGGCTACCTTGTTACGA-3)。
聚合酶链式反应(polymerase chain reaction,PCR)体系(25 μL):12.5 μL 2×Taq DNA聚合酶;1 μL引物F;1 μL引物R;1 μL模板DNA;9.5 μL ddH2O。PCR步骤:94 ℃热启动变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s;29 次循环;72 ℃延伸10 min。PCR产物用1%的葡聚糖凝胶在120 V的电压下进行电泳,并以DL 2000作为其分子质量标准。
PCR产物用胶回收试剂盒进行胶回收后送到南京金斯瑞生物科技有限公司进行测序,测得的基因序列利用BLAST在GenBank中搜索一致性序列后利用软件Clustal X与样品序列进行比对,并用软件MEGA5.0[24]构建T-10进化树。
1.3.6 普鲁兰酶酶学性质初步分析
1.3.6.1 普鲁兰酶的最适温度及热稳定性
参考文献:[25]的方法,在pH 6.0、不同温度(30、40、50、60、70 、80、90 ℃)条件下测定普鲁兰酶的活力,以酶活力最高者为100%对照,确定最适反应温度。将酶液分别置于不同温度(30、40、50、60、70、80、90 ℃)的水浴中保温4 h,然后迅速冷却,在最适反应温度下反应,测定普鲁兰酶的剩余酶活力,以活力最高者为100%对照,研究温度对普鲁兰酶稳定性的影响。
1.3.6.2 普鲁兰酶的最适pH值及pH值稳定性
参考文献[25]的方法,在最适温度条件下,将酶液分别与pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0的普鲁兰糖底物反应10 min,测定普鲁兰酶活力,以酶活力最高者为100%对照,确定最适pH值。将酶液置于pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0的缓冲液中室温保持4 h后,于最适pH值下测定剩余酶活力,以活力最高者为100%对照,研究pH值对普鲁兰酶稳定性的影响。
2.1 平板筛选菌株
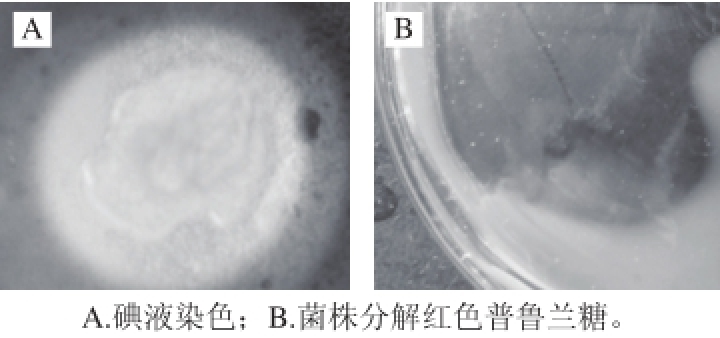
图1 菌株T-10平板筛选结果
Fig. 1 Screening of strain T-10
表1 初筛出菌株的酶活力检测结果
Table 1 Enzymatic activity of the pre-screened strains
从某火山口采集的3 份土样,经过分离培养基平板的初筛,选出可以与碘液反应出现透明圈(图1A)的菌株,接入鉴别培养基平板,筛选得到10 株能分解红色普鲁兰糖,出现白色透明圈(图1B)的菌株。通过DNS比色法检测酶活力后(表1),菌株T-10的酶活力达到1.22 U/mL,酶活力最高,选择菌株T-10作为后期研究的对象。
2.2 菌株的培养性状、形态特征和生理生化特征
菌株T-10为革兰氏染色阳性菌,菌体形状为短杆状、染色均匀和具有运动性(图2A),有芽孢且呈卵圆形(图2B)。在筛选培养基平板上的菌落为白色、低凸起、边缘不规则;表面皱褶、无光泽、不透明、菌体黏稠、能拉丝(图2C)。

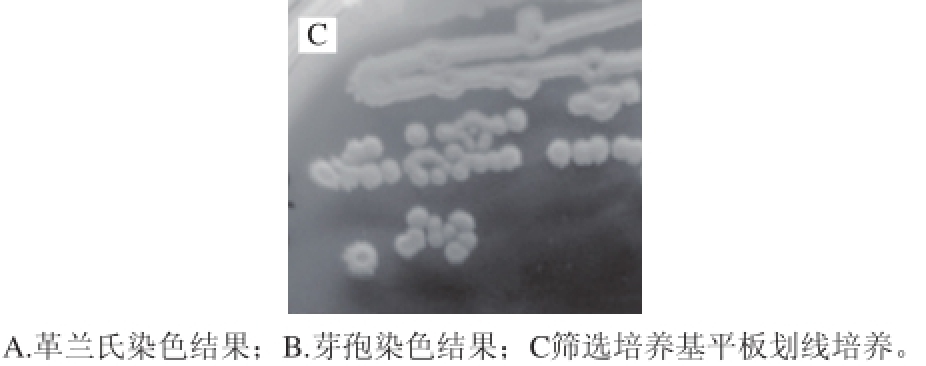
图2 菌株T-10培养特征
Fig. 2 Cultural characteristics of strain T-10
表2 菌株T-10生理生化特征鉴定结果
Table 2 Physiological and biochemical characteristics of strain T-10

注:+.代表阳性;-.代表阴性。
菌株T-10生理生化特征鉴定结果如表2所示。通过微生物的形态观察和生理生化实验,按文献[26]方法进行分析,初步鉴定菌株T-10为属于解淀粉芽孢杆菌或枯草芽孢杆菌。
2.3 菌株T-10的16S rDNA序列分析

图3 菌株T-10的系统发育树
Fig. 3 Phylogenetic relationship between strain T-10 and its close relatives
菌株T-10 16S rDNA序列测序后采用NCBI数据库,使用Blast-n在GenBank基因库中进行同源性搜索,所得结果中,与菌株T-10相似度最高能达到99%,如Bacillus amyloliquefaciens DSM7(登录号:NC014551.1)和Bacillus subtilis subsp. subtilis str. 168 chromosome(登录号:NC000964.3)。从GenBank比对结果中选出11 株菌与T-10一起进行系统发育树的构建,系统发育树如图3所示,可以看出,菌株T-10与Bacillus amyloliquefaciens DSM7(登录号:
NC014551.1)的亲缘关系最近,结合其形态学和生理生化鉴定结果可以确定菌株T-10为解淀粉芽孢杆菌属。
2.4 酶的性质测定结果
2.4.1 普鲁兰酶的最适温度及热稳定性
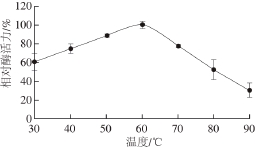
图4 温度对普鲁兰酶活力的影响
Fig. 4 Effect of temperature on the pullulanase activity
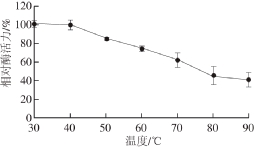
图5 普鲁兰酶热稳定性
Fig. 5 Thermal stability of the pullulanase
如图4所示,菌株T-10所产普鲁兰酶在30~60 ℃条件下相对酶活力随着温度的提高而增长,在60~90 ℃条件下相对酶活力随着温度的提高而降低,60 ℃是酶反应的最适温度。该酶的温度稳定性实验结果表明(图5),普鲁兰酶在30~40 ℃保温4 h后酶活力基本不变,在50 ℃保温4 h后活力残留84.73%,在60 ℃保温4 h后活力残留73.79%,在70 ℃保温4 h后活力残留61.41%,在90 ℃保温4 h后相对酶活力依然超过40%。由此可知,菌株T-10所产普鲁兰酶具有很好的热稳定性。
2.4.2 普鲁兰酶的最适pH值及pH值稳定性
如图6所示,菌株T-10所产普鲁兰酶在pH 3.0~6.0相对酶活力随着pH值的提高而增长,在pH 6.0~10.0相对酶活力随着pH值的提高而降低,pH 6.0是酶反应的最适pH值。该酶的pH值稳定性实验结果表明(图7),该酶在pH 5.0~7.0条件下室温保存4 h后相对酶活力保持在80%以上,pH 3.0~8.0在室温保存4 h后相对酶活力大约为70%。由此可知,菌株T-10所产普鲁兰酶具有很好的pH值稳定性,而且该酶具有较广泛的pH值适应性。
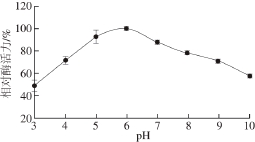
图6 pH值对普鲁兰酶活力的影响
Fig. 6 Effect of pH on the pullulanase activity

图7 普鲁兰酶pH值稳定性
Fig. 7 pH stability of the pullulanase
本实验通过固体平板初筛和摇瓶复筛从某火山口的土壤样品中分离筛选获得一株产耐热普鲁兰酶的菌株T-10,发酵液中普鲁兰酶活力为1.22 U/mL,经形态特征观察、生理生化特征实验以及16S rDNA序列同源性分析,确定菌株T-10是解淀粉芽孢杆菌。菌株T-10所产普鲁兰酶的最适温度是60 ℃,在70 ℃保温4 h后活力残留60%以上;最适pH值为6.0,pH 3.0~8.0在室温保存4 h 后相对酶活力大约为70%,具有很好的热稳定性和较为广泛的pH值稳定性。
然而,直接从天然环境中分离筛选出的产耐热普鲁兰酶菌株T-10无法满足实际生产需要,产酶量和酶活力较低,必需要借助基因工程和蛋白质工程进行改造,才能使耐热普鲁兰酶真正意义上实现大规模工业化的生产。其一是通过基因工程手段构建基因工程菌,进一步提高酶的产量和活性,降低生产成本,真正实现该酶产业化;其二是利用定点突变技术进一步提高普鲁兰酶的产量和活性[5]。其三利用现有解淀粉芽孢杆菌构建的普鲁兰酶基因的表达载体,研究普鲁兰酶和淀粉酶在解淀粉芽孢杆菌中共同表达应用[27]。
参考文献:
[1] 张树政. 酶制剂工业: 下册[M]. 北京: 科学出版社, 1998: 524.
[2] 张明焱. 地衣芽孢杆菌普鲁兰酶编码基因的克隆与表达[D]. 无锡:江南大学, 2008: 1. DOI:10.7666/d.y1397613.
[3] BERTOLDO C, ANTRANIKIAN G. Starch-hydrolyzing enzymes from thermophilic archaea and bacteria[J]. Current Opinion in Chemical Biology, 2002, 6(2): 151-160. DOI:10.1016/S1367-5931(02)00311-3.
[4] 张晓宇, 艾志录, 李梦琴, 等. 极限糊精酶的研究及展望[J]. 中国食品添加剂, 2004(3): 32-35. DOI:10.3969/j.issn.1006-2513.2004.03.009.
[5] 孙劭靖, 路福平, 姜楠, 等. 一株产耐热普鲁兰酶菌株Anoxybacillus sp. LM14-2分离鉴定及酶学性质研究[J]. 生物技术通报, 2011(9): 136-141.
[6] 李淑彬, 陆广欣, 林如妹, 等. 嗜热菌—工业用酶的新来源[J]. 中国生物工程杂志, 2003, 23(7): 67-71. DOI:10.3969/j.issn.1671-8135.2003.07.015.
[7] ZEIKUS J G, BROCK T D. Protein synthesis at high temperatures: aminoacylation of tRNA[J]. Biochimica et Biophysica Acta, 1971, 228(3): 736-745. DOI:10.1016/0005-2787(71)90739-8.
[8] 周念波, 孙杰, 王晶, 等. 普鲁兰酶在食品工业中的应用[J]. 食品工程, 2008(2): 18-20. DOI:10.3969/j.issn.1673-6044.2008.02.005.
[9] 夏永军, 沈哲胜, 艾连中, 等. 两级酶解工艺制备超高麦芽糖浆的研究[J]. 食品与发酵科技, 2015, 51(2): 70-73. DOI:10.3969/j.issn.1674-506X.2015.02-016.
[10] 张泽生, 曹力心, 张建昌. 酶法制备马铃薯抗性淀粉的工艺研究[J]. 食品研究与开发, 2006, 27(5): 57-60. DOI:10.3969/ j.issn.1005-6521.2006.05.022.
[11] 冷志富, 杜双奎, 蔡萌, 等. 普鲁兰酶酶法制备玉米抗性淀粉工艺优化[J]. 中国粮油学报, 2014, 29(8): 28-32.
[12] 谭瑶瑶, 吴亨, 古碧, 等. 不同酶制备木薯抗性淀粉的性质比较[J].食品工业科技, 2013, 34(11): 88-91.
[13] 刘雷, 邹险峰, 雷海容. 油莎豆复合酶法抗性淀粉的制备及纯化工艺[J]. 食品科技, 2015, 40(6): 296-299. DOI:10.13684/j.cnki. spkj.2015.06.066.
[14] NAIR S U, SINGHAL R S, KAMAT M Y. Induction of pullulanase production in Bacillus cereus FDTA-13[J]. Bioresource Technology, 2007, 98(4): 856-859. DOI:10.1016/j.biortech.2006.03.010.
[15] 王秀丽, 王家林. 不同糖化工艺对大麦啤酒的麦汁质量的影响[J].食品研究与开发, 2012, 33(10): 153-155.
[16] 王葳, 贾树彪, 佟晓芳. 燃料乙醇的液化糖化连续发酵工艺[J]. 酿酒, 2006, 33(1): 55-56. DOI:10.3969/j.issn.1002-8110.2006.01.027.
[17] 蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 353-386.
[18] 程丽娟, 薛泉宏. 微生物学实验技术[M]. 2版. 北京: 科学出版社, 2012: 10-13; 75-85.
[19] 钱存柔, 黄仪秀. 微生物学实验教程[M]. 北京: 北京大学出版社, 1999: 85-96.
[20] 朱旭芬. 现代微生物学实验技术[M]. 杭州: 浙江大学出版社, 2011: 198-225.
[21] 乔宇. Ⅰ型普鲁兰酶产业菌的筛选及其基因克隆、分子改造和高密度发酵表达研究[D]. 北京: 中国农业科学院, 2012: 18.
[22] 徐妙, 马玉超, 赵帆, 等. 耐酸、耐热普鲁兰酶产生菌的筛选及酶学性质研究[J]. 广东农业科学, 2012, 39(15): 104-107. DOI:10.3969/ j.issn.1004-874X.2012.15.034.
[23] 朱梦. 普鲁兰酶产生菌的筛选及其酶学性质的研究[D]. 海口: 海南大学, 2010: 18-19.
[24] TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/ molbev/msr121.
[25] 严芬, 王新, 叶秀云. 一株碱性普鲁兰酶菌株的筛选、鉴定及酶学性质研究[J]. 福州大学学报(自然科学版), 2014, 42(4): 633-638. DOI:10.7631/issn.1000-2243.2014.04.0633.
[26] 布坎南, 吉本斯. 伯杰细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984: 729-758.
[27] 孙娟娟. 普鲁兰酶在解淀粉芽孢杆菌中表达方法的探索[D]. 无锡:江南大学, 2011: 3-5.
Isolation, Screening and Identifi cation of a Bacterial Strain Producing Thermostable Pullulanase
GAO Tao, WANG Fang, BIE Xiaomei, LÜ Fengxia, ZHAO Haizhen, ZHANG Chong, LU Zhaoxin*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:A themostable pullulanase-producing strain, designated as T-10, with enzymatic activity of 1.22 U/mL, was isolated from soil samples collected at a crater fi eld. By applying morphological observation, physiological and biochemical tests and 16S rDNA sequence homology analysis, it was identifi ed as Bacillus amyloliquefacienss. The optimum temperature for the pullulanase activity was 60 ℃ and more than 60% of its maximum activity was maintained after incubation at 70 ℃for 4 h. The optimum pH value for the pullulanase activity was 6.0, and about 70% of its maximum activity was maintained in the range of 3.0‒8.0 after incubation for 4 h. At present, only a few thermostable pullulanase-producing strains of B. amyloliquefaciens are available, and so this new strain of B. amyloliquefaciens has a good application prospect.
Key words:pullulanase; screening; physiological and biochemical characteristics; 16S rDNA; enzymatic properties
DOI:10.7506/spkx1002-6630-201708019
中图分类号:Q939.9
文献标志码:A
文章编号:1002-6630(2017)08-0117-05
引文格式:
高涛, 王芳, 别小妹, 等. 产耐热普鲁兰酶菌株的分离、筛选与鉴定[J]. 食品科学, 2017, 38(8): 117-121. DOI:10.7506/ spkx1002-6630-201708019 http://www.spkx.net.cn
GAO Tao, WANG Fang, BIE Xiaomei, et al. Isolation, screening and identification of a bacterial strain producing thermostable pullulanase[J]. Food Science, 2017, 38(8): 117-121. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201708019. http://www.spkx.net.cn
收稿日期:2016-06-03
作者简介:高涛(1990—),男,硕士研究生,研究方向为食品生物技术。E-mail:2014108040@njau.edu.cn
*通信作者:陆兆新(1957—),男,教授,博士,研究方向为食品生物技术。E-mail:fmb@njau.edu.cn