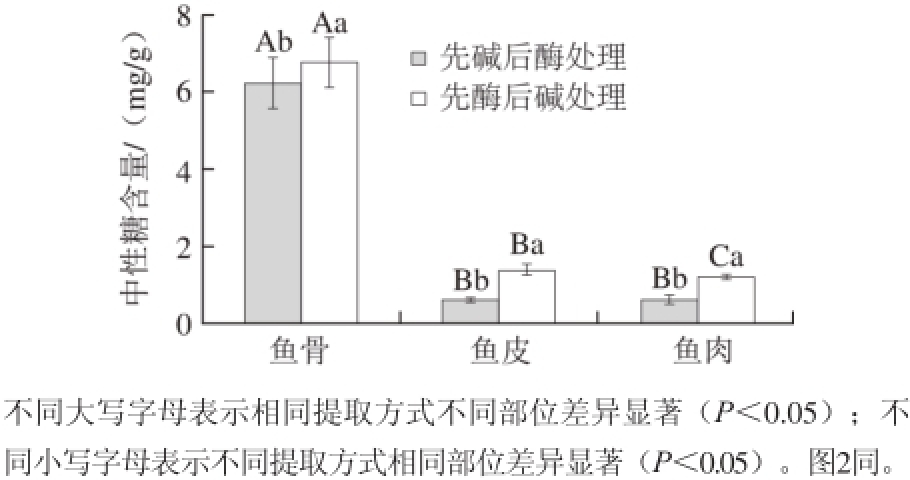
图1 不同处理方式提取的大菱鲆中性糖含量
Fig. 1 Effects of different extraction methods on neutral polysaccharide contents extracted from turbot
郭 丽1,2,3,4,刘 斌1,3,4,温成荣1,3,4,宋 爽1,3,4,*,朱蓓薇1,3,4
(1.大连工业大学食品学院,辽宁 大连 116034;2.绥化学院食品与制药工程学院,黑龙江 绥化 152061;3.国家海洋食品工程技术研究中心,辽宁 大连 116034;4.海洋活性多糖开发应用技术国家地方联合工程实验室,辽宁 大连 116034)
摘 要:为开发大菱鲆功能性多糖成分,采用胰蛋白酶和木瓜蛋白酶双酶法结合碱浸提法对大菱鲆鱼骨、鱼肉、鱼皮3 个部位的多糖进行提取与检测,同时将所得多糖使用三氟乙酸水解、1-苯基-3-甲基-5-吡唑啉酮柱前衍生化,利用高效液相色谱-串联质谱对水解产物中的二糖衍生物片段进行分析。结果表明,采用先酶后碱法提取获得鱼骨粗多糖中性糖含量最高为6.79 mg/g干质量,鱼骨硫酸多糖含量最高为3.81 mg/g干质量。通过与标准品的保留时间和质谱数据对比,确定大菱鲆鱼骨中含糖醛酸多糖(uronic acid-containing polysaccharides,UACPs)主要为硫酸软骨素(chondroitin sulfate,CS);鱼皮中主要为透明质酸(hyaluronic acid,HA)和CS;鱼肉UACPs主要有HA、CS、肝素、GlcA(1→2)-Man聚糖以及一种由糖醛酸与己糖连接的重复片段构成的未知多糖UACP1。
关键词:大菱鲆;含糖醛酸多糖;高效液相色谱-串联质谱
GUO Li, LIU Bin, WEN Chengrong, et al. Qualitative analysis of polysaccharides from different tissues of turbot (Scophthalmus maximus) by HPLC-MS/MS[J]. Food Science, 2017, 38(8): 171-178. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201708027. http://www.spkx.net.cn
大菱鲆(Scophthalmus maximus L.),又名多宝鱼,是较名贵的低温经济鱼类,养殖范围遍布世界各地,在我国主要分布在山东省、辽宁省、河北省和天津等沿海地区。大菱鲆肉质鲜嫩、味道鲜美、营养丰富,是生产鱼片的上好原料,在美国、欧洲、东南亚等地区市场前景广阔。我国作为大菱鲆养殖规模最大的国家之一,大菱鲆速冻鱼片、生鱼片、熏制品和腌制品等加工制品消费市场不断扩展,而与此同时产生了大量的鱼皮、鱼骨等副产物和废弃物,这些生产废料如不及时处理会产生环境污染的一系列相关问题,因此开发高附加值的大菱鲆副产物成为亟待解决的问题。
目前对大菱鲆的研究多集中在育种[1-2]、饲料[3-4]、疾病[5-6]、养殖技术[7-8]、保鲜加工[9-12]和营养成分及挥发性成分分析[13-14]方面,但对大菱鲆功能性成分的研究鲜有报道。
多糖作为信息分子参与生物体多种生命现象和生理过程,具有多种生物活性功能[15-17]。糖胺聚糖(glycosaminoglycans,GAGs)是广泛存在于鱼类等动物组织中的杂多糖,通常是由氨基己糖和糖醛酸组成的重复单元构成。因GAGs中透明质酸(hyaluronic acid,HA)、硫酸软骨素(chondroitin sulfate,CS)、硫酸皮肤素(dermatan sulfate,DS)、肝素(heparin,HP)和硫酸乙酰肝素(heparan sulfate,HS)的重复二糖片段中都包含一个糖醛酸,可将其归类为糖醛酸多糖(uronic acid-containing polysaccharides,UACPs),除GAGs外,在水产动物中还发现了一些由己糖与糖醛酸组成的重复二糖片段构成的含UACPs[18]。UACPs由于糖链能与蛋白相互作用而发挥出众多功效,具有抗氧化、抗菌、抗凝血、抗动脉粥样硬化、抗糖尿病、降血脂、治疗关节炎等多种功能[19-23]。
UACPs的提取需要使与其相互结合的蛋白质发生降解,通常可以采用酶法降解和化学方法释放[24-25]方式将糖链从动物组织中释放出来。为获得大菱鲆高附加值产品、获得产物降解少而产量高的大菱鲆组织多糖,本实验以大菱鲆鱼骨、鱼皮和鱼肉为原料,使用稀碱浸提和酶法相结合的工艺提取多糖,采用高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法分析大菱鲆不同组织多糖组成,为大菱鲆多糖的活性研究和深加工利用提供理论依据。
1.1 材料与试剂
大菱鲆原料,购于辽宁省大连市长兴农副产品批发市场;GlcA(1→2)-Man聚糖(abalone gonad sulfated polysaccharide,AGSP)由本实验前期提取制备自鲍鱼性腺[18];CS(标准品) 美国Sigma公司;透明质酸钠(标准品)、肝素钠(标准品)、木瓜蛋白酶(生化试剂)、胰蛋白酶(生化试剂) 生工生物工程股份有限公司;甲醇、乙腈(均为色谱纯) 美国Specturm Chemical MFG公司;乙酸铵(色谱纯) 美国Aladdin公司;其他试剂均为国产分析纯。
1.2 仪器与设备
LC-20A HPLC仪 日本Shimadzu公司;4000QTRAP三重四极杆串联线性离子阱质谱仪 美国AB SCIEX公司;SCANVAC SS40 55-4冻干浓缩一体机丹麦Labogene公司;PH-070A电热鼓风干燥箱 上海一恒科学仪器有限公司;CF16RXⅡ高速冷冻离心机日本日立公司。
1.3 方法
1.3.1 不同组织原料前处理
活大菱鲆鱼运至实验室后,敲头致死,按王垚等[12]的分割方式,获取带皮鱼片和鱼骨,将鱼片置于包有碎冰的保鲜袋上,用手术刀将带皮鱼片肉皮分离,大菱鲆鱼骨、鱼肉和鱼皮3 个组织切碎后经捣碎机捣碎待用。
1.3.2 不同组织水分含量的测定
采用直接干燥法[26]对鱼骨、鱼皮和鱼肉3 个组织中水分含量进行测定。
1.3.3 先酶法提取后碱浸提
酶法提取:利用双酶酶解条件进行提取[27],每种样品捣碎后称取鲜样5 g于100 mL三角瓶中,向其中加入2.5 mL、0.05 mol/L半胱氨酸-乙二胺四乙酸二钠溶液及22.5 mL的pH 8、0.05 mol/L磷酸盐缓冲溶液,再向每个样品中加入质量分数0.5%胰蛋白酶,37 ℃水浴振荡酶解4 h之后加入质量分数0.5%木瓜蛋白酶,65 ℃水浴振荡酶解3 h。之后在100 ℃条件下灭酶5 min,以10 000 r/min离心20 min取上清液(沉淀进行碱浸提处理)。在每个试样的上清液中加入1.5 倍体积的无水乙醇在4 ℃醇沉12 h,8 000 r/min离心取沉淀。挥干乙醇,用2 mL去离子水复溶,低温冷冻干燥得粗多糖。
碱浸提:上述获得的沉淀加入质量分数4% NaOH溶液20 mL在40 ℃水浴振荡酶解6 h,10 000 r/min离心20 min取上清液,加入1.5 倍体积的无水乙醇在4 ℃醇沉12 h,8 000 r/min离心取沉淀。挥干乙醇,用2 mL去离子水复溶,低温冷冻干燥得粗多糖。
1.3.4 先碱浸提后酶法提取
碱浸提:取每种样品捣碎后称取5 g于100 mL三角瓶中,加入质量分数4% NaOH溶液20 mL在40 ℃水浴振荡酶解6 h,10 000 r/min离心20 min取上清液(沉淀再进行酶法提取),加入1.5 倍体积的无水乙醇在4 ℃醇沉12 h,8 000 r/min离心取沉淀。挥干乙醇,用2 mL去离子水复溶,低温冷冻干燥得粗多糖。
酶法提取:上述沉淀调节pH值至中性,然后进行酶法提取,方法同1.3.3节,低温冷冻干燥得粗多糖。
1.3.5 中性糖和硫酸多糖含量的测定
1.3.5.1 中性糖含量的测定
标准曲线制作:准确称量标准葡聚糖20 mg于500 mL容量瓶中,加水至刻度,分别吸取0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mL于试管中,补水至2.0 mL。然后加入质量分数6.0%苯酚溶液1.0 mL,浓硫酸5.0 mL,摇匀,室温放置20 min后,于波长490 nm处测光密度OD490nm。以2.0 mL水以同样显色操作为空白,以横坐标为葡萄糖含量、纵坐标为光密度,绘制标准曲线。
样品含量测定:称取待测稀释样品2.0 mL,于波长490 nm处测光密度OD490nm,以标准曲线计算待测样中多糖含量。方程为y=0.007x+0.018(R2=0.990),其中y为待测样中的中性糖含量/(μg/mL);x为待测样的光密度。结果以干质量计。
1.3.5.2 硫酸多糖含量的测定
采用1,9-二甲基亚甲蓝(1,9-dimethylmethylene blue,DMB)比色法进行测定。
标准曲线制作:准确称量CS标准品10 mg于100 mL的容量瓶中,加水至刻度,0、30、60、90、120、150、180、210、240 μL CS溶液于试管中,每个梯度做3 组平行实验,用蒸馏水补至240 μL。再加入4 mL DMB显色液,混匀,室温避光放置15 min后,于波长525 nm处测光密度(OD525nm)。以240 μL去离子水以同样显色操作为空白,以横坐标为CS含量、纵坐标为光密度,绘制标准曲线。
样品含量测定:称取待测样品各10 mg于试管中,再向试管中加入1 mL去离子水配成母液,再将母液稀释,吸取待测样240 μL,于波长525 nm处测光密度,以标准曲线计算待测样中硫酸多糖含量。方程为y=0.011x-0.022(R2=0.98)。其中,y为待测样中硫酸多糖的含量/(μg/mL);x为待测样的光密度。结果以干质量计。
1.3.6 多糖的HPLC-MS/MS分析
1.3.6.1 酸水解
采用前期优化的条件[27],取HA、AGSP、CS、HP标准品和各多糖样品5 mg放入水解管中,再加入1 mL 1.3 mol/L三氟乙酸(trifluoroacetic acid,TFA)溶液在105 ℃的培养箱中,水解3 h后,向酸水解液中加入1 mL水,氮吹除去TFA,重复3 次,除净TFA。
1.3.6.2 1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生化
向酸水解后的干燥标准品和样品中加入400 μL氨水于水解管中,再向水解管中加入400 μL 0.3 moL/L PMP-甲醇溶液,混匀后在70 ℃条件下水浴30 min;加入1 mL甲醇,使用冻干浓缩一体机减压除去溶剂(再分别2 次各加入1 mL甲醇,减压挥干);然后加入1 mL去离子水,再加入1 mL氯仿,振荡后除去氯仿,重复萃取3 次,水层作为供试液。水层经0.22 μm微孔滤膜过滤后,进行HPLC-MS/MS分析。
1.3.6.3 HPLC-MS/MS分析
色谱条件:Phenomenex Synergi Fusion-RP色谱柱(2.0 mm×50 mm,4 μm,80 Å);柱温30 ℃;流动相20 mmol/L乙酸铵-乙腈(82∶18,V/V)溶液;流速0.5 mL/min。质谱条件:电喷雾离子源;喷雾电压5.5 kV;正离子模式;辅助加热气温度600 ℃;选择多重反应监测;信息依赖采集-增强离子扫描方式获得二级质谱图。
1.4 数据处理
采用SPSS 19.0统计软件进行组间的差异显著性分析,检验水平P值小于0.05时为差异显著,具有统计学意义。
2.1 大菱鲆不同部位中性糖和硫酸多糖含量测定2.1.1 不同提取方式对大菱鲆中性糖含量的影响

图1 不同处理方式提取的大菱鲆中性糖含量
Fig. 1 Effects of different extraction methods on neutral polysaccharide contents extracted from turbot
由图1可知,采用先酶后碱法处理获得的鱼骨、鱼皮和鱼肉中的中性糖含量分别为(6.79±0.61) 、(1.43±0.12)mg/g和(1.21±0.09)mg/g,研究人员发现裸盖鱼肉、大菱鲆鱼肉、牙鲆鱼肉中总糖含量分别为42.2、170、39.6 mg/g干质量[28],这些数据是通过鱼肉干质量除去粗脂肪、粗蛋白和灰分间接得到的,因此与本研究数据存在较大的差异。先酶后碱法处理明显高于先碱后酶法处理得到的中性糖含量(P<0.05),利用木瓜蛋白酶和胰蛋白酶2 种酶依次作用大菱鲆鱼蛋白质中的肽键,使胶原蛋白及黏蛋白降解成小肽或者氨基酸,从而使多糖从鱼不同组织中释放出来,利用多糖的溶解特性将其与氨基酸等其他物质分离[29]。之后在稀碱条件下进行提取,由于发生了β-消去反应,-O-糖肽链开裂,使多糖进一步从蛋白聚糖中释出来[30],但是碱提时间过长,会使各组织中的一些其他物质溶解度增大,使提取物中杂质含量相应增加,从而造成糖含量相对降低[29]。
采用先碱后酶法处理获得的鱼骨、鱼皮和鱼肉中的中性糖含量分别为(6.21±0.57)、(0.63±0.05)mg/g和(0.64±0.05)mg/g,先利用稀碱提取多糖,此条件下鱼组织中胶原蛋白及黏蛋白不易水解,因而影响了多糖提取效果。
2.1.2 不同提取方式对大菱鲆硫酸多糖含量的影响

图2 不同处理方式下大菱鲆硫酸多糖含量
Fig. 2 Effects of different extraction methods on sulfated polysaccharide contents extracted from turbot
由图2可知,先酶后碱提取方式获得的鱼骨、鱼皮和鱼肉硫酸多糖总量分别为(3.81±0.30)、(0.43±0.03)、(0.27±0.01) mg/g,明显高于先碱后酶提取方式获得的硫酸多糖含量(鱼骨(2.37±0.22)mg/g,鱼皮(0.30±0.03)mg/g,鱼肉(0.13±0.01)mg/g)(P<0.05)。在大菱鲆鱼骨中硫酸多糖含量最高,其次为鱼皮,含量最少的部位是鱼肉。有研究发现,在日本鲭鱼、大西洋鲭鱼、鳝鱼头骨中糖胺聚糖含量分别为1.87、2.89、4.30 mg/g干质量,鳝鱼鱼皮中糖胺聚糖含量为0.18 mg/g干质量[31],这与本实验中大菱鲆鱼骨和鱼皮中硫酸多糖含量相近。不同鱼组织中的硫酸多糖含量、硫酸根离子分布可影响多糖的生物活性,硫酸根离子作为聚阴离子,具有和带正电荷离子和大分子相互作用的能力,因此使多糖具有降血脂、免疫调节、抗氧化等多种生物活性。
2.2 HPLC-MS/MS分析大菱鲆UACPs组成
2.2.1 UACPs对照品分析
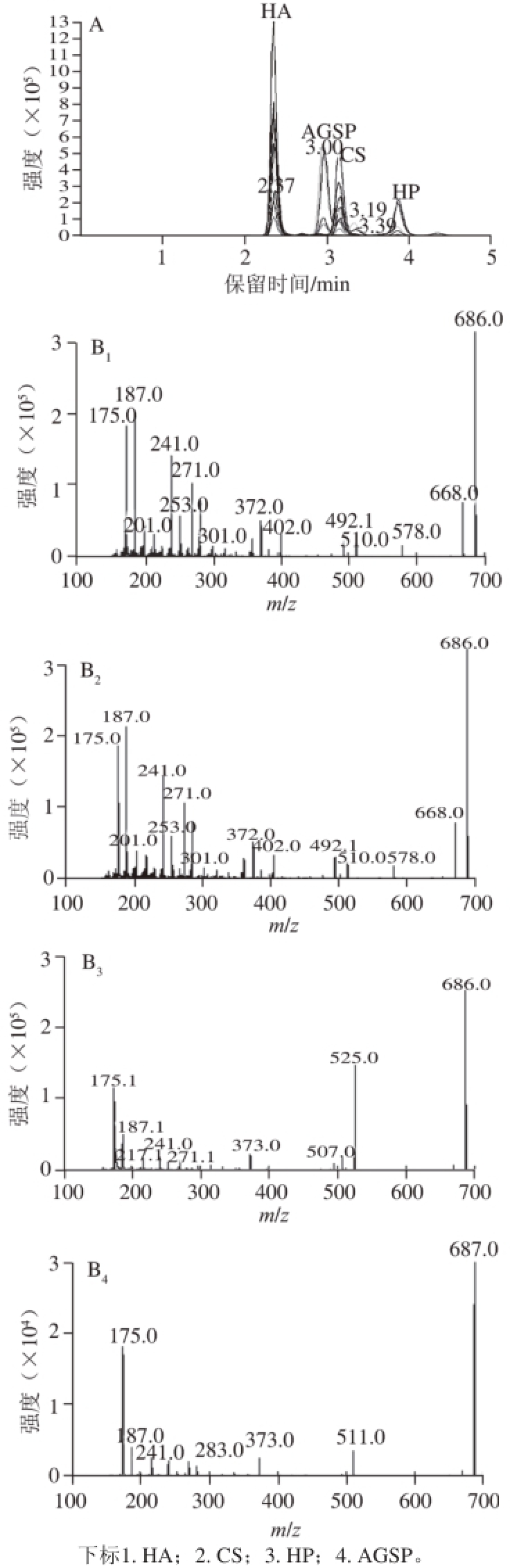
图3 4 种UACPs产生的二糖PMP衍生物的色谱图(A)及二级质谱图(B)
Fig. 3 MRM Chromatograms (A) and MS/MS spectra (B) of PMP labeled disaccharides from four UACPs
以4 种UACPs为对照品,其中包括HA、CS和HP 3 种GAGs,一种非糖胺聚糖AGSP[32],经TFA水解、PMP柱前衍生化,HPLC-MS/MS分析获得的二糖衍生物片段,由图3A可知,HA、AGSP、CS和HP的保留时间分别为2.37、3.00、3.19 min和3.85 min。4 种UACPs可获得特征性二糖片段,3 种GAGs的二糖衍生物分子离子峰为m/z 686.3,二糖片段分别为:HA为GlcA-(1→3)-GlcN,CS为GlcA-(1→3)-GalN,HP为IdoA-(1→4)-GlcN;AGSP的二糖衍生物分子离子峰为m/z 687.3,二糖片段为GlcA-(1→2)-Man[27]。由图3B可知,HA和CS的二糖PMP衍生化二级质谱特征离子为m/z 668、m/z 578和m/z 510。HP的二糖PMP衍生物的二级质谱特征离子是m/z 525。AGSP的二糖PMP衍生物的二级质谱特征离子是m/z 511。
2.2.2 大菱鲆不同部位UACPs成分分析


图4 先碱后酶处理大菱鲆不同部位UACPs色谱图
Fig. 4 MRM Chromatograms of UACPs extracted by alkali pretreatment and enzymatic hydrolysis from different tissues of turbot
采用2 种提取方法获得的大菱鲆不同部位多糖,经过酸水解、PMP柱前衍生化后,使用HPLC-MS/MS对含有糖醛酸的二糖片段PMP衍生物进行分析。由图4可知,先碱法、后酶法提取的鱼皮得到的二糖片段组成相同,主要为HA和CS的二糖衍生物;先碱法、后酶法提取的鱼骨得到的二糖片段主要为CS的二糖衍生物,后酶法处理在保留时间4.67 min处还存在一个质谱信号与AGSP二糖衍生物相似的未知物(UACP1);先碱法提取得到的鱼肉UACPs种类较多,存在HA、AGSP、CS和HP的二糖衍生物,同时在保留时间3.51 min处还存在一个未知二糖片段,后续的实验研究确定其为硫酸皮肤素,后采取酶法提取得到的鱼肉二糖片段主要为UACP1,其在保留时间4.62 min处为单一峰。
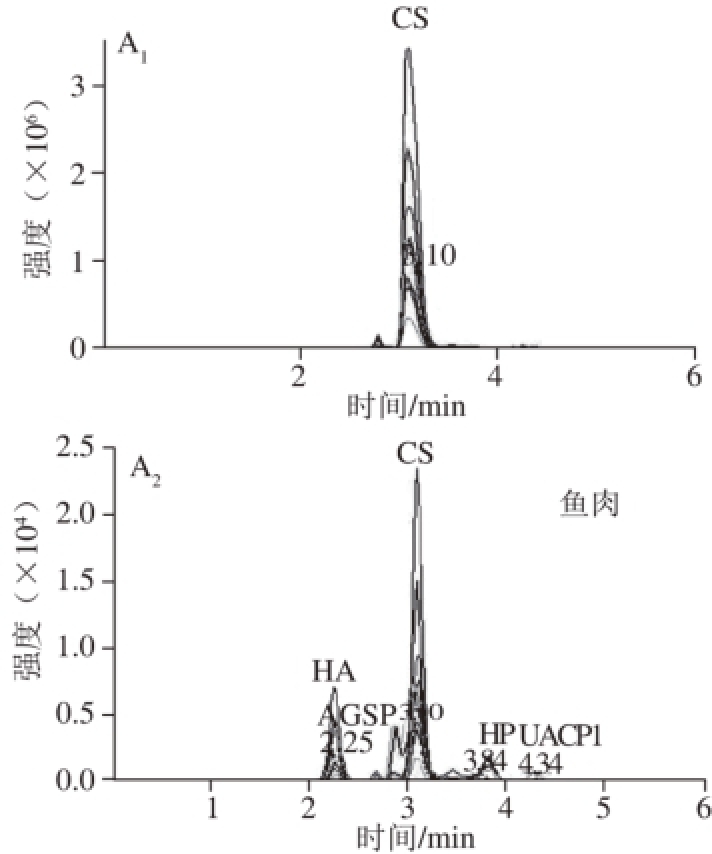
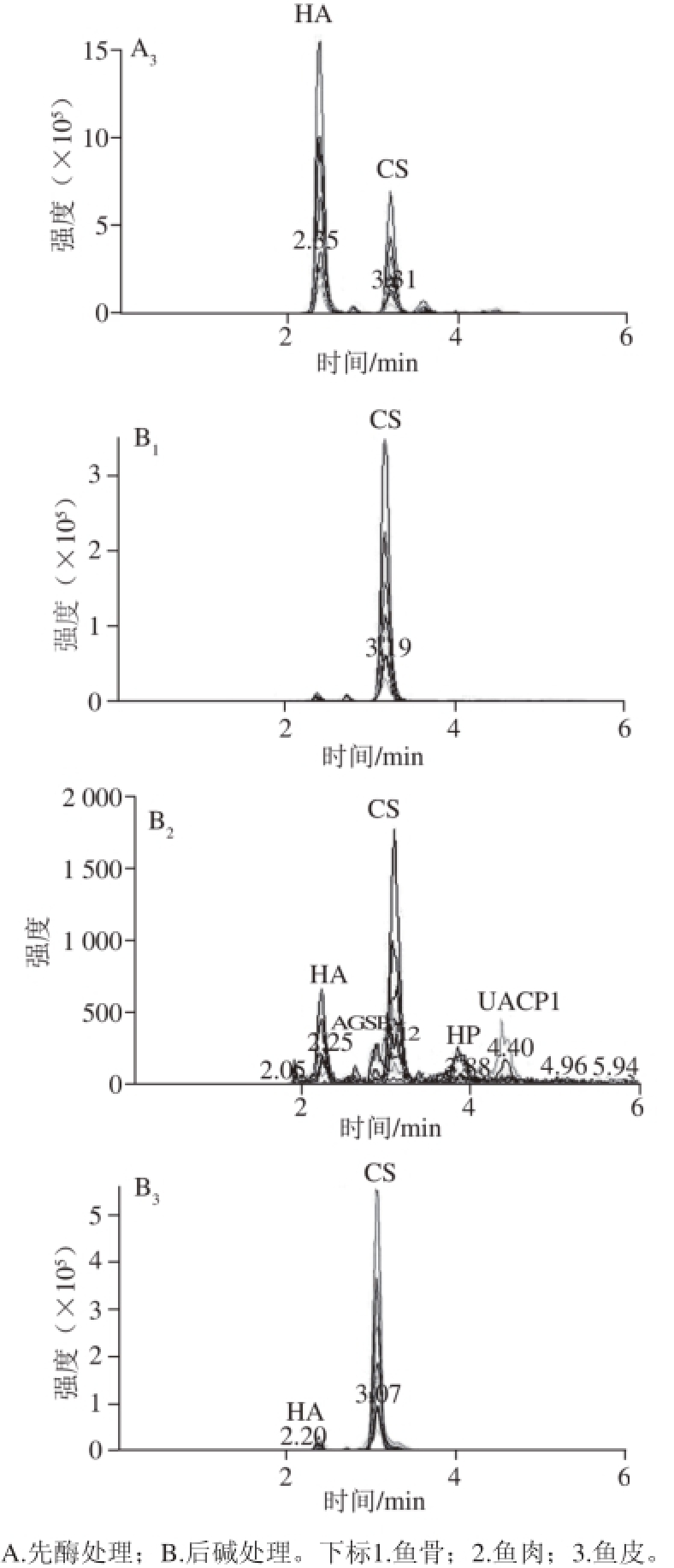
图5 先酶后碱处理获得大菱鲆不同部位UACPs色谱图
Fig. 5 MRM Chromatograms of UACPs extracted by enzymatic pretreatment and alkali extraction from different tissues of turbot
由图5可见,先酶法、后碱法提取的鱼骨、鱼肉和鱼皮的二糖片段组成相同,鱼骨中主要为CS的二糖衍生物,鱼肉中成分较为复杂,含有HA、AGSP、CS、HP和UACP1的二糖衍生物。鱼皮中主要为HA和CS的二糖衍生物。
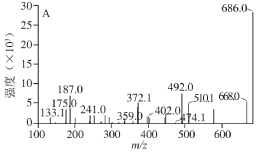
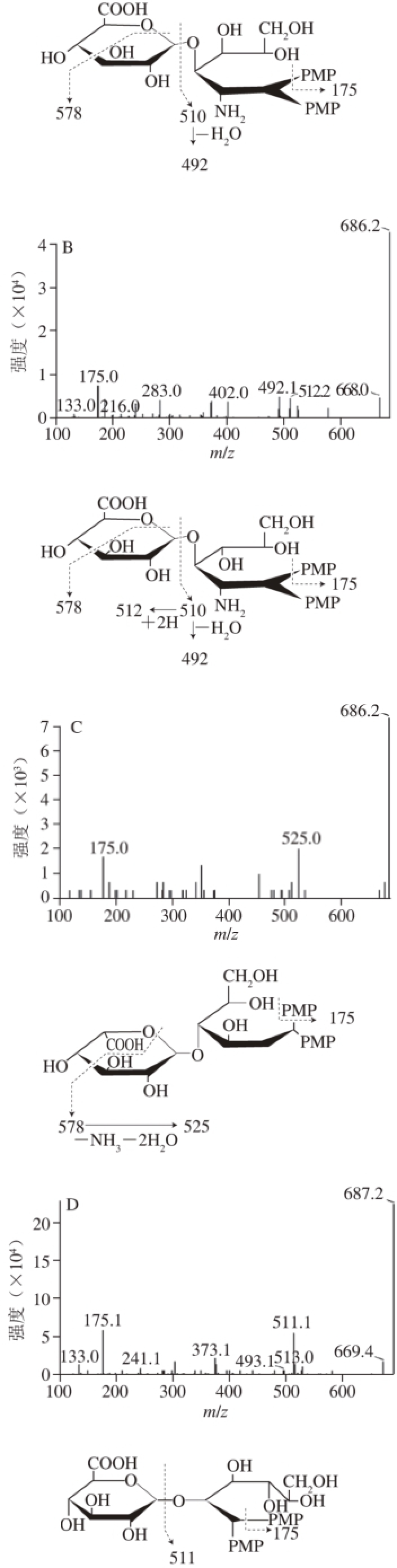

图6 大菱鲆组织中UACPs的二糖PMP衍生物质谱图
Fig. 6 Mass spectra of PMP labeled disaccharides from UACPs in turbot tissues
如图6所示,HA、CS和HP二糖PMP衍生物准分子离子均为m/z 686[M+H]+,其差别主要体现在碎片离子上。HA特征碎片峰表现为离子丰度m/z 510[M-GlcA+H2O]+,该碎片离子是由糖苷键断裂产生,CS特征碎片峰表现为离子丰度m/z 512[M-GlcA+H2O+2H]+,该碎片离子是由m/z 510离子结构中未成环或未脱质子形成双键,多了2 个氢质子而得到。在HA和CS二糖PMP衍生物中还包含有m/z 578和m/z 492碎片离子,m/z 578是由糖醛酸环裂解而得到,m/z 492是由m/z 510碎片离子脱去一分子水得到。HP特征碎片峰表现为离子丰度m/z 525,该碎片离子可能是由糖醛酸环裂解产生的碎片m/z 578脱去一分子NH3和两分子水后形成。
AGSP和UACP1的二糖PMP衍生物准分子离子均为m/z 687[M+H]+,二者特征碎片峰表现为离子丰度m/z 511,AGSP特征碎片离子m/z 511[M-IdoA+H2O+H]+已得到确定[18],由此也可推断未知多糖UACP1结构中重复二糖片段为糖醛酸与己糖连接而成,Cao等[27]在紫石房蛤、青蛤和扁玉螺中也发现了该未知的含有糖醛酸二糖片段UACP1,可见非糖胺聚糖除存在于海洋贝类中,还存在于海洋鱼类中。
所有UACPs二糖PMP衍生物质谱图中均含有m/z 175[PMP+H]+的特征离子。
先酶后碱方法提取大菱鲆中性糖和硫酸多糖含量较高,鱼骨、鱼皮和鱼肉中性糖含量分别为(6.79±0.61)、(1.43±0.12)mg/g和(1.21±0.09)mg/g;硫酸多糖含量分别为(3.81±0.30)、(0.43±0.03)mg/g和(0.27±0.01)mg/g。
大菱鲆鱼肉UACPs主要有HA、CS、HP、AGSP以及一种由糖醛酸与己糖连接的重复片段构成的未知多糖UACP1,大菱鲆鱼骨中UACPs主要为CS,而大菱鲆鱼皮中主要为HA和CS。
参考文献:
[1] MENG Z, LIU X, LIU B, et al. Induction of mitotic gynogenesis in turbot Scophthalmus maximus[J]. Aquaculture, 2016, 451(1/2/3): 429-435. DOI:10.1016/j.aquaculture.2015.09.010.
[2] HAFFRAY P, LEBEGUE E, JEU S, et al. Genetic determination and temperature effects on turbot Scophthahnus maximus sex differentiation: an investigation using steroid sex-inverted males and females[J]. Aquaculture, 2009, 294(1/2): 30-36. DOI:10.1016/ j.aquaculture.2009.05.004.
[3] WANG Q, HE G, MAI K, et al. Fishmeal replacement by mixed plant proteins and maggot meal on growth performance, target of rapamycin signaling and metabolism in juvenile turbot (Scophthalmus maximus L.)[J]. Aquaculture Nutrition, 2016, 22(4): 752-758. DOI:10.1111/ anu.12296.
[4] FUCHS V I, SCHMIDT J, SLATER M J, et al. The effect of supplementation with polysaccharides, nucleotides, acidifiers and Bacillus strains in fish meal and soy bean based diets on growth performance in juvenile turbot (Scophthalmus maximus)[J]. Aquaculture, 2015, 437(2): 243-251. DOI:10.1016/j.aquaculture.2014.12.007.
[5] TORANZO A E, MAGARINOS B, ROMALDE J L. A review of the main bacterial fish diseases in mariculture systems[J]. Aquaculture, 2005, 246(1): 37-61. DOI:10.1016/j.aquaculture.2005.01.002.
[6] CERDA-CUELLAR M, BLANCH A. Detection and identifi cation of Vibrio scophthalmi in the intestinal microbiota of fi sh and evaluation of host specifi city[J]. Journal of Applied Microbiology, 2002, 93(2): 261-268. DOI:10.1046/j.1365-2672.2002.01697.x.
[7] HOSFELD C D, HANDELAND S O, FIVELSTAD S. Physiological effects of normbaric environmental hyperoxia on Atlantic salmon (Salmo salar L.) presmolts[J]. Aquaculture, 2010, 308(1/2): 28-33. DOI:10.1016/j.aquaculture.2010.08.003.
[8] MUNILLA M R, STARK J R, BARBOUR A. The role of exogenous enzymes in digestion in cultured turbot larvae (Scophthalmus maximus L.)[J]. Aquaculture,1990, 88(3/4): 337-350.
[9] 牛宝卫. 大菱鲆冰温气调保鲜技术研究[D]. 青岛: 中国海洋大学, 2009.
[10] 曾慧. 海藻多酚QSI对大菱鲆腐败变质调控的初步研究[D]. 青岛:中国海洋大学, 2012.
[11] 李婷婷, 刘剑侠, 李学鹏, 等. 大菱鲆冷藏过程中新鲜度评价[J].食品科学, 2014, 35(18): 190-195. DOI:10.7506/spkx1002-6630-201418037.
[12] 王垚, 傅新鑫, 潘锦锋, 等. 大菱鲆背腹部肌肉基本组成、质构及加工特性[J]. 食品科学, 2015, 36(23): 64-70. DOI:10.7506/spkx1002-6630-201523013.
[13] 徐永霞, 刘滢, 姜程程, 等. 电子鼻结合气质联用法分析大菱鲆冷藏过程中挥发性成分变化[J]. 食品与发酵工业, 2014, 40(1): 193-197. DOI:10.13995/j.cnki.11-1802/ts.2014.01.005.
[14] 王甜甜, 李振兴, 林洪, 等. 腌制工艺对大菱鲆质构及理化性质的影响[J]. 中国工程科学, 2014, 16(9): 64-68.DOI:10.3969/ j.issn.1009-1742.2014.09.010.
[15] SONIA S F, CLAUDIA P P, PEDRO M, et al. Structure-function relationships of immunostimulatory polysaccharides: a review[J]. Carbohydrate Polymers, 2015, 132(21): 378-396. DOI:10.1016/ j.carbpol.2015.05.079.
[16] FATMA K, WAFA K, ASSAAD S, et al. Extraction, characterization and antimicrobial activity of sulfated polysaccharides from fish skins[J]. International Journal of Biological Macromolecules, 2015, 75: 283-289. DOI:10.1016/j.ijbiomac.2015.01.044.
[17] ZHU B W, LI D M, ZHOU D Y, et al. Structural analysis and CCK-releasing activity of a sulphated polysaccharide from abalone (Haliotis discus hannai Ino) viscera[J]. Food Chemistry, 2011, 125(4): 1273-1278. DOI:10.1016/j.foodchem.2010.10.065.
[18] WANG H X, ZHAO J, LI D M, et al. Structural investigation of an uronic acid-containing polysaccharide from abalone by graded acid hydrolysis followed by PMP-HPLC-MSnand NMR analysis[J]. Carbohydrate Research, 2015, 402: 95-101. DOI:10.1016/ j.carres.2014.10.010.
[19] ASSAAD S, NADHEM S, RAFIK B, et al. Biochemical and antioxidant properties of peptidic fraction of carotenoproteins generated from shrimp by-products by enzymatic hydrolysis[J]. Food Chemistry, 2014, 148(7): 445-452. DOI:10.1016/j.foodchem.2013.05.146.
[20] WU M, WEN D, GAO N, et al. Anticoagulant and antithrombotic evaluation of native fucosylated chondroitin sulfates and their derivatives as selective inhibitors of intrinsic factor Xase[J]. European Journal of Medicinal Chemistry, 2015, 92(5): 257-269. DOI:10.1016/ j.ejmech.2014.12.054.
[21] ABDELMALEK B E, SILA A, KRICHEN F, et al. Sulfated polysaccharides from Loligo vulgaris skin: potential biological activities and partial purification[J]. International Journal of Biological Macromolecules, 2015, 72(1): 1143-1151. DOI:10.1016/ j.ijbiomac.2014.09.041.
[22] LEVETT P A, MELCHELS F P W, SCHROBBACK K, et al. A biomimetic extracelluar matrix for cartilage tissue engineering centered on photocurable gelatin, hyaluronic acid and chondroitin sulfate[J]. Acta Biomaterialta, 2014, 10(1): 214-223. DOI:10.1016/ j.actbio.2013.10.005.
[23] BOTTEGONI C, MUZZARELLI R A A, GIOVANNI F, et al. Oral chondroprotection with nutraceuticals made of chondroitin sulphate plus glucosamine sulphate in osteoarthritis[J]. Carbohydrate Polymers, 2014, 109(16): 126-138. DOI:10.1016/j.carbpol.2014.03.033.
[24] 张晓, 凡飞, 赵小亮, 等. 猪肺组织糖胺聚糖的分离纯化及其结构鉴定[J]. 药物分析杂志, 2016, 36(4): 587-593.
[25] 邢晓旭, 赵峡, 李大敬, 等. 扁玉螺多糖的提取、分离和结构分析[J].中国海洋药物, 2013, 32(4): 15-22.
[26] 卫生部. 食品中水分的测定: GB 5009.3—2010[S]. 北京: 中国标准出版社, 2010.
[27] CAO J L, WEN C R, LU J J, et al. Characterization of acidic polysaccharides from the mollusks through acid hydrolysis[J]. Carbohydrate Polymers, 2015, 130(19): 268-274. DOI:10.1016/ j.carbpol.2015.05.006.
[28] 刘长琳, 陈四清, 王有廷, 等. 裸盖鱼(Anoplopoma fimbria)肌肉的营养成分分析及评价[J]. 渔业科学进展, 2015, 36(2): 133-138. DOI:10.11758/yykxjz.20150218.
[29] 黄琪琳, 陈若雯, 丁玉琴, 等. 鲟鱼头骨多糖的提取及性质研究[J]. 食品科学, 2009, 30(12): 135-139. DOI:10.3321/j.issn:1002-6630.2009.12.026.
[30] 于广利, 赵峡. 糖药物学[M]. 青岛: 中国海洋大学出版社, 2012: 45-46.
[31] ARIMA K, FUJITA H, TOITA R, et al. Amounts and compositional analysis of glycosaminoglycans in the tissue of fish[J]. Carbohydrate Research, 2013, 366: 25-32. DOI:10.1016/j.carres.2012.11.010.
[32] 刘海曼, 艾春青, 刘斌, 等. 四种鱼类内脏中含糖醛酸多糖的结构分析[J]. 现代食品科技, 2017, 33(1): 33-38. DOI:10.13982/ j.mfst.1673-9078.2017.1.006.
Qualitative Analysis of Polysaccharides from Different Tissues of Turbot (Scophthalmus maximus) by HPLC-MS/MS
GUO Li1,2,3,4, LIU Bin1,3,4, WEN Chengrong1,3,4, SONG Shuang1,3,4,*, ZHU Beiwei1,3,4
(1. School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China; 2. College of Food and Pharmaceutical Engineering, Suihua University, Suihua 152061, China; 3. National Engineering Research Center of Seafood, Dalian 116034, China; 4. National and Local Joint Engineering Laboratory for Marine Bioactive Polysaccharide Development and Application, Dalian 116034, China)
Abstract:Polysaccharides from bone, muscle, and skin of turbot (Scophthalmus maximus) were extracted by sequential hydrolysis with trypsin and papain followed by alkali extraction or the reverse sequence for functional food application. The disaccharide fragments from turbot polysaccharides were analyzed using high performance liquid chromatographytandem mass spectrometry (HPLC-MS/MS) after trifi uoroacetic acid (TFA) hydrolysis and 1-phenyl-3-methyl-5-pyrazolone (PMP) derivatization. The crude polysaccharides from fi sh bone produced by enzymatic pretreatment and alkali extraction contained the highest amounts of neutral polysaccharides (6.79 mg/g dried weight) and sulfated polysaccharides (3.81 mg/g dried weight). The uronic acid polysaccharides (UACPs) from fi sh bone were identifi ed mainly as chondroitin sulfate (CS) by comparing their retention time and mass spectral data with those of standards, the UACPs from fi sh mainly included hyaluronic acid and chondroitin sulfate, and the UACPs from fish muscle mainly consisted of hyaluronic acid, heparin, chondroitin sulfate, a polysaccharide comprised of GlcA(1→2)-Man repeated units (AGSP), and an unknown polysaccharide UACP1 with repeats of uronic acid linked to hexose.
Key words:turbot; uronic acid-containing polysaccharide; HPLC-MS/MS
引文格式:
引文格式:
郭丽, 刘斌, 温成荣, 等. HPLC-MS/MS定性分析大菱鲆不同组织中多糖成分[J]. 食品科学, 2017, 38(8): 171-178.
DOI:10.7506/spkx1002-6630-201708027. http://www.spkx.net.cn
DOI:10.7506/spkx1002-6630-201708027
中图分类号:TS254.9
文献标志码:A
文章编号:1002-6630(2017)08-0171-08
收稿日期:2016-08-01
基金项目:中国博士后科学基金面上资助项目(2016M591418);国家自然科学基金青年科学基金项目(31301431;31501439);“十二五”国家科技支撑计划项目(2014BAD04B09);国家高技术研究发展计划(863计划)项目(2014AA093602)
作者简介:郭丽(1979—),女,副教授,博士,研究方向为食品资源开发与利用。E-mail:guoli2138@163.com
*通信作者:宋爽(1981—),女,副教授,博士,研究方向为海洋活性多糖。E-mail:songs1008@163.com