
图1 萃取剂种类对5 种核苷类化合物萃取量的影响
Fig. 1 Effect of different types of extraction solvents on the extraction effi ciencies of fi ve nucleosides
张 伟,张 勇,尹震花,康文艺*
(黄河科技学院 郑州市药用资源研究重点实验室,河南 郑州 450063)
摘 要:建立离子液体[C4MIM]PF6萃取剂,结合超声辅助萃取,利用高效液相色谱法同时测定人工蛹虫草中尿苷、肌苷、鸟苷、腺苷及虫草素含量。采用Inert Sustain C18色谱柱(4.6 mm×150 mm,5 μm),流动相为甲醇、0.02 mol/L KH2PO4溶液梯度洗脱,洗脱流速为0.6 mL/min,柱温30 ℃,检测波长254 nm。5 种成分的最佳萃取条件为0.7 mol/L [C4MIM]PF6-20%甲醇溶液、过50 目筛、固液比1∶50(g/L)、超声时间50 min、离心转速3 000 r/min。线性范围分别为0.568~3.408、0.284~1.704、0.264~1.584、0.232~1.392、1.672~10.032 mg/mL,相关系数均在0.999 8以上,加样回收率为97.6%~101.5%,相对标准偏差为1.43%~1.97%。所建方法快速简便、准确可靠、重复性良好,可用于人工蛹虫草中核苷类成分的同时快速分析。
关键词:人工蛹虫草;离子液体;高效液相色谱法;核苷类
蛹虫草(Cordyceps militaris)又名北冬虫夏草或北虫草,属麦角菌科虫草属真菌[1],是虫草菌寄生在鳞翅目、鞘翅目、双翅目等昆虫蛹体及幼虫形成的虫菌复合体[2]。
蛹虫草为我国传统名贵药食同源中药材之一[3],为新资源食品[4],用于饮料[5-6]、酱油[7]、花生乳[8]等功能食品研究和开发。核苷类被报道具有抗炎、抗菌、抗肿瘤[9-10]、抑制血小板聚集[11]、保护心肌损伤[12]等作用。蛹虫草主要活性成分是核苷类,此外还含有虫草多糖、蛋白质、有机酸、维生素及微量元素等多种化学成分[13-14]。
文献报道学者多以水[15-16]、不同比例甲醇或乙醇-水溶液[17-18]等作为萃取剂结合超声[15-16,18-19]、索氏回流[17]等方法同时采用高效液相色谱[15,19]、高效液相色谱-电喷雾质谱[17]、毛细管区带电泳法[16]、高效薄层色谱扫描[18]等检测方式测定蛹虫草中核苷类及碱基类成分,但鲜见离子液体作为萃取剂同时测定人工蛹虫草中核苷类活性成分的相关研究。离子液体作为新型“绿色溶剂”,因对环境友好、富集效率高[20-22],在活性成分研究领域受到广泛关注[23-24]。本课题组前期应用离子液体对多种中药活性成分进行研究[25-28],本实验采用超声辅助-离子液体对人工蛹虫草进行微萃取,同时测定人工蛹虫草中尿苷、肌苷、鸟苷、腺苷及虫草素含量,与传统有机溶剂对比分析,并对萃取条件进行优化,该方法快速简便、重复性好,可用于人工蛹虫草中核苷类成分的快速分析检测,为人工蛹虫草建立快速有效的质量控制方法提供科学依据。
1.1 材料与试剂
人工蛹虫草由河南省濮阳市天元虫草研究有限公司提供,河南大学中药研究所李昌勤教授鉴定为麦角菌科虫草属蛹虫草(Cordyceps militaris)。
1-己基-3-甲基咪唑六氟磷酸盐[C6MIM]PF6日本TCI公司;1-丁基-3-甲基咪唑四氟硼酸盐[BMIM]BF4、1-丁基-3-甲基咪唑六氟磷酸盐[C4MIM]PF6、1-丁基-3-甲基咪唑溴盐[BMIBr] 德国Merck公司;甲醇(色谱纯)美国Avantor公司;磷酸二氢钾(分析纯) 天津基准化学试剂有限公司;Milli-Q超纯水机(Millipore)制备的超纯水。
对照品尿苷(120624)、肌苷(121013)、鸟苷(120521)、腺苷(120521)和虫草素(120401)(纯度均不小于98%) 成都普菲德生物科技有限公司。
1.2 仪器与设备
AB-135S型1/10万型精密电子天平 美国梅特勒-托利多公司;24、40、50、70、90目药典筛 浙江上虞市五四仪器筛具厂;KQ-500DB型数控超声波清洗器昆山市超声仪器有限公司;TGL-16gR高速冷冻离心机上海安亭科学仪器厂;LC-20AT高效液相色谱仪(配有SIL-20AC自动进样器、LC-20AD四元低压梯度泵、CTO-20AC柱温箱、SPD-20AV UV-VIS检测器) 日本岛津公司。
1.3 方法
1.3.1 色谱条件
色谱柱:InertSustain C18柱(4.6 mm×150 mm,5 μm);流动相:甲醇(B)、0.02 mol/L KH2PO4(C),0~5 min,0% B;5~30 min,0%~5% B;3 0~3 5 m i n,5%~7.5% B;3 5~8 0 m i n,7.5%~21.3% B;检测波长254 nm;流速0.6 mL/min;柱温30 ℃;进样量为10 μL。
1.3.2 对照品溶液的制备
取尿苷、肌苷、鸟苷、腺苷及虫草素对照品适量,精密称定,加体积分数20%甲醇溶液制成每1 mL含尿苷0.284 mg、肌苷0.142 mg、鸟苷0.132 mg、腺苷0.116 mg、虫草素0.836 mg的混合溶液,置于冰箱(4 ℃)内避光保存备用。
1.3.3 供试品溶液的制备
准确称取人工蛹虫草粉末(过50 目筛)20 mg,置4 mL离心管中,精密加入1 mL 0.7 mol/L的[C4MIM]PF6-20%甲醇溶液,超声(100 W、40 kHz)提取50 min,3 000 r/min离心10 min,取上清液,经0.22 μm微孔滤膜过滤,取续滤液,即得。
1.3.4 萃取条件优化
应用单因素试验方法分别考察萃取剂种类、萃取剂浓度、样品粒度、固液比、超声时间和离心转速对人工蛹虫草中5 种核苷类化合物萃取量的影响,并对不同萃取条件进行优化。
2.1 萃取条件优化
2.1.1 萃取剂种类的选择

图1 萃取剂种类对5 种核苷类化合物萃取量的影响
Fig. 1 Effect of different types of extraction solvents on the extraction effi ciencies of fi ve nucleosides
选择水溶性和脂溶性的[C6MIM]PF6、[BMIM]BF4、[C4MIM]PF6和[BMIBr]4 种离子液体作为萃取剂,精密称定人工蛹虫草粉末(过50 目筛)约20 mg共5 份,分别加入0.9 mol/L的含上述4 种离子液体的20%甲醇溶液及20%甲醇溶液试剂1 mL,超声(100 W、40 kHz)30 min,5 000 r/min离心10 min,后经0.22 μm有机滤膜过滤后高效液相色谱进样分析,记录待测组分的峰面积,比较其对目标分析物的萃取效果。如图1所示,不同萃取剂对目标分析物萃取量影响很大,离子液体溶液对待测组分的萃取量均明显高于20%甲醇溶液,且[C4MIM] PF6-20%甲醇溶液整体高于其他3 种,因此选择[C4MIM] PF6作为萃取剂。
2.1.2 萃取剂浓度的选择
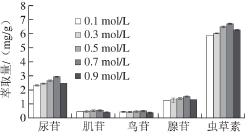
图2 萃取剂浓度对5 种核苷类化合物萃取量的影响
Fig. 2 Effect of solvent concentration on the extraction effi ciencies of fi ve nucleosides
分别以0.1、0.3、0.5、0.7、0.9 mol/L [C4MIM]PF6-20%甲醇溶液1 mL作为萃取剂,如图2所示,当萃取剂浓度在0.1~0.7 mol/L时,5 种待测组分萃取量逐渐增加,当浓度大于0.7 mol/L后,萃取量下降。离子液体浓度增加,体系黏度增强,相反其扩散能力减弱,难进入药材内,导致萃取量下降。因此0.7 mol/L为最佳萃取剂浓度。
2.1.3 样品粒度的选择
由图3可知,随分样筛目数增大,药材粉末的粒度越小。50目分样筛对目标分析物的萃取量最高,故选择使用50 目的分样筛。

图3 样品粒度对5 种核苷类化合物萃取量的影响
Fig. 3 Effect of sample particle size on the extraction effi ciencies of fi ve nucleosides
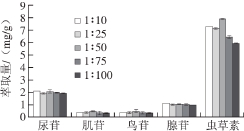
图4 固液比对5 种核苷类化合物萃取量的影响
Fig. 4 Effect of ionic liquid to sample ratios on extraction effi ciencies of fi ve nucleosides
2.1.4 固液比的选择如图4所示,萃取剂用量增加,离子液体对5 种核苷类成分的萃取量发生变化,在1∶50时达到最大值,可知此时样品中的待测组分基本已被萃取完全;继续增大萃取剂比例时,萃取量反而降低,原因可能与离子液体黏度相关,故选择最佳固液比为1∶50。
2.1.5 超声时间的选择
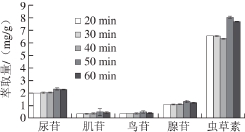
图5 超声时间对5 种核苷类化合物萃取量的影响
Fig. 5 Effect of ultrasonication time on the extraction effi ciencies of fi ve nucleosides
如图5可知,超声时间延长,溶剂对目标成分萃取量呈增长趋势,在50 min达到最大,之后超声时间延长,萃取量降低。可能原因是超声时间过长,导致药材中的其他成分溶出增加,对目标成分检测有一定的影响。
2.1.6 离心转速的选择
如图6所示,随转速增加,5 种化合物的萃取量逐渐增大,转速为3 000 r/min时,5 种核苷类成分均达到最大值;而后随转速增加,萃取量降低。所以选择最佳转速为3 000 r/min。

图6 离心转速对5 种核苷类化合物萃取量的影响
Fig. 6 Effect of centrifugation speed on the extraction effi ciencies of fi ve nucleosides
2.2 线性关系考察结果
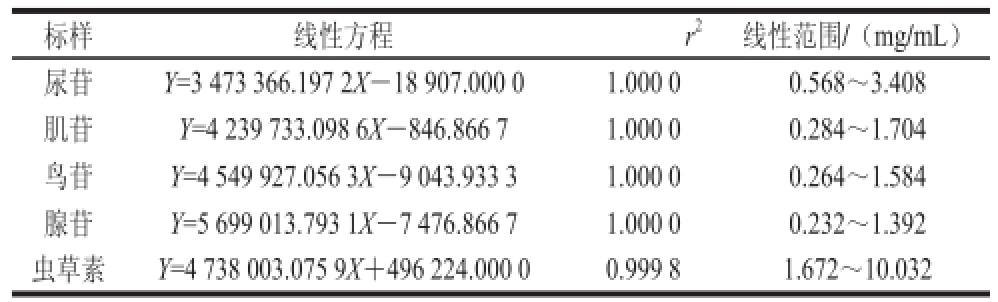
精密量取混合对照品溶液适量,按1.3.1节色谱条件分别进样,记录峰面积。以进样量(X/μg)为横坐标,峰面积(Y)为纵坐标进行线性绘制5 个的标准曲线,如图7、表1所示。
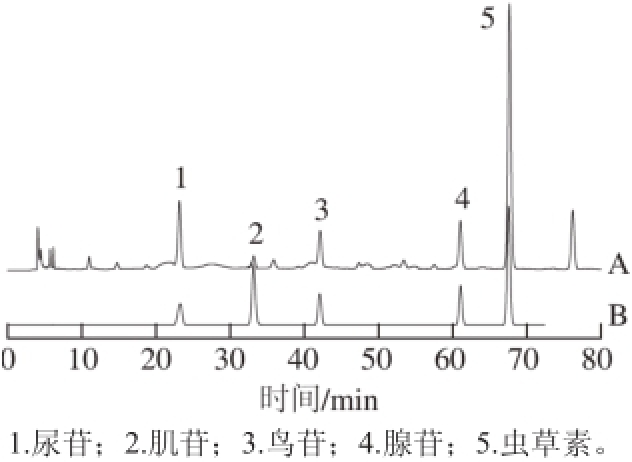
图7 人工蛹虫草样品(A)和混合对照品(B)的高效液相色谱图
Fig. 7 HPLC chromatograms of fi ve nucleosides from cultured Cordyceps militaris (A) and reference substances (B)
表1 核苷类化合物回归方程及线性范围
Table 1 Regression equation and linear ranges for nucleosides
2.3 方法学验证
2.3.1 精密度结果
精密吸取1.3.2节混合对照品溶液10 μL,按1.3.1节的色谱条件操作,连续进样6 次,分别测定尿苷、肌苷、鸟苷、腺苷及虫草素的峰面积,计算相对标准偏差分别为0.063%、0.078%、0.089%、0.173%和0.606%,表明仪器的精密度良好。
2.3.2 稳定性结果
精密吸取1.3.2节混合对照品溶液10 μL,按1.3.1节的色谱条件操作,分别在0、2、4、8、16 h和24 h进样测定,尿苷、肌苷、鸟苷、腺苷及虫草素峰面积的相对标准偏差分别为1.687%、1.506%、1.059%、1.261%和0.219%,说明供试品溶液在24 h内基本保持稳定。
2.3.3 重复性结果
精密称取同一批人工蛹虫草样品6 份,按1.3.3节方法制备供试品溶液,按1.3.1节的色谱条件分别进样测定,尿苷、肌苷、鸟苷、腺苷及虫草素峰面积的相对标准偏差分别为0.931%、1.409%、2.452%、2.444%和1.153%,表明方法重复性良好。
2.3.4 加样回收率结果
取人工蛹虫草粉末9 份各20 mg,分为3 组,进行分析测定,得出样品中尿苷、肌苷、鸟苷、腺苷及虫草素的含量,之后分别加入相当于样品中尿苷、肌苷、鸟苷、腺苷及虫草素质量分数80%、100%、120%的对照品,进样测定,计算加样回收率,尿苷、肌苷、鸟苷、腺苷及虫草素加样回收率分别为101.5%、99.0%、99.3%、97.6%和97.7%,相对标准偏差分别为1.97%、1.76%、1.94%、1.43%和1.82%。
2.4 样品含量测定
表2 人工蛹虫草中5 种核苷类成分的含量
Table 2 The contents of fi ve nucleosides in cultured Cordyceps militaris determined by the proposed method
mg/g
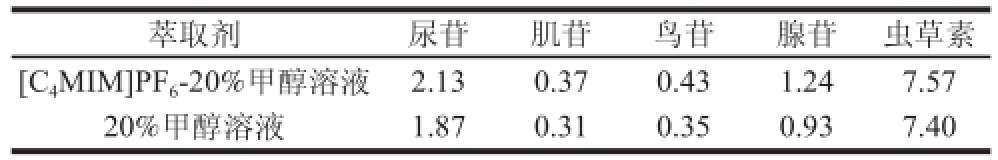
记录样品中5 种核苷类成分的相应峰面积,代入回归方程中计算,算出样品在不同萃取溶剂条件下相应物质的含量。从表2可知,在相同条件下,采用离子液体作为萃取剂时,尿苷、肌苷、鸟苷、腺苷和虫草素的萃取量比20%甲醇溶液作为萃取剂时分别高出13.9%、19.3%、22.8%、33.3%和2.30%。咪唑类离子液体可将纤维素高效溶解[29],其机制可能为离子液体通过氢键与木质纤维素组分竞争性结合,破坏其三维结构[26],从而提高萃取量。
目前,已报道离子液体作为萃取剂能提高药用植物三萜及其苷[26]、黄酮[28]、醌类[27]及生物碱、酚类[30]等成分的萃取量,对齐墩果酸和芍药苷分别高出甲醇提取的41.67%和561.73%[26];张小梅等[30]发现相比常规溶剂甲醇,离子液体对雷公藤晋碱、雷公藤碱庚、雷酚内酯、雷公藤次碱和雷公藤醌A提取分别高出104.7%、83.1%、28.8%、141.8%和11.1%。同时离子液体也可提高微量化学成分的提取、富集及分析[31]。此外,离子液体作为流动相添加剂,可改善峰形,提高分离度[32-33]。另一方面,引入离子液体用于牛奶中激素[21]、三嗪类和苯基脲类除草剂[34]的残量分析,同时也可用于肉中磺胺类药物[35]、氯霉素的检测[36]及水中有害物质溴敌隆及溴鼠灵[37]、萘二酚[38]、胺类[39]等的痕量测定,较大的提高其灵敏度和检测限。
本实验建立离子液体微萃取人工蛹虫草中5 种核苷类成分含量测定方法。并对萃取剂种类、浓度、样品粒度、固液比、超声时间和离心转速等条件进行优化。结果表明,以0.7 mol/L [C4MIM]PF6-20%甲醇溶液为萃取剂,过50 目筛、固液比1∶50、超声时间50 min、离心转速3 000 r/min时,萃取量最高。同时通过方法学验证,可知该方法操作简便、快速、稳定、萃取量高,可用于人工蛹虫草中核苷类成分的快速检测,同时为其质量控制方法建立提供参考依据。
参考文献:
[1] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
[2] 李军, 陈广生, 方清茂, 等. 人工培养蛹虫草与冬虫夏草的比较研究[J]. 成都中医药大学学报, 2010, 33(3): 82-83. DOI:10.13593/ j.cnki.51-1501/r.2010.03.027.
[3] 张国财, 赵博, 刘春延, 等. 响应面法优化超声波-微波协同提取富硒蛹虫草硒多糖工艺[J]. 食品科学, 2016, 37(12): 33-39. DOI:10.7506/ spkx1002-6630-201612006.
[4] 叶洲. 卫生部批准蛹虫草为新资源食品[J]. 中国保健食品, 2009(5): 14.
[5] 李尽哲, 叶兆伟, 黄雅琴. 蛹虫草桑叶复合保健饮料的研制[J]. 食品研究与开发, 2016, 37(3): 77-79. DOI:10.3969/ j.issn.1005-6521.2016.03.020.
[6] 孟梦, 张军, 朱振元. 蛹虫草悬浮型固体饮料制备工艺研究[J]. 食品研究与开发, 2016, 37(14): 62-67. DOI:10.3969/ j.issn.1005-6521.2016.14.017.
[7] 李林波, 边红杰, 崔建东. 蛹虫草保健酱油的工艺研究[J]. 中国调味品, 2016, 41(7): 100-103. DOI:10.3969/j.issn.1000-9973.2016.07.021.
[8] 孙明超, 李静媛, 朴美子. 蛹虫草花生乳的工艺研究[J]. 食品科技, 2016, 41(2): 117-121. DOI:10.13684/j.cnki.spkj.2016.02.023.
[9] 万朋, 高俊涛, 吕世杰. 蛹虫草化学成分及药理作用研究进展[J].上海中医药杂志, 2015, 38(6): 95-97. DOI:10.16305/j.1007-1334.2015.06.033.
[10] 王普, 郑明, 何军邀, 等. 虫草多糖的化学结构及药理活性研究进展[J]. 浙江工业大学学报, 2010, 38(2): 129-133. DOI:10.3969/ j.issn.1006-4303.2010.02.003.
[11] 陈小丽, 巫光宏, 黄卓烈. 一种蛹虫草多糖的结构特征及体外抗氧化活性[J]. 食品工业科技, 2016, 37(6): 155-159. DOI:10.13386/ j.issn1002-0306.2016.06.023.
[12] 王风光. 虫草多糖化学结构及药理活性研究[J]. 亚太传统医药, 2014, 10(8): 50-51.
[13] 王蕾, 于荣敏, 张辉, 等. 人工培养蛹虫草多糖的分离纯化及其结构的初步研究[J]. 中国生化药物杂志, 2003, 24(1): 23-25. DOI:10.3969/j.issn.1005-1678.2003.01.008.
[14] 盖新杰, 张翼伸. 蛹虫草胞外多糖的研究[J]. 真菌学报, 1992(4): 300-307.
[15] 袁蜜, 乐昕, 徐鲁荣, 等. 高效液相色谱法同时测定蛹虫草子实体中腺苷和虫草素含量[J]. 食品科学, 2013, 34(14): 306-310. DOI:10.7506/spkx1002-6630-201314064.
[16] 刘玉军, 徐芳, 陈波, 等. 毛细管区带电泳法测定冬虫夏草及人工蛹虫草子实体中核苷及碱基成分的含量[J]. 药物分析杂志, 2010, 30(1): 24-29. DOI:10.16155/j.0254-1793.2010.01.011.
[17] 黄兰芳, 郭方遒, 梁逸曾, 等. HPLC-ESI-MS测定冬虫夏草和蚕蛹虫草中腺苷和虫草素含量[J]. 中国中药杂志, 2004, 29(8): 762-764. DOI:10.3321/j.issn:1001-5302.2004.08.015.
[18] 米莉莉, 张素文, 孙家进, 等. 冬虫夏草及人工虫草核苷类成分的TLCS研究[J]. 中成药, 2003, 25(5): 402-405. DOI:10.3969/ j.issn.1001-1528.2003.05.021.
[19] 牛聪聪, 王身艳, 刘畅, 等. HPLC测定人工蛹虫草中6 种核苷类成分的含量[J]. 中国生化药物杂志, 2016, 36(3): 169-171. DOI:10.3969/ j.issn.1005-1678.2016.03.56.
[20] QIN H, ZHOU G, PENG G, et al. Application of ionic liquid-based ultrasound-assisted extraction of five phenolic compounds from Fig (Ficus carica L.) for HPLC-UV[J]. Food Analytical Methods, 2014, 8(7): 1-9. DOI:10.1007/s12161-014-0047-9.
[21] 戚琦, 黄闵, 谢海华. 离子液体分散液-液微萃取-高效液相色谱法测定牛奶中己烯雌酚[J]. 食品科学, 2016, 37(4): 202-205. DOI:10.7506/spkx1002-6630-201604036.
[22] LOU Z, WANG H, SONG Z, et al. Ionic liquids based simultaneous ultrasonic and microwave assisted extraction of phenolic compounds from burdock leaves[J]. Analytica Chimica Acta, 2012, 716(4): 28-33. DOI:10.1016/j.aca.2011.03.012.
[23] 张丹丹, 谭婷, 刘鄂湖, 等. 离子液体在中药提取分离与分析中的应用[J]. 中国药科大学学报, 2013, 44(4): 380-384. DOI:10.11665/ j.issn.1000-5048.20130418.
[24] 邵江娟, 吴昊, 赵雅秋, 等. 离子液体萃取技术及其在中药领域中的应用[J]. 中草药, 2013, 44(24): 3561-3565. DOI:10.7501/ j.issn.0253-2670.2013.24.025.
[25] 陆程灿, 赵琳, 黄勇鑫, 等. 超声辅助离子液体-反相高效液相色谱法同时测定垂丝海棠叶中槲皮苷、根皮苷和3-羟基根皮苷含量[J]. 中国中药杂志, 2016, 41(11): 2131-2136. DOI:10.4268/cjcmm20161125. [26] 刘微, 李冬冬, 杨洪帅, 等. 超声辅助离子液体-反相液相色谱法测定赤芍中齐墩果酸和芍药苷的含量[J]. 中国中药杂志, 2015, 40(3): 443-449. DOI:10.4268/cjcmm20150314.
[27] 杨红帅, 王菊, 郭翠, 等. 超声辅助离子液体-反相液相色谱法同时测定茜草中茜草素和大叶茜草素的含量[J]. 中国中药杂志, 2015, 40(13): 2617-2623. DOI:10.4268/cjcmm20151324.
[28] 魏金凤, 张志娟, 李冬冬, 等. 离子和液体辅助萃取山高粱中4 种黄酮类成分的研究[J]. 中国中药杂志, 2015, 40(7): 1305-1310. DOI:10.4268/cjcmm20150717.
[29] 李维尊. 咪唑类离子液体对生物质中木质纤维素选择性提取及分离[D]. 天津: 南开大学, 2013.
[30] 张小梅, 陈一龙, 姚媛媛, 等. 基于离子液体-超声辅助-HPLC同时测定昆明山海棠中5 种成分的含量[J]. 中国中药杂志, 2016, 41(5): 879-886. DOI:10.4268/cjcmm20160520.
[31] 李兰杰, 李绪文, 丁健, 等. 超声辅助结合离子液体双水相提取-高效液相色谱法测定三七中5 种稀有人参皂苷的含量[J]. 高等学校化学学报, 2016, 37(3): 454-459. DOI:10.7503/cjcu20150703.
[32] 朱益雷, 方海红, 魏惠珍, 等. 以离子液体为流动相添加剂测定香连丸中3 种生物碱[J]. 中国实验方剂学杂志, 2016, 22(12): 75-78. DOI:10.13422/j.cnki.syfjx.2016120075.
[33] 方海红, 朱益雷, 魏惠珍, 等. 离子液体作流动相添加剂高效液相色谱法分离莨菪类生物碱[J]. 分析测试学报, 2016, 35(5): 614-617. DOI:10.3969/j.issn.1004-4957.2016.05.021.
[34] 黄智鸿, 孙茂红, 王素利, 等. 离子液体涡旋辅助/表面活性剂乳化-液相微萃取测定牛奶中的三嗪类和苯基脲类除草剂[J]. 现代食品科技, 2016, 32(1): 266-272. DOI:10.13982/ j.mfst.1673-9078.2016.1.042.
[35] 王庚南, 张会彩, 刘静, 等. 离子液体单滴微萃取-高效液相色谱法检测肉中的磺胺类药物[J]. 畜牧与兽医, 2016, 48(3): 5-10.
[36] 周惠燕, 陈珏, 王嘉俊. 基于离子液体的原位溶剂形成微萃取-高效液相测定虾肉中的氯霉素[J]. 食品科技, 2016, 41(1): 307-310. DOI:10.13684/j.cnki.spkj.2016.01.060.
[37] 陈晓红, 魏晓琴, 蔡美强, 等. 离子液体[C_4 mim][PF_6]超声辅助萃取/LC-MS/MS法测定水中痕量溴敌隆及溴鼠灵[J]. 分析测试学报, 2014, 33(6): 648-652. DOI:10.3969/j.issn.1004-4957.2014.06.005.
[38] 何东. 离子液体分散液液微萃取/高效液相色谱法测定环境水样中7 种萘二酚[J]. 分析测试学报, 2016, 35(7): 844-848. DOI:10.3969/ j.issn.1004-4957.2016.07.011.
[39] 徐能斌, 冯加永, 朱丽波, 等. 两种离子液体-分散液液微萃取方法富集水中4 种胺类化合物的比较[J]. 分析化学, 2016, 44(1): 117-123. DOI:10.11895/j.issn.0253-3820.150411.
Determination of the Active Ingredients in Cultured Cordyceps militaris by Ultrasound-Assisted Ionic Liquid Microextraction Coupled with Reversed Phase Liquid Chromatography
ZHANG Wei, ZHANG Yong, YIN Zhenhua, KANG Wenyi*
(Zhengzhou Key Laboratory of Medicinal Resources Research, Huanghe Science and Technology College, Zhengzhou 450063, China)
Abstract:This study aimed to develop a high performance liquid chromatography (HPLC) method for the simultaneous determination of the contents of five nucleoside (uridine, inosine, guanosine, adenosine and cordycepin) in cultured Cordyceps militaris. An ultrasonic-assisted ionic liquid microextraction procedure was proposed using [C4MIM]PF6-20% methanol as extraction solvent for sample pretreatment. The method was performed on an Inert Sustain C18column (4.6 mm × 150 mm, 5 μm) with methanol-0.02 mol/L KH2PO4 solution as mobile phase at a fi ow rate of 0.6 mL/min by gradient elution. The column temperature was 30 ℃ and the detection wavelength was set at 254 nm. The highest extraction yields of fi ve nucleosides were obtained by using 0.7 mol/L [C4MIM]PF6-20% methanol solution as extraction solvent at a solid-to-liquid ratio of 1:50 (g/L), pulverizing samples to pass through a 50-mesh sieve, ultrasonic irradiation for 50 min, and centrifugation at 3 000 r/min. A good linearity was observed in the range of 0.568‒3.408, 0.284‒1.704, 0.264‒1.584, 0.232‒1.392 and 1.672‒10.032 mg/mL for uridine, inosine, guanosine, adenosine and cordycepin, respectively, with correlation coeffi cients above 0.999 8. The average recoveries were in the range of 97.6%‒101.5%, with relative standard deviation (RSDs) ranging between 1.43% and 1.97%. The method was rapid, simple and sensitive, and it could be applied for rapid analysis of fi ve nucleosides in cultured C. militaris.
Key words:cultured Cordyceps militaris; ionic liquid; high performance liquid chromatography (HPLC); nucleoside constituents
引文格式:
引文格式:
张伟, 张勇, 尹震花, 等. 超声辅助离子液体微萃取-反相液相色谱法测定人工蛹虫草活性成分[J]. 食品科学, 2017, 38(8): 179-183. DOI:10.7506/spkx1002-6630-201708028. http://www.spkx.net.cn
ZHANG Wei, ZHANG Yong, YIN Zhenhua, et al. Determination of the active ingredients in cultured Cordyceps militaris by ultrasound-assisted ionic liquid microextraction coupled with reversed phase liquid chromatography[J]. Food Science, 2017, 38(8): 179-183. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201708028. http://www.spkx.net.cn
DOI:10.7506/spkx1002-6630-201708028
中图分类号:R931.7
文献标志码:A
文章编号:1002-6630(2017)08-0179-05
收稿日期:2016-10-31
基金项目:河南省产学研合作项目(162107000038);河南省教育厅科学技术研究重点项目(17B360005);
2016年度河南省高校科技创新团队项目(16IRTSTHN019)
作者简介:张伟(1974—),男,副教授,硕士,研究方向为天然药物活性成分。E-mail:zzzwwwqq@126.com
*通信作者:康文艺(1971—),男,教授,博士,研究方向为天然产物化学。E-mail:kangweny@hotmail.com