表1 L9(34)正交试验因素与水平
Table 1 Factors and their coded and actual levels used in L9(34) orthogonal array design
许先猛1,董文宾1,*,卢 军2,孙皎皎1
(1.陕西科技大学化学与化工学院,陕西 西安 710021;2.汉中市食品药品监督管理局,陕西 汉中 723000)
摘 要:为减少食品和动物饲料加工过程中无机铜的使用和添加对环境的污染和营养物质的浪费,开发新型氨基酸铜制剂具有重要意义。本实验从食品级猪皮明胶中分离制备L-羟脯氨酸(L-Hyp),并以L-Hyp和CuSO4•5H2O为原料,采用固相微波辐射和加压二级处理的方法制备L-羟脯氨酸-Cu(Ⅱ)(L-Hyp-Cu(Ⅱ)),制备条件为:L-Hyp和CuSO4·5H2O物质的量比2.5∶1,即10.5 g L-Hyp和8.0 g CuSO4·5H2O充分混匀,加入引发水20 mL,微波功率600 W,添加除酸剂无水Na2CO35.6 g,微波时间180 s;二级加压处理,将微波辐射处理后的样品转入加压反应釜中,在二级反应温度90 ℃、二级反应压强15 MPa、搅拌速率100 r/min条件下,反应35 min。并用紫外光谱、红外光谱、X衍射、扫描电子显微镜、配合分析、元素分析、重量分析等手段对配合物的组成和结构进行表征。结果表明:经微波辐射和加压二级处理可以提高L-Hyp-Cu(Ⅱ)螯合率,产品螯合率为86.4%。通过表征分析发现,Cu(Ⅱ)与L-Hyp中的羧基和亚氨基发生配位,反应所得产物L-Hyp-Cu(Ⅱ)配位比为1∶2,分子式为Cu(C5H8NO3)2。
关键词:L-羟脯氨酸-Cu(Ⅱ);微波固相法;加压;二级处理;结构表征
人和动物体内所有的组织和体液中都存在着大量的矿物质,矿物质是人和动物体必不可少的组成部分并且参与所有的生理活动[1]。其中,铜元素是非常重要的微量元素之一[2],参与多种体内生物过程[3-5],包括呼吸作用、新陈代谢、DNA合成以及氧化还原反应等。Megias等[6]指出铜在人和动物体内能够产生活性氧诱导核苷酸碱基氧化,促使DNA链断裂。铜参与了体内30多种酶的组成和活化,例如铜是细胞色素氧化酶的重要辅助因子,也是酪氨酸酶、赖氨酸氧化酶、胺氧化酶和铜蓝蛋白等的辅基,还是超氧化物歧化酶的重要组成部分[7]。此外,铜也是植物生长必需的微量元素[8]。但无机铜存在吸收率低、与其他微量元素颉颃等缺点,应用过程中容易产生环境污染、动物中毒等一系列问题。近年来,有机铜在动物营养中的作用已引起人们的广泛关注。
羟脯氨酸(Hyp)是胶原蛋白的特征氨基酸,也是胶原蛋白的主要组成成分(21%)[9],被作为特征成分用来测定食品等样品中胶原蛋白含量[10]。羟脯氨酸是动物体内很多生理活动的必需物质,比如它是甘氨酸、丙酮酸和葡萄糖的合成底物[11]。在临床还用于治疗皮肤病,能促进伤口愈合,也可用于治疗风湿性关节炎和结缔组织疾患,添加到化妆品中还可以起到抗氧化、抗辐射等作用[12]。目前,国内外研究[1,8,13]主要是采用液体反应法合成复合氨基酸铜,并在动物生产中应用。本实验从食品级猪皮明胶中分离制备L-Hyp,并以L-Hyp和CuSO4·5H2O为原料,通过添加引发剂和酸度调节剂,原料在充分混合均匀的前提下,采用新型工艺加压微波固相二级处理的方法制备L-Hyp-Cu(Ⅱ),即第1阶段进行微波辐射处理,充分提高反应速度,第2阶段在加压条件下固相合成反应,促使整个反应平衡正向进行,提高L-Hyp-Cu(Ⅱ)螯合率,并对其结构进行表征,为羟脯氨酸微量元素螯合物的进一步开发利用提供依据。
1.1 材料与试剂
食品级猪皮明胶 山东淄博宝恩生物科技有限公司;L-Hyp 实验室制备;L-Hyp标准品 美国Sigma公司;HCl、NaNO2、CuSO4·5H2O、无水NaCO3、95%乙醇溶液、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)及其他试剂均为分析纯。
1.2 仪器与设备
LXH-100A微波合成仪 北京祥鹄科技有限公司;GSH-5反应釜 威海化工机械公司;Lewatit Monopulus S108阳离子交换树脂 德国Lanxess公司;754型紫外-可见分光光度计 上海菁华科技有限公司;VERTEX 70傅里叶变换红外光谱分析仪 德国Brüker公司;S-4800场发射扫描电子显微镜 日本Hitachi公司;D/max2200PC X光衍射仪 日本Rigaku公司;MD31透析袋 美国Spectrum公司;CPA124S电子分析天平 德国Sartorius公司;Vario EL CUBE元素分析仪 德国Elementar公司;SX2-4-10马弗炉 北京科伟永兴仪器有限公司。
1.3 方法
1.3.1 L-Hyp的制备
取猪皮明胶200 g置于圆底烧瓶中,加入6 mol/L盐酸溶液2 L,在110 ℃回流28 h,浓缩至1 L以内,加6 g活性炭,90 ℃脱色1 h。取200 g NaNO2溶于250 mL水中,于3 h内加入脱色后的猪皮明胶水解液内,水解液在60 ℃搅拌,加完后继续加热搅拌2 h。加入等体积的浓盐酸,浓缩至0.8 L,用玻璃纤维过滤,95%乙醇溶液洗涤滤渣,合并滤液与洗涤液,采用活性炭二次脱色。将阳离子交换树脂装柱,用盐酸处理成H+型,将滤液按6 mL/min上柱,用双蒸水洗脱杂质,用0.1 mol/L的氨水以6 mL/min洗脱,用10 mL溶液收集器收集洗脱液,采用纸层析显色法[14]定性洗脱液中L-Hyp为单一组分。合并L-Hyp洗脱液,浓缩、结晶、热水溶解、脱色、浓缩、重结晶,得到L-Hyp成品。
1.3.2 单因素试验设计
引发水用量的选择:将10.5 g L-Hyp和8.0 g CuSO4·5H2O(物质的量比2.5∶1)充分混合,分别添加5、10、15、20、25 mL引发水后混匀,在微波功率600 W条件下辐射180 s,添加5.6 g除酸剂碳酸钠(质量分数30%),分2 次添加(每隔60 s添加2.8 g),二级加压处理,将微波辐射处理后的样品转入加压反应釜中,在二级反应温度90 ℃,二级反应压强15 MPa,搅拌速率100 r/min条件下,反应35 min,确定引发水用量。
微波功率的选择:将样品混合后添加20 mL引发水,在微波功率分别为200、400、600、800、1 000 W条件下辐射180 s,添加5.6 g除酸剂碳酸钠(质量分数30%),分2 次添加,二级加压处理条件不变,确定微波功率。
微波时间的选择:将样品混合后添加20 mL引发水,在微波功率600 W条件下分别辐射60、120、180、240、300 s,添加5.6 g除酸剂碳酸钠(质量分数30%),分2 次添加,二级加压处理条件不变,确定微波时间。
除酸剂用量的选择:将样品混合后添加20 mL引发水,在微波功率600 W条件下辐射180 s,分别添加2.8、4.2、5.6、7.0、8.4 g除酸剂碳酸钠,分2 次添加,二级加压处理条件不变,确定除酸剂用量。
二级反应温度的选择:一级微波辐射,将10.5 g L-Hyp和8.0 g CuSO4·5H2O(物质的量比2.5∶1)充分混合,加入20 mL引发水,进行微波辐射催化反应,微波功率600 W条件下辐射180 s,添加5.6 g除酸剂碳酸钠(质量分数30%),分2 次添加(每隔60 s添加2.8 g),二级加压处理,将微波处理后的样品转入加压反应釜中,二级反应压强15 MPa,搅拌速率100 r/min,二级反应时间35 min,在二级反应温度分别为60、70、80、90、100 ℃条件下进行考察,确定二级反应温度。
二级反应压强的选择:一级微波条件不变,在二级反应温度90 ℃,搅拌速率100 r/min,二级反应时间35 min,二级反应压强分别为3、6、9、12、15 MPa条件下进行考察,确定二级反应压强。
二级反应时间的选择:一级微波条件不变,在二级反应温度90 ℃,二级反应压强15 MPa,搅拌速率100 r/min条件下,二级反应时间分别为15、25、35、45、55 min,确定二级反应时间。
1.3.3 正交试验设计
在单因素试验基础上,将1 0.5 g L-H y p和8.0 g CuSO4·5H2O(物质的量比2.5∶1)充分混合,选取引发水用量(A)、微波功率(B)、除酸剂用量(C)、二级反应时间(D)4 个因素,采用L9(34)正交试验设计,以螯合率为指标,优化合成工艺参数,因素水平设计如表1所示。
表1 L9(34)正交试验因素与水平
Table 1 Factors and their coded and actual levels used in L9(34) orthogonal array design

1.3.4 L-Hyp-Cu(Ⅱ)样品合成
一级微波辐射处理,分别精确称取10.5 g L-Hyp和8.0 g CuSO4·5H2O在烧杯中充分混合,加入20 mL引发水,进行微波催化反应,在微波功率600 W条件下辐射180 s,添加5.6 g除酸剂碳酸钠(质量分数30%),分2 次添加(每隔60 s添加2.8 g);二级加压处理,将微波辐射处理后的样品转入加压反应釜中,二级反应温度90 ℃,二级反应压强15 MPa,搅拌速率100 r/min,二级反应时间为35 min。用乙醇重结晶3 次,真空冷冻干燥48 h,制得深蓝色羟脯氨酸铜螯合样品,备用。
1.3.5 L-Hyp-Cu(Ⅱ)螯合率的测定
采用EDTA[16]滴定法测定制备L-Hyp-Cu(Ⅱ)中Cu含量,记为m。按下式计算L-Hyp-Cu(Ⅱ)螯合率:
式中:m为螯合物中Cu含量/g;2.048 0为使用原料8.0 g CuSO4·5H2O中Cu含量/g。
1.3.6 紫外光谱分析
配制质量分数为0.1% L-Hyp和L-Hyp-Cu(Ⅱ)样品溶液,稀释10 倍后于波长190~400 nm范围内扫描。
1.3.7 红外光谱分析
取适量冷冻干燥L-Hyp和L-Hyp-Cu(Ⅱ)样品粉末,采用KBr压片法进行压片,测定它们在4 000~400 cm-1的红外图谱。
1.3.8 X衍射分析
采用D/max2200PC X光衍射仪,分析条件为Cu靶,Ka线,管电压40 kV,管电流40 mA,连续扫描,扫描速率为8 deg/min,步长0.02 deg/step,扫描角度范围2θ为4°~60°。
1.3.9 扫描电子显微镜分析
将适量的L-Hyp和L-Hyp-Cu(Ⅱ)样品分别均匀涂抹于样盘,喷金镀膜处理,施加电压聚焦清晰后,在20 000放大倍数获取图像。
1.3.10 L-Hyp-Cu(Ⅱ)配合分析
取定量L-Hyp-Cu(Ⅱ)溶液,装入截留100 D分子质量透析袋中,封口,置于烧杯中搅拌透析[15],每隔1 h取样,采用EDTA[16]滴定法测定透过液中Cu(Ⅱ)浓度,至透析平衡,以平衡时透析袋内Cu(Ⅱ)和L-Hyp的量为准,采用EDTA滴定法测定透析袋中Cu(Ⅱ)浓度,采用比色法[10]测定L-Hyp含量,计算L-Hyp-Cu(Ⅱ)的配位比。
1.3.11 元素分析
采用EDTA[16]滴定法测定L-Hyp-Cu(Ⅱ)中Cu元素含量,C、H、O的质量分数由元素分析仪测定。
1.4 数据处理
采用Design-Expert 8.0软件处理数据。
2.1 单因素试验结果
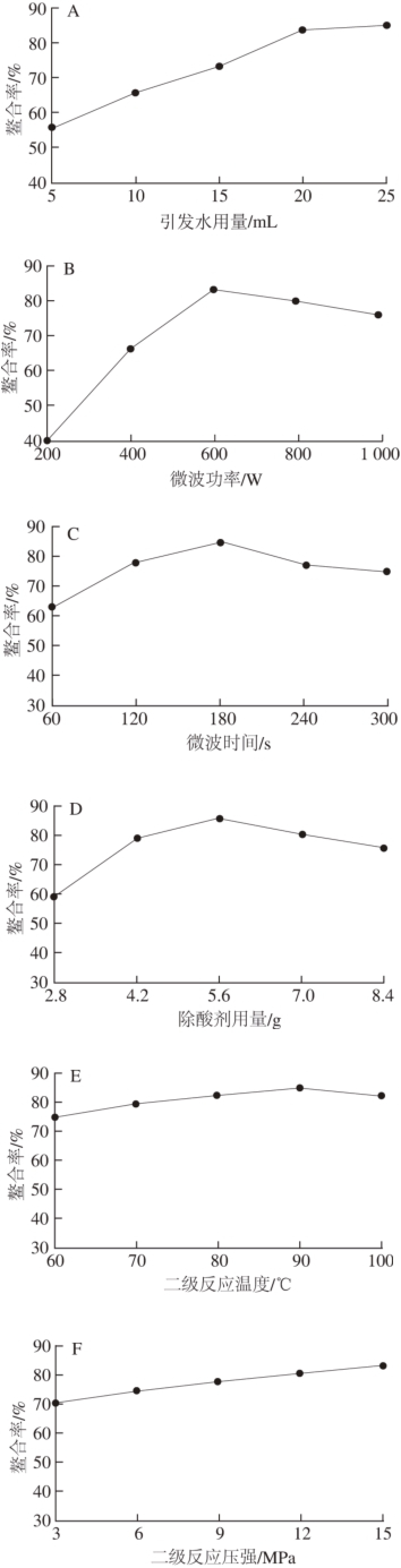

图1 各因素对L-Hyp-Cu(Ⅱ)螯合率影响
Fig. 1 Effect of various factors on the chelation ratio of L-Hyp-Cu(Ⅱ)
如图1A所示,随着引发水用量的增加,螯合率不断增大。水分子介电常数大,在微波固相反应过程中能够增强对微波的吸收率,促进反应向正向进行[17]。如图1B所示,微波能够通过辐射作用对物体进行加热,随着微波功率的增加,产生的能量不断增加,螯合率呈现增加趋势,微波功率过高,物料容易焦化[18],当功率超过600 W,由于微波产生的温度过高,引起原料结构发生改变,导致螯合率呈现下降趋势。如图1C所示,随着微波时间的延长,产能不断增加且环境温度不断升高,螯合率呈现先增加后降低的趋势,原理与微波功率影响螯合率基本相似。如图1D所示,随着除酸剂碳酸钠用量的增加,螯合率呈现先增加后降低的趋势。螯合反应过程中,容易产生硫酸等副产物,对反应有着较大的负面影响,添加除酸剂碳酸钠能够促进反应正向进行,当除酸剂添加量为5.6 g时螯合率最高,继续增加除酸剂,螯合率会因降低原料反应接触面积而降低。如图1E所示,二级反应温度在60~90 ℃范围内,随着温度的升高,螯合反应正向进行,螯合率呈现增加趋势,但增幅不太明显,当温度超过90 ℃,过高的温度引起原料结构变化,螯合率出现下降趋势。如图1F所示,增加反应环境的压强,增加了反应原料之间的碰撞概率[19],提高了螯合反应速率,促进反应平衡向正反应方向移动,二级反应压强在3~15 MPa范围内,螯合率出现逐渐增加趋势。如图1G所示,随着二级反应时间的延长,螯合率呈现先增加后降低的趋势,高压可以促进反应平衡正向进行,但长时间高压容易发生逆反应[20],因此产物螯合率会有所下降。
2.2 正交试验结果
如表2所示,L-Hyp-Cu(Ⅱ)螯合率的影响顺序为二级反应时间>除酸剂用量>引发水用量>微波功率,最优螯合条件为A3B2C3D1,即加入20 mL引发水,微波功率为600 W,添加5.6 g除酸剂,二级反应时间35 min。
精确称取10.5 g L-Hyp和8.0 g CuSO4·5H2O在烧杯中充分混合,加入20 mL引发水,进行微波辐射催化反应,在微波功率600 W条件下辐射180 s,添加5.6 g除酸剂碳酸钠(每隔60 s添加2.8 g,分2次添加);二级加压处理,将微波辐射处理后的样品转入加压反应釜中,在二级反应温度90 ℃,二级反应压强15 MPa,搅拌速率100 r/min条件下,反应35 min。按此条件进行验证实验,得到螯合率为86.4%。
表2 正交试验设计及结果
Table 2 Orthogonal array design with experimental results

2.3 L-Hyp-Cu(Ⅱ)螯合率测定结果
L-Hyp和CuSO4·5H2O一级微波辐射反应结束后,终止反应,适量双蒸水溶解,95%乙醇溶液重结晶3 次,真空冷冻干燥,测定L-Hyp-Cu(Ⅱ)螯合率为78.6%;L-Hyp和CuSO4·5H2O一级微波辐射反应和二级加压处理反应结束后,经重结晶、干燥,测定L-Hyp-Cu(Ⅱ)螯合率为86.4%,经微波固相和加压二级处理可以提高L-Hyp-Cu(Ⅱ)螯合率。
2.4 紫外光谱分析结果
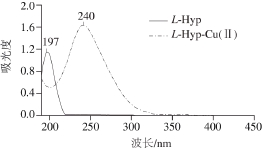
图2 L-Hyp和L-Hyp-Cu(Ⅱ)的紫外吸收曲线
Fig. 2 UV absorption spectra of L-Hyp and L-Hyp-Cu(Ⅱ)
将L-Hyp和L-Hyp-Cu(Ⅱ)样品的水溶液在波长190~500 nm之间进行紫外扫描。由图2可以看出,L-Hyp和L-Hyp-Cu(Ⅱ)最大吸收波长分别在197 nm和240 nm,发生了43 nm的红移,这主要是由于L-Hyp与Cu(Ⅱ)螯合后,介电常数增大,GNR等离子体性质发生改变,形成了稳定的L-Hyp-Cu(Ⅱ)螯合物。于倩[21]采用脉冲电场辅助方法制备甘氨酸螯合铜,用紫外扫描观察到了25 nm的红移。许洁[22]利用味精浓缩液与铜离子螯合确定谷氨酸主要参与铜螯合反应,紫外光谱分析发现有52 nm的红移。杜俊等[23]利用甘氨酸和组氨酸混合物与铜离子螯合,紫外光谱分析出现18~24 nm的红移。螯合物L-Hyp-Cu(Ⅱ)中,酚羟基和羧基、亚氨基间形成了分子内氢键,分子内氢键能够起到增加深色效应的作用[24]。L-Hyp-Cu(Ⅱ)螯合物制备过程中,由于羧基和亚氨基取代基的电负性增大,最大吸收波长也出现了43 nm红移,证明羧基和亚氨基可能发生取代和配位作用。
2.5 红外光谱分析结果
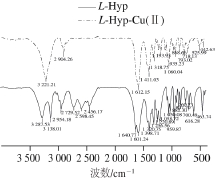
图3 L-Hyp和L-Hyp-Cu(Ⅱ)的红外光谱图
Fig. 3 Infrared spectral analysis of L-Hyp and L-Hyp-Cu(Ⅱ)
如图3所示,L-Hyp在3 287.53 cm-1处的吸收峰是由—OH伸缩振动引起的;—NH伸缩振动引起3 138.01 cm-1的特征吸收;—CH伸缩振动引起2 954.18 cm-1的特征吸收;在1 700~1 000 cm-1内出现了7 个吸收峰,其中1 640.77 cm-1是—NH弯曲振动的特征峰,1 601.24 cm-1是CO伸缩振动的特征峰,1 398.71 cm-1是C—O伸缩振动的特征峰;959.87 cm-1是—COOH弯曲振动的特征峰。当L-Hyp与铜螯合后,CO和C—O伸缩振动分别红移至1 612.15 cm-1和1 411.03 cm-1,L-Hyp-Cu(Ⅱ)的ΔʋCOO比L-Hyp的Δ ʋ有一定增大,这是由于羧基上的氧原子参与配位,基团—COOH螯合后变成了—COOCu,伸缩振动能量增大[25];在442.63 cm-1处出现的吸收峰为Cu—N伸缩振动引起的,表明Cu与N形成了配位键。L-Hyp-Cu(Ⅱ)的红外光谱图中,430~500、1 000~1 100 cm-1和1 100~1 200 cm-1均为单峰,说明是一种反式结构[26]。
2.6 X衍射分析

图4 L-Hyp和L-Hyp -Cu(Ⅱ)X衍射图谱
Fig. 4 X-ray diffraction patterns of L-Hyp and L-Hyp-Cu(Ⅱ)
如图4所示,当L-Hyp与Cu(Ⅱ)螯合以后,其主要衍射吸收峰位置发生了偏移,晶面间距d和相对响度(I/I0)也发生了变化。L-Hyp的主强峰2θ为12.52°,次强峰2θ为38.04°,在2θ分别为27.38°、21.70°、20.82°时也有强度较大的峰出现,峰形分布比较分散;L-Hyp-Cu(Ⅱ)的主强峰2θ为11.90°,次强峰2θ分别为19.80°和27.78°,说明L-Hyp与Cu(Ⅱ)发生螯合反应,而非简单的混合[27]。L-Hyp-Cu(Ⅱ)X衍射图谱本底小,衍射峰高且尖锐,说明晶型较好。
2.7 扫描电子显微镜分析结果

图5 扫描电子显微镜图
Fig. 5 Scanning electron micrographs
由图5A可知,L-Hyp在放大20 000倍条件下L-Hyp呈现光滑均匀平面,L-Hyp分子质量较小,组织状态较均匀细腻。由图5B可知,混合干物质在20 000 倍条件下有很多不太规则骨架镶嵌在平面内部,应该是L-Hyp与CuSO4·5H2O热水溶解过程中产生了一定的螯合反应,同时L-Hyp吸附了一些CuSO4晶体,从而出现不规则骨架形状。由图5C可知,L-Hyp-Cu(Ⅱ)在20 000 倍条件下,许多较为规则晶状结构紧密连接在一起并呈横向排列,晶状结构之间存在一定空隙。L-Hyp与Cu(Ⅱ)螯合以后形成了晶型较好的L-Hyp-Cu(Ⅱ),经快速真空冷冻干燥后由于水分的蒸发出现裂纹空隙现象。
2.8 L-Hyp-Cu(Ⅱ)配合分析
通过透析平衡动态监测,L-Hyp-Cu(Ⅱ)溶液透析36 h达到平衡,平衡透过液中Cu(Ⅱ)含量0.44 mmol。Cu(Ⅱ)和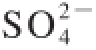 分子质量小于100 D,可通过截留分子质量100 D透析袋;而L-Hyp-Cu(Ⅱ)分子质量远大于100 D,不能通过透析袋。Cu(Ⅱ)与L-Hyp配位提供4 个空的杂化轨道,可以与L-Hyp的羧基形成配位键。L-Hyp-Cu(Ⅱ)螯合物中Cu(Ⅱ)受羧基和亚氨基限制,比较稳定,很难游离出来,不容易通过透析袋。因此,到达透析平衡时,透析袋内溶液中Cu(Ⅱ)与L-Hyp应为两者的配位化合物。计算结果得到,透析袋内溶液中Cu(Ⅱ)和L-Hyp的含量分别为0.22 mmol和0.42 mmol,两者的比例约为1∶2,所以得出L-Hyp-Cu(Ⅱ)配合物的配位比为1∶2。
分子质量小于100 D,可通过截留分子质量100 D透析袋;而L-Hyp-Cu(Ⅱ)分子质量远大于100 D,不能通过透析袋。Cu(Ⅱ)与L-Hyp配位提供4 个空的杂化轨道,可以与L-Hyp的羧基形成配位键。L-Hyp-Cu(Ⅱ)螯合物中Cu(Ⅱ)受羧基和亚氨基限制,比较稳定,很难游离出来,不容易通过透析袋。因此,到达透析平衡时,透析袋内溶液中Cu(Ⅱ)与L-Hyp应为两者的配位化合物。计算结果得到,透析袋内溶液中Cu(Ⅱ)和L-Hyp的含量分别为0.22 mmol和0.42 mmol,两者的比例约为1∶2,所以得出L-Hyp-Cu(Ⅱ)配合物的配位比为1∶2。
2.9 元素分析结果
表3 L-Hyp-Cu(Ⅱ)的元素分析结果
Table 3 Elemental analysis of L-Hyp-Cu(Ⅱ)

L-Hyp-Cu(Ⅱ)配合物中,采用EDTA[15]滴定法测定Cu元素含量,元素分析仪测定C、H、O、N的质量分数,理论值按分子式为Cu(C5H8NO3)2计算,见表3。所合成的L-Hyp-Cu(Ⅱ)配合物元素分析数据与理论计算数值相吻合,可以推断产物的化学组成与推测产物一致。
2.10 重量分析
重量分析按照张景渠[28]提出的方法测定和分析,将样品研细,取1.032 3 g L-Hyp-Cu(Ⅱ)样品置于恒质量的瓷坩埚中,在电炉上碳化1 h,将碳化好的瓷坩埚移入预热好的马福炉内,在550 ℃条件下灼烧6 h,降温,移入干燥器内冷却,称质量。结果坩埚质量为36.124 5 g,坩埚加样品质量为37.156 8 g,灼烧后坩埚加样品灰分质量为36.376 2 g。
根据实验可知,L-Hyp-Cu(Ⅱ)配合物中Cu和L-Hyp配位比=(36.376 2-36.124 5)/(64+16)∶(37.156 8-36.376 2)/131.13≈1∶2
综合以上各测定分析结果,金属离子Cu(Ⅱ)与L-Hyp反应所得产物可确定其配位比为1∶2,分子式为Cu(C5H8NO3)2,推测其结构式如图6所示。L-Hyp和Cu(Ⅱ)的螯合反应方程式为:2L-Hyp+Cu2+→Cu(C5H8NO3)2+2H+。

图6 L-Hyp-Cu(Ⅱ)结构式
Fig. 6 Molecular structure of L-Hyp-Cu(Ⅱ)
2.11 在动物生产中的应用
氨基酸铜能够有效促进动物生长和发育,提高动物繁殖性能等,其在动物生产中应用较为广泛。Coffey等[29]研究表明,100 mg/kg赖氨酸铜源的铜能够提高断奶仔猪采食量和生长速率。Lim等[30]研究表明,0.1 g/kg蛋氨酸铜能够提高蛋鸡的产蛋量和增加产蛋蛋壳的硬度。羟脯氨酸是动物体内很多生理活动的必需物质,L-Hyp-Cu(Ⅱ)与无机铜比较,在提供铜源的同时还提供L-Hyp。
微波固相法制备L-Hyp-Cu(Ⅱ)具备反应速度快、产率高等特点,较传统液相反应有一定优势;采用二级加压处理方法,增大了反应物间的接触面积,加速正向反应,提高L-Hyp-Cu(Ⅱ)螯合率。
介质在微波条件下能够迅速吸收电磁波的能量,分子之间会相互碰撞,产生的能量不断增加。因此,微波对有机物有致热作用,能够通过辐射作用对物体进行加热,可以在较短的时间内加热到很高的温度,缩短反应时间,加快反应速度。高压可以影响反应平衡,使螯合反应平衡向正反应方向移动有利于进一步提高螯合率。通过一级微波辐射,可以有效加快反应速度提高L-Hyp-Cu(Ⅱ)螯合率,通过二级加压反应,可以进一步提高L-Hyp-Cu(Ⅱ)螯合率。
L-Hyp与Cu(Ⅱ)螯合后,介电常数增大,紫外扫描最大吸收峰发生了43 nm的红移。Cu(Ⅱ)与多种氨基酸螯合反应,紫外扫描结果显示会出现18~52 nm的红移,紫外光谱分析方法可以作为Cu(Ⅱ)与氨基酸螯合反应定性分析方法的重要依据。
Cu(Ⅱ)与L-Hyp分子中羧基氧原子和亚氨基氮原子形成配位,配位比为1∶2,分子式为Cu(C5H8NO3)2,并推断出了铜与氨基酸螯合反应的产物一般通式为二氨基酸合铜。
制备L-Hyp-Cu(Ⅱ)呈现较为规则晶状结构,晶型较好,可以在食品和动物饲料加工过程中使用,课题组将对L-Hyp-Cu(Ⅱ)在动物毒理学和体内转运机制进行深入研究。
参考文献:
[1] LI D G, PADRAIGIN A H, MARTINA B, et al. Fractionation and identification of Alaska pollock skin collagen-derived mineral chelating peptides[J]. Food Chemistry, 2015, 173: 536-542. DOI:10.1016/j.foodchem.2014.10.055.
[2] TIE L M, JUN X, YUAN W, et al. Ternary copper(Ⅱ) complexes with amino acid chains and heterocyclic bases: DNA binding, cytotoxic and cell apoptosis induction properties[J]. Journal of Inorganic Biochemistry, 2015, 144: 38-46. DOI:10.1016/ j.jinorgbio.2014.12.011.
[3] NHA H V, ZHI Q X, JASON H, et al. Synthesis, crystallographic characterization and electrochemical property of a copper(Ⅱ) complex of the anticancer agent elesclomol[J]. Journal of Inorganic Biochemistry, 2014, 130: 69-73. DOI:10.1016/ j.jinorgbio.2013.10.005.
[4] URQUIZA N M, ISLAS M S, DITTLER M L, et al. Inhibition behavior on alkaline phosphatase activity, antibacterial and antioxidant activities of ternary methimazole-phenanthroline-copper(Ⅱ) complex[J]. Inorganica Chimica Acta, 2013, 405(24): 243-251. DOI:10.1016/j.ica.2013.05.022.
[5] CHEW S T, LO K M, LEE S K, et al. Copper complexes with phosphonium containing hydrazone ligand: topoisomerase inhibition and cytotoxicity study[J]. European Journal of Medicinal Chemistry, 2014, 76(9): 397-407. DOI:10.1016/j.ejmech.2014.02.049.
[6] MEGIAS C, PEDROCHE J, YUST M M, et al. Affi nity purifi cation of copper chelating peptides from chickpea protein hydrolysates[J]. Journal of Agricultural and Food Chemistry, 2007, 55(10): 3949-3954. DOI:10.1021/jf063401s.
[7] 熊家林, 张珩. 饲料添加剂[M]. 北京: 化学工业出版社, 2001.
[8] 冯贵颖, 刘娟, 呼世斌, 等. 复合氨基酸铜螯合物的合成条件研究[J]. 西北农业学报, 2005, 14(1): 71-75. DOI:10.3969/ j.issn.1004-1389.2005.01.016.
[9] HIROAKI S, KAZUYA W, AYAKO K, et al. A bienzyme electrochemical biosensor for the detection of collagen L-hydroxyproline[J]. Sensing and Bio-Sensing Research, 2015, 4: 37-39. DOI:10.1016/j.sbsr.2015.03.002.
[10] SEIYA W, YOSHINOBU H, SHIORI E, et al. An enzymatic method to estimate the content of L-hydroxyproline[J]. Journal of Biotechnology, 2015, 199: 9-16. DOI:10.1016/j.jbiotec.2015.01.026.
[11] WU G, BAZER F W, BURGHARDT R C, et al. Proline and hydroxyproline metabolism: implications for animal and human nutrition[J]. Amino Acids, 2011, 40: 1053-1063. DOI:10.1007/s00726-010-0715-z.
[12] MICHAEL L, MARIA S. Aging skin[R]. Anti-Aging Research Brief (A3R), 2001.
[13] 杨坡, 王选年, 李敬玺. 氨基酸螯合铜在动物生产中的应用[J]. 动物医学进展, 2006, 27(9): 46-50. DOI:10.3969/ j.issn.1007-5038.2006.09.012.
[14] 吕红线. 从骨胶中制备L-羟脯氨酸的研究[J]. 山东轻工业学院学报, 1997, 11(4): 53-56.
[15] 左瑞雅, 周小华, 杜首英. L-羟脯氨酸-Zn(Ⅱ)的配合机制及其抗氧化性研究[J]. 生物工程学报, 2007, 23(4): 704-709. DOI:10.3321/ j.issn:1000-3061.2007.04.027.
[16] 易凯, 张妮娅, 齐德生. 微量元素氨基酸螯合物螯合率测定方法研究[J]. 饲料工业, 2007(14): 47-49. DOI:10.3969/j.issn.1001-991X.2007.14.018.
[17] 刘玲, 冯振, 燕南, 等. 微波固相合成L-瓜氨酸锌螯合物的研究[J]. 食品工业科技, 2014, 35(8): 283-285. DOI:10.13386/ j.issn1002-0306.2014.08.055.
[18] 王赵改, 王晓敏, 杨慧, 等. 微波辐射预处理提取香椿老叶总黄酮工艺研究[J]. 核农学报, 2016, 30(10): 1989-1996. DOI:10.11869/ j.issn.100-8551.2016.10.1989.
[19] 金渭龙, 顾松园, 钟思青, 等. 煤焦加压水蒸气催化气化反应特性及甲烷释放规律研究[J]. 应用化工, 2016, 45(6): 1111-1116. DOI:10.16581/j.cnki.issn1671-3206.20160315.046.
[20] 司展, 蒋剑春, 王奎, 等. 碳基固体酸催化剂加压催化合成生物柴油[J]. 农业工程学报, 2014, 30(1): 169-174. DOI:10.3969/ j.issn.1002-6819.2014.01.022.
[21] 于倩. 脉冲电场辅助制备氨基酸螯合铜的研究[D]. 广州: 华南理工大学, 2014: 15-25.
[22] 许洁. 利用味精浓缩液制备铜、镧氨基酸螯合物的工艺研究[D]. 济南: 山东大学, 2014: 20-30.
[23] 杜俊, 李茂国, 高迎春, 等. Cu(Ⅱ)-α-氨基酸配合物的紫外光谱性质及组成测定[J]. 光谱实验室, 2003, 20(3): 415-418. DOI:10.3969/ j.issn.1004-8138.2003.03.029.
[24] 吴平, 任国庆, 鲍长坤, 等. 五中偶氮苯酚的合成和紫外光谱分析[J].广州化工, 2016, 44(18): 130-131.
[25] 徐秀廷, 朴贵金, 张富平, 等. L-羟脯氨酸与CuⅡ的螯合物的水热合成及表征[J]. 内蒙古民族师范学报(自然科学版), 1998, 13(1): 69-71.
[26] 中本雄一. 无机和配位化合物的红外和拉曼光谱[M]. 北京: 化学工业出版社, 1986.
[27] LIN Z R, ZENG X A, YU S J, et al. Enhancement of ethanol-acetic acid esterification under room temperature and non-catalytic condition via pulsed electric field application[J]. Food and Bioprocess Technology, 2012, 5(7): 2637-2645. DOI:10.1008/S11947-011-0678-4.
[28] 张景渠. 关于小麦粉灰分测定方法的探讨[J]. 现代面粉工业, 2015(2): 37-39. DOI:10.3969/j.issn.1674-5280.2015.02.016.
[29] COFFEY R D, CROMWEL G L, MONEGUE H J, et al. Effi ciency of a copper lysine complex as a growth promotant for weanling pigs[J]. Journal of Animal Science, 1994, 72(10): 2880-2886.
[30] LIM H S, PAIK I K. Effects of supplementary mineral methionine chelates (Zn, Cu, Mn) on the performance and eggshell quality of laying hens[J]. Asian-Australasian Journal of Animal Sciences, 2003, 16(12): 1804-1808. DOI:10.5713/ajas.2003.1804.
Solid Phase Preparation and Characterization of L-Hydroxyproline-Cu(Ⅱ) under Pressurized Microwave Irradiation
XU Xianmeng1, DONG Wenbin1,*, LU Jun2, SUN Jiaojiao1
(1. College of Chemistry and Chemical Engineering, Shaanxi University of Science and Technology, Xian 710021, China; 2. Hanzhong Food and Drug Administration, Hanzhong 723000, China)
Abstract:The significance of developing amino acid-chelated copper is evident to reduce environmental pollution and nutrient wastes caused by the use copper inorganic salts in food and feed processing. In this experiment, L-hydroxyproline (L-Hyp) was prepared and separated from food grade pig skin gelatin and further used to obtain L-hydroxyproline-Cu(Ⅱ) (L-Hyp-Cu(Ⅱ) with CuSO4·5H2O by sequential microwave irradiation and solid-state synthesis under pressurized conditions. The synthesis conditions were established as follows: after thorough mixing of L-Hyp with CuSO4·5H2O at a molar ratio of 2.5:1 namely 10.5:8.0 (m/m), the reaction was triggered by adding 20 mL of water followed by addition of 5.6 g of anhydrous Na2CO3for acid removal under microwave irradiation for 180 s at 600 W, and then transferred to a pressurized reaction kettle at 90 ℃ and 15 MPa with an agitation speed of 100 r/min for 35 min. The composition and structure of the fi nal product were characterized by ultraviolet (UV) spectroscopy, infrared spectroscopy, X-ray diffraction (XRD), scanning electron microscope (SEM), coordination analysis, elemental analysis and gravimetry. Results indicated that this synthesis procedure gave higher chelate rate of L-Hyp-Cu(Ⅱ), reaching 86.4%. The chelating reaction between copper (Ⅱ) and carboxyl and imino groups in L-Hyp to fomr L-Hyp-Cu(Ⅱ) with a coordination ratio of 1:2, whose molecular formula was established as Cu(C5H8NO3)2.
Key words:L-hydroxyproline-Cu(Ⅱ); microwave-assisted solid-state method; pressurization; two-stage treatment; characterization
引文格式:
引文格式:
许先猛, 董文宾, 卢军, 等. 加压微波固相法制备L-羟脯氨酸-Cu(Ⅱ)及其结构表征[J]. 食品科学, 2017, 38(8): 213-219. DOI:10.7506/spkx1002-6630-201708033. http://www.spkx.net.cn
XU Xianmeng, DONG Wenbin, LU Jun, et al. Solid phase preparation and characterization of L-hdroxyproline-Cu(Ⅱ) under pressurized microwave irradiation[J]. Food Science, 2017, 38(8): 213-219. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201708033. http://www.spkx.net.cn
DOI:10.7506/spkx1002-6630-201708033
中图分类号:S872
文献标志码:A
文章编号:1002-6630(2017)08-0213-07
收稿日期:2016-07-30
基金项目:“十二五”农村领域国家科技计划课题(2012BAD12B07-05)
作者简介:许先猛(1984—),男,讲师,博士,主要从事功能食品开发研究。E-mail:xuxianmeng@sina.com
*通信作者:董文宾(1951—),男,教授,硕士,主要从事食品安全性与新材料制备研究。E-mail:dongwb@sust.edu.cn