王悦齐1,2,吴燕燕1,李来好1,*,杨贤庆1,王锡昌2,蔡秋杏3,赵永强1,魏 涯1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学食品学院,上海 201306;3.中国海洋大学食品科学与工程学院,山东 青岛 266000)
摘 要:将从传统腌干鱼中筛选出的3 株具有抗氧化活性乳酸菌(干酪乳杆菌、植物乳杆菌和戊糖片球菌)作为发酵剂加入到腌干带鱼中,测定pH值、过氧化值、酸值、硫代巴比妥酸值和正己醛含量等指标,以监测发酵腌干带鱼加工过程中脂肪的氧化程度,并分析了乳酸菌发酵对腌干带鱼成品脂肪酸组成的影响。结果表明,在腌干带鱼生产过程中抗氧化乳酸菌对不饱和脂肪酸的氧化有一定的抑制作用,接菌发酵的腌 干带鱼过氧化值、硫代巴比妥酸值、正己醛含量和饱和脂肪酸含量显著低于传统腌干带鱼,而酸值和不饱和脂肪酸含量高于传统腌干带 鱼。对测定的指 标进行主成分分析的结果表明,第1主成分能反映脂肪水解程度,其线性回归函数为:Y1=0.131X1+0.208X2+0.360X3+0.244X4+0.083X5-0.388X6+0.324X7+0.343X8;第2主成分能反映脂肪氧化程度,其线性回归函数为:Y2=0.330X1+0.406X2+0.182X3+0.440X4+0.294X5-0.205X6+0.135X7+0.157X8。本研究为提高发酵腌干鱼的安全性提供理论依据。
关键词:腌干鱼;乳酸菌;脂肪氧化;主成分分析
腌干鱼作为我国传统水产加工制品之一,由于其独特的风味,深受消费者的青睐[1-2]。据统计,2013年我国腌干制品总量为158万 t,约占水产品加工总量(1 954万t)的8.1%[3]。传统腌干鱼一般采用手工作坊式生产,主要是利用鱼肉自身携带的微生物在自然条件下进行发酵,生产周期较长,在腌制和热风干燥过程中极易发生脂肪水解与氧化反应。脂肪氧化对腌干鱼品质具有两面性,适度的脂肪氧化是腌干鱼形成醛、酮、醇、脂等风味化合物的重要途径,而过度的脂肪氧化则会引起强烈的哈喇味[4]。脂肪氧化与微生物的代谢有密切的关系,腐败菌如假单胞菌属(Pseudomonas)等能产生脂肪氧合酶,脂肪氧合酶会加速鱼体中不饱和脂肪酸的氧化从而导致产品发生酸败[5]。
有研究表明,通过定向接种发酵技术能够改进传统发酵制品的生产工艺,将分离自传统发酵制品的乳酸菌接种到产品中,能够缩短产品的生产周期和提高安全性[6],同时乳酸菌的抗氧化活性和抑菌性已得到广泛验证,因此利用微生物抗氧化是解决腌干鱼制品过度氧化的另一途径。Baka等[7]利用清酒乳杆菌(L. sakei 4413)等4 株菌对希腊香肠进行发酵,经过发酵后其成品的硫代巴比妥酸(thiobarbituric acid,TBARS)值比对照组降低了1 mg/kg,能有效控制香肠发生脂肪氧化。Kang等[8]报道了短乳杆菌BJ20发酵的海带能够显著降低志愿者血清中的丙二醛(malondialdehyde,MDA)含量,同时超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性也明显提高。
目前关于腌干鱼的研究主要集中在工艺优化、降解亚硝基化合物、风味比较和品质评价上,而运用主成分分析法综合探讨腌干鱼加工过程中脂肪氧化情况的研究鲜有报道。本研究对发酵腌干带鱼加工过程中的pH值、过氧化值(peroxide value,POV)、酸值(acid value,AV)、TBARS和正己醛含量进行跟踪检测,同时结合乳酸菌发酵对产品游离脂肪酸的影响,借助主成分分析法将测定的多个指标进行数据转换和降维,阐明抗氧化乳酸菌对腌干带鱼脂肪氧化的影响,以期为发酵腌干鱼加工技术提供理论依据。
1.1 材料与试剂
冰鲜带鱼 广州华润万家生活超市;3株具有抗氧化活性乳酸菌:干酪乳杆菌(Lactobacillus casei)、植物乳杆菌(Lactobacillus plantarum)和戊糖片球菌(Pediococcus pentosaceus)为农业部水产品加工重点实验室自行分离鉴定[9];1,1,3,3-四乙氧基丙烷、三氟化硼-甲醇溶液、十一烷酸标品 美国Sigma公司;2,4,6-三甲基吡啶(2,4,6-trimethylpyridine,TMP) 日本TCI公司;其他试剂均为分析纯。
1.2 仪器与设备
G C M S-Q P 2 0 1 0 p l u s气相色谱-质谱(g a s chromatography-mass spectrometry,GC-MS)联用仪、UV-2550紫外分光光度计 日本岛津公司;65 μm DVBPDMS萃取头 美国Supelco公司;809Titrando自动电位滴定仪 瑞士万通公司;BS224S分析天平 美国Sartorius公司;3k30冷冻离心机 美国Sigma公司;Five Easy Plus pH计 瑞士梅特勒-托勒多公司;T25均质机德国IKA公司;HH-4快速恒温数显水浴箱 常州澳华仪器公司。
1.3 方法
1.3.1 发酵腌干带鱼的制备与取样
将冰鲜带鱼去头去内脏,用流动水冲洗干净并去除差异较大的个体,待鱼体表面水分沥干后,将浓度为108CFU/g菌液接种至鱼体中(发酵温度(18±0.5)℃,相对湿度80%~90%),发酵6 h后将鱼体移入腌制池内,腌制温度为(10±1)℃,用盐量为8%,腌制16 h后取出,用清水脱盐漂洗2 h,补充接种108CFU/g的菌液后,在(25±2)℃条件下初烘发酵12 h,然后移入(30±2)℃的热泵除湿干燥箱中烘干水分至40%左右,包装称量即为成品。
选用干酪乳杆菌、植物乳杆菌、戊糖片球菌和混菌(植物乳杆菌-干酪乳杆菌-戊糖片球菌体积比1∶1∶1)发酵的腌干带鱼,传统法生产的腌干带鱼记为CK。在5个关键点进行取样,分别是原料、腌制、漂洗、初烘和成品,每个点取3尾鱼均匀绞碎后用真空包装置于-20 ℃冰箱备用。
1.3.2 pH值的测定
称取10 g样品于离心管中,加入90 mL去离子水,用高速均质机在1 000 r/min条件下均质1 min后,立即用pH计进行测定,每个样品重复3 次平行。
1.3.3 POV的测定
参照靳国锋[10]的方法,对发酵腌干带鱼的POV进行测定,每份试样测3次平行。
1.3.4 AV的测定
参照赵东豪等[11]的方法略做修改。精确称取(5.00±0.01)g试样于50 mL的离心管中,每份试样称3 次平行,加入15 mL乙醚-乙醇混合溶剂,超声提取15 min后,在4 ℃、6 000 r/min的条件下离心5 min,收集上清液,重复提取2 次,合并上清液于锥形瓶中,用Titrando自动电位滴定仪滴定。AV计算如式(1)所示:
式中:V为KOH标准溶液的体积/mL;C为KOH标准溶液的浓度/(mol/L);56.1为氢氧化钾的摩尔质量/(g/mol);m为称取的鱼肉质量/g。
1.3.5 TBARS值的测定
参照U l u[12]的方法略做修改。精确称取(5.00±0.01)g试样,加入25 mL 7.5%的三氯乙酸溶液,振摇30 min后过滤2 次,取5 mL滤液向其中加入5 mL的2-硫代巴比妥酸溶液(0.02 mol/L),置于沸水浴中加热反应40 min后,冷却至室温加5 mL三氯甲烷,静置分层后,取上清液于538 nm波长处测吸光度。MDA含量以1,1,3,4-四乙氧基丙烷标准曲线标定后计算。结果以mg/kg计,每份试样测3 次平行。
1.3.6 正己醛含量的测定
用固相微萃取(solid-phase microextraction,S P M E)-G C-M S联用法进行测定。精确称取(1.00±0.01)g搅碎的样品,加入0.2 μg内标物TMP和5 mL生理盐水置于15mL顶空瓶中,迅速封闭瓶口,插入已老化好的65 μm DVB-PDMS的萃取头,置于温度为60 ℃的磁力搅拌台上,吸附40 min。再插入GC-MS进样口进行解析,进样口温度为250 ℃,解析10 min。用CD-5MS(30 m×0.25 mm,0.25 μm)色谱柱对正己醛进行分离,采用流量为1.0 mL/min氦气作为载气,GC升温程序为:35℃保持1 min,以5 ℃/min的速率升温到60 ℃保持1 min,再以6 ℃/min上升到140 ℃保持1 min,最后以8 ℃/min速率升温到 230 ℃,保持5 min。MS离子源温度为200 ℃,电子能量为70 eV,质量扫描范围为m/z 35~350。根据检出的正己醛与内标物TMP的峰面积之 比,求出正己醛含量,计算如式(2)所示:
式中:P为正己醛与内标物TMP的峰面积之比;2为内标物TMP的质量/μg;M为称取的鱼肉样品质量/ g。
1.3.7 脂肪酸分析
脂肪的提取与甲酯化:按照Folch等[13]的方法,略作修改,提取液用氮气仪吹扫有机试剂,得到浓缩脂质。向浓缩脂质加入2 mL 14%三氟化硼-甲醇,在60 ℃水浴进行甲酯化反应30 min,冷却后加入1 mL正己烷和蒸馏水,振荡萃取后,吸取上层清液,过0.22 μm有机滤膜后,待GC-MS测定。用DB-5MS(30 m×0.25 mm,0.25 μm)色谱柱对正己醛进行分离,采用流量为1.52 mL/min氦气作为载气,GC升温程序为:110 ℃保持4 min,以10 ℃/min的速率升温到60 ℃保持1 min,再以6 ℃/min速率上升到140 ℃保持1 min,最后以8 ℃/min速率升温到160 ℃,保持1 min,最后以5 ℃/min的速率升到240 ℃,保持15 min。MS离子源温度为200 ℃,电子能量为70 eV,质量扫描范围为m/z 40~550,溶剂切除时间为3 min。将0.1 g十一烷酸内标物加入样品中,通过脂肪酸和内标物峰面积之比来计算脂肪酸含量,如式(3)所示:
式中:P为脂肪酸与十一烷酸的峰面积之比;10为内标物十一烷酸的质量/mg;M为称取的鱼肉样品质量/g。
1.4 数据处理和质谱检索
数据用Microsoft Excel 2010统计处理,利用SPSS 19.0软件进行差异显著性和主成分分析。利用NIST 05a. L谱库数据库检索,对比质谱图库中的标准谱图,分别确认正己醛和脂肪酸甲酯成分。
2.1 发酵腌干带鱼加工过程中pH值的变化
表1 发酵腌干带鱼加工过程中pH值的变化
Table 1 Changes in pH value in fermented dry-cured hairtail during processing
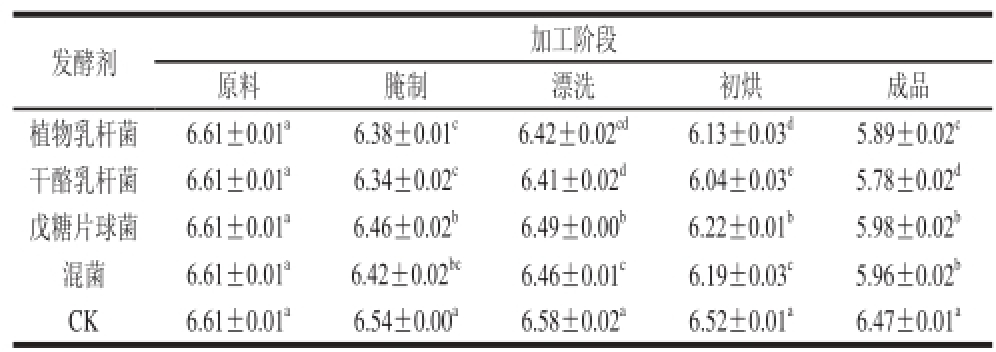
注:同列肩标字母不同表示差异显著(P<0.05),下同。
pH值不仅影响腐败菌和致病菌的生长,还对食品中内源酶的活性具有重要意义,是衡量食品风味和口感的重要指标[14]。由表1可以看出,不同样品组的腌干带鱼pH值随加工时间的延长呈下降的趋势,其中腌制阶段和初烘阶段下降最为明显,这主要是因为在腌制阶段乳酸菌接种到鱼肉中大量繁殖,分解鱼肉中的碳水化合物产生乳酸等酸类物质,从而快速降低鱼肉中的pH值,抑制其他腐败菌和致病菌的生长,达到快速发酵、缩短工艺时间的目的[6,15]。经过乳酸菌发酵的腌干带鱼pH值显著低于传统法腌干带鱼(P<0.05),干酪乳杆菌发酵的腌干带鱼pH值下降最为明显,由原料的6.61±0.01下降到5.78±0.02,而混菌发酵的腌干带鱼的pH值高于植物乳杆菌和干酪乳杆菌发酵的腌干带鱼,这可能是由于菌株间生长的相互竞争所致。传统腌干带鱼的pH值虽有下降,但仍维持在6.47±0.01较高的水平,接菌组的腌干带鱼的pH值低于传统法。
2.2 发酵腌干带鱼加工过程中POV的变化
表2 发酵腌干带鱼加工过程中POV的变化
Table 2 Changes in peroxide value in fermented dry-cured hairtail during processing
meq/kg
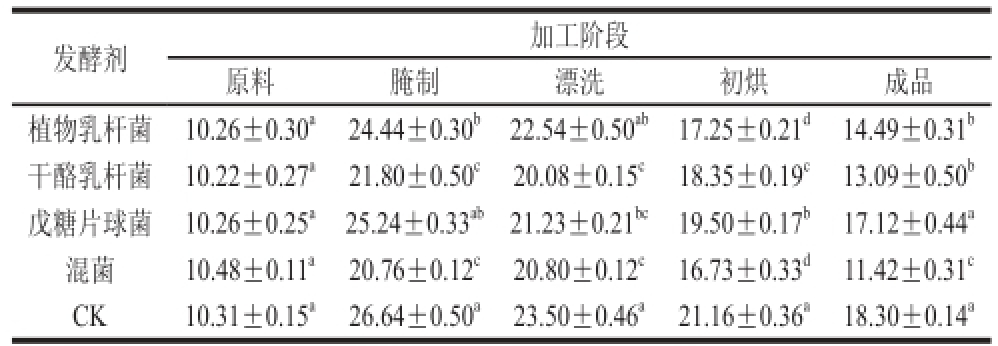
POV是衡量脂肪氧化过程中初级氧化的指标[16],不饱和脂肪酸容易发生链式反应生成氢过氧化物,氢过氧化物虽然不会对腌干鱼的风味造成直接影响,但却是异味有机物的前体物质,对反映脂肪酸初级氧化程度具有重要意义[17]。由表2可以看出,不同处理组的腌干带鱼随着加工时间的延长,鱼肉的POV呈先上升后下降的趋势,在腌制阶段就迅速发生氧化并出现了最高值,在后续的烘干发酵过程中POV逐渐下降,这主要是由于不饱和脂肪酸发生氧化反应生成的氢过氧化物具有不稳定性,容易分解生成醛酮等物质。在整个加工过程中,原料的POV平均值为10.30 meq/kg,接菌组和CK组的差异性显著(P<0.05),在成品阶段传统腌干带鱼(CK)的POV为(18.30±0.14)meq/kg,混菌发酵腌干带鱼的POV最低,为(11.42±0.31)meq/kg,比传统腌干带鱼(CK)降低了37.60%,而戊糖片球菌发酵的鱼肉和传统腌干带鱼(CK)差异性不明显。广式腊味制品中规定的腊鱼中POV不大于47.28 meq/kg,因此所有实验组均符合规定的卫生标准。接菌组的腌干带鱼的POV低于传统腌干带鱼,这可能是乳酸菌在生长过程中分泌CAT,对氢过氧化物具有分解作用,阻断过氧化物的形成[18],另外乳酸菌将碳水化合物降解为乳酸等物质,使得鱼体的pH值降低从而抑制脂肪酸氧化速率,使得接菌组的POV低于传统法生产的腌干带鱼。
2.3 发酵腌干带鱼加工过程中AV的变化
表3 发酵腌干带鱼加工过程中AV的变化
Table 3 Changes in AV value in fermented dry-cured hairtail during processing mg KOH/g

AV是对脂肪酸中游离羧酸基团数量的一个计量标准,能够衡量脂质水解程度的高低,其值越大反映游离脂肪酸含量越高[19-20]。由表3可知,不同样品组的腌干带鱼随着加工时间的延长,AV均呈现不断增高的趋势,这主要是由于脂肪的水解和氧化伴随着腌干带鱼整个加工过程,不饱和脂肪酸中的脂键在酶和微生物的作用下发生水解,生成游离脂肪酸和甘油,从而使得AV不断增大。进一步分析发现,接菌组和对照组的AV差异性显著(P<0.05),而接菌组间的AV差异性不显著。传统腌干带鱼成品的AV为(7.13±0.11)mg KOH/g,而接菌组则相对较高,AV在7.99~8.16 mg KOH/g之间,戊糖片球菌发酵的腌干带鱼AV最高为(8.16±0.11)mg KOH/g,比传统腌干带鱼高12.62%,这与预期的结果不一致。AV最早是作为衡量植物油氧化酸败程度的指标,但有学者提出在肉制品中AV反映的是脂肪水解程度而非脂肪氧化产物的数量[21]。乳酸菌发酵的腌干带鱼的AV高于传统法的鱼肉,可能是由于乳酸菌具有一定的脂肪酶活性,能够促进鱼体中脂肪发生水解生成游离脂肪酸,同时其发酵产酸作用在AV测定过程中会增加KOH的消耗量,从而使得AV偏高。
2.4 发酵腌干带鱼加工过程中TBARS值的变化
表4 发酵腌干带鱼加工过程中TBARS值的变化
Table 4 Changes in TBARS values in fermented dry-cured hairtail during processing
mg/kg
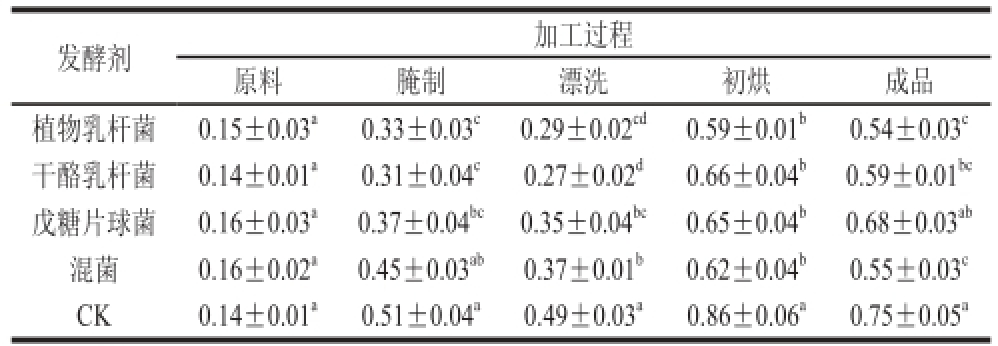
TBARS与脂肪氧化中间衍生产物MDA发生缩合反应,生成的红色物质在波长532 nm处有最大吸收,TBARS值能够衡量脂肪氧化程度[22-23]。加工过程中发酵腌干带鱼TBARS值的变化见表4。不同样品组的TBARS值随着加工进程呈波动上升,在腌制阶段和初烘阶段出现两个峰值,波动上升主要是由于加工过程中氧化产物MDA的不断积累,同时又与氨基结合生成1-氨基-3-氨基丙烯。在初烘阶段TBARS值均出现最高值,这可能是由于伴随水分的流失,鱼体中的脂肪从内部渗透至鱼体表面,加速脂肪与氧气的接触使其氧化速率加快。原料的TBARS值在0.15 mg/kg左右,在成品阶段传统腌干带鱼TBARS值增加至0.75 mg/kg,接菌组则增加的相对缓慢,TBARS值为0.54~0.68 mg/kg,由此可知传统法生产的腌干带鱼TBARS值显著高于各接菌组(P<0.05),经过植物乳杆菌发酵的腌干带鱼TBARS值最低,比传统法腌干带鱼降低了28%。Zeng Xuefeng等[24]也发现采用发酵剂(L. plantarum 120,P. pentosaceus 220,S. cerevisiae 22)接种于酸鱼,接种发酵剂组的酸鱼TBARS值增加的较为缓慢,由此推测微生物发酵剂可能对不饱和脂肪酸有抗氧化作用。
2.5 发酵腌干带鱼加工过程中正己醛含量的变化
表5 发酵腌干带鱼加工过程中正己醛含量的变化
Table 5 Changes in hexanal content in fermented dry-cured hairtail during processing
ng/g

正己醛作为腌制食品中主要的氧化产物,主要来源于ω-6不饱和脂肪酸的氧化,其在低含量时会呈现青草蔬菜香味,而含量过高时则会产生强烈的哈喇味[25],正己醛是性质比较稳定且含量较高的挥发性物质,能作为氧化指标评价腌干鱼氧化程度。由表5可知,在腌干带鱼整个生产过程中正己醛含量和TBARS值变化趋势基本一致,在整个加工过程中呈波动上升的趋势,在腌制阶段和初烘阶段氧化程度最为明显,这可能是腌制和初烘期间,脂肪酸烷氧自由基发生分解使得醛类物质增加,同时蛋白质水解产生大量的游离氨基酸,氨基酸发生氧化生成正己醛等化合物。原料的正己醛含量平均值为180 ng/g左右,在成品阶段传统腌干带鱼正己醛含量为(907.99±8.71)ng/g,而经过植物乳杆菌、干酪乳杆菌和戊糖片球菌混合发酵的腌干带鱼中正己醛含量仅为(619.49±3.95)ng/g,比传统法腌干带鱼降低了31.77%。有学者研究不同腌制方法对腌干鱼风味的影响,发现乳酸菌发酵不仅能缩短鱼肉的腌制时间,还能赋予鱼肉特有的风味,提升产品的品质和安全性,低盐发酵法生产的红牙或鱼正己醛含量显著低于传统法生产的腌干红牙或鱼[25],这与本研究结果一致。
2.6 发酵腌干鱼脂肪酸成分分析
表6 发酵腌干带鱼中的脂肪酸组成含量
Table 6 Fatty acid composition in fermented dry-cured hairtail mg/g
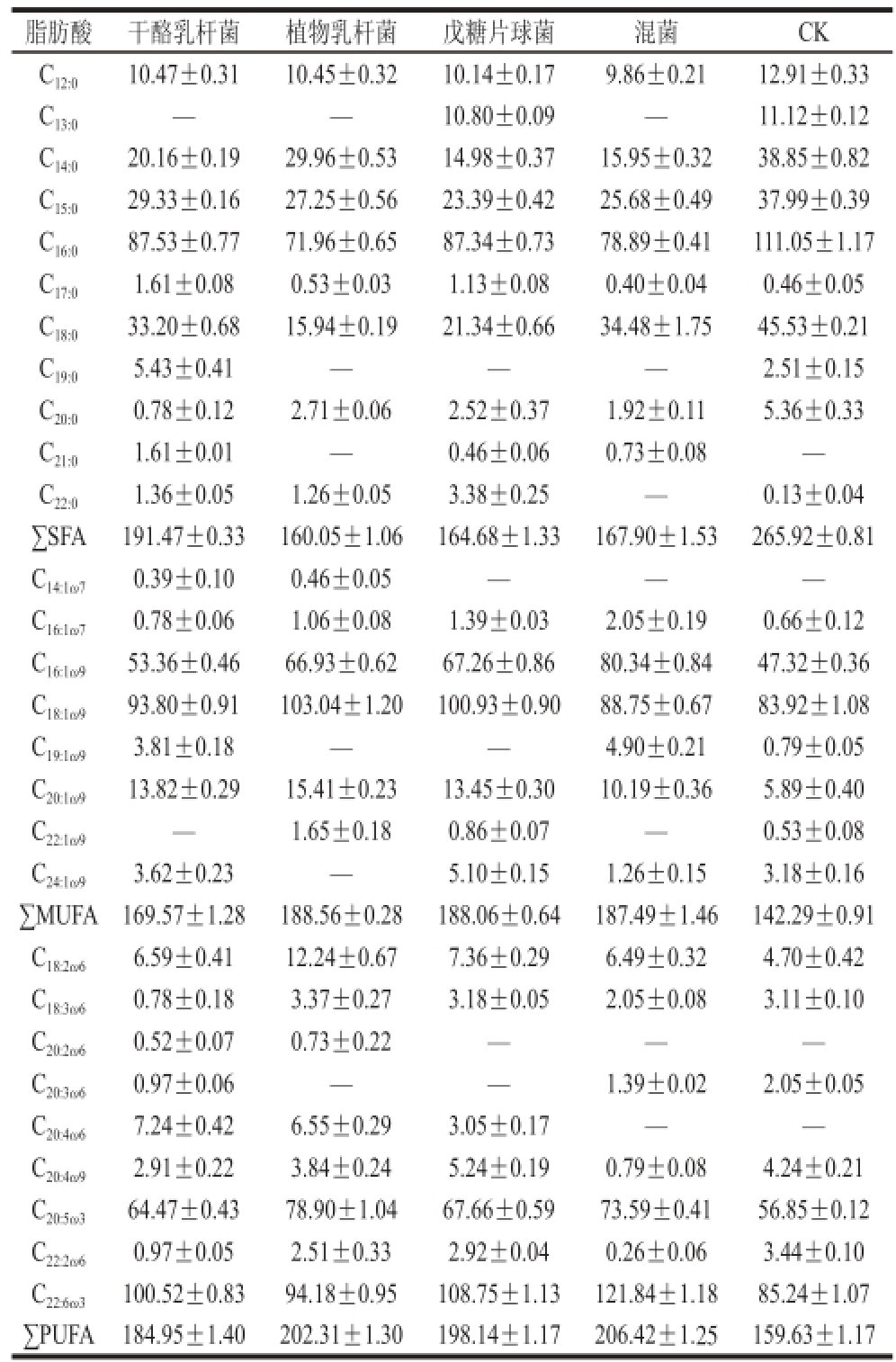
注:.未检出。
游离脂肪酸作为挥发性风味物质的前体,对风味的形成具有重要的作用[26]。在游离脂肪酸的成分中,ω-3系列不饱和脂肪酸如二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexenoic acid,DHA)作为脑神经的重要营养成分,可以提高脑细胞活力、促进儿童脑部发育和延缓智力下降[27-29]。由表6可知,5种发酵腌干带鱼共检出28 种脂肪酸,其中饱和脂肪酸(saturated fatty acid,SFA)11 种,含量(0.13±0.04)~(111.05±1.17 )mg/g,含量较高的有肉豆蔻酸(C14:0)、十五烷酸(C15:0)、棕榈酸(C16:0)及硬脂酸(C18:0);单不饱和脂肪酸(monounsaturated fatty acids,MUFA)8 种,含量(0.53±0.08)~(103.04±1.20)mg/g,含量较高的有棕榈油酸(C16:1ω9)和油酸(C18:1ω9);多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)9 种,含量(0.26±0.06)~(121.84±1.18)mg/g,含量较高的有亚油酸(C18:2ω6)、花生四烯酸(C20:4ω6)、EPA(C20:5ω3)及DHA(C22:6ω3)。进一步分析表6可知,SFA含量最低的是植物乳杆菌发酵腌干带鱼为(160.05±1.06)mg/g,约为传统腌干带鱼的40%;植物乳杆菌、戊糖片球菌和混菌发酵这3 种发酵腌干带鱼MUFA的含量差异不大,其中最高的是植物乳杆菌发酵腌干带鱼,其MUFA含量比传统腌干带鱼约高出25%;PUFA含量最高的是混菌发酵腌干带鱼为(206.42±1.25) mg/g,PUFA含量比传统腌干带鱼约高出23%,尤其是具有功能性的ω-3不饱和脂肪酸EPA和DHA增加明显,这可能是在酶和微生物的共同作用下引起的。另外,接菌发酵的腌干带鱼的SFA含量均要低于传统腌干带鱼,而MUFA和PUFA的含量均显著高于传统腌干带鱼(P<0.05),可能是乳酸菌发酵在一定程度上对不饱和脂肪酸有抗氧化作用,但不饱和脂肪酸的变化还与脂肪酸的空间构效和双键位置有关,因此乳酸菌对不饱和脂肪酸的抗氧化机理有待进一步研究。
2.7 不同评价指标主成分分析

图1 主成分分析碎石图
Fig. 1 Scree plot of principal component analysis
表7 总方差解释
Table 7 Total variance explained

主成分分析目的是利用原变量间具有较强的相关性的特点,将测定的多个指标进行数据转换和降维,并对降维后的特征向量进行线性变换,用少量的因素来描述多种指标或因素之间的关系[30-31]。该研究利用SPSS 19.0软件进行主成分分析,对不同乳酸菌发酵的腌干带鱼成品的pH值、POV、AV、TBARS值、正己醛含量、SFA含量、MUFA含量和PUFA含量8 个指标进行数据转换和降维。碎石图能够确定最优的主成分数目,其横坐标为主成分数目,纵坐标为特征值,主成分特征值的陡曲线在开始平坦线趋势的第一个点即为应取的主成分数目。如图1可以看出,第1主成分特征值很高,对解释原有变量的贡献最大,第3个以后的主成分特征值都较小,对解释原有变量的贡献很小,因此提取两个主成分是合适的。
由表7得出主成分及方差贡献率,第1主成分特征值为6.750,贡献率为84.372%,第2主成分特征值为0.867,贡献率为10.834%,两个成分累计贡献率可以达到90%以上,说明用这2 个主成分能较好地代替上述9 项脂肪氧化特性指标来评价抗氧化乳酸菌对低盐发酵腌干带鱼脂肪氧化的影响。但进一步分析主成分载荷矩阵发现,8 个变量在第1主成分上的载荷值接近0.9,意味着它们与第1主成分的相关程度高,第2主成分与原有变量的相关性均较小,它对原有变量的解释作用不显著,因此采取了正交旋转法对分析方法进一步优化,获得旋转后的主成分载荷矩阵以及主成分散点图,旋转后第1主成分贡献率为49.148%,第2主成分贡献率为46.058%,两个成分累计贡献率同样为95.206%,证明不影响数据的原始性。
表8 主成分载荷矩阵
Table 8 Principal component loading matrix
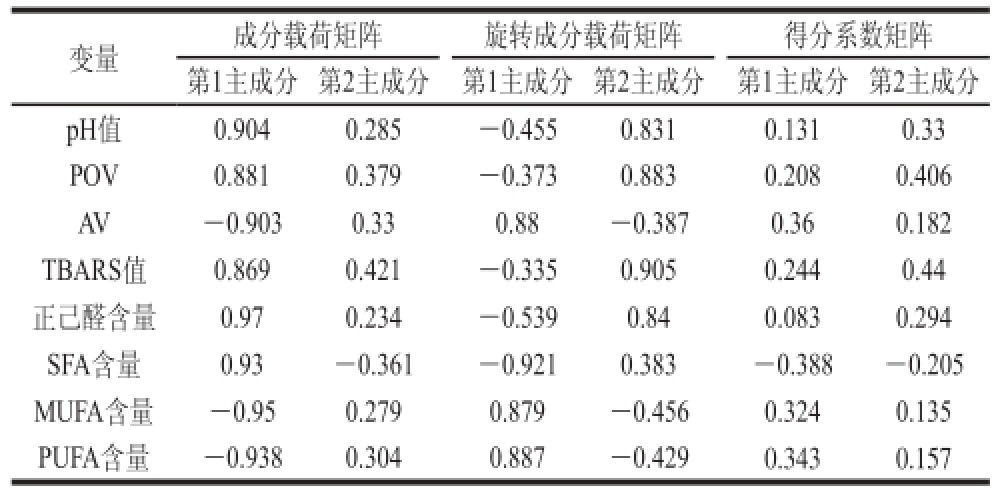
表8反映不同变量在两个主成分上的旋转载荷值,结果发现,与第1主成分相关性较大的变量是AV、MUFA含量和PUFA含量,与第2主成分相关性较大的变量是TBARS值、POV、pH值和正己醛含量。由此看出,第1主成分主要反映发酵腌干带鱼的脂肪水解程度,第2主成分则反映发酵腌干带鱼的脂肪氧化程度。得分系数表示各个指标对主成分的影响程度,通过得分系数可以将各个变量进行线性组合,建立关于第1主成分(Y1)、第2主成分(Y2)与pH值(X1)、POV(X2)、AV(X3)、TBARS值(X4)、正己醛含量(X5)、SFA含量(X6)、MUFA含量(X7)和PUFA含量(X8)这8个变量的得分系数模型,因此第1主成分可以提取为:Y1=0.131X1+0.208X2+0.360X3+0.244X4+0.083X5-0.388X6+0.324X7+0.343X8;第2主成分可以提取为:Y2=0.330X1+0.406X2+0.182X3+0.440X4+0.294X5-0.205X6+0.135X7+0.157X8。

图2 发酵腌干带鱼脂肪氧化与脂肪水解主成分分析图
Fig. 2 Principal component analysis of lipid oxidation and lipid hydrolysis of fermented dry-cured hairtail
图2 为主成分散点图,以十字交叉点为顶点,pH值、POV、TBARS值、正己醛含量和SFA含量在第2象限,AV、MUFA含量和PUFA含量在第4象限,通过变量在图中的相对位置解释变量间的相关性。SFA含量与脂肪氧化指标POV、TBARS值和正己醛含量呈正相关,而与AV呈负相关,这也就解释为什么发酵腌干带鱼的AV高于传统腌干带鱼(P<0.05),而其他脂肪氧化指标均比传统腌干带鱼低(P<0.05),这主要是由于乳酸菌具有一定的脂肪酶活性,能够促进鱼体中脂肪发生水解生成游离脂肪酸,同时乳酸菌对不饱和脂肪酸有一定的抗氧化作用,故使其SFA含量较低,而MUFA含量和PUFA含量较高,李贺楠等[21]对120 种腌腊肉制品的AV和POV的变化趋势进行分析,发现AV与产品氧化变质趋势没有明显的相关性,由此判定AV反映的是脂肪水解程度而非脂肪氧化产物的数量。另外,pH值也与脂肪氧化指标POV、TBARS值和正己醛含量呈正相关,而与AV呈负相关,这表明乳酸菌发酵产酸作用能抑制产生脂肪氧合酶的假单胞菌的生长,使得POV等脂肪氧化指标较低,同时其发酵产酸作用在AV测定过程中会增加KOH的消耗量,造成AV偏高。AV、MUFA含量和PUFA含量与第1主成分呈正相关,反映了腌干带鱼脂肪水解程度,pH值、POV、TBARS值、正己醛含量和SFA含量与第2主成分呈正相关,反映了腌干带鱼脂肪氧化程度,然而关于脂肪水解程度与脂肪氧化之间的关系,Muriel等[32]认为脂肪水解与氧化之间存在显著的相关性,脂肪水解在一定程度上能促进脂肪氧化,由于脂肪水解会产生游离脂肪酸,游离脂肪酸比脂质更容易被氧化,这与本研究结果不一致。本研究发现脂肪水解与脂肪氧化的指标相关性较弱,这可能是水解与氧化是两个动态平衡过程存在于腌干带鱼的整个加工工程,乳酸菌发酵能加速鱼肉中脂肪的水解程度,但乳酸菌生长过程中也会分泌含有SOD、NADH和CAT等抗氧化酶具有协同作用,能够消除自由基对不饱和脂肪酸的氧化攻击作用,因此关于乳酸菌对腌干鱼制品脂肪水解与脂肪氧化的关系有待进一步研究。
随着加工时间的延长,鱼肉的pH值呈下降的趋势,接菌发酵的腌干带鱼pH值显著低于传统腌干带鱼(P<0.05)。在腌干鱼加工过程中,抗氧化乳酸菌对腌干鱼不饱和脂肪酸的氧化有一定的抑制作用,从POV、TBARS值和正己醛含量看,接菌发酵的腌干带鱼显著低于传统法腌制的鱼肉(P<0.05),POV呈先上升后下降的趋势,TBARS值和正己醛含量变化一致,呈波动上升的趋势。从AV看,接菌发酵的腌干带鱼的AV高于传统法腌制的鱼肉(P<0.05),而接菌组间的AV差异性不显著。接菌发酵的腌干带鱼的SFA含量均要低于传统腌干带鱼,而MUFA和PUFA的含量均显著高于传统腌干带鱼(P<0.05),尤其是具有功能性的ω-3不饱和脂肪酸EPA和DHA增加明显。利用主成分分析法对测定的数据进行转换和降维,第1主成分相关性较大的变量是AV、MUFA含量和PUFA含量,与第2主成分相关性较大的变量是TBARS值、POV、pH值和正己醛含量。
参考文献:
[1] 任中阳, 吴燕燕, 李来好, 等. 腌干鱼制品热泵干燥工艺参数优化[J]. 南方水产科学, 2015, 11(1): 81-88. DOI:10.3969/ j.issn.2095-0780.2015.01.012.
[2] 游刚, 吴燕燕, 李来好, 等. 添加复合乳酸菌再发酵对腌干鱼肉微生物亚硝酸盐和亚硝胺的影响[J]. 南方水产科学, 2015, 11(4): 109-115. DOI:10.3969/j.issn.2095-0780.2015.01.012.
[3] 农业部渔业渔政管理局. 2014年渔业年鉴[M]. 北京: 中国农业出版社, 2014.
[4] SAMPAIO G, SALDANHA T, SOARES R, et al. Effect of natural antioxidant combinations on lipid oxidation in cooked chicken meat during refrigerated storage[J]. Food Chemistry, 2012, 135(3): 1383-1390. DOI:10.1016/j.foodchem.2012.05.103.
[5] CASABURI A, MONACO R D, CAVELLA S, et al. Proteolytic and lipolytic starter cultures and their effect on traditional fermented sausages ripening and sensory traits[J]. Food Microbiology, 2007, 25(2): 335-347. DOI:10.1016/j.fm.2007.10.006.
[6] 曾雪峰. 淡水鱼发酵对酸鱼品质影响的研究[D]. 无锡: 江南大学, 2013.
[7] BAKA A, PAPAVERGOU E, PRAGALAKI T, et al. Effect of selected autochthonous starter cultures on processing and quality characteristics of greek fermented sausages[J]. LWT-Food Science and Technology, 2011, 44(1): 54-61. DOI:10.1016/j.lwt.2010.05.019.
[8] KANG Y M, LEE B, KIM J I, et al. Antioxidant effects of fermented sea tangle (Laminaria japonica) by Lactobacillus brevis Bj20 in individuals with high level of γ-GT: a randomized, double-blind, and placebo-controlled clinical study[J]. Food and Chemical Toxicology, 2012, 50(3): 1166-1169. DOI:10.1016/j.fct.2011.11.026.
[9] 王悦齐, 李来好, 蔡秋杏, 等. 分离自腌干鱼的抗氧化发酵菌株的筛选及鉴定[J]. 南方水产科学, 2016, 12(3): 74-83. DOI:10.3969/ j.issn.2095-0780.2016.03.010.
[10] 靳国锋. 干腌培根加工过程中脂质氧化调控机制研究[D]. 南京: 南京农业大学, 2011.
[11] 赵东豪, 黎智广, 杨金兰, 等. 水产品中酸价测定方法的研究[J]. 南方水产科学, 2009, 5(5): 72-74. DOI:10.3969/j.issn.1673-222 7.2009.05.013.
[12] ULU H. Evaluation of three 2-thiobarbituric acid meth ods for the measurement of lipid oxidation in various meats and meat products[J]. Meat Science, 2004, 67(4): 683-687. DOI:10.1016/ j.meatsci.2003.12.014.
[13] FOLCH J, LEES M, STANL G H S. A simple method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[14] BA H V, AMNA T, HWANG I. Significant influence of particular unsaturated fatty acids and pH on the volatile compounds in meat-like model syst ems[J]. Meat Science, 2013, 94(4): 480-488. DOI:10.1016/ j.meatsci.201 3.04.029.
[15] HUGAS M, MONFORT J M. Bacterial starter cultures for meat fermentation[J]. Food Chemistry, 1997, 59(4): 547-554. DOI:10.1016/ S0308-8146(97)00005-8.
[16] 李婷婷, 丁婷, 胡文忠, 等. 冷藏大西洋鲑背腹部鱼片脂肪氧化变化规律及货架期模型的建立[J]. 水产学报, 2015, 39(2): 265-274.
[17] 张燕平, 岑琦琼, 戴志远, 等. 梅鱼热风干燥工艺模型及脂肪氧化规律初探[J]. 中国食品学报, 2013, 13(9): 39-47.
[18] 田丰伟. 缓解氧化应激乳酸菌的筛选、表征和功能评价研究[D].无锡: 江南大学, 2012.
[19] WARDHANI D, FUCIÑ OS P, VÁ ZQUEZ J, et al. Inhibition kinetics of lipid oxidation of model foods by using antioxidant extract of fermented soybeans[J]. Food Chemistry, 2013, 139(1): 837-844. DOI:10.1016/j.foodchem.2013.01.049.
[20] 申雷. 茶多酚分子修饰改性及其对中式培根抗氧化作用的研究[D].南京: 南京农业大学, 2011.
[21] 李贺楠, 时宏霞, 李莹莹, 等. 传统腌腊肉制品酸价和过氧化值指标适用性[J]. 肉类研究, 2014, 28(1): 17-21.
[22] HALLDORSDOTTIR S M, KRISTINSSON H G, SVEINSDOTTIR H, et al. The effect of natura l antioxidants on haemoglobinmediated lipid oxidation during enzymatic hydrolysis of cod protein[J]. Food Chemistry, 2013, 141(2): 914-919. DOI:10.1016/ j.foodchem.2013.03.101.
[23] 付湘晋, 贺海翔, 许时婴, 等. 酵母细胞液处理对白鲢鱼鱼糜脂肪氧化和风味的影响[J]. 食品科学, 2010, 31(15): 95-99.
[24] ZENG X, XIA W, JIANG Q, et al. Effect of autochthonous starter cultures on microbiological and physico-chemical characteristics of Suan Yu, a traditional chinese low salt fermented fi sh[J]. Food Control, 2013, 33(2): 344-351. DOI:10.1016/j.foodcont.2013.03.001.
[25] 吴燕燕, 游刚, 李来好, 等. 低盐乳酸菌法与传统法腌干鱼制品的风味比较[J]. 水产学报, 2014, 38(4): 600-611. DOI:10.3724/ SP.J.1231.2014.49049
[26] KANG G, CHO S, SEONG P, et al. Effects of high pressure processing on fatty acid composition and volatile compounds in Kor ean native black goat meat[J]. Meat Science, 2013, 94(4): 495-499. DOI:10.1016/ j.meatsci.2013.03.034.
[27] CI L, LIU Z, GUO J, et al. The infi uence of ma ternal dietary fat on the fatty acid composition and lipid metabolism in the subcutaneous fat of progeny pigs[J]. Meat Scien ce, 2015, 108(10): 82-87. DOI:10.1016/ j.meatsci.2015.05.027.
[28] QIU C, ZHAO M, SUN W, et al. Changes in lipi d composition, fatty acid profile and lipid oxidative stability during cantonese sau sage processing[J]. Meat Science, 2013, 93(3): 525-532.
[29] 刘冬敏, 王建辉, 刘永乐, 等. 草鱼肌肉脂肪酸组成及其在冷藏中的含量变化[J]. 食品科学, 2013, 34(2): 194-198.
[30] NUR A T, CHE M Y, RN R M H, et al. Use of principal component analysis for differentiation of ge latine sources based on polypeptide molecular weights[J]. Food Chemistry, 2014, 151(5): 28 6-292. DOI:10.1016/j.foodchem.2013.11.066.
[31] GUILLÉN-CASLA V, ROSALES-CONRADO N, LEÓNGONZÁLEZ M E, et al. Principal component analysis (PCA) and multiple linear regression (MLR) statistical tools to evaluate the effect of E-beam irradiation on ready-to-eat food[J]. Journal of Food Composition and Analysis, 2011, 24(3): 456-464. DOI:10.1016/ j.jfca.2010.11.010.
[3 2] MURIEL E, ANDRES A, PETRON M, et al. Lipolytic and oxidative changes in iberian dry-cured loin[J]. Meat Science, 2007, 75(2): 315-323. DOI:10.1016/j.meatsci.2006.07.017.
Effect of Antioxidant Lactic Acid Bacteria on Lipid Hydrolysis and Oxidation of Dry-Cured Hairtail: a Study Using Principal Components Analysis
WANG Yueqi1,2, WU Yanyan1, LI Laihao1,*, YANG Xianqing1, WANG Xichang2, CAI Qiuxing3, ZHAO Yongqiang1, WEI Ya1
(1. Key Lab of Aquatic Product Processing, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 2. College of Food Science & Technology, Shanghai Ocean University, Shanghai 201306, China; 3. College of Food Science and Engineering, Ocean University of China, Qingdao 266000, China)
Abstract:Three lactic acid bacterial (LAB) strains (namely Lactobacillus casei, Lactobacillus plantarum and Pediococcus pentosaceus) with antioxidant activities, screened from traditional dry-cured fi sh, were used as starter culture to ferment drycured hairtail. The changes in lipid oxidation of dry-cured fermented hairtail during processing were determined in terms of pH value, peroxide value, acid value, thiobarbituric acid reactive substances (TBARS) value and hexanal content. Moreover, the effect of LAB fermentation on the fatty acid composition of dry-cured hairtail was analyzed. All indices were analyzed by principal component analysis (PCA) eventually. The results indicated that LAB fermentation could inhibit the oxidat ion of unsaturated fatty acids. The peroxide value, TBARS value, hexanal content and staturated fatty acid content of fermented dry-cured hairtail were signifi cantly lower than those of traditional dry-cured hairtail, but the acid value and unsaturated fatty acid content were signifi cantly higher than those of traditional dry-cured hairtail. The fi rst principal component refi ected the degree of lipolysis, while the second principal component reflected the degree of lipid oxidation. And the principal component functions were Y1= 0.131X1+ 0.208X2+ 0.36 0X3+ 0.244X4+ 0.083X5− 0.388X6+ 0.324X7+ 0.343X8and Y2= 0.330X1+ 0.406X2+ 0.182X3+ 0.440X4+ 0.294X5− 0.205X6+ 0.135X7+ 0.157X8, respectively. These results provide a good theoretical basis for controlling the safety of fermented dry-cured fi sh.
Key words:dry-cured fi sh; lactic acid bacteria; lipid ox idation; principal component analysis
DOI:10.7506/spkx1002-6630-201708036
收稿日期:2016-05-05
基金项目:国家自然科学基金面上项目(31571869;31371800);广东省海洋渔业科技与产业发展专项(A201501C02);广东省海洋渔业科技推广专项(A201301C01)
作者简介:王悦齐(1990—),男,硕士研究生,研究方向为水产品加工与质量安全。E-mail:ayueqiwang@163.com
*通信作者:李来好(1963—),男,研究员,博士,研究方向为水产品加工与质量安全。E-mail:laihaoli@163.com
中图分类号:Q946.5
文献标志码:A
文章编号:1002-6630(2017)08-0231-08
引文格式:
王悦齐, 吴燕燕, 李来好, 等. 抗氧化乳酸菌对发酵腌干带鱼脂肪氧化的影响及其主成分分析[J]. 食品科学, 2017, 38(8): 231-238. DOI:10.7506/spkx1002-6630-201708036. http://www.spkx.net.cn
WANG Yueqi, WU Yanyan, LI Laihao, et al. Effect of antioxidant lactic acid bacteria on lipid hydrolysis and oxidation of dry-cured hairtail: a study using principal components analysis[J]. Food Science, 2017, 38(8): 231-238. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201708036. http://www.spkx.net.cn