
图1 ENR人工抗原合成技术路线
Fig. 1 Synthetic route of BSA-ENR and OVA-ENR conjugates
杨 熠1,孟坤杰1,赵红琼1,米克热木·沙衣布扎提1,张小莺1,2,*
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.西北农林科技大学动医学院,陕西 杨凌 712100)
摘 要:为检测动物源性食品中恩诺沙星残留量,评估基于卵黄抗体的间接竞争酶联免疫吸附法检测恩诺沙星的可行性,用活性脂法将恩诺沙星同卵清蛋白偶联制备免疫原和包被抗原并用紫外光谱进行验证。用聚乙二醇-6000提取卵黄抗体。五免之后效价达到峰值1∶32 000。用间接竞争酶联免疫吸附法确定包被原质量浓度、卵黄抗体的稀释倍数和IC50分别为38 ng/mL、1∶64 000和18.207 ng/mL,回归曲线方程为y=0.891 1-0.016 5x(R2=0.990)。结果表明,制备的抗恩诺沙星卵黄抗体为进一步建立检测动物源性食品中恩诺沙星的残留的免疫方法提供参考依据。
关键词:恩诺沙星;卵黄抗体;药物残留;酶联免疫吸附法
恩诺沙星(enrofloxacin,ENR)属于第2代氟喹诺酮类抗生素,其已经在预防和治疗动物疾病中被广泛使用[1-3]。但在动物养殖中,一些人为了获取更大经济利益,往往通过滥用抗生素(如随意加大抗生素使用剂量)促进动物生长或不遵循动物休药期随意使用抗生素,以致使抗生素残留在动物源食品中成为一个普遍现象,进而严重威胁着人类健康。大量文献研究已证明,食品中残留的ENR能够造成消化系统、神经系统和泌尿生殖系统等系统的不良反应以及过敏反应[4]。此外,欧盟和中国也规定了动物源性食品中ENR的最大残留检测限为0.3 μg/g[5]。因此,为了保障人类健康和食品安全,建立一种新的、快速的检测动物源食品中ENR的残留的方法是必不可少的。
目前,已建立检测食品中ENR的残留已存在很多种,如高效液相色谱法[1]、毛细管电泳法[6-7]、免疫条生物传感器系统[8]、液相色谱-串联质谱法[9]、基于单克隆抗体的酶联免疫吸附(enzyme-linked immunosorbent immunoassay,ELISA)法[10]。虽然有些方法比较灵敏、精确,但其存在费用昂贵、检测时间长、技术要求高等缺点,也不适合快速检测大量样品。相反,建立以ELISA为基础的检测动物源性食品中ENR残留量的方法操作简单、灵敏、快速,只需对操作人员进行简单培训,即可独立完成检测,具有良好的发展前景。
卵黄抗体(IgY)是一种功能上等同于鸟类、爬行类、哺乳动物血液中的免疫球蛋白,其从免疫后的母鸡产的蛋中分离提取得到,IgY抗体的生产使用价廉同时符合动物福利要求。研究发现IgY并不和哺乳动物的Fc片段反应,因而更有效地降低了交叉反应的副作用[11-12]。目前,基于IgY抗体建立的间接竞争ELISA(indirect competitive ELISA,ic-ELISA)法已广泛应用在药物残留和病原菌检测中,如用IgY抗体作为检测抗体,通过ELISA检测抗乙肝抗体[13]。这种方法也已成功地应用于犬细小病毒和氟苯尼考胺残留量的检测[14-15]。然而,调查研究发现该方法还并未应用在动物源性食品中ENR的残留检测。因此,本实验旨在建立一种基于IgY抗体的ic-ELISA方法,进而为进一步应用检测动物源性食品中ENR的残留提供理论依据。
1.1 材料与试剂
ENR 西乡药业公司;牛血清白蛋白(bovine albumin,BSA,纯度99%) 科邦生物科技有限公司;鸡卵白蛋白(ovalbumin,OVA,纯度99%) 美国Sigma公司;氯化钠、磷酸二氢钾、磷酸氢二钠、氯化钾、氢氧化钠、盐酸 成都市科隆化工试剂厂公司。
1.2 仪器与设备
SPECORD 50 PLUS紫外分光光度仪 德国耶拿公司;Elx800酶标仪 美国伯腾仪器有限公司;HJ-3恒温磁力搅拌器 常州国华电器有限公司;TGL-20M离心机上海卢湘仪离心机仪器有限公司。
1.3 方法
1.3.1 ENR抗原的制备

图1 ENR人工抗原合成技术路线
Fig. 1 Synthetic route of BSA-ENR and OVA-ENR conjugates
ENR末端有羧基,采用活性脂法进行合成[16](图1)。准确称取37.1 mg ENR半抗原,溶于N,N-二甲基甲酰胺(N,N-dimethyl formamide,DMF),加热至澄清透明;另取一个2 mL环氧树脂管(Epoxy epoxide,EP管),加入80 mg二环己基碳二亚胺(dicyclohexylcarbodiimide,D C C),融于1 m L D M F,将上述两者缓缓地加到一起,再加入8 5 m g N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS),室温搅拌1 h,4 ℃过夜。次日,5 000 r/min离心10 min,取上清液。称取BSA 100 mg、OVA 100 mg分别溶于4 mL磷酸盐缓冲液(phosphate buffer saline,PBS,0.01 mol/L,pH 7.4),取2/3活性脂液,冰盐浴条件下逐滴滴加到BSA溶液中。剩下的1/3活性脂液,冰盐浴条件下逐滴滴加到OVA溶液中,室温避光反应2 h,于4 ℃冰箱缓慢搅拌过夜。将反应液装入透析袋,用PBS于4 ℃冰箱透析(每4 h换一次透析液,最后一次用灭菌水透析),直至紫外扫描透析外液中无半抗原紫外吸收为止。取出透析袋中溶液,分装后冷冻干燥,于-20 ℃冰箱保存备用。
1.3.2 合成产物的鉴定
1.3.2.1 紫外分光光度计扫描鉴定
精确称取BSA、OVA和ENR各10 mg,分别溶于10 mL PBS,用紫外分光光度计分别扫描BSA、OVA、ENR、ENR-BSA和ENR-OVA的吸光度。
1.3.2.2 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDSPAGE)鉴定
采用SDS-PAGE(5%的上层胶和12%的下层胶),对已合成的ENR-BSA和ENR-OVA鉴定。
1.3.3 动物免疫
选取2 只健康状况良好的25 周龄白来航鸡,在动物房适应性饲养1 周。分别取250 μL ENR-BSA和ENR-OVA抗原与等体积的弗氏完全佐剂乳化后,采用六点法每点0.1 mL对鸡胸部肌肉注射。然后于第21、35、49天和63天用弗氏不完全佐剂乳化对鸡加强免疫。首免后开始收集鸡蛋,4 ℃保存备用。
1.3.4 IgY抗体的分离与纯化
采用聚乙二醇-6000(Macrogol 6000,PEG-6000)法提取IgY[17]。以卵黄液1∶2与无菌的0.01 mol/L PBS稀释,混匀后加总体积的3.5%的PEG-6000,充分混匀后于摇床室温作用40 min。混合液10 000×g、4 ℃离心30 min,用滤纸过滤回收上清液,再加滤液体积8.5%的PEG-6000,摇床室温作用30 min 后, 4 ℃、10 000×g离心25 min,弃上清液收集沉淀用10 mL PBS重悬,加12%的PEG-6000,摇床室温作用30 min,4 ℃、10 000×g离心20 min,弃上清液收集沉淀用1.2 mL PBS重悬,在PBS中透析24 h,并用SDS-PAGE鉴定提取结果,抗体分装后于-20 ℃冰箱保存备用[18]。
1.3.5 ic-ELISA的优化
棋盘法确定最佳抗原包被质量浓度[19]。在96 孔酶标板上包被不同质量浓度的包被原ENR-OVA(ENRBSA)(1 200、600、300、150、75、37.5、19.75、9.875 ng/mL),加入用PBS稀释成不同质量浓度梯度(1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000)纯化后的抗ENR的IgY。抗原包被于4 ℃过夜。次日,弃去抗原液,用PBST(PBS加0.5%吐温-20)洗板3 次后,再加入200 μL 5% 脱脂乳PBSM封闭(0.5 g脱脂奶粉+10 mL PBS),于37 ℃恒温箱2 h后弃去PBSM,用PBST洗涤3 次,加一抗(用PBS稀释),37 ℃孵育1 h,用PBST洗涤3 次,加入二抗100 μL(40 μL二抗+PBS)37 ℃孵育1 h后,PBS洗涤3 次,每孔加入100 μL(10 mL底物缓冲液+100 μL TMB+10 μL H2O2)避光显色约10 min,每孔加入硫酸终止液50 μL,用酶标仪读取数据,结果显示在450 nm波长处的OD值等于1.0,为最佳稀释浓度。
1.3.6 ic-ELISA
按棋盘法已经确定的包被原质量浓度包板,进行ic-ELISA,每孔先加入50 μL ENR标准液,再加入50 μL纯化后不同稀释质量浓度的IgY抗体。用PBS把ENR标准液稀释为不同质量浓度(50、35、20、10、5 ng/mL)。用半数抑制浓度(half maximal inhibitory concentration,IC50)评价免疫测定的灵敏度。把检测限(limit of detection,LOD)和检测范围的限制分别定义为IC10和IC20~IC80。抑制率计算公式如下:
式中:IR为抑制率/%;B为不同质量浓度ENR的OD450nm值;B0为ENR质量浓度为时0的OD450nm值。
2.1 ENR人工抗原的鉴定
采用紫外分光光度计检测ENR人工抗原。BSA、OVA和ENR的吸收峰分别是287、288 nm和280(和330)nm。ENR-BSA(OVA)在BSA(OVA)的吸收峰和ENR的吸收峰之间有特征吸收峰(图2),即证明ENR人工抗原偶联成功。
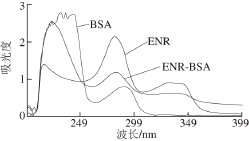

图2 ENR人工抗原的紫外吸收峰
Fig. 2 UV spectra of anti-ENR artifi cial antigens
通过SDS-PAGE检测ENR人工抗原(图3),蛋白分子质量越大,迁移速度越慢。偶联后的抗原的分子质量比未偶联的半抗原(ENR)的分子质量大,迁移速度更慢,因此电泳结果证明偶联成功。

图3 ENR人工抗原蛋白电泳
Fig. 3 Protein electrophoresis of anti-enrofi oxacin artifi cial antigens
2.2 IgY抗体鉴定与效价监控
SDS-PAGE(图4a)鉴定结果显示有两条蛋白带:重链(66 kD)、轻链(27 kD)。再通过ic-ELISA来评估IgY抗体的效价(图4b),五免之后效价最高达到1∶32 000。最高效价持续约25 d,25 d后效价降低至1∶12 000并且持续到实验结束。

图4 IgY抗体蛋白电泳(a)及抗ENR IgY抗体效价滴度(b)
Fig. 4 Protein electrophoresis of the IgY and development of IgY antibody titer against ENR
2.3 ic-ELISA检测结果
棋盘法确定抗体和包被原的最佳稀释浓度。结果表明IgY抗体标准稀释度为1∶64 000且包被原标准包被质量浓度为38 ng/mL时,最终反应OD450nm为1.0。根据所得数据建立标准曲线推到回归方程y=0.891 1-0.016 5x(R2=0.990),IC50为18.207 ng/mL,LOD(IC10)为4.323 ng/mL。检测在7.350 ng/mL(IC20)与45.102 ng/mL(IC80)之间,具有较好的特异性。
2.4 本方法检测与其他方法检测结果对比
表1 检测ENR的不同方法对比
Table 1 Comparison between ic-ELISA and other ENR detection methods

注:—.无相关文献对上述指标有记载。
以往报道中,ENR有不同的LOD和测定范围(表1)。在本研究中,ic-ELISA结果表明38 ng/mL包被原,IgY抗体稀释1∶64 000时为最佳实验条件。免疫测定法的灵敏度(IC50)值和LOD分别为18.207 ng/mL与4.323 ng/mL。IgY基于ELISA检测抗原,检测范围为7.350~45.102 ng/mL,这表明IgY抗体基于ELISA法检测抗原具有较高的灵敏度[20]。与以往报道的方法相比,本研究的相对部分方法较为灵敏,易操作,检测范围相对适宜。为IgY抗体基于ic-ELISA检测动物源性食品中抗生素残留的免疫分析方法提供了参考依据。
目前,抗生素残留一直是重要的食品安全问题。因为在治疗患病动物时不可避免会使用抗生素药物。所以,就需要灵敏和准确的分析方法来评估抗生素的残留。另外,免疫分析法也已经应用到食品检测中[28],其关键技术是人工抗原的合成,这不仅仅是为了获得一种较好的免疫原去触发特异性抗体的产生,也是为了提高包被原在免疫分析法中的灵敏度[10]。因此,半抗原应该具有或衍生出能与载体蛋白进行偶联的功能基团(羟基、氨基、羧基、酯基、重氮盐等)。本研究中ENR末端有羧基,采用活性脂法合成人工抗原,经紫外光谱法与SDS-PAGE法鉴定半抗原偶联成功。
鉴定人工抗原的分析方法包括紫外光谱法、蛋白电泳法、红外光谱法、核磁共振法、标记抗原示踪法、免疫鉴定等[29-30]。最常用的鉴定人工抗原的方法是紫外光谱法,其主要通过半抗原与载体蛋白紫外光谱的叠加性来判断人工抗原是否偶联成功。SDS-PAGE依据蛋白质分子质量的大小差异(偶联成功的人工抗原分子量较载体蛋白增大,电泳条带迁移速度变慢)判断人工抗原是否偶联成功。本研究中采用紫外光谱法及蛋白电泳法鉴定半抗原与载体蛋白的偶联,二者结果均证明人工抗原偶联成功。
参考文献:
[1] GORLA N, CHIOSTRI E, UGNIA L, et al. HPLC residues of enrofi oxacin and ciprofi oxacin in eggs of laying hens[J]. International Journal of Antimicrobial Agents, 1997, 8(4): 253-256. DOI:10.1016/ S0924-8579(97)00018-6.
[2] MARTINEZ M, MCDERMOTT P, WALKER R, et al. Pharmacology of the fluoroquinolones: a perspective for the use in domestic animals[J]. The Veterinary Journal, 2006, 172(1): 10-28. DOI:10.1016/ j.tvjl.2005.07.010.
[3] SCHRODER J. Enrofi oxacin: a new antimicrobial agent[J]. Journal of the South African Veterinary Association, 1989, 60: 122-124.
[4] ARAL F, KARACAL F, BABA F. The effect of enrofloxacin on sperm quality in male mice[J]. Research in Veterinary Science, 2008, 84: 95-99. DOI:10.1016/j.rvsc. 2007.04.007.
[5] Commission regulation (EU) No 37/2010 of 22 December 2009 on pharmacologically active substances and their classifi cation regarding maximum residue limits in foodstuffs of animal origin: EU No 37/2010[S]. Offi cial Journal of the European Union, 2010.
[6] XU X Y, LIU L H, JIA Z M, et al. Determination of enrofi oxacin and ciprofloxacin in foods of animal origin by capillary electrophoresis with field amplified sample stacking-sweeping technique[J]. Food Chemistry, 2015, 17: 219-225. DOI:10.1016/j.tvjl.2005.07.010.
[7] ZHOU X, XING D, ZHU D, et al. Development and application of a capillary electrophoresis-electrochemiluminescent method for the analysis of enrofloxacin and its metabolite ciprofloxacin in milk[J]. Talanta, 2008, 75: 1300-1306. DOI:10.1016/j.talanta.2008.01.040.
[8] KIM Y K, KIM H. Immuno-strip biosensor system to detect enrofloxacin residues[J]. Journal of Industrial and Engineering Chemistry, 2009, 15: 229-232. DOI:10.1016/j.jiec.2008.10.007.
[9] TIAN H. Determination of chloramphenicol, enrofloxacin and 29 pesticides residues in bovine milk by liquid chromatography-tandem mass spectrometry[J]. Chemosphere, 2011, 83: 349-355. DOI:10.1016/ j.chemosphere.2010.12.016.
[10] WANG Z, ZHANG H, NIA H, et al. Development of a highly sensitive and specific immunoassay for enrofloxacin based on heterologous coating haptens[J]. Analytica Chimica Acta, 2014, 820: 152-158. DOI:10.1016/j.aca.2014.02.043.
[11] RICHMAN D D, CLEVELAND P M, OXMAN M N, et al. The binding of staphylococcal protein A by the sera of different animal species[J]. Journal of Immunology, 1982, 128: 2300-2305.
[12] CONSTANTINIU C C, MOLLOY J B, JORGENSEN W K, et al. Purification of immunoglobulins from chicken sera by thiophilic gel chromatography[J]. Poultry Science, 2007, 86(9): 1910-1914. DOI:10.1093/ps/86.9.1910.
[13] NAFEA N M, SABBAH M A, AL-SUHAIL R, et al. Development of hen antihepatitis B antigen IgY-based conjugate for ELISA assay[J]. Advanced Biomedical Research, 2015, 4: 100. DOI:10.4103/2277-9175.156678.
[14] HE J, WANG Y, SUN S, et al. Evaluation of chicken IgY generated against canine parvovirus viral-like particles and development of enzyme-linked immunosorbent assay and immunochromatographic assay for canine parvovirus detection[J]. Viral Immunology, 2015, 28: 489-494. DOI:10.1089/vim.2015.0030.
[15] LIU X S, YANG W J, HE J X, et al. Preparation of artifi cial antigen and egg yolk-derived immunoglobulin (IgY) of fi orfenicol amine for ELISA assay[J]. Journal of Environmental Sciences Health B, 2014, 49: 109-115. DOI:10.1080/03601234.2014.846747.
[16] 彭远义, 周宛蓉. 恩诺沙星人工抗原的合成与鉴定[J]. 西南农业大学学报(自然科学版), 2005, 27(4): 505-508. DOI:10.13718/j.cnki. xdzk.2005.04.019.
[17] POLSON A, von WECHMAR M B, van REGENMORTEL M H. Isolation of viral IgY antibodies from yolks of immunized hens[J]. Immunological Investigations, 1980, 9(5): 475-493. DOI:10.3109/08820138009066010.
[18] HE J, THINRUMALAI D, SCHADE R, et al. Chronobiological studies of chicken IgY: monitoring of infradian, circadian and ultradian rhythms of IgY in blood and yolk of chickens[J]. Veterinary Immunology and Immunopathology, 2014, 160: 266-272. DOI:10.1016/j.vetimm.2014.05.016.
[19] HE J X, HU J J, THIRUMALAI D, et al. Development of indirect competitive ELISA using egg yolk-derived immunoglobulin (IgY) for the detection of gentamicin residues[J]. Journal of Environmental Science and Health, 2015, 51(1): 1-6. DOI:10.1080/03601234.2015.1080479.
[20] HE J X, WANG Y, ZHANG X Y. Preparation of artifi cial antigen and development of indirect competitive ELISA based on chicken IgY for the detection of acid orange Ⅱ in food samples[J]. Food Analytical Methods, 2016, 9(2): 1-7.
[21] BARRON D, JIMENEZ-LOZANO E, CANO J, et al. Determination of residues of enrofi oxacin and its metabolite ciprofi oxacin in biological materials by capillary electrophoresis[J]. Journal of Chromatography B, 2001, 759: 73-79. DOI:10.1016/S0378-4347(01)00214-6.
[22] SUNDERLAND J, LOCERING A M, TOBIN C M, et al. A reverse-phase HPLC assay for the simultaneous determination of enrofloxacin and ciprofloxacin in pig faeces[J]. International Journal of Antimicrobial Agents, 2004, 23: 390-393. DOI:10.1016/ j.ijantimicag.2003.07.014.
[23] JIANG X D, CHEN Y F, TU J, et al. Establishment of an indirect competitive enzyme-linked immunosorbent assay for the residues of enrofi oxacin in chicken tissue[J]. Animal Husbandry and Veterinary Medicine, 2008, 40: 30-33.
[24] CHEN J X, XU F, JIANG H Y, et al. A novel quantum dot-based fluoroimmunoassay method for detection of enrofloxacin residue in chicken muscle tissue[J]. Food Chemistry, 2009, 113: 1197-1201. DOI:10.1016/j.foodchem.2008.08.006.
[25] 余法建, 水柏年, 龚云飞. 水产品中恩诺沙星残留胶体金免疫层析技术的研究[J]. 安徽农业科学, 2014, 42(7): 2059-2061. DOI:10.13989/j.cnki.0517-6611.2014.07.022.
[26] YU F, YU S C, YU L L, et al. Determination of residual enrofi oxacin in food samples by a sensitive method of chemiluminescence enzyme immunoassay[J]. Food Chemistry, 2014, 149: 71-75. DOI:10.1016/ j.foodchem.2013.10.024.
[27] SPELTINI A, STURINI M, MARASCHI F, et al. Fluoroquinolone residues in compost by green enhanced microwave-assisted extraction followed by ultra performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2015, 1410: 44-50. DOI:10.1016/j.chroma.2015.07.093.
[28] 李兴霞, 王国霞, 潘家荣, 等. 免疫分析新方法在食品安全检测中的应用[J]. 生物技术通报, 2006(1): 42-45. DOI:10.13560/j.cnki.biotech. bull.1985.2006.01.011.
[29] 张小燕, 施祖灏, 陆俊贤, 等. 三聚氰胺抗原合成及其多克隆抗体的制备[J]. 中国动物检疫, 2013, 30(1): 53-56.
[30] 赵津子, 郑礼, 谢文艳, 等. 药物残留免疫分析研究进展[J]. 中国药学杂志, 2011, 46(2): 85-88.
ELISA Determination of Enrofi oxacin
YANG Yi1, MENG Kunjie1, ZHAO Hongqiong1, Mikeremu·SHAYIBUZHATI1, ZHANG Xiaoying1,2,*
(1. College of Veterinary Medicine, Xinjiang Agricultural University, Ürümqi 830052, China; 2. College of Veterinary Medicine, Northwest A&F University, Yangling 712100, China)
Abstract:An indirect competitive enzyme-linked immunosorbent immunoassay (ic-ELISA) based on chicken IgY was developed and validated for the detection of enrofloxacin (ENR) residues in animal-derived food samples. The ENR immunogen and coating antigen were prepared by the active ester method and confi rmed by UV spectroscopy for further detection and immunization into laying hens. IgY antibodies were extracted with PEG-6000 precipitation. The titer of anti-ENR IgY attained its peak (1:32 000) after the fi fth booster immunization. Checkerboard titration showed that 1:64 000 dilution of anti-ENR IgY could give OD around 1.0 at 38 ng/mL ENR-OVA coating concentration. The IC50of the ELISA for ENR was 18.207 ng/mL and the regression curve equatio n was y = 0.891 1−0.016 5x (R2= 0.990). The study demonstrated that anti-ENR IgY antibody was feasible for the detection of ENR in animal-derived food samples.
Key words:enrofi oxacin; IgY; antibiotic residues; indirect competitive enzyme-linked immunosorbent immunoassay (ic-ELISA)
DOI:10.7506/spkx1002-6630-201708037
中图分类号:S859.79
文献标志码:A
文章编号:1002-6630(2017)08-0239-05
引文格式:
杨熠, 孟坤杰, 赵红琼, 等. 酶联免疫吸附法检测动物源性食品中恩诺沙星残留量[J]. 食品科学, 2017, 38(8): 239-243.
DOI:10.7506/spkx1002-6630-201708037. http://www.spkx.net.cn
YANG Yi, MENG Kunjie, ZHAO Hongqiong, et al. ELISA determination of enrofioxacin[J]. Food Science, 2017, 38(8): 239-243. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201708037. http://www.spkx.net.cn
收稿日期:2016-04-11
基金项目:国家自然科学基金面上项目(31572556);2016年度国家外国专家局国文教专家聘请计划学校重点项目(X2015017);中国-上合组织国家动物疫病与动物源性食品安全检测创新平台项目(2016E03012)
作者简介:杨熠(1993—),女,硕士研究生,研究方向为动物医学。E-mail:531433177@qq.com
*通信作者:张小莺(1976—),男,教授,博士,研究方向为药理学、新药研发及抗体工程。E-mail:zhang.xy@nwsuaf.edu.cn