
图 1丁醚脲(a)、丁醚脲-酰胺(b)、丁醚脲-脲(c)和丁醚脲-甲酰胺(d)分子结构图
Fig. 1 Structures of diafenthiuron (a), diafenthiuron-carbodiimide (b), diafenthiuron-urea (c) and diafenthiuron-methanimidamide (d)
董晓倩,刘松南*,刘 蕊,黄田田,宗 琦,王 华,欧阳亚旭
(北京食品科学研究院北京市茶叶质量监督检验站,北京 100162)
摘 要:目的:建立茶叶中丁醚脲农药残留检测的液相色谱-串联质谱方法。方法:茶叶样品用乙腈提取后所得提取液经过QuEChERS法净化除去杂质。采用乙腈-水(含0.1%甲酸)流动相体系进行洗脱,C18色谱柱进行色谱分离,电喷雾正离子模式电离,多级反应模式监测,外标法定量。结果:采用GB/T 23205—2008《茶叶中448 种农药及相关化学品残留量的测定 液相色谱-串联质谱法》检测丁醚脲时回收率低的主要原因是其在前处理过程中发生了分解。采用本实验建立的方法,丁醚脲在1.0~500 μg/L质量浓度范围内线性良好(r=0.999 9),定量限为0.01 mg/kg。在0.010、1.0、5.0 mg/kg三个添加量水平的平均加标回收率为83.3%~99.4%,相对标准偏差在1.87%~6.30%之间。结论:本方法操作简便,耗时较短,有效避免了前处理过程中丁醚脲分解对检测结果的影响,适用于茶叶中丁醚脲残留的定性及定量分析。
关键词:茶叶;丁醚脲;液相色谱-串联质谱法;QuEChERS
由于防虫除害的需要,在茶叶种植中不得不使用各种农药。国家及地方各级食药局的抽检结果表明茶叶农药残留超标已经是影响茶叶产品质量安全的首要因素。丁醚脲是一种新型硫脲类杀螨杀虫剂,具有触杀、内吸、胃毒、熏蒸等作用[1-4]。其化学结构见图1a。该农药被广泛用于茶树上。因其对人类存在潜在的危险,一些发达国家和地区都制定了严格的残留限量标准。日本在2006年5月29日实施的“食品中农业化学品残留肯定列表制度”中规定茶叶中丁醚脲最大残留限量为20 mg/kg。欧盟也于2002年颁布了第2076/2002号法规,明令禁止使用和销售丁醚脲[5]。同时,我国也规定了丁醚脲在茶叶中临时最大残留限量为5 mg/kg[6]。目前我国仅有GB/T 23205—2008《茶叶中448种农药及相关化学品残留量的测定 液相色谱-串联质谱法》[7]一个标准方法涉及到茶叶中丁醚脲的检测。GB 2763—2014《食品中农药最大残留限量》却未将GB/T 23205—2008列为检测丁醚脲的推荐方法,丁醚脲成为了茶叶类产品中仅有的3个有限量要求但无推荐检测方法的农药(丁醚脲、氯噻啉、草铵膦)之一,检测方法的不足和缺失影响了GB 2763—2014的可操作性,茶叶中丁醚脲农药残留实际处于监管的空白地带。目前,有关丁醚脲这一农药残留检测方法的报道多见于棉花、柑橘、苹果、土壤、水、甘蓝、花菜等[8-13],对于茶叶中丁醚脲残留的检测报道很少[14-16]。
本实验室依据GB/T 23205—2008的方法对茶叶中的丁醚脲残留物进行提取。实验结果表明在0.010、1.0、5.0 mg/kg三个加标水平下,丁醚脲的回收率在0.31~0.55%之间,不满足方法学要求。已有研究表明丁醚脲在阳光和氧的作用下会生成丁醚脲-酰胺、丁醚脲-脲和丁醚脲-甲酰胺3 种分解产物[17-18](图1),因此,见光分解可能是导致丁醚脲回收率低的原因,需要对GB/T 23205—2008方法检测丁醚脲回收率低的原因进行研究,找出问题的关键所在,并建立适合茶叶中丁醚脲农药残留的检测方法,为茶叶中该种农药残留的检测分析及风险评估提供可靠方法依据,保障我国茶叶食品安全。
QuEChERS(quick,easy,cheap,effective,rugged,safe)方法是近年来国际上兴起的快速、高效的农药残留检测前处理技术,具有简单、方便的优点[19-20],日益受到国内外科研工作者的广泛关注。QuEChERS快速前处理技术结合色谱-质谱联用法在农药及兽药残留检测方面已经得到广泛应用[21-25]。本实验采用三重四极杆液相色谱-串联质谱技术,结合QuEChERS净化方法,建立了一套快速检测茶叶中丁醚脲残留量的方法,可解决GB/T 23205—2008不适用于茶叶中丁醚脲检测的关键问题。

图 1丁醚脲(a)、丁醚脲-酰胺(b)、丁醚脲-脲(c)和丁醚脲-甲酰胺(d)分子结构图
Fig. 1 Structures of diafenthiuron (a), diafenthiuron-carbodiimide (b), diafenthiuron-urea (c) and diafenthiuron-methanimidamide (d)
1.1 材料与试剂
茶叶 北京市购。
丁醚脲(纯度98.5%,CAS:80060-09-9) 德国Dr. Ehrenstorfer公司;乙腈、甲醇(均为色谱纯)、甲酸(液相色谱-质谱级) 美国Thermo Fisher公司;氯化钠、无水硫酸镁(均为分析纯) 天津大茂化学试剂厂;N-丙基乙二胺(N-propylethylenediamine,PSA)吸附剂(40~60 μm)、多壁碳纳米管(10~20 nm)和石墨化炭黑(graphitized carbon black,GCB)吸附剂(120~400目) 天津博纳艾杰尔公司。实验用水由Millipore纯水机制备而得。
1.2 仪器与设备
TSQ Quantum Ultra EMR液相色谱-串联质谱联用仪(配有电喷雾离子源(electrospray ion source,ESI))美国Thermo Fisher公司;AEL200分析天平(感量0.1 mg) 日本岛津公司;KDC-140HR离心机(配有2 mL和8 mL转头) 安徽中科中佳公司;涡旋混匀器北京金紫光公司;HR40-ⅡA2生物安全柜 海尔公司。
1.3 方法
1.3.1 溶液配制
标准贮备溶液:准确称取10.0 mg(准确到0.1 mg)丁醚脲标准品,用乙腈定容至100 mL容量瓶中,配制成100 μg/mL的标准溶液,4 ℃冰箱冷藏保存,有效期为6 个月。
标准工作溶液:将上述标准贮备溶液用乙腈-水(1∶1,V/V)逐级稀释为标准工作溶液,现用现配。
1.3.2 提取
称取混匀后的茶叶样品200 g,经粉碎机粉碎,过80 目筛,装袋保存,备用。
称取上述茶叶粉末1.000 0 g于10 mL离心管中,加入0.200 g无水硫酸镁、0.200 g氯化钠、5.0 mL乙腈充分混匀,旋涡振荡1 min,浸泡提取10 min,再次涡旋振荡1 min,于6 000 r/min离心3 min,收集上清液,待净化。
1.3.3 净化
取1.3.2节上清液1.00 mL于2 mL净化管(GCB吸附剂0.050 g、PSA吸附剂0.050 g、无水硫酸镁0.150 g)中,旋涡振荡1 min,6 000 r/min离心3 min。取净化液0.500 mL于2 mL离心管中,加入0.500 mL水,混匀,经0.22 μm有机微孔滤膜过滤,上机测定。
1.3.4 仪器条件
1.3.4.1 色谱条件
色谱柱:Hypersil GOLD C18(100 mm×2.1 mm,1.7 μm);柱温:40 ℃;进样体积:10 μL;流动相:A为0.1%甲酸溶液;B为乙腈;流速:0.30 mL/min。洗脱梯度见表1。
表1 梯度洗脱程序
Table 1 Gradient elution program

1.3.4.2 质谱条件
ESI正离子模式,喷雾电压4 000 V,气化温度300 ℃,鞘气流速15 mL/min,辅助气流速15 mL/min;离子传输管温度320 ℃,碰撞气压力2.0×104kPa,选择反应监测(selective reaction monitoring,SRM),其他参数见表2。
表2 丁醚脲及其分解产物质谱检测参数
Table 2 Mass spectrometry parameters for determination of diafenthiuron residue and its decomposition products
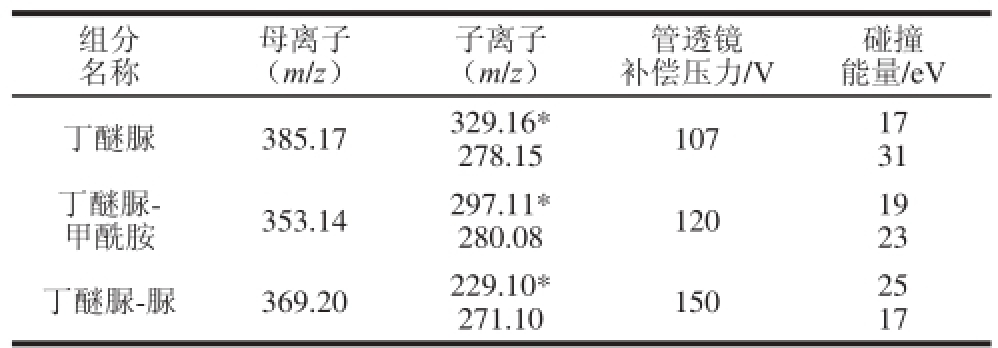
注:*.定量离子。
2.1 提取方法的优化
2.1.1 提取溶剂的选择
研究表明丁醚脲在乙腈、丙酮、甲醇、二氯甲烷、乙酸乙酯等有机溶剂中均具有良好的溶解性。考虑到本实验所采用流动相为乙腈,以及后续的净化过程,选取乙腈作为丁醚脲的提取剂,不仅可以避免更换流动相所带来的繁琐步骤,同时使用乙腈作为提取溶剂时提取液中所含色素等杂质较少[26],有利于后续的净化实验。
2.1.2 提取方法的选择
GB/T 23205—2008中的提取需使用乙腈提取两次,还需要经过离心、浓缩等过程,这个过程不仅繁琐还会导致丁醚脲的分解发生。本研究所采取的QuEChERS法实验步骤简单,在保证提取效率的同时显著地减少了提取时间和试剂用量。提取时加入无水硫酸镁脱除样品和溶剂中的水分,加入氯化钠可以通过盐析作用提升提取效率。实验结果表明使用本方法经过单次提取即可以完全提取出茶叶样品中的丁醚脲。
2.2 净化方法的优化
2.2.1 GB/T 23205—2008净化方法的问题分析
通过比较丁醚脲及两种代谢产物质量浓度的变化研究GB/T 23205—2008方法以及其各环节中丁醚脲的分解情况。以3 种组分处理后的质量浓度与初始质量浓度的比值(相对质量浓度,%)为纵坐标绘图(图2),结果表明新配制的丁醚脲标准品中本身就含有丁醚脲-脲和丁醚脲-甲酰胺两种分解产物,经过GB/T 23205—2008方法的前处理过程后,丁醚脲-甲酰胺的相对质量浓度为6.12%,丁醚脲-脲的相对质量浓度为650%(图2过程1)。这表明,丁醚脲在前处理过程中发生了分解。为进一步探明丁醚脲发生分解的确切环节,本实验在25 mL乙腈-甲苯(3∶1,V/V)溶液中添加1 mL 0.2 μg/mL丁醚脲(乙腈基质)标准溶液,模拟按GB/T 23205—2008方法经过固相萃取净化后的洗脱液旋蒸浓缩、氮吹、复溶的过程,实验结果表明在经过旋蒸浓缩、氮吹、复溶等过程后,丁醚脲的相对质量浓度仅为0.60%,丁醚脲-甲酰胺的相对质量浓度为170%,丁醚脲-脲的相对质量浓度为850%(图2过程2)。本实验并未检测到丁醚脲-酰胺,原因是该物质是一种中间分解产物,极不稳定,会进一步发生光解生成丁醚脲-脲[27]。

图2 丁醚脲及其分解产物在各处理条件下的相对质量浓度
Fig. 2 Relative concentrations of diafenthiuron and its metabolites under different processing conditions
本实验通过紫外线照射加速模拟丁醚脲的分解,将2.0 μg/mL的丁醚脲标准溶液(乙腈基质)置于生物安全柜中,距离紫外灯20 cm的位置进行照射,实验发现丁醚脲迅速分解,经过5 min的照射后丁醚脲的相对质量浓度仅为0.3%,通过计算得出在紫外线照射条件下丁醚脲半衰期为1.2 min。新配制的丁醚脲标准溶液中也存在一定含量的丁醚脲-脲和丁醚脲-甲酰胺组分,在丁醚脲降解的同时丁醚脲-甲酰胺的质量浓度基本不变,而丁醚脲-脲的质量浓度增加了4 倍(图3)。除了丁醚脲-脲外,该结果与前述过程2的情况基本一致,验证了在过程2中确实发生了丁醚脲的分解。经过过程2后丁醚脲-甲酰胺质量浓度增加,但紫外线照射后丁醚脲-甲酰胺质量浓度基本不变,这表明过程2中除了发生光降解还可能有其他机理的降解发生,如旋蒸过程导致的热降解和真空导致的降解,具体机理还需要进一步的研究。

图3 丁醚脲及其分解产物在紫外线照射下的变化
Fig. 3 Changes in diafenthiuron and its decomposition products under ultraviolet light
上述结果表明丁醚脲在旋蒸、氮吹、复溶的过程中会分解损失。GB/T 23205—2008方法在样品提取和净化中两次涉及到旋转蒸发浓缩过程,都可能导致丁醚脲的分解。而经过TPT固相萃取小柱的处理后,无论丁醚脲还是其分解产物又都发生了不同程度的损失,除了其分解的原因外,也可能有部分待测物质被固相萃取小柱吸附无法洗脱。因此GB/T 23205—2008的方法并不适用于丁醚脲的检测,实验的关键在于简化前处理过程从而减少或避免丁醚脲的分解。因此,考虑到QuEChERS法简单、快速、无旋蒸浓缩的优点,本实验采用该方法进行前处理后进行茶叶中丁醚脲残留的检测。
2.2.2 QuEChERS净化填料的选择
由于茶叶中含有大量的有机酸、茶多酚、色素、生物碱等,而PSA是弱阴性离子交换剂,能有效吸附糖类物质、茶多酚、脂肪酸及少量色素等极性杂质[28],石墨化炭黑和碳纳米管能够有效去除茶叶中的色素、固醇及一些平面结构的干扰物质[29]。为确保吸附剂在吸附茶叶中杂质的同时不对样品提取液中的目标物有不可逆吸附,本实验考察了PSA、石墨化炭黑及多壁碳纳米管这3种吸附剂材料对丁醚脲的吸附能力。由图4可见,多壁碳纳米管对该物质的吸收能力过强,不适合用做丁醚脲检测的净化剂,PSA、石墨化炭黑则对丁醚脲没有明显的吸附作用。因此本研究选择加入PSA 0.050 g,石墨化炭黑0.050 g,同时加入无水硫酸镁0.150 g作为脱水剂制成净化管。实验结果表明,该净化管不仅能够有效去除提取液中的杂质,还能够满足方法回收率的要求。

图4 不同吸附剂对丁醚脲吸附能力的比较
Fig. 4 Comparison of the adsorption effi ciencies of different adsorbents for diafenthiuron
2.3 液相色谱及质谱条件的优化
由丁醚脲结构式(图1)可知,该化合物中含有氨基基团,容易得到一个带正电荷的基团,在正模式下灵敏度更高,因此选取ESI+模式对其进行检测。取质量浓度为1.0 μg/mL的丁醚脲标准工作溶液进行质谱参数的优化。优化后所得具体参数见1.3.4节。
丁醚脲为弱极性化合物,在C18色谱柱上有较好的保留。茶叶中含有茶多酚、色素等多种成分,这些物质会对丁醚脲的分析造成极大的干扰,梯度洗脱能够将一些极性较大的杂质先行洗脱下来,进而使丁醚脲得到较好的分离与分析。本实验分别比较了甲醇-水(含0.1%甲酸)、乙腈-水(含0.1%甲酸)以及乙腈-乙酸铵(5 mmol/L)3 种流动相体系下丁醚脲的分离效果。结果发现,丁醚脲在3 种流动相体系下的峰形非常接近,在甲醇-水体系中的保留时间较长,而在另外两种体系下则具有相同的保留时间(图5)。本实验室前期研究发现,当采用乙腈-水(含0.1%甲酸)作为流动相分析氯噻啉、丁醚脲、杀螟丹、噻虫嗪、多菌灵、灭多威、吡虫啉、啶虫脒、除虫脲、腐霉利和喹螨醚等农药时,相互之间没有干扰,并且能够达到很好的分离效果[26]。因此为缩短分析时间、减少其他常见农药的干扰,选择乙腈-水(含0.1%甲酸)体系作为流动相。通过对洗脱条件的优化,将丁醚脲的分析时间从GB/T 23205—2008的23 min缩短为14 min,大大提高了分析速度和工作效率。


图5 乙腈-水(a)、乙腈-乙酸铵(b)、甲醇-水(c)流动相体系条件下丁醚脲的SRM色谱图
Fig. 5 SRM chromatograms for diafenthiuron standard in different mobile phases consisting of acetonitrile/water (a), acetonitrile/ammonium acetate (b) and methanol/water (c)
2.4 方法学结果
2.4.1 线性和基质效应
分别配制质量浓度为1.0、5.0、10、50、100、200、500 μg/L的丁醚脲标准工作溶液上机分析。以质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。结果表明,在1.0~500 μg/L的质量浓度范围内丁醚脲线性关系良好,线性方程为y=-4 074+134 456x(r=0.999 8)。采用不含丁醚脲的红茶提取液稀释标准溶液绘制标准曲线,考察基质效应。不同基质下丁醚脲的提取色谱图见图6。结果表明,采用茶叶提取液稀释标准溶液所绘制的标准曲线方程为y=-1 305+111 115x(r=0.999 9),其斜率与标准品的标准曲线斜率之比为82.6%,具有一定的基质减弱效应。因此,为保证实验的准确性,需采用基质标准进行定量分析。

图6 茶叶空白样品(a)、茶叶基质标准(b)(0.10 μg/mL)、乙腈溶剂标准(c)(0.10 μg/mL)中丁醚脲的SRM色谱图
Fig. 6 SRM chromatograms for diafenthiuron standard in tea blank sample (a), real tea (b) (0.10 μg/mL), and acetonitrile solution (c) (0.10 μg/mL)
2.4.2 检出限及定量限
采用不含丁醚脲农药的茶叶提取液逐级稀释丁醚脲标准溶液,当定量离子对和定性离子对的信噪比RSN不小于3时,所对应的丁醚脲含量为0.005 mg/kg。当定量离子对RSN等于10且定性离子对RSN不小于3时,所对应的丁醚脲含量为0.01 mg/kg。因此本方法的检出限为0.005 mg/kg,定量限为0.01 mg/kg,该结果满足我国茶叶中丁醚脲残留的限量的判定要求[6]。
2.4.3 加标回收率及精密度
选取经测定不含有丁醚脲的绿茶及红茶样品,分别添加0.010、1.0、5.0 mg/kg的丁醚脲,发现绿茶的加标回收率范围为77.8%~100%,相对标准偏差为1.87%~5.70%,红茶的加标回收率范围为78.8%~104%,相对标准偏差为2.07%~6.30%(表3)。加标回收率和精密度实验结果均符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》的要求[30]。而当采用GB/T 23205—2008的方法进行处理时,回收率在0.31~0.55%之间,不能满足方法学要求。
表3 加标回收率及精密度实验(n=7)
Table 3 Average recoveries and precisions (RSDs) at three spiked levels (n= 7)

2.5 实际样品检测结果
对市场上购买的50 种茶叶样品进行检测,茶叶品种涉及红茶、绿茶、花茶、黑茶、乌龙茶5 个品种,有2 件样品检出丁醚脲,其含量分别为0.038 mg/kg和0.008 5 mg/kg,还有3 件样品虽然没有检测到丁醚脲,但检测到了丁醚脲-脲和丁醚脲-甲酰胺。作为比较,按照GB/T 23205—2008的方法对上述5 个样品进行了检测,结果均小于0.005 mg/kg。

图7 实际样品中丁醚脲-甲酰胺(a)、丁醚脲-脲(b)和丁醚脲(c)(0.003 8 μg/mL)SRM色谱图
Fig. 7 SRM chromatograms for diafenthiuron-methanimidamide (a), diafenthiuron-urea (b) and diafenthiuron (c) (0.003 8 μg/mL) in real tea sample
本实验发现采用GB/T 23205—2008的方法检测茶叶中丁醚脲残留时回收率在0.31%~0.55%之间,不适用于茶叶中丁醚脲的检测。造成这一结果的主要原因是丁醚脲不稳定,在前处理过程中发生了分解。本实验建立了将QuEChERS净化技术与液相色谱-串联质谱联用法相结合检测茶叶中丁醚脲残留的方法。与GB/T 23205—2008相比,本方法大大简化了实验过程、降低了操作成本、提高了工作效率,适用于茶叶样品中丁醚脲残留的检测。本方法的线性范围较宽,精密度、回收率符合GB/T 27404—2008的相关规定,定量限为0.01 mg/kg,可以满足我国农药残留限量标准GB 2763—2014对茶叶中丁醚脲残留量的判定要求。
由于丁醚脲的半衰期较短,茶叶中的丁醚脲在生产、运输、存储过程中会逐渐分解,难以检测到丁醚脲的残留。丁醚脲经腹腔注射小鼠半数致死量(median lethal dose,LD50)为15 mg/kg,其分解产物按毒性大小顺序为丁醚脲-酰胺>丁醚脲-甲酰胺>丁醚脲-脲。丁醚脲-酰胺的LD50值为0.3 mg/kg,为剧毒物质;丁醚脲-甲酰胺的LD50值为30 mg/kg,为极毒物质;丁醚脲-脲的LD50值为100 mg/kg,为很毒物质。这些分解产物还对肺、肝脏等靶器官的毒性具有积累作用[17-18],抑制线粒体中的酶活性,进而导致其迅速麻痹,因此比丁醚脲具有更大的毒性。建议我国卫生和风险评估行政部门对丁醚脲及其分解产物进行食品安全风险评估,在评估的基础上重新制定食品中丁醚脲的残留限量标准,新的限量标准应该以丁醚脲及其分解产物总量来计算。
参考文献:
[1] 刘刚. 新型果蔬杀虫杀螨剂-丁醚脲[J]. 西北园艺(果树), 2006(4): 53.
[2] 杜鹏. 丁醚脲在甘蓝和土壤中残留和消解动态研究[D]. 石河子: 石河子大学, 2009: 9-12.
[3] RUDER F, KAYSER H. The thiourea insecticide diafenthiuron inhibits mitochondrial ATPase in vitro and in vivo by its carbodiimide product[J]. Biochemical Society Transactions, 1994, 22(1): 241-244. DOI:10.1042/bst0220241.
[4] 高亚男, 单正军, 程燕, 等. 丁醚脲农药对3 种水生生物的风险评价[J]. 生态与农村环境学报, 2010, 26(5): 487-491. DOI:10.3969/ j.issn.1673-4831.2010.05.016.
[5] The Commission of the European Communities. Commission Regulation (EC): No. 2076. Official Journal of the European Communities, 2002.
[6] 国家卫生和计划生育委员会, 农业部. 食品中农药最大残留限量: GB 2763—2014[S]. 北京: 中国标准出版社, 2014.
[7] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 茶叶中448 种农药及相关化学品残留量的测定 液相色谱-串联质谱法: GB/T 23205—2008[S]. 北京: 中国标准出版社, 2008.
[8] 葛含光, 王永芳, 葛宝坤, 等. QuEChERS-高效液相色谱-串联质谱法测定苹果中丁醚脲及其代谢物残留量[J]. 食品安全质量检测学报, 2015, 6(2): 436-441.
[9] 刘艳萍, 王思威, 孙海滨, 等. 丁醚脲在柑橘及其土壤中的残留及消解动态[J]. 农药学学报, 2013, 15(6): 673-678. DOI:10.3969/ j.issn.1008-7303.2013.06.12.
[10] 马婧玮, 张军锋, 李萌, 等. 丁醚脲在棉花及土壤中的残留消解动态[J].农药, 2014, 53(3): 200-202.
[11] 卢委委, 孙福胜, 董杰, 等. 超声辅助离子液体分散液液微萃取-反相液相色谱法测定水中丁醚脲残留[J]. 分析测试学报, 2010, 29(11): 1198-1202. DOI:10.3969/j.issn.1004-4957.2010.11.018.
[12] 朱烈, 李旦阳, 许敏球, 等. 丁醚脲在甘蓝和花菜中的残留动态研究[J]. 安徽农业科学, 2016, 44(14): 104-106. DOI:10.3969/ j.issn.0517-6611.2016.14.035.
[13] 石卿, 郭正元, 张舜, 等. 应用液相色谱同时测定土壤中丁醚脲和哒螨灵残留量的新方法研究[J]. 湖南农业科学, 2012(9): 54-56. DOI:10.3969/j.issn.1006-060X.2012.09.018.
[14] 王利强, 张新忠, 罗逢健, 等. 超高效液相色谱-串联质谱法测定茶叶和土壤中丁醚脲及其代谢物的残留[J]. 分析化学, 2011, 39(9): 1329-1335. DOI:10.3724/SP.J.1096.2011.01329.
[15] 陈磊, 上官良敏, 付凤富. QuEChERS预处理结合HPLC-MS/MS同时检测茶叶中7 种农药残留[J]. 中国科学: 化学, 2016, 46(3): 302-308.
[16] 吕慧芝. QuEChERS-超高效液相色谱-串联质谱法测定茶叶中丁醚脲的残留量[J]. 广东化工, 2016, 43(16): 177-178. DOI:10.3969/ j.issn.1007-1865.2016.16.086.
[17] WANG L, ZHAO P Y, ZHANG F Z, et al. Diafenthiuron residue and decline in pakchoi and soil under fi eld application[J]. Ecotoxicology and Environmental Safety, 2012, 79: 75-79. DOI:10.1016/ j.ecoenv.2011.12.002.
[18] PETROSKE E, CASIDA J E. Diafenthiuron action: carbodiimide formation and ATPase inhibition[J]. Pesticide Biochemistry and Physiology, 1995, 53: 60-74. DOI:10.1006/pest.1995.1055.
[19] 刘亚伟, 董一威, 孙宝利, 等. QuEChERS在食品中农药多残留检测的应用研究进展[J]. 食品科学, 2009, 30(9): 285-289. DOI:10.3321/ j.issn:1002-6630.2009.09.067.
[20] MAJORS R E. QuEChERS-a new technique for multiresidue analysis of pesticides in foods and agricultural samples[J]. LC-GC Asia Pacifi c, 2008, 11(1): 22-31.
[21] 高青珍. QuEChERS-色谱法快速测定蔬菜水果中的农药多残留[D].北京: 中国农业科学院, 2014: 5-7.
[22] 曲斌. QuEChERS在动物源性食品兽药残留检测中的研究进展[J].食品科学, 2013, 34(5): 327-330.
[23] GOLGE O, KABAK B. Evaluation of QuEChERS sample preparation and liquid chromatography-triple-quadrupole mass spectrometry method for the determination of 109 pesticide residues in tomatoes[J]. Food Chemistry, 2015, 176: 319-332. DOI:10.1016/ j.foodchem.2014.12.083.
[24] LOZANO A, RAJSKI Ł, BELMONTE-VALLES N, et al. Pesticide analysis in teas and chamomile by liquid chromatography and gas chromatography tandem mass spectrometry using a modified QuEChERS method: validation and pilot survey in real samples[J]. Journal of Chromatography A, 2012, 1268: 109-122. DOI:10.1016/ j.chroma.2012.10.013.
[25] 陈琼, 喻芳, 张惠, 等. QuEChERS法处理结合液质法测茶叶中多种农残[J]. 2015, 43(16): 143-146. DOI:10.3969/ j.issn.1001-9677.2015.16.052.
[26] 刘松南, 赵新颖, 董晓倩, 等. QuEChERS净化-液相色谱-串联质谱法测定茶叶中氯噻啉[J]. 色谱, 2015, 33(11): 1205-1209. DOI:10.3724/SP.J.1123.2015.07006.
[27] YOUNG S, JEONG H. Photodegradation of diafenthiuron in water[J]. Pest Manage Science, 2002, 58(5): 496-502. DOI:10.1002/ps.483.
[28] KAYSER H, EILINGER P. Metabolism of diafenthiuron by microsomal oxidation: procide activation and inactivation as mechanisms contributing to selectivity[J]. Pest Management Science, 2001, 57(10): 975-980. DOI:10.1002/ps.360.
[29] 袁平. 农残QuEChERS前处理研究和直接质谱[D]. 长沙: 湖南师范大学, 2012: 8-10.
[30] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 实验室质量控制规范 食品理化检测: GB 27404—2008[S]. 北京: 中国标准出版社, 2008.
Determination of Diafenthiuron Residue in Tea by QuEChERS-Liquid Chromatography-Tandem Mass Spectrometry
DONG Xiaoqian, LIU Songnan*, LIU Rui, HUANG Tiantian, ZONG Qi, WANG Hua, OUYANG Yaxu
(Beijing Tea Qualify Supervision and Inspection Station, Beijing Academy of Food Sciences, Beijing 100162, China)
Abstract:Purpose: To develop a method for the determination of diafenthiuron residue in tea by liquid chromatographytandem mass spectrometry (LC-MS/MS). Methods: The diafenthiuron in tea was extracted by acetonitrile and purifi ed by the quick, easy, cheap, effective, rugged and safe (QuEChERS) method. The separation of the analyte was performed on a C18column by gradient elution using a mobile phase consisting of acetonitrile and water (containing 0.1% formic acid). The mass spectrometer was operated with electrospray ion source in positive mode (ESI+) by selective reaction monitoring (SRM), and the analyte was quantifi ed by the external standard method. Results: Low recoveries of diafenthiuron obtained by the method described in GB/T 23205‒2008 was in part ascribed to the decomposition of diafenthiuron in the pretreatment processes. A good linearity (r = 0.999 9) was observed over the range of 1.0 to 500 μg/L using the new method developed in this study. The limit of quantifi cation (LOQ) was 0.01 mg/kg, and the recoveries at three spiked levels (0.010, 1.0 and 5.0 mg/kg) varied from 83.3% to 99.4%, with relative standard deviations (RSDs) of 1.87%6.30%. Conclusion: This method is simple and convenient, and it can effectively avoid the infi uence of diafenthiuron decomposition in the pretreatment process, and thus can be applied for the qualitative and quantitative confirmation of diafenthiuron residue in tea.
Key words:tea; diafenthiuron; liquid chromatography-tandem mass spectrometry (LC-MS/MS); QuEChERS
DOI:10.7506/spkx1002-6630-201708038
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)08-0244-07
引文格式:
董晓倩, 刘松南, 刘蕊, 等. QuEChERS-液相色谱-串联质谱法测定茶叶中的丁醚脲[J]. 食品科学, 2017, 38(8): 244-250.
DOI:10.7506/spkx1002-6630-201708038. http://www.spkx.net.cn
DONG Xiaoqian, LIU Songnan, LIU Rui, et al. Determination of diafenthiuron residue in tea by QuEChERS-liquid chromatography-tandem mass spectrometry[J]. Food Science, 2017, 38(8): 244-250. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201708038. http://www.spkx.net.cn
收稿日期:2016-07-19
基金项目:国家高技术研究发展计划(863计划)项目(2013AA030901)
作者简介:董晓倩(1988—),女,中级工程师,硕士,研究方向为食品分析与检测。E-mail:dongxiaoqian@163.com
*通信作者:刘松南(1982—),男,高级工程师,硕士,研究方向为食品分析与检测。E-mail:lsnmail@qq.com