表1 核酸适配体序列和DNA随机序列[30]
Table 1 Aptamer nucleic acid sequences and random DNA sequences

注:序列均由生工生物工程有限公司合成。
付 田1,曹锦轩1,潘道东1,2,*,程克文1,曾小群1,吴 振1,孙杨赢1
(1.浙江省动物蛋白精深加工技术重点实验室,浙江 宁波 315211;2.南京师范大学 国家乳品加工技术研发分中心,江苏 南京 210097)
摘 要:分别利用最适长度的雌二醇DNA核酸适配体的特异性识别和胶体金聚集前后颜色及吸光度的变化实现雌二醇的定性和定量检测。本研究制备了胶体金,并设计了75-mer、35-mer和22-mer的雌二醇核酸适配体,依据没有核酸适配体保护的胶体金在最适氯化钠浓度条件下聚集,而有核酸适配体保护的胶体金在此浓度条件下不聚集以及雌二醇的核酸适配体与雌二醇特异性结合的特性,实现对雌二醇的超灵敏检测。结果表明,在NaCl浓度30 mmol/L、35-mer核酸适配体质量浓度30 nmol/L条件下,雌二醇质量浓度与胶体金在625 nm和523 nm波长条件下,吸光度的比 值(A625nm/A523nm)在13.6~54.4 pg/mL的范围内呈良好的线性关系,检测限为2.7 pg/mL。所构建的比色法的特异性、稳定性和重复性均良好。应用该方法对牛乳样品进行检测,雌二醇的最低检测限为13.6 pg/mL,因此可用于奶制品中雌二醇的快速检测。
关键词:雌二醇;胶体金;DNA核酸适配体;比色法
雌二醇是一种广 泛分布于人体和哺乳动物的内分泌雌激素,并且具有很强的雌激素效应。低浓度的雌二醇就能扰乱人体的免疫系统,造成人体生殖系统紊乱,特别是引起儿童性早熟,因此雌二醇的危害越来越受到人们的关注[1]。研究表明人类饮食中摄入的外源性雌激素60%~70%来源于牛乳及乳制品[2]。此外,雌二醇的残留受奶牛品种,妊娠奶牛的产奶以及养殖户为提高瘦肉比、促进发情而非法添加的兽药的共同影响[3]。Arditsoglou等[4]表明富含雌二醇的污物经常被排放到水源中,导致水体雌二醇超标。Salehi[5]、Cutolo[6]等指出,雌二醇可通过食物链的富集作用影响人体的生殖、致癌、致畸、免疫功能以及影响自然环境中生物固氮。因此,建立一种快速、灵敏的食品中的雌二醇检测方法是非常有必要的。
目前,关于雌二醇的检测方法主要有色谱法[7-9]、电化学法[10-13]、免疫分析法[14-16]等。根据GB 29698—2013《奶及奶制品中17β-雌二醇、雌三醇、炔雌醇多残留的测定》可知,雌二醇残留的检测限为5 ng/mL,这些检测方法不仅达到国家标准,且具有较高的检测灵敏度,例如电化学法[10]中雌二醇残留的最低检测限为0.84 pg/mL,但由于受到样品前处理过程繁琐、操作复杂、设备要求高和酶的稳定性的限制,使其应用难以扩大,也不能广泛地用于食品的快速检测。核酸适配体是通过体外指数富集配体系统进化技术(systematic evolution of lgands by exponential enrichment,SELEX)筛选出来的由人工合成的一段单链DNA或RNA。它们能识别各种目标物,包括小分子、糖、蛋白质甚至整个细胞[17-18]。更重要的是,相对抗体而言,筛选出来的核酸适配体具有亲和力高、稳定性好、检测范围广等特点,而且此技术已经被广泛用于比色[19-20]、电化学[21-22]、化学发光[23]、荧光[24]等各种检测方法中。胶体金是由金盐被还原成原金后形成的金颗粒悬液,是一种电学性质、光学性质、化学性质都较优异的纳米材料,并被作为广谱的比色法传感器[25]。其中胶体金-适配体比色法具有快速、简单、灵敏、不需要特殊设备就能得到肉眼可见的结果等优点,已经被广泛用于开发便携和现场使用的快速检测试剂盒和其他装置中[26-27]。Kim等[28]指出核酸适配体能有效地和雌二醇结合。Huang Kejing等[29]利用核酸适配体建立了生物传感器法检测雌二醇。核酸适配体不但具有高灵敏度和高选择性,而且能有效保护胶体金,使之不发生聚集。胶体金结合适配体的比色法是基于分子识别技术,能很好地捕捉色差引起的信号变化。目前此技术已经在金属离子和小分子物质的检测中有报道,然而对于食品中残留的雌二醇的检测未被研究。
基于此,本实验探究了雌二醇的核酸适配体碱基长度对胶体金比色法检测雌二醇的影响,以及利用最适碱基长度的核酸适配体通过胶体金比色法检测牛乳中的雌二醇。此实验的建立,旨在快速检测食物中雌二醇的残留,为一些由雌二醇引起的疾病诊断提供更加快速、灵敏的方法,提高人类对雌二醇的认识和改善雌二醇的评价体系。
1.1 材料与试剂
蒙牛牛乳 宁波市购;氯金酸、柠檬酸三钠、氯化钠(均为分析纯) 国药集团化学试剂有限公司;雌二醇、孕酮、双酚A、呋喃它酮、氯霉素标准品 中国标准物质网;实验用水均为超纯水。
表1 核酸适配体序列和DNA随机序列[30]
Table 1 Aptamer nucleic acid sequences and random DNA sequences

注:序列均由生工生物工程有限公司合成。
1.2 仪器与设备
RCT加热磁力搅拌器 广州仪科实验室技术有限公司;WH-1微型旋涡混合仪 上海沪西分析仪器厂有限公司;Heraeus Fresco17低温高速离心机 德国贺利氏公司;UV5100紫外-可见分光光度计 安徽皖仪科技股份有 限公司。
1.3 方法
1.3.1 胶体金的制备
本实验采用传统的柠檬酸三钠还原四氯金酸法制得15 nm的胶体金[31]。具体步骤如下:取250 mL的锥形瓶先用双蒸水洗干净,再用王水浸泡24 h后洗净烘干备用;向锥形瓶中加入1 mL 0.5%的氯金酸和60 mL的双蒸水,在加热磁力搅拌器上加热至沸腾;维持1 500 r/min的转速不变,向沸腾后的溶液中迅速加入一定量1%的柠檬酸钠溶液;溶液的颜色在2 min内发生明显变化,当颜色不再变化时继续加热煮沸5 min,冷却后补水至原体积,在4 ℃冰箱保存备用。
1.3.2 胶体金的表征
将制备好的胶体金浓缩5 倍,用紫外-可见分光光度计测得制备的胶体金在400~750 nm的吸光度,根据最大的吸收峰位置判断胶体金颗粒的均一性;利用粒度分析(dynamic light scattering,DLS)仪测得胶体金的粒径大致分布情况,具体步骤如下:取1 mL浓缩后的胶体金溶液于比色皿中,放入DLS仪器中测得其数据,再通过Origin 8.0处理数据,即可绘制出胶体金颗粒的尺寸与胶体金尺寸分布强度的关系曲线。
1.3.3 雌二醇的检测
经柠檬酸钠还原法制备的胶体金在25~35 nm(即分散状态)呈酒红色。当溶液中有NaCl存在时,胶体金表面的负电荷被溶液中的阳离子中和,导致胶体金之间的静电作用力降低,引起胶体金聚集,溶液颜色根据胶体金的聚集程度不同呈现紫色或者灰色。核酸适配体可以通过静电吸附到胶体金的表面,起到保护胶体金的作用,增强了胶体金对NaCl的稳定性,当加入高浓度的NaCl后,胶体金溶液依然呈现酒红色。再加入目标物后,由于目标物与核酸适配体之间的亲和力更 强,核酸适配体从胶体金表面脱落下来,引起胶体金的聚集,溶液颜色发生变化的程度与待检测溶液中的雌二醇的含量呈正相关,通过肉眼观察溶液颜色的变化情况就可以做出定性判断。通过紫外-可见分光光度计得到溶液的吸收光谱图可以定量计算出溶液中雌二醇的含量。基于DNA核酸适配体序列的胶体金比色法检测雌二醇的原理图,如图1所示。

图1 基于DNA核酸适配体序列的胶体金比色法检测雌二醇的原理
Fig. 1 Principle of estradiol detection by colloidal gold assay based on DNA aptamer sequence
1.3.4 NaCl浓度的优化
通过单链雌二醇核酸适配体保护的胶体金能在高浓度NaCl条件下保持稳定,但是NaCl浓度太高也会引起胶体金的聚集。当在一个合适的NaCl浓度条件下,没有核酸适配体保护的胶体金刚好发生聚集,而有核酸适配体保护的胶体金不会聚集。取6 支试管,分别加入100 μL浓缩后的胶体金(取制备好的胶体金1 mL,在9.0×g离心5 min,除去上清液,加双蒸水至200 μL,即得到浓缩5 倍的胶体金),再分别加入一定量不同浓度的NaCl, NaCl终浓度为0、10、20、30、40、50 mmol/L,轻轻摇晃,室温 孵育10 min后观察试管溶液颜色的变化。
1.3.5 雌二醇核酸适配体浓度的优化
取18 支试管,平均分成3 组,第1组为75-mer核酸适配体,第2组为35-mer核酸适配体,第3组为22-mer核酸适配体,向每支试管中加入80 μL浓缩后的胶体金,再向3组实验中分别依次加入不同浓度的核酸适配体,室温孵育90 min,最终每支试管中形成100 μL的胶体金-核酸适配体溶液,且每组实验中核酸适配体的浓度为50、40、30、20、10、0 nmol/L,最后向每支试管中加入30 mmol/L的NaCl,轻轻摇晃,室温孵育10 min后观察试管中溶液颜色变化。
1.3.6 核酸适配体的长度对雌二醇检测的影响
取18 支试管,平均分成3 组,第1组为75-mer的核酸适配体,第2组为35-mer核酸适配体,第3组为22-mer核酸适配体,向每支试管中加入80 μL浓缩后的胶体金,再向3组实验中分别依次加入适量终浓度为20 nmol/L 75-mer核酸适配体、终浓度为30 nmol/L的35-mer核酸适配体和终浓度为30 nmol/L的22-mer核酸适配体,混匀,室温孵育90 min,每支试管的总体积为100 μL,再向每支试管中分别加入30 mmol/L的NaCl,轻轻摇晃,室温孵育10 min,最后向75-mer核酸适配体中分别加入0、13.6、27.2、54.4、81.6、108.8 ng/mL的雌二醇,向35-mer和22-mer核酸适配体中分别加入0、13.6、27.2、54.4、108.8、163.2 pg/mL的雌二醇,室温孵育15 min后观察试管溶液颜色变化。
1.3.7 定量检测
利用胶体金比色法检测雌二醇,在用肉眼观察的情况下可以实现定性及半定量的检测,而比色检测的结果经紫外-可见分光光度计可以实现定量的检测。由核酸适配体长度优化的结果可知,35-m er和22-mer核酸适配体对雌二醇的检测效果更好,因此选择35-mer和22-mer核酸适配体进行标准样本的检测。取24支试管,平均分成4组,第1组为35-mer核酸适配体,第2组为35-mer随机序列,第3组为22-mer核酸适配体,第4组为22-mer随机序列,向每支试管中加入80 μL浓缩后的胶体金,再向第1组中各加入适量终浓度为30 nmol/L的35-mer核酸适配体,第2组中各加入适量终浓度为30 nmol/L的35-mer随机序列,第3组试管中各加入适量终浓度为30 mmol/L的22-mer核酸适配体,第4组中各加入适量终浓度为30 nmol/L的22-mer随机序列,室温孵育90 min,向每支试管中加入30 mmol/L的NaCl,轻轻摇晃,室温孵育10 min,最后向每组试管中分别加入0、1.36、2.72、13.6、27.2、54.4 pg/mL的雌二醇,室温孵育15 min后观察试管内溶液颜色变化,利用紫外-可见分光光度计测得不同浓度的雌二醇在625 nm和523 nm波长下的吸光度,通过625 nm和523 nm的吸光度比值(A625nm/A523nm)和雌二醇的质量浓度建立标准曲线,即可实现雌二醇的定量检测,独立重复实验3 次。
1.3.8 特异性实验
用胶体金比色法检测雌二醇时,雌二醇的一些类似物如孕酮、双酚A等也可能会对检测结果产生影响,本实验验证了比色法检测雌二醇的特异性,通过以上优化条件,选择35-mer核酸适配体作为下面实验的条件,具体的方案如下:取6支试管,向每支试管中加入80 μL浓缩后的胶体金,再加入适量终浓度为30 nmol/L的35-mer核酸适配体,室温孵育90 min,再向每支试管中加入30 mmol/L的NaCl,轻轻摇晃,室温孵育10 min,最后向第1支试管中加入13.6 pg/mL的雌二醇,向第2~5支试管中加入13.6 ng/mL的雌二醇,向第6支试管中加入水,室温孵育15 min后观察颜色变化,并利用紫外-可见分光光度计实现定量分析。独立重复实验3 次。
1.3.9 实际样品的检测
胶体金比色法检测可以实现现场快速检测,本实验以牛乳为检测对象来测试比色检测法对实际样品检测的实用性。具体步骤如下:取20 mL牛乳,加入雌二醇标准样品,将混合样品混匀摇晃20 min后,在3 000 r/min离心20 min,取上清液用0.22 μm针头式过滤器过滤,再用氮气吹干,最后用20 mL双蒸水溶解,制成不同质量浓度的雌二醇的实际样品,且雌二醇的质量浓度分别为0、1.36、2.72、13.6、27.2、54.4 pg/mL;实际样品检测的具体步骤与标准样品一样。
2.1 胶体金的表征

图2 胶体金的紫外吸收光谱(a)和胶体金的粒度分布(b)图
Fig. 2 UV absorption spectrum (a) and particle size distribution (b) of colloidal gold particles
本实验制备的胶体金溶液呈酒红色,扫描胶体金溶液在400~750 nm的紫外-可见吸收光谱,利用DLS测得胶体金的粒径分布情况。由图2a可知,所制得的胶体金溶液在523 nm波长处有最大吸收峰,并且吸收峰尖锐,没有杂峰出现,说明所制备胶体金粒径均一。由图2b可知,所制得的胶体金粒径分布均匀,集中在25~35 nm之间,满足实验需要。
2.2 NaCl浓度的优化结果
没有单链核酸探针保护的胶体金在适当的盐离子浓度下就会聚集,导致溶液颜色变蓝,而有核酸探针保护的胶体金在此浓度不会产生聚集。由图3可知,随着NaCl浓度的增加,胶体金溶液的颜色由酒红色逐渐变紫,当NaCl浓度为30 mmol/L时,胶体金出现聚集,溶液颜色变成淡紫色,所以NaCl的最适浓度为30 mmol/L。

图3 NaCl浓度的优化
Fig. 3 Optimization of NaCl concentration
2.3 不同长度的核酸适配体浓度的优化结果

图4 不同长度的核酸适配体浓度的优化
Fig. 4 Optimization of the concentrations of nucleic acid aptamers of different lengths
如图4所示,当NaCl浓度为30 mmol/L时,胶体金刚好发生聚集,在此NaCl浓度条件下,随着核酸适配体的加入,适配体会吸附在胶体金的表面,再加入此浓度的NaCl,胶体金刚好不会聚集,只有加入雌二醇后才会引起胶体金的聚集,此时的核酸适配体浓度即为最适浓度。由图4可知,当75-mer核酸适配体浓度为20 nmol/L时,胶体金溶液刚好不发生聚集,此时的核酸适配体浓度即为最适浓度;35-mer核酸适配体和22-mer核酸适配体的最适浓度均为30 nmol/L。
2.4 核酸适配体长度的优化结果

图5 核酸适配体长度对雌二醇检测的影响
Fig. 5 Effect of the length of the nucleic acid aptamer on the detection of estradiol
雌二醇核酸适配体的长度会直接影响核酸适配体与胶体金结合的能力,进一步影响目标物的检测灵敏度。在最适核酸适配体浓度和NaCl浓度条件下,用不同长度的核酸适配体检测雌二醇,当加入不同质量浓度的雌二醇时,雌二醇与核酸适配体特异性结合,引起胶体金的聚集,通过比较雌二醇的检测限,选择最适的核酸适配体长度进行雌二醇标准样品和实际样品的检测。由图5可知,75-mer、35-mer、22-mer核酸适配体对应的雌二醇的检测限分别为54.4 ng/mL、27.2 pg/mL和54.4 pg/mL。当选择75-mer核酸适配体时,由于核酸适配体太长,即使加入较高质量浓度的雌二醇也很难将胶体金表面的核酸适配体竞争下来,可能会导致核酸适配体不仅和胶体金结合还与雌二醇结合,影响胶体金的聚集,从而降低了雌二醇的检测灵敏度。35-mer和22-mer核酸适配体由于长度适中,雌二醇的检测限相对很低,所以最终选择这两个长度的核酸适配体进行雌二醇的检测。
2.5 定量检测结果
由于肉眼鉴别不能得到定量的结果,只能根据颜色变化的程度进行定性或半定量的判断,因此需要通过紫外-可见分光光度计定量判断。由图6a可知,35-mer核酸适配体和22-mer核酸适配体通过肉眼判断雌二醇的检测限分别为2.72、27.2 pg/mL。紫外图谱进一步定量验证了肉眼判断的结果,由图6b可知,当选择35-mer核酸适配体时,在0~54.4 pg/mL的线性范围内,雌二醇的质量浓度与A625nm/A523nm呈现良好的线性关系,线性相关系数R2为0.98,22-mer核酸适配体在相同线性范围内,雌二醇的质量浓度与A625nm/A523nm的线性关系比35-mer核酸适配体要差,线性相关系数R2为0.96,可能是因为核酸适配体太短,胶体金与核酸适配体的结合物相对很小,在加入目标物后,目标物难以找到核酸适配体并与之结合,降低了检测灵敏度。因此,当选择35-mer核酸适配体时,雌二醇的检测限更低,而且线性相关性更好。
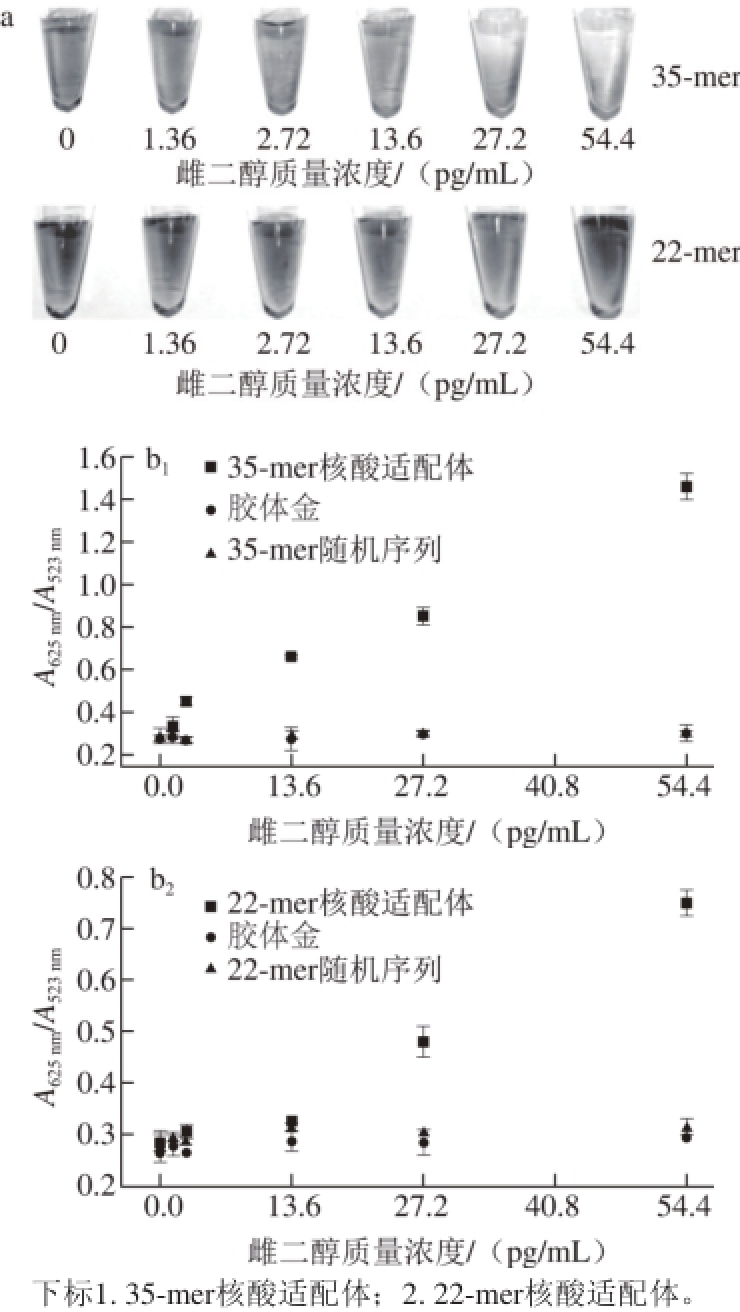
图6 雌二醇的定性(a)与定量(b)检测
Fig. 6 Qualitative (a) and quantitative (b) detection of estradiol
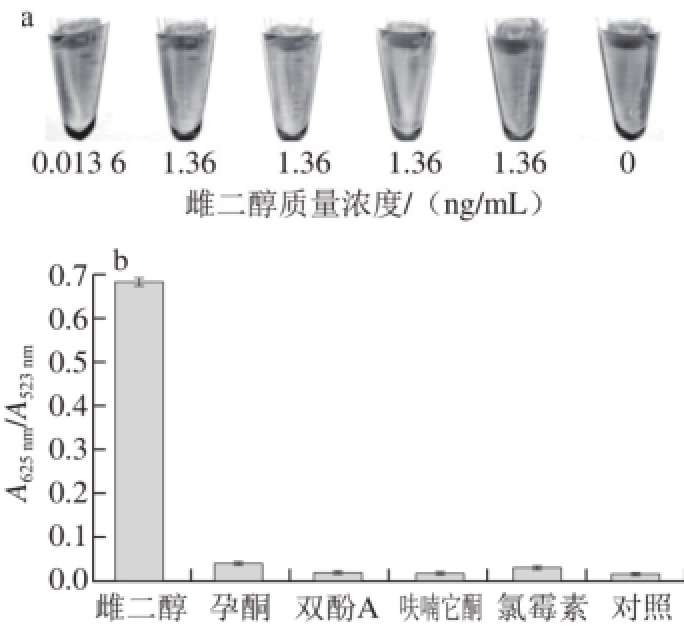
图7 雌二醇的定性(a)与定量(b)特异性检测
Fig. 7 Specifi c detection of estradiol
雌二醇的一些类似物如孕酮、双酚A等在结构上与雌二醇十分相似,为了验证这些类似物是否会对雌二醇的检测造成干扰,实验在检测体系中加入高质量浓度的雌二醇类似物,结果如图7所示。从图7a可知,当选择35-mer核酸适配体时,雌二醇质量浓度为13.6 pg/mL时,实验组胶体金的颜色与对照组相比就已经变紫,而加入1.36 ng/mL的雌二醇类似物的胶体金的颜色与对照组相比并没有明显变化,紫外-可见分光光度计测得的结果(图7b)与肉眼判断的结果基本一致,因此本方法具有很高的特异性。
2.7 实际样品检测结果
为了验证本方法的实用性,现将雌二醇标准样品加入到牛乳中,制备成实际样品,检测的结果如图8所示。由图8a可知,对照组的颜色呈酒红色,实验组中雌二醇质量浓度为13.6 pg/mL时,胶体金发生明显的聚集,与紫外图谱测得的结果(图8b)一致,说明本方法对牛乳中雌二醇的最低检测限为13.6 pg/mL,完全可以满足实际样品检测的需求。

图8 实际样品(牛乳)中雌二醇的定性(a)与定量(b)检测Fig. 8 Qualitative (a) and quantitative (b) detection of estradiol in real milk samples
利用最适长度雌二醇适配体的特异性和胶体金聚集前后颜色及吸光度变化来实现雌二醇的定量检测。当NaCl浓度为30 mmol/L,35-mer雌二醇适配体浓度为30 nmol/L时,雌二醇的最低检测限为2.7 pg/mL,且检测特异性、稳定性和重复性均良好,本方法可以实现雌二醇的快速灵敏检测。在用牛乳样品作为实际样品检测时,最低检测限可达到13.6 pg/mL,说明本方法在食品安全检测中具有较强的实用性,并且为研制更多快速、便携、现场检测的方法提供了参考。
参考文献:
[1] YUAN L, ZHANG J, ZHOU P, et al. Electrochemical sensor based on molecularly imprinted membranes at platinum nanoparticles-modifi ed electrode for determination of 17β-estradiol[J]. Biosensors and Boelectronics, 2011, 29(1): 29-33. DOI:10.1016/j.bios.2011.07.058.
[2] GANMAA D, WANG P Y, QIN L Q, et al. Is milk responsible for male reproductive disorders[J]. Medical Hypotheses, 2001, 57(4): 510-514. DOI:10.1054/mehy.2001.1380.
[3] ROBINSON J A, MA Q, STAVELEY J P, et al. Degradation and transformation of 17α-estradiol in water-sediment systems under controlled aerobic and anaerobic conditions[J]. Environmental Toxicology and Chemistry, 2016. DOI:10.1002/etc.3383.
[4] ARDITSOGLOU A, VOUTSA D. Occurrence and partitioning of endocrine-disrupting compounds in the marine environment of thermaikos gulf, northern aegean sea, greece[J]. Marine Pollution Bulletin, 2012, 64(11): 2443-2452. DOI:10.1016/ j.marpolbul.2012.07.048.
[5] SALEHI F, TURNER M C, PHILLIPS K P, et al. Review of the etiology of breast cancer with special attention to organochlorines as potential endocrine disruptors[J]. Journal of Toxicology and Environmental Health Part B, 2008, 11(3): 276-300. DOI:10.1080/10937400701875923.
[6] CUTOLO M, WILDER R L. Different roles for androgens and estrogens in the susceptibility to autoimmune rheumatic diseases[J]. Rheumatic Disease Clinics of North America, 2000, 26(4): 825-839. DOI:10.1016/S0889-857X(05)70171-X.
[7] 张珊珊, 于慧娟, 惠芸华, 等. 液相色谱串联质谱法测定水产品中苯甲酸雌二醇的残留[J]. 食品科学, 2013, 34(22): 208-212. DOI:10.7506/spkx1002-6630-201322042.
[8] GAO W, STALDER T, KIRSCHBAUM C. Quantitative analysis of estradiol and six other steroid hormones in human saliva using a high throughput liquid chromatography-tandem mass spectrometry assay[J]. Talanta, 2015, 143: 353-358. DOI:10.1016/j.talanta.2015.05.004.
[9] 曾三妹, 徐敦明, 魏一婷, 等. 全自动固相萃取-高效液相色谱-串联质谱法测定食糖中的雌二醇[J]. 色谱, 2016, 34(7): 703-707. DOI:10.3724/SP.J.1123.2016.03011.
[10] MONERRIS M J, ARÉVALO F J, FERNÁNDEZ H, et al. Development of a very sensitive electrochemical immunosensor for the determination of 17β-estradiol in bovine serum samples[J]. Sensors and Actuators B Chemical, 2015, 208(14): 525-531. DOI:10.1016/ j.snb.2014.11.048.
[11] HAN Q, XIN S, ZHU W, et al. Magnetic sensing fi lm based on Fe3O4@ Au-GSH molecularly imprinted polymers for the electrochemical detection of estradiol[J]. Biosensors and Bioelectronics, 2015, 79: 180-186. DOI:10.1016/j.bios.2015.12.017.
[12] FLOREA A, CRISTEA C, VOCANSON F, et al. Electrochemical sensor for the detection of estradiol based on electropolymerized molecularly imprinted polythioaniline fi lm with signal amplifi cation using gold nanoparticles[J]. Electrochemistry Communications, 2015, 59: 36-39. DOI:10.1016/j.elecom.2015.06.021.
[13] MORAES F C, ROSSI B, DONATONI M C, et al. Sensitive determination of 17β-estradiol in river water using a graphene based electrochemical sensor[J]. Analytica Chimica Acta, 2015, 881: 37-43. DOI:10.1016/j.aca.2015.04.043.
[14] CHIU M L, TSENG T T, MONBOUQUETTE H G. A convenient homogeneous enzyme immunoassay for estradiol detection[J]. Biotechnology and Applied Biochemistry, 2011, 58(1): 75-82. DOI:10.1002/bab.5.
[15] ZHU S, ZHANG Q, GUO L H. Part-per-trillion level detection of estradiol by competitive fluorescence immunoassay using DNA/dye conjugate as antibody multiple labels[J]. Analytica Chimica Acta, 2008, 624(1): 141-146. DOI:10.1016/j.aca.2008.06.028.
[16] SEN Z, BIN D, HE L, et al. Metal ions-based immunosensor for simultaneous determination of estradiol and diethylstilbestrol[J]. Biosensors and Bioelectronics, 2014, 52(4): 225-231. DOI:10.1016/ j.bios.2013.08.042.
[17] SHARMA A K, KENT A D, HEEMSTRA J M, et al. Enzyme-linked small-molecule detection using split aptamer ligation[J]. Analytical Chemistry, 2012, 84(14): 6104-6109. DOI:10.1021/ac300997q.
[18] WU P, HWANG K, LAN T, et al. A dnazyme-gold nanoparticle probe for uranyl ion in living cells[J]. Journal of the American Chemical Society, 2013, 135(14): 5254-5257. DOI:10.1021/ja400150v.
[19] WANG L, LIU X, HU X, et al. Unmodified gold nanoparticles as a colorimetric probe for potassium DNA aptamers[J]. Chemical Communications, 2006, 36(36): 3780-3782. DOI:10.1039/b607448k.
[20] MEI Z, CHU H, CHEN W, et al. Ultrasensitive one-step rapid visual detection of bisphenol A in water samples by label-free aptasensor[J]. Biosensors and Bioelectronics, 2013, 39(1): 26-30. DOI:10.1016/ j.bios.2012.06.027.
[21] DU Y, CHEN C, ZHOU M, et al. Microfluidic electrochemical aptameric assay integrated on-chip: a potentially convenient sensing platform for the amplified and multiplex analysis of small molecules[J]. Analytical Chemistry, 2011, 83(5): 1523-1529. DOI:10 .1021/ac101988n.
[22] LEE C Y, WU K Y, SU H L, et al. Sensitive label-free electrochemical analysis of human IgE using an aptasensor with cDNA amplifi cation[J]. Biosensors and Bioelectronics, 2013, 39(1): 133-138. DOI:10.1016/j. bios.2012.07.009.
[23] QI Y, LI P B. A sensitive, label-free, aptamer-based biosensor using a gold nanoparticle-initiated chemiluminescence system[J]. Chemistry, 2011, 17(5): 1642-1648. DOI:10.1002/chem.201001856.
[24] ZHENG D M, ZOU R X, LOU X H. Label-free fi uorescent detection of ions, proteins, and small molecules using structure-switching aptamers, sybr gold, and exonuclease I[J]. Analytical Chemistry, 2012, 84(8): 3554-3560. DOI:10.1021/ac300690r.
[25] NIEMEYER C M, CEYHAN B. DNA-directed functionalization of colloi dal gold with proteins[J]. Angewandte Chemie International Edition, 2004, 40(19): 3685-3688. DOI:10.1002/1521-3773(20011001)40:19<3685::AID-ANIE3685>3.0.CO;2-E.
[26] SONG K M, JEONG E, JEON W, et al. Aptasensor for ampicillin using gold nanoparticle based dual fluorescence-colorimetric methods[J]. Analytical and Bioanalytical Chemistry, 2012, 402(6): 2153-2161. DOI:10.1007/s00216-011-5662-3.
[27] WANG J, GUI Z, XIE X, et al. Selection and identification of streptomycin-specific single-stranded DNA aptamers and the application in the detection of streptomycin in honey[J]. Talanta, 2013, 108(8): 109-116. DOI:10.1016/j.talanta.2013.01.064.
[28] KIM Y S, KIM J H, KIM I A, et al. A novel colorimetric aptasensor using gold nanoparticle for a highly sensitive and specifi c detection of oxytetracycline[J]. Biosensors and Bioelectronics, 2010, 26(4): 1644-1649. DOI:10.1016/j.bios.2010.08.046.
[29] HUANG K J, LIU Y J, ZHANG J Z, et al. Aptamer/au nanoparticles/ coba lt sulfide nanosheets biosensor for 17β-estradiol detection using a guanine-rich complementary DNA sequence for si gnal amplification[J]. Biosensors and Bioelectronics, 2015, 67: 184-191. DOI:10.1016/j.bios.2014.08.010.
[30] ALSAGER O A, KUMAR S, ZHU B, et al. Ultrasensitive colorimetric detection of 17β-estradiol: the effect of shortening DNA aptamersequences[J]. Analytical Chemistry, 2015, 87(8): 1716-1723. DOI:10.1021/acs.analchem.5b00335.
[31] SAHA K, AGASTI S S, KIM C, et al. Gold nanoparticles in chemical and biological sensing[J]. Chemical Reviews, 2012, 112(5): 2739-2779. DOI:10.1021/cr2001178.
A Supersensitive Colorimetric Method Based on DNA Aptamers for Estradiol Detection in Milk
FU Tian1, CAO Jinxuan1, PAN Daodong1,2,*, CHENG Kewen1, ZENG Xiaoqun1, WU Zhen1, SUN Yangying1
(1. Key Laboratory of Animal Protein Food Deep Processing Technology of Zhejiang Province, Ningbo 315211, China; 2. Branch of National Dairy Processing Technology Developing Center, Nanjing Normal University, Nanjing 210097, China)
Abstract:A novel method was developed for the qualitative and quantitative determination of estradiol based on its specifi c recognition by the DNA aptamer of optimum length as well as the changes in the color and absorbance of colloidal gold before and after aggregation. In this work, colloidal gold particles were prepared and the 75-mer, 35-mer and 22-mer estradiol-specific nucleic acid aptamers were designed for the ultrasensitive colorimetric det ection of estradiol. The colorimetric method was based on the fact that the optimal concentration of sodium chloride leads to the aggregation of colloidal gold without the protection of the aptamer, while the colloidal gold does not aggregate under the protection of the aptamer. The results showed that the concentration of estradiol in the range of 13.6‒54.4 pg/mL exhibited a good linear relationship with the absorbance ratio (A625nm/A523nm) of colloidal gold at 625 nm and 523 nm with a limit of detection (LOD) of 2.7 pg/mL, under the condition of 30 mmol/L sodium chloride and 30 nmol/L 35-mer nucleic acid aptamer. The developed colorimetric sensor had the advantages of high specifi city, stability and reproducibility. The practicality of this proposed method was further confi rmed through the detection of estradiol in milk samples with LOD of 13.6 pg/mL. Therefore, this colorimetric method will be useful for the rapid and sensitive detection of estradiol in milk products.
Key words:estradiol; colloidal gold; DNA aptamer; colorimetry
DOI:10.7506/spkx1002-6630-201708041
中图分类号:TS252.7
文献标志码:A
文章编号:1002-6630(2017)08-0264-07
引文格式:
付田, 曹锦轩, 潘道东, 等. 基于DNA核酸适配体序列的超灵敏比色法检测牛乳中的雌二醇[J]. 食品科学, 2017, 38(8): 264-270. DOI:10.7506/spkx1002-6630-201708041. http://www.spkx.net.cn
FU Tian, CAO Jinxuan, PAN Daodong, et al. A supersensitive colorimetric method based on DNA aptamers for estradiol detection in milk[J]. Food Science, 2017, 38(8): 264-270. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201708041. http://www.spkx.net.cn
收稿日期:2016-07-04
基金项目:“十二五”国家科技支撑计划项目(2015BAD17B02-3);浙江省攻关项目(2014C02020)
作者简介:付田(1990—),女,硕士研究生,研究方向为食品安全检测。E-mail:17855847969@163.com
*通信作者:潘道东(1964—),男,教授,博士,研究方向为畜乳产品加工与安全。E-mail:daodongpan@163.com