改良QuEChERS技术结合液相色谱-串联质谱联用法同时快速检测辣椒制品中14 种非法添加工业染料
陈 林1,温家欣2,吴 霞3,雷 毅2,4,*,张 荣4,*
(1.南阳市食品药品检验所,河南 南阳 473059;2.广东省药品检验所,广东 广州 510180;3.安捷伦科技有限公司,广东 广州 510613;4.广东药科大学药科学院,广东 广州 510006)
摘 要:采用改良QuEChERS技术作为前处理方法,建立了辣椒制品中14 种非法添加工业染料的液相色谱-串联质谱联用快速检测方法。样品采用乙腈-丙酮(7∶3,V/V)提取,经EMR-Lipid净化,以Agilent Poroshell 120 EC C18(50 mm×2.1 mm,2.7 μm)色谱柱分离,采用多反应监测模式检测,外标法定量分析。14 种成分在11 min内完成分离,检出限为0.4~7.1 μg/kg,不同加标水平的平均回收率为70.5%~102.1%,相对标准偏差为0.3%~9.3%。本方法准确、快速、重复性好,可为辣椒制品中非法添加工业染料的检测提供一种更加快速、简便的技术支持。
关键词:QuEChERS;EMR-Lipid;液相色谱-串联质谱联用;辣椒制品;非法添加工业染料
工业染料作为一类广泛应用于毛皮制品、纺织品、及木制品等生产的染料,因其染色牢固、价格低廉的优点,近年来被一些不法商贩用于食品生产加工,常有文献报道在辣椒制品中检出大红粉、苏丹红类、碱性橙类等工业染料[1-4]。已有文献对苏丹红类[5-6]、罗丹明类[7]等工业染料进行了毒理学研究,表明工业染料对人体具有三致(致癌、致畸、致突变)危害。卫生部已将苏丹红、碱性橙、罗丹明等工业染料列入食品非法添加黑名单。辣椒制品基质复杂,非法添加的工业染料与基质中的油脂类成分极性相似,因此样品前处理方法是检测的关键点和难点。凝胶渗透色谱(gel permeation chromatography,GPC)法与固相萃取(solid phase extraction,SPE)法是国家标准及文献[8-11]采用的净化方法,但这些方法耗时、耗试剂,不能实现快速分析,需要开发一种能同时快速提取与净化多目标成分的前处理方法。
QuEChERS(quick, easy,cheap,effective,rugged,safe)技术是由Anastassiades等在2003年首次提出的一种用于农药残留检测的快速前处理技术,后来逐渐被推广到兽药残留检测[12-13]、真菌毒素分析[14-16]、非法添加成分分析[17-18]等领域。在QuEChERS方法中,吸附剂材料是整个技术的关键之一。早期应用于农残检测的吸附剂PSA/C18主要根据农药结构与植物基质的特点设计,当应用于高脂肪含量样品时,选择性不够高,不适合该类基质样品的检测。适用性广泛、除杂效果优异的新型吸附剂材料等一直是QuEChERS技术研究的热点和难点,各大公司相继推出了各种新产品如SAX[19]、 、Waters Oasis PRIME HLB[21]等。Enhanced Matix Removal Lipid(EMR-Lipid)[22-26]是一种根据油脂类成分及大多数目标分析物结构特点设计的增强型脂质去除净化剂,对长链结构物质(如磷脂、游离脂肪酸、甘油三酯等)具有强大的吸附作用。EMR-Lipid能有效降低高脂肪含量基质对目标成分的干扰,但目前还鲜有报道将其应用于QuEChERS方法中。辣椒制品是以辣椒为原料,添加或不添加辅料加工而成的食品。辣椒素类物质属于弱极性有机物,通常辣椒制品基质为油脂。本实验选择14 种易滥用的工业染料作为目标检测对象,以高油脂含量的辣椒制品为样品基质,将EMR-Lipid引入QuEChERS技术,建立辣椒制品中14 种非法添加工业染料的液相色谱-串联质谱联用快速检测方法。
、Waters Oasis PRIME HLB[21]等。Enhanced Matix Removal Lipid(EMR-Lipid)[22-26]是一种根据油脂类成分及大多数目标分析物结构特点设计的增强型脂质去除净化剂,对长链结构物质(如磷脂、游离脂肪酸、甘油三酯等)具有强大的吸附作用。EMR-Lipid能有效降低高脂肪含量基质对目标成分的干扰,但目前还鲜有报道将其应用于QuEChERS方法中。辣椒制品是以辣椒为原料,添加或不添加辅料加工而成的食品。辣椒素类物质属于弱极性有机物,通常辣椒制品基质为油脂。本实验选择14 种易滥用的工业染料作为目标检测对象,以高油脂含量的辣椒制品为样品基质,将EMR-Lipid引入QuEChERS技术,建立辣椒制品中14 种非法添加工业染料的液相色谱-串联质谱联用快速检测方法。
1 材料与方法
1.1 材料与试剂
辣椒制品样品从广东省流通市场抽样获得。
乙腈、甲醇、丙酮(均为色谱纯) 美国Honeywell公司;乙酸铵、冰醋酸(分析纯) 天津市科密欧化学试剂有限公司;QuEChERS净化材料 美国安捷伦公司;酸性橙2、罗丹明B、柑橘红2标准品 德国Dr. Ehrenstorfer公司;碱性橙2、碱性橙21、碱性橙22标准品 上海安谱科学仪器有限公司;苏丹红Ⅰ、苏丹红Ⅱ、苏丹红Ⅲ、苏丹红Ⅳ标准品 中国计量科学研究院;苏丹橙G、苏丹红7B、对位红标准品 阿拉丁试剂(上海)有限公司;大红粉 上海源叶生物科技有限公司。
1.2 仪器与设备
LC-20A液相色谱仪 日本岛津公司;API 5500型质谱仪 美国AB Sciex公司;Sorvall ST16离心机 美国Thermo公司;CP225D电子分析天平 德国赛多利斯公司;Milli-Q纯水仪 美国Millipore公司。
1.3 方法
1.3.1 标准溶液的配制
分别准确称取各标准品10 mg,苏丹红Ⅰ、苏丹红Ⅱ、苏丹红Ⅲ、苏丹红Ⅳ、苏丹红7B、大红粉用乙腈配制成200 mg/L标准储备液,其他染料标准品用甲醇配制成1 000 mg/L标准储备液,4 ℃保存备用。临用时,取各单标储备液适量,用初始比例流动相配制成不同质量浓度混合标准溶液。
1.3.2 样品前处理
1.3.2.1 提取
称取3.0 g样品于离心管中,先加入8 mL水(如为辣椒粉样品需加入10 mL水)涡旋混匀,再加入10 mL乙腈-丙酮(7∶3,V/V)涡旋混匀,最后加入盐析剂(4.0 g无水硫酸镁、1.0 g氯化钠、1.0g柠檬酸钠)迅速混匀,超声提取10 min,4 000 r/min离心5 min,静置分层后取上层溶液。再加入10 mL乙腈-丙酮(7∶3,V/V)重复提取一次,合并两次提取液,用乙腈定容至25 mL。
1.3.2.2 净化
取15 mL提取液,加入50 mL装有QuEChERS净化材料EMR-Lipid的离心管中(净化材料使用前采用3 mL水溶液活化),涡旋混匀,4 000 r/min离心3 min,静置分层后取上层溶液于离心管中,加入4.0 g无水硫酸镁与1.0 g氯化钠,迅速混匀,4 000 r/min离心3 min,静置分层后取上层溶液,用水定容至20 mL,混匀后过聚四氟乙烯滤膜。
1.3.3 液相色谱-串联质谱条件
1.3.3.1 色谱条件
色谱柱:A g i l e n t P o r o s h e l l 1 2 0 E C C18(50 mm×2.1 mm,2.7 μm);流速:0.3 mL/min;柱温:35 ℃;进样量:3 μL;流动相:A为甲醇,B为5 mmol/L乙酸铵;梯度洗脱程序:0~3 min,60% A;3~6 min,60%~95% A;6~9 min,95% A;9.5~11 min,60% A。
1.3.3.2 质谱条件
电喷雾离子源(electrospray ionization,ESI):酸性橙2采用负离子模式,其他成分采用正离子模式,取各工业染料的标准物质溶液(0.1 μg/mL),以微量挤压泵形式进样,进行一级全扫描,扫描方式:多反应监测;离子温度:550 ℃;气帘气压力:40 psi;碰撞气压力:9 psi;离子气1压力:65 psi;离子气2压力:65 psi;离子喷射电压:5 500 V(正离子模式),-4 500 V(负离子模式),优化得到的质谱分析参数见表1,其中以信号响应较强的子离子作为定量离子。
表1 14 种染料的多反应监测质谱参数
Table 1 Mass spectrometry parameters in MRM mode for 14 dyes
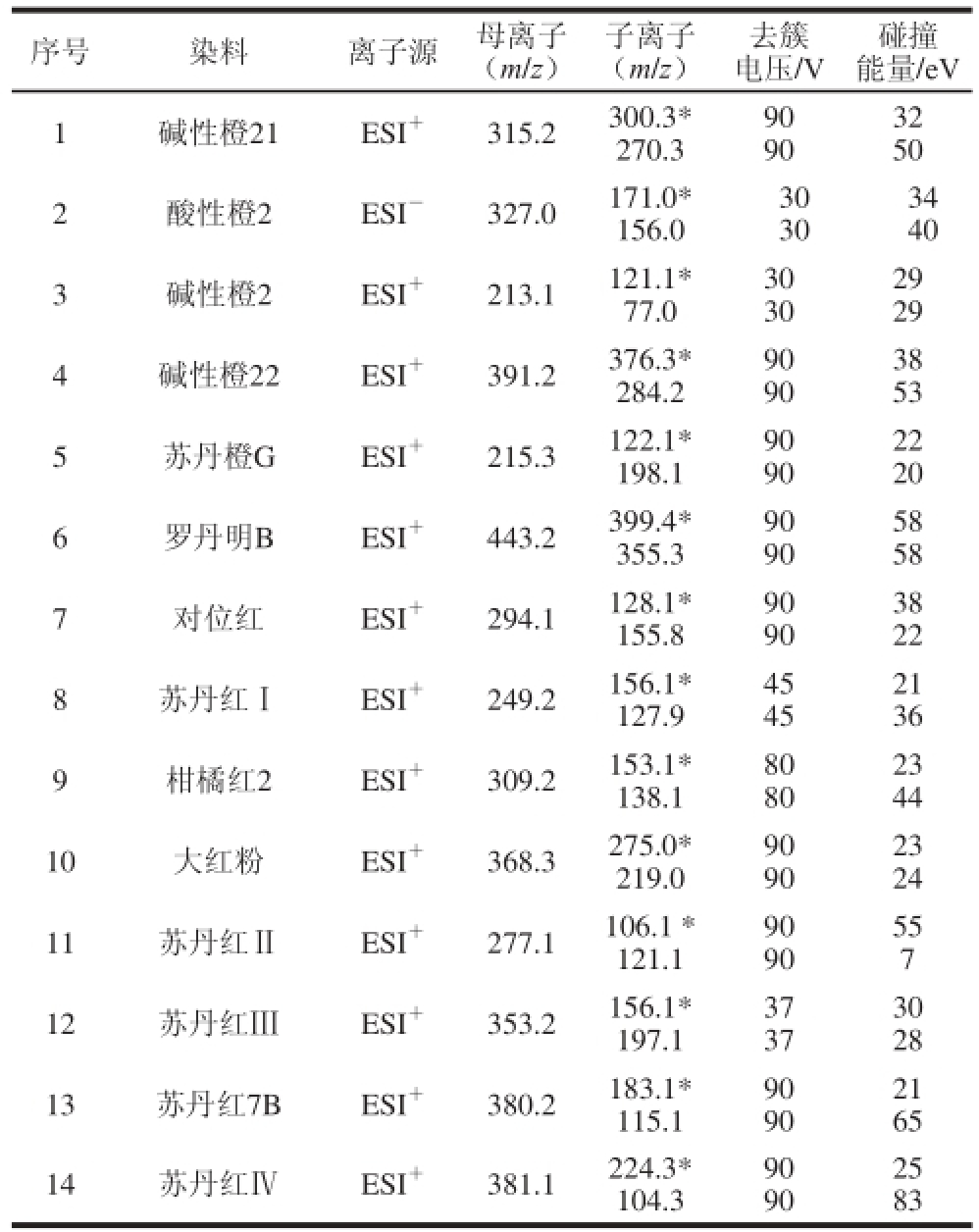
注:*.定量离子。
序号染料离子源母离子(m/z)碰撞能量/eV 1碱性橙21ESI+315.2300.3*270.3子离子(m/z)去簇电压/V 32 50 2酸性橙2ESI-327.0171.0*156.0 90 90 34 40 3碱性橙2ESI+213.1121.1*77.0 30 30 29 29 4碱性橙22ESI+391.2376.3*284.2 30 30 38 53 5苏丹橙GESI+215.3122.1*198.1 90 90 22 20 6罗丹明BESI+443.2399.4*355.3 90 90 58 58 7对位红ESI+294.1128.1*155.8 90 90 38 22 8苏丹红ⅠESI+249.2156.1*127.9 90 90 23 44 10大红粉ESI+368.3275.0*219.0 21 36 9柑橘红2ESI+309.2153.1*138.1 45 45 80 80 23 24 11苏丹红ⅡESI+277.1106.1*121.1 90 90 55 7 12苏丹红ⅢESI+353.2156.1*197.1 90 90 30 28 13苏丹红7BESI+380.2183.1*115.1 37 37 90 90 25 83 21 65 14苏丹红ⅣESI+381.1224.3*104.3 90 90
2 结果与分析
2.1 色谱柱的选择
14 种待测成分极性差异大,为实现快速分离,本研究选择分离性能优异的核壳填料亚3 μm色谱柱Agilent Poroshell 120 EC C18进行液相色谱条件优化,分别考察了5 cm和10 cm不同长度色谱柱分离情况,结果表明14 种成分在两条色谱柱上均得到了理想的分离。核壳填料亚3 μm色谱柱其实心的硅核结构减小了颗粒内部扩散路径,从而可在更短的色谱柱上实现快速分离。因此本实验选择Agilent Poroshell 120 EC C18(50 mm×2.1 mm,2.7 μm)色谱柱进行分离,14 种成分在11 min内完成了分析,ESI+、ESI-模式下总离子流色谱图(图1)及定量离子流图(图2)。
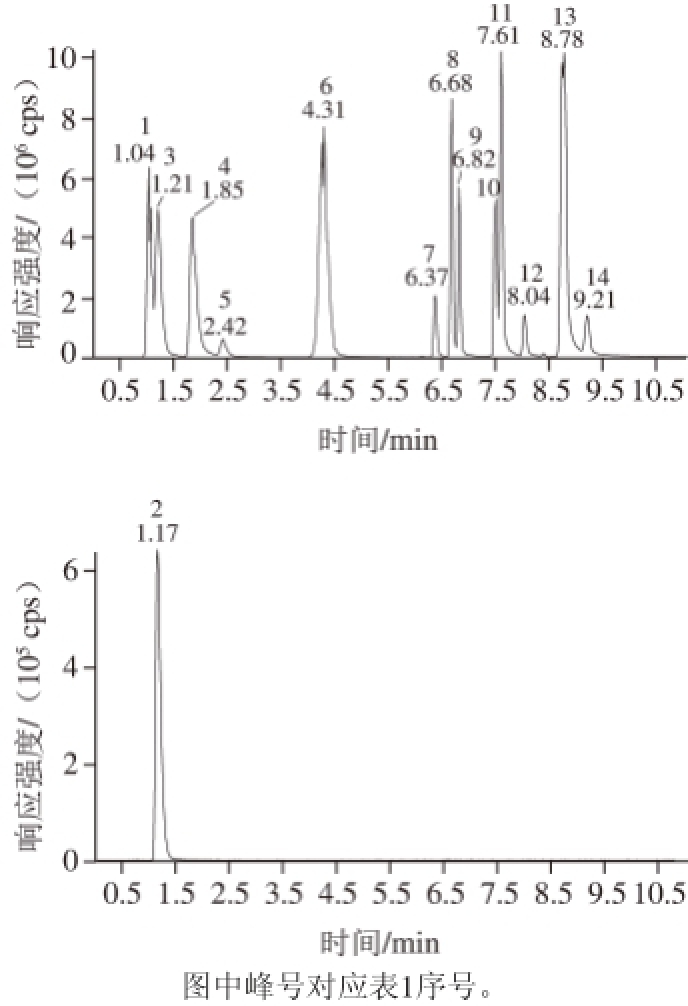
图1 14 种染料的总离子流图
Fig. 1 Total ion current (TIC) chromatograms for 14 kinds of dyes
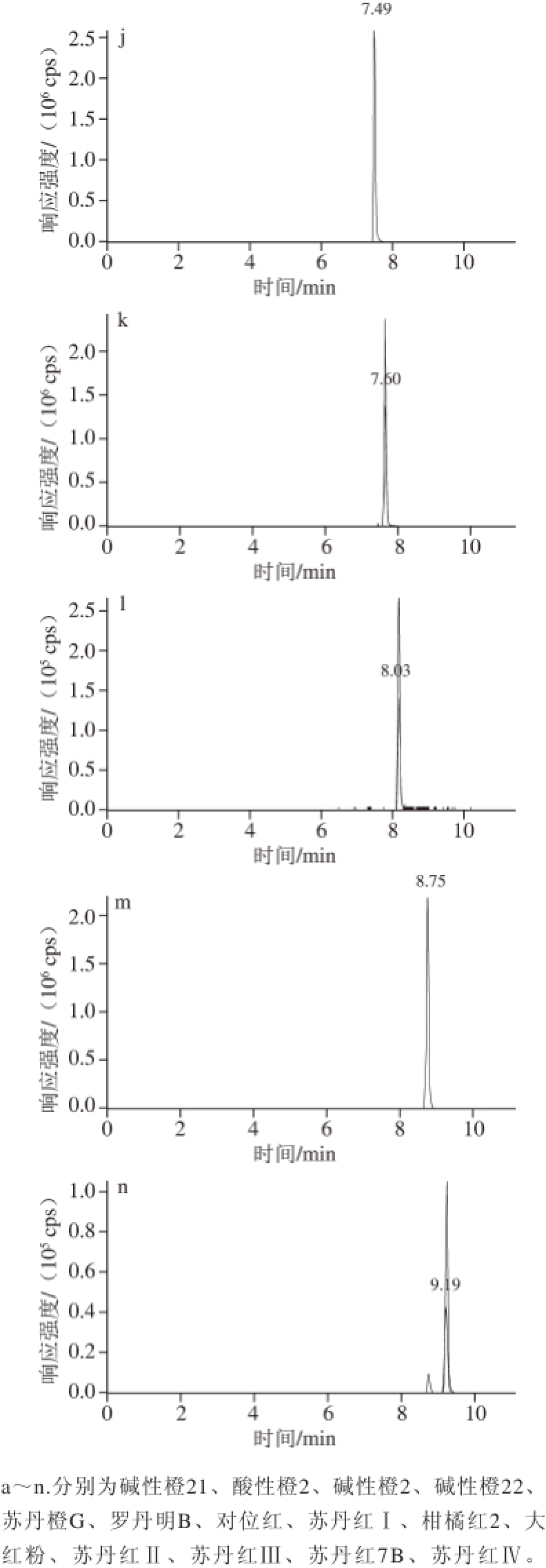
图2 14 种染料定量离子流图
Fig. 2 Chromatograms of quantitative ion pairs for 14 kinds of dyes
2.2 前处理条件优化
2.2.1 提取条件优化
本实验的14 种工业染料可分为中等极性与弱极性2 个组分,甲醇、乙腈、丙酮是常用的提取溶剂,但甲醇盐析效果不佳,因此研究首先考察了乙腈与丙酮对各染料的提取效果,发现丙酮提取液颜色较深,表明提出较多弱极性物质,其油脂溶解率比乙腈高,将会增加后续净化难度;乙腈对油脂含量较高的样品中弱极性染料提取率差。因此研究进一步考察了乙腈与丙酮不同比例(9∶1、8∶2、7∶3、6∶4、5∶5,V/V)混合溶剂对5 种弱极性染料的提取情况,结果见图3。由图3可见,随着丙酮溶剂比例的增加,提取回收率逐渐提高,当乙腈与丙酮体积比例达到7∶3时,提取回收率相当,综合考虑目标成分与样品杂质的提取回收率,选择体积比为7∶3的乙腈与丙酮混合溶剂作为提取溶剂。
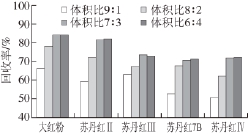
图3 不同比例乙腈-丙酮对5 种染料提取效率的影响
Fig. 3 Extraction effi ciencies of different proportions of acetonitrile to acetone for fi ve industrial dyes
2.2.2 净化条件的选择与优化
EMR-Lipid使用前需采用少量水进行活化,增强EMR-Lipid与脂质基质组分的疏水作用,最大限度确保目标物不损失。研究发现活化水溶液与样品提取液的体积比影响EMR-Lipid对目标分析物的吸附力强弱,故分别考察了活化水溶液与样品提取液不同体积比(11、12、13、14、1∶5,V/V)条件下,对14种染料对照品的回收情况,结果见图4。由图4可见,随着样品提取液比例的增加,EMR-Lipid净化材料对待测成分的吸附力减弱,当活化水溶液与样品提取液体积比达到15时,各成分回收率最理想。
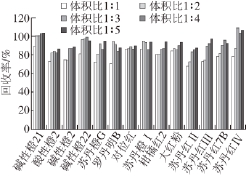
图4 活化水溶液与样品提取液比例对14 种染料回收率的影响
Fig. 4 Effect of different ratios of water to sample extract on the recoveries of 14 industrial dyes
为评价EMR-Lipid的净化效果及对14 种染料回收率情况,研究采用EMR-Lipid作为QuEChERS技术吸附剂,与GCB+PSA+C18、PSA+C18两种农残检测常用的吸附剂,及两种传统的净化方法SPE法[27]、GPC法[28]进行比较。从实验现象看:当处理脂肪含量高的样品时,在净化后的样品处理液中加入适当比例水溶液稀释,经滤膜过滤后,EMR-Lipid、GPC净化方法处理液澄清,其他方法处理液浑浊。从回收率结果(表2)看,在QuEChERS方法中:EMR-Lipid对各成分回收率最稳定,均能达到70%以上;GCB+PSA+C18对14 种染料回收率最差,均低于10%;PSA+C18对酸性橙2回收率小于50%;传统的两种净化方法SPE法与GPC法对酸性橙2、碱性橙21、碱性橙2及碱性橙22等成分回收率均低于50%。
此外,在操作步骤上,两种传统净化方法(SPE法、GPC法)的提取液通常先经浓缩与复溶,再进行净化,步骤繁琐。以EMR-Lipid为吸附剂的QuEChERS方法可直接净化提取液,有效吸附脂溶性杂质,省去了溶剂浓缩与转换过程,简化了操作步骤,显著提高了检测效率。
表2 不同净化方法对14 种染料回收率的影响
Table 2 Effect of different purifi cation techniques on the recoveries of 14 dyes

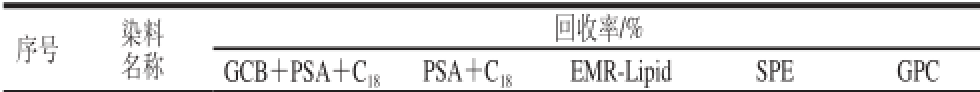 序号染料名称回收率/% GCB+PSA+C18PSA+C18EMR-LipidSPEGPC 1碱性橙212.191.289.717.920.5 2酸性橙2042.983.540.239.9 3碱性橙2076.470.515.720.3 4碱性橙22081.379.432.845.4 5苏丹橙G082.383.262.074.5 6罗丹明B7.571.893.067.372.1 7对位红078.282.064.774.3 8柑橘红24.675.570.166.071.7 9苏丹红Ⅰ4.158.385.653.272.5 10大红粉077.385.664.171.5 11苏丹红Ⅱ070.482.460.473.0 12苏丹红Ⅲ056.470.463.374.9 13苏丹红7B070.471.365.175.8 14苏丹红Ⅳ072.775.658.973.5
序号染料名称回收率/% GCB+PSA+C18PSA+C18EMR-LipidSPEGPC 1碱性橙212.191.289.717.920.5 2酸性橙2042.983.540.239.9 3碱性橙2076.470.515.720.3 4碱性橙22081.379.432.845.4 5苏丹橙G082.383.262.074.5 6罗丹明B7.571.893.067.372.1 7对位红078.282.064.774.3 8柑橘红24.675.570.166.071.7 9苏丹红Ⅰ4.158.385.653.272.5 10大红粉077.385.664.171.5 11苏丹红Ⅱ070.482.460.473.0 12苏丹红Ⅲ056.470.463.374.9 13苏丹红7B070.471.365.175.8 14苏丹红Ⅳ072.775.658.973.5
2.3 基质效应评价
表3 14 种化合物的基质效应评价
Table 3 Evaluation of matrix effects in the determination of the 14 compounds
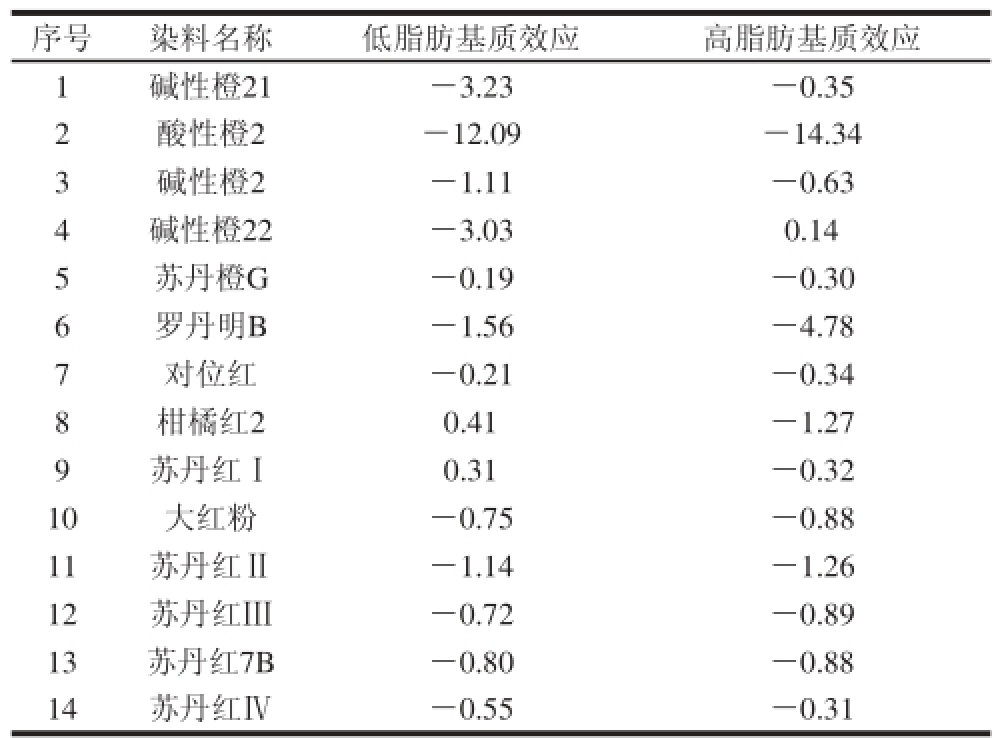
 序号染料名称低脂肪基质效应高脂肪基质效应1碱性橙21-3.23-0.35 2酸性橙2-12.09-14.34 3碱性橙2-1.11-0.63 4碱性橙22-3.030.14 5苏丹橙G-0.19-0.30 6罗丹明B-1.56-4.78 7对位红-0.21-0.34 8柑橘红20.41-1.27 9苏丹红Ⅰ0.31-0.32 10大红粉-0.75-0.88 11苏丹红Ⅱ-1.14-1.26 12苏丹红Ⅲ-0.72-0.89 13苏丹红7B-0.80-0.88 14苏丹红Ⅳ-0.55-0.31
序号染料名称低脂肪基质效应高脂肪基质效应1碱性橙21-3.23-0.35 2酸性橙2-12.09-14.34 3碱性橙2-1.11-0.63 4碱性橙22-3.030.14 5苏丹橙G-0.19-0.30 6罗丹明B-1.56-4.78 7对位红-0.21-0.34 8柑橘红20.41-1.27 9苏丹红Ⅰ0.31-0.32 10大红粉-0.75-0.88 11苏丹红Ⅱ-1.14-1.26 12苏丹红Ⅲ-0.72-0.89 13苏丹红7B-0.80-0.88 14苏丹红Ⅳ-0.55-0.31
基质效应是由基质中的共提取干扰物与目标化合物竞争电离所致[29]。为评价基质效应,实验配制了20%和50%脂肪含量的辣椒粉样品溶液,经1.3.2节样品前处理方法处理后分别采用2 种样品处理液与溶剂配制质量浓度为2、10、20、100、500 ng/mL的3 条不同溶液的标准曲线,采用(基质匹配标准曲线的斜率/溶剂标准曲线的斜率-1)×100%进行评价[30],负值表示存在抑制效应,正值表示存在增强效应,绝对值越大则基质效应越强,由表3可见,不同脂肪含量的样品,除酸性橙2基质效应大于10%外,其他13 种目标成分基质效应均小于5%,表明基质效应弱,同时也说明所建立的净化方法具有较好的净化效果。
2.4 线性关系与检出限
在空白样品处理液中准确添加适量标准溶液,配制2、10、20、100、500 μg/L系列质量浓度混合标准溶液,根据1.3.3节色谱、质谱条件,以质量浓度为横坐标(x),峰面积为纵坐标(y)进行线性回归,14 种成分在2~500 ng/mL质量浓度范围内线性关系良好,相关系数(R2)为0.994 2~0.999 9。将标准曲线最低点质量浓度溶液进行适当稀释,重复测定3 次,以3 倍信噪比为方法检出限,10 倍信噪比为方法定量限,14 种成分的方法检出限为0.4~7.1 μg/kg,方法定量限为1.2~21.3 μg/kg。各成分线性方程、相关系数、检出限及定量限见表4。
表4 14 种工业染料的回归方程、相关系数、检出限和定量限
Table 4 Regression equations, correlation coeffi cients, LODs and LOQs for 14 industrial dyes

序号染料回归方程相关定量限/(μg/kg)1碱性橙21y= 82 116x+315 6650.996 93.39.9 2酸性橙2y= 36 594x+1 069 6100.996 57.121.3 3碱性橙2y=42 600x+310 8130.998 67.121.3 4碱性橙22y= 96 489x+7 6740.996 13.39.9 5苏丹橙Gy=8 554x+8 5590.996 70.41.2 6罗丹明By= 13 219x+99 1280.998 83.39.9 7对位红y= 5 782x+34 9920.994 67.121.3 8柑橘红2y=39 789x+506 3430.994 20.92.7 9苏丹红Ⅰy= 19 364x+195 2190.995 30.92.7 10大红粉y= 64 361x+631 7020.999 4 0.41.2 11苏丹红Ⅱy= 19 364x+195 2190.999 9 0.41.2 12苏丹红Ⅲy= 11 507x+133 2830.998 00.72.1 13苏丹红7By=118 015x+72 2790.999 20.92.7 14苏丹红Ⅳy=9 071x+144 3160.999 11.13.3系数R2检出限/(μg/kg)
2.5 回收率与精密度实验结果
采用不含14 种待测成分的样品作为空白基质,进行回收率实验。在空白基质中分别添加0.1、1.0、5.0 mg/kg 3 个水平的14 种染料混合标准溶液,每个水平进行6 次平行实验,按1.3.2节样品处理方法处理,1.3.3节色谱、质谱条件检测,计算平均回收率与精密度,结果见表5。总体回收率为70.5%~102.1%,相对标准偏差(relative standard deviation,RSD)为0.3%~9.3%(n=6),表明所建立的方法具有良好的精密度与准确度,满足定量分析要求。
表5 不同基质辣椒制品中14 种工业染料的加标回收率结果(n=6)
Table 5 Recoveries for 14 industrial dyes in different spiked matrix samples (n= 6)
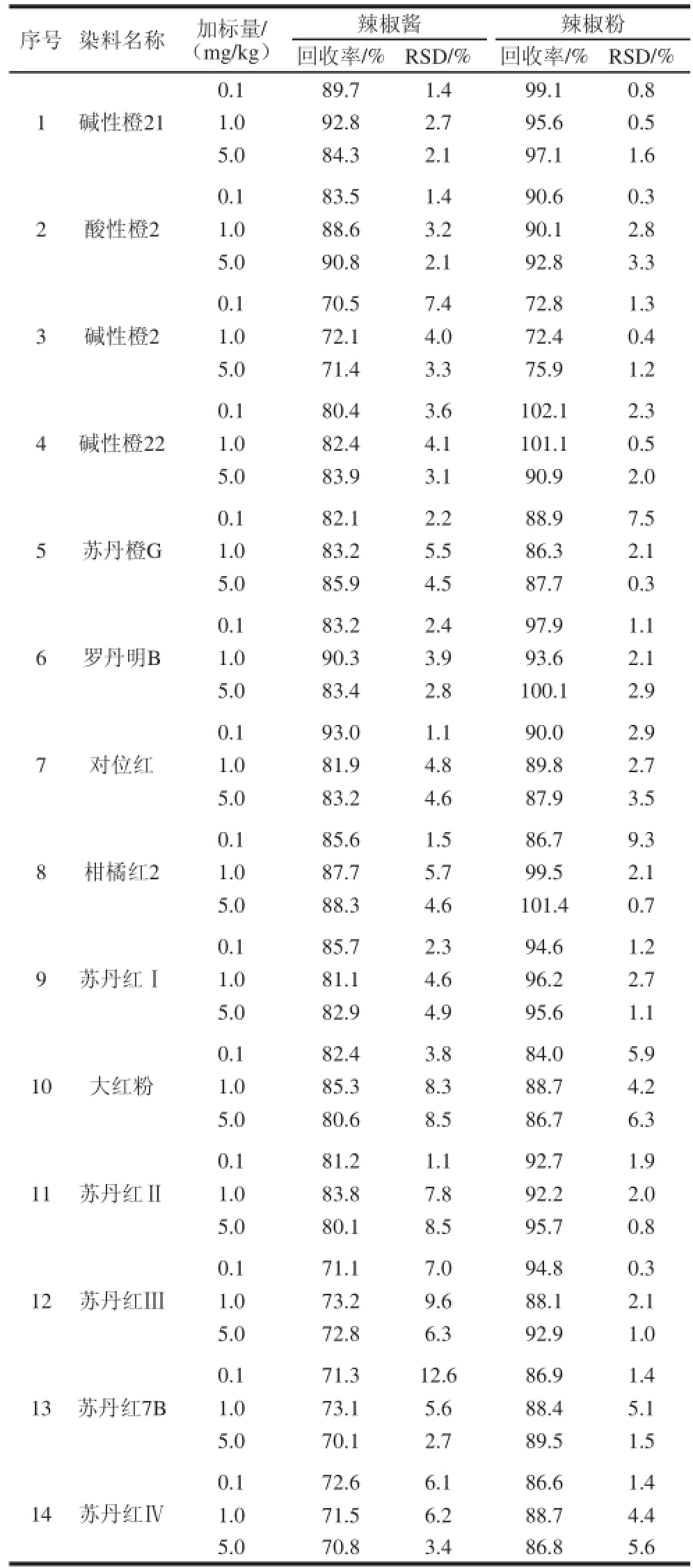
序号染料名称加标量/(mg/kg)辣椒酱辣椒粉回收率/%RSD/%回收率/%RSD/% 1碱性橙21 0.189.71.499.10.8 1.092.82.795.60.5 5.084.32.197.11.6 2酸性橙2 0.183.51.490.60.3 1.088.63.290.12.8 5.090.82.192.83.3 3碱性橙2 0.170.57.472.81.3 1.072.14.072.40.4 5.071.43.375.91.2 4碱性橙22 0.180.43.6102.12.3 1.082.44.1101.10.5 5.083.93.190.92.0 5苏丹橙G 0.182.12.288.97.5 1.083.25.586.32.1 5.085.94.587.70.3 6罗丹明B 0.183.22.497.91.1 1.090.33.993.62.1 5.083.42.8100.12.9 7对位红0.193.01.190.02.9 1.081.94.889.82.7 5.083.24.687.93.5 8柑橘红2 0.185.61.586.79.3 1.087.75.799.52.1 5.088.34.6101.40.7 9苏丹红Ⅰ0.185.72.394.61.2 1.081.14.696.22.7 5.082.94.995.61.1 10大红粉0.182.43.884.05.9 1.085.38.388.74.2 5.080.68.586.76.3 11苏丹红Ⅱ0.181.21.192.71.9 1.083.87.892.22.0 5.080.18.595.70.8 12苏丹红Ⅲ0.171.17.094.80.3 1.073.29.688.12.1 5.072.86.392.91.0 13苏丹红7B 0.171.312.686.91.4 1.073.15.688.45.1 5.070.12.789.51.5 14苏丹红Ⅳ0.172.66.186.61.4 1.071.56.288.74.4 5.070.83.486.85.6
2.6 实际样品检测结果
采用上述方法,对100 批辣椒制品中14 种工业染料进行检测,结果均未检出。同时也未发现有杂峰干扰各染料的检测。
3 结 论
本实验将一种新型吸附剂EMR-Lipid应用到QuEChERS方法中,结合液相色谱-串联质谱法建立了辣椒制品中14 种非法添加工业染料同时快速分析方法,显著提高了方法的检测效率。研究结果表明,本方法快速、可靠、重复性好,能满足大批量实际样品快速分析,EMR-Lipid吸附剂具有广阔的应用前景。
参考文献:
[1] ZHU Y H, ZHAO B, XIAO R Q, et al. Simultaneous determination of 14 oil-soluble synthetic dyes in chilli products by high performance liquid chromatography with a gel permeation chromatography clean-up procedure[J]. Food Chemistry, 2014, 145(7): 956-962. DOI:10.1016/ j.foodchem.2013.09.008.
[2] 罗诗萌, 于秋红, 牛晓梅, 等. UFLC-MS-MS方法快速筛查葡萄酒和辣椒酱中的17 种工业染料[J]. 中国卫生检验杂志, 2014, 24(6): 819-823. [3] 李鹏, 李晓丽, 苗虹, 等. 高效液相色谱-线性离子阱质谱法测定辣椒制品中23 种工业染料[J]. 中国食品卫生杂志, 2012, 24(5): 430-435. [4] 胡侠, 肖光, 潘炜, 等. 高效液相色谱-串联质谱法同时测定辣椒粉即辣椒油中的7 种罗丹明染料[J]. 色谱, 2010, 28(6): 590-595. DOI:10.3724/SP.J.1123.2010.00590.
[5] STIBOROVA M, MARTINEK V, RYDLOVA H, et al. Sudan Ⅰ is a potential carcinogen for humans: evidence for its metabolic activation and detoxication by human recombinant cytochrome P450 1A1 and liver microsomes[J]. Cancer Research, 2002, 62(20): 5678-5684.
[6] 宋雁, 李宁. 食品中苏丹红的危害性评估[J]. 国外医学: 卫生学分册, 2005, 32(3): 129-132.
[7] 陈美艳, 于淼. 罗丹明B染色食品对人体的危害及检测[J]. 科学之友, 2011(18): 153.
[8] 林宏琳, 华永有, 倪蕾, 等. 液-质联用法同时测定食品中罗丹明B和苏丹红染料[J]. 中国卫生检验杂志, 2012, 22(10): 2302-2304.
[9] 曹鹏, 乔旭光, 娄喜山, 等. 固相萃取结合超高效液相色谱-串联质谱法同时检测食品中的6 种工业染料[J]. 分析化学, 2011, 39(11): 1670-1675. DOI:10.3724/SP.J.1096.2011.01670.
[10] QI P, ZENG T, WEN Z J, et al. Interference-free simultaneous determination of Sudan dyes in chili foods using solid phase extraction coupled with HPLC-DAD[J]. Food Chemistry, 2011, 125: 1462-1467. DOI:10.1016/j.foodchem.2010.10.059.
[11] TANG B B, XI C X, ZOU Y, et al. Simultaneous determination of 16 synthetic colorants in hotpot condiment by high performance liquid chromatography[J]. Journal of Chromatography B, 2014, 960: 87-91. DOI:10.1016/j.jchromb.2014.04026.
[12] PULIDO M V, LOPEZ B G, REYES J F G, et al. Multiclass detection and quantitation of antibiotics and veterinary drugs in shrimps by fast liquid chromatography time-of-fiight mass spectrometry[J]. Talanta, 2011, 85: 1419-1427. DOI:10.1016/j.talanta.2011.06.036.
[13] KUNG T A, TSAI C W, KU B C, et al. A generic and rapid strategy for determining trace multiresidues of sulfonamides in aquatic products by using an improved QuEChERS method and liquid chromatography-electrospray quadrupole tandem mass spectrometry[J]. Food Chemistry, 2015, 175: 189-196. DOI:10.1016/ j.foodchem.2014.11.133.
[14] KARASEVA N M, AMELIN V G, TRETYAKOV A V. QuEChERS coupled to dispersive liquid-liquid microextraction for the determination of aflatoxins B1and M1in dairy foods by HPLC[J]. Journal of Analatical Chemistry, 2014, 69(5): 510-515. DOI:10.1134/ S1061934814030071.
[15] SARTORI A V, MATTOS J S D, MORAES M H P D, et al. Determination of afi atoxins M1, M2, B1, B2, G1 and G2 and ochratoxin A in UHT and powdered milk by modified QuEChERS method and ultra-high-performance liquid chromatography tandem mass spectrometry[J]. Food Analytical Methods, 2015, 8(9): 2321-2330. DOI:10.1007/s12161-015-0128-4.
[16] 胡文彦, 许磊, 杨军, 等. 基于QuEChERS提取的快速液相色谱-串联质谱法测定婴幼儿谷基辅助食品中的9 种真菌毒素[J]. 色谱, 2014, 32(2): 133-138. DOI:10.3724/SP.J.1123.2013.10014.
[17] LI J H, ZHANG Z H, LIU X, et al. Analysis of fourteen β-agonists in weight-reducing dietary supplements using QuEChERS-based extraction followed by high resolution UHPLC-MS[J]. Food Analytical Methods, 2014, 7: 977-985. DOI:10.1007/s12161-013-9700-y.
[18] 宋宁宁, 张科明, 刘向红, 等. QuEChERS-超高效液相色谱-串联质谱法快速测定凉茶中非法添加的12 种化学药物[J]. 色谱, 2015, 33(10): 1026-1031. DOI:10.3724/SP.J.1123.2015.05023.
[19] 朱程云, 魏杰, 董雪芳, 等. 改进的QuEChERS方法用于鱼肉中孔雀石绿、隐色孔雀石绿、结晶紫和隐色结晶紫的快速检测[J]. 色谱, 2014, 32(4): 419-425. DOI:10.3724/SP.J.1123.2014.01016.
[20] 李娜, 张玉婷, 刘磊, 等. QuEChERS-超高效液相色谱-串联质谱法测定动物源食品中4 类29 种禁限用兽药残留[J]. 色谱, 2014, 32(12): 1313-1319. DOI:10.3724/SP.J.1123.2014.07044.
[21] 李琴, 陶大利, 周红, 等. 超高效液相-串联质谱法同时测定生鲜乳中45 种兽药残留量[J]. 中国乳品工业, 2016, 44(1): 44-47.
[22] 申海鹏, 任羽红. Agilent Bond Elut QuEChERS EMR-Lipid-样品前处理中去除脂质的利器[J]. 食品安全导刊, 2015(9): 26-29. DOI:10.106043/j.cnki.cfs.2015.25.008.
[23] 吴岩, 赵伟, 刘永, 等. 快速基质分散净化-超快速液相色谱-串联质谱法同时测定玉米中22 种三嗪类除草剂残留[J]. 分析化学, 2016, 44(6): 950-957. DOI:10.11895/j.issn.0253-3820.160012.
[24] 曲斌, 耿士伟, 陆桂萍, 等. 新型QuEChERS方法结合液相色谱串联质谱法快速测定猪肝中β-受体激动剂残留[J]. 食品安全质量检测学报, 2015, 6(12): 4747-4754.
[25] DIS J V, CUTILLAS V, LOZANO A, et al. Determination of pesticides in edible oils by liquid chromatography-tandem mass spectrometry new generation materials for dispersive solid phase extraction clean-up[J]. Journal of Chromatography A, 2016, 1462: 8-18. DOI:10.1016/j.chroma.2016.07072.
[26] 李磊, 李海畅, 高婧, 等. QuEChERS EMR-Lipid-LC/MS/MS测定8 种β-受体激动剂[J]. 食品研究与开发, 2015, 37(9): 178-182. DOI:10.3969/j.issn.1005-6521.2016.09.042.
[27] LIU R Y, HEI W J, HE P L, et al. Simultaneous determination of fifteen illegal dyes in animal feeds and poultry products by ultra-high performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B, 2011, 879: 2416-2422. DOI:10.1016/ j.jchromb.2011.06037.
[28] SUN H W, WANG F C, AI L F. Determination of banned 10 azodyes in hot chili products by gel permeation chromatography-liquid chromatography-electrospray ionization-tandem mass spectrometry[J]. Journal of Chromatography A, 2007, 1164: 120-128. DOI:10.1016/ j.chroma.2007.06075.
[29] 曹亚飞, 康健, 常巧英, 等. QuEChERS结合液相色谱-串联质谱法快速测定奶酪种多种兽药残留[J]. 色谱, 2015, 33(2): 132-139. DOI:10.3724/SP.J.1123.2014.10022.
[30] 卜明楠, 石志红, 康健, 等. QuEChERS结LC-MS/MS同时测定虾肉中72 种兽药残留[J]. 分析测试学报, 2012, 31(5): 552-558. DOI:10.3969/j.issn.1004-4957.2012.05008.
Rapid Simultaneous Determination of 14 Adulterated Industrial Dyes in Chilli Products by a Modifi ed QuEChERS Method Coupled with LC-MS/MS
CHEN Lin1, WEN Jiaxin2, WU Xia3, LEI Yi2,4,*, ZHANG Rong4,*
(1. Nanyang Institute for Food and Drug Control, Nanyang 473059, China; 2. Guangdong Institute for Drug Control, Guangzhou 510180, China; 3. Agilent Technologies Co. Ltd., Guangzhou 510613, China; 4. School of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China)
Abstract:A rapid method for the simultaneous determination of 14 adulterated industrial dyes in chilli products was developed by using liquid chromatography-tandem mass spectrometry (LC-MS/MS) based on a modifi ed quick, easy, cheap, effective, rugged, and safe (QuEChERS) sample pretreatment method. Samples were extracted with acetonitrile-acetone (7:3, V/V), and then the extract was cleaned up using Enhanced Matrix Removal Lipid (EMR-Lipid). The chromatographic separation was performed on an Agilent Poroshell 120 EC C18(50 mm × 2.1 mm, 2.7 μm) column. The separated analytes were analyzed with LC-MS/MS by multiple reaction monitoring (MRM), and quantifi ed by the external standard method. The results showed that the 14 pigments were separated completely in 11 minutes, and their quantitative detection limits ranged from 0.4 to 7.1 μg/kg. The average recoveries at three spiked levels ranged from 70.5% to 102.1% with relative standard deviations (RSDs)(n = 6) of 0.3%9.3%. The method is quick, accurate, and sensitive, and can be applied to the determination of 14 adulterated industrial dyes in chilli products.
Key words:QuEChERS; EMR-lipid; LC-MS/MS; chilli products; adulterated industrial dyes
DOI:10.7506/spkx1002-6630-201708046
中图分类号:O658
文献标志码:A
文章编号:1002-6630(2017)08-0296-07
引文格式:
陈林, 温家欣, 吴霞, 等. 改良QuEChERS技术结合液相色谱-串联质谱联用法同时快速检测辣椒制品中14 种非法添加工业染料[J]. 食品科学, 2017, 38(8): 296-302. DOI:10.7506/spkx1002-6630-201708046. http://www.spkx.net.cn
CHEN Lin, WEN Jiaxin, WU Xia, et al. Rapid simultaneous determination of 14 adulterated industrial dyes in chilli products by a modifi ed QuEChERS method coupled with LC-MS/MS[J]. Food Science, 2017, 38(8): 296-302. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201708046. http://www.spkx.net.cn
收稿日期:2016-07-11
基金项目:广东省省级科技计划项目(2013B090200059);广州市健康产品非法添加化学成分快速检测技术重点实验室项目(2013年);
广东省食品药品检验检测技术创新专项(2015ZX01)
作者简介:陈林(1991—),女,硕士研究生,研究方向为食品药品质量分析。E-mail:1185315333@qq.com
*通信作者:雷毅(1977—),男,主任药师,博士,研究方向为食品药品质量分析。E-mail:Leiy04@qq.com
张荣(1978—),女,教授,博士,研究方向为物理药学。E-mail:zhangr-zju@hotmail.com
 、Waters Oasis PRIME HLB[21]等。Enhanced Matix Removal Lipid(EMR-Lipid)[22-26]是一种根据油脂类成分及大多数目标分析物结构特点设计的增强型脂质去除净化剂,对长链结构物质(如磷脂、游离脂肪酸、甘油三酯等)具有强大的吸附作用。EMR-Lipid能有效降低高脂肪含量基质对目标成分的干扰,但目前还鲜有报道将其应用于QuEChERS方法中。辣椒制品是以辣椒为原料,添加或不添加辅料加工而成的食品。辣椒素类物质属于弱极性有机物,通常辣椒制品基质为油脂。本实验选择14 种易滥用的工业染料作为目标检测对象,以高油脂含量的辣椒制品为样品基质,将EMR-Lipid引入QuEChERS技术,建立辣椒制品中14 种非法添加工业染料的液相色谱-串联质谱联用快速检测方法。
、Waters Oasis PRIME HLB[21]等。Enhanced Matix Removal Lipid(EMR-Lipid)[22-26]是一种根据油脂类成分及大多数目标分析物结构特点设计的增强型脂质去除净化剂,对长链结构物质(如磷脂、游离脂肪酸、甘油三酯等)具有强大的吸附作用。EMR-Lipid能有效降低高脂肪含量基质对目标成分的干扰,但目前还鲜有报道将其应用于QuEChERS方法中。辣椒制品是以辣椒为原料,添加或不添加辅料加工而成的食品。辣椒素类物质属于弱极性有机物,通常辣椒制品基质为油脂。本实验选择14 种易滥用的工业染料作为目标检测对象,以高油脂含量的辣椒制品为样品基质,将EMR-Lipid引入QuEChERS技术,建立辣椒制品中14 种非法添加工业染料的液相色谱-串联质谱联用快速检测方法。







 序号染料名称低脂肪基质效应高脂肪基质效应1碱性橙21-3.23-0.35 2酸性橙2-12.09-14.34 3碱性橙2-1.11-0.63 4碱性橙22-3.030.14 5苏丹橙G-0.19-0.30 6罗丹明B-1.56-4.78 7对位红-0.21-0.34 8柑橘红20.41-1.27 9苏丹红Ⅰ0.31-0.32 10大红粉-0.75-0.88 11苏丹红Ⅱ-1.14-1.26 12苏丹红Ⅲ-0.72-0.89 13苏丹红7B-0.80-0.88 14苏丹红Ⅳ-0.55-0.31
序号染料名称低脂肪基质效应高脂肪基质效应1碱性橙21-3.23-0.35 2酸性橙2-12.09-14.34 3碱性橙2-1.11-0.63 4碱性橙22-3.030.14 5苏丹橙G-0.19-0.30 6罗丹明B-1.56-4.78 7对位红-0.21-0.34 8柑橘红20.41-1.27 9苏丹红Ⅰ0.31-0.32 10大红粉-0.75-0.88 11苏丹红Ⅱ-1.14-1.26 12苏丹红Ⅲ-0.72-0.89 13苏丹红7B-0.80-0.88 14苏丹红Ⅳ-0.55-0.31
