 ±s表示,采用SAS 9.2统计分析软件的ANOVA程序进行方差分析和Duncan’s多重比较。
±s表示,采用SAS 9.2统计分析软件的ANOVA程序进行方差分析和Duncan’s多重比较。张 爽1,2,张 楠2,*,朱良齐2,李春保2
(1.芜湖职业技术学院,安徽 芜湖 241003;2.南京农业大学食品科技学院,江苏 南京 210095)
摘 要:目的:探讨畜禽肉宰后能量代谢的差异及其可能的原因。方法:于宰后45 min测定鸡肉、灰白(pale soft exudative,PSE)猪肉、正常猪肉和牛肉中糖原、ATP/ADP/AMP含量及乳酸脱氢酶(lactate dehydrogenase,LDH)活性,并提取肌浆和肌原纤维蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)和液相色谱-串联质谱鉴定,分析各组肉的磷酸化水平差异。结果:牛肉中糖原含量显著高于其他组(P<0.05),正常猪肉组糖原和ATP含量显著高于PSE猪肉组和鸡肉组(P<0.05),而PSE猪肉组的LDH活性显著高于其他组(P<0.05);肌浆蛋白SDS-PAGE ProQ染色表明,宰后45 min PSE猪肉组中6 个条带的磷酸化水平显著低于正常猪肉组(P<0.05),而另有6 个条带的磷酸化水平显著高于正常猪肉组(P<0.05)。牛肉组和鸡肉组中分别有3 个和1 个条带的磷酸化水平偏低,1 个条带和8 个条带的磷酸化水平明显偏高。而肌原纤维蛋白电泳表明,牛肉中大部分蛋白质的磷酸化水平处于最高值,而鸡肉组处于最低值,猪肉介于两者之间;PSE猪肉组中7 个条带的磷酸化水平显著低于正常猪肉(P<0.05);6 个条带的磷酸化水平显著高于正常猪肉(P<0.05)。结论:宰后异质肉的形成受宰后糖原和ATP消耗速率、LDH活性的影响,同时与肌肉中糖酵解酶的磷酸化水平有关。
关键词:异质肉;乳酸脱氢酶;糖酵解;能量代谢
对异质猪肉发生率调查发现,灰白(pale soft exudative,PSE)猪肉发生率较高,黑干(dark firm dry,DFD)肉发生率较低。相关文献显示,禽类中类PSE肉的发生率高达50%,而牛肉中DFD肉发生率较高,达到20%~30%左右[1-2],说明异质肉的发生不仅受宰前因素的影响,同时可能与宰后肌肉糖酵解和能量代谢差异有关。相比较而言,禽肉一般以冻肉消费或深加工为主,牛肉的核心问题是嫩度问题,对消费者的感官选择不会产生太大影响。而PSE猪肉通常出现于冷鲜肉,其肉色苍白、汁液渗出、质地松软的特征直接影响消费者的购买行为,对产业效益的影响较大。宰前应激容易导致异质肉的产生,而乳酸脱氢酶(lactate dehydrogenase,LDH)活性是反映机体能量代谢和心肌损伤的重要指标,LDH活性越高,PSE肉发生的可能性越高。研究发现,糖酵解速率主要由ATP水解速率决定,它影响着糖酵解的第一步磷酸化反应和磷酸果糖激酶调控的反应,低浓度的ATP将促进这些反应,高浓度的ATP将阻止磷酸烯醇式丙酮酸转变成丙酮酸[3-5]。ATP的大量消耗,导致糖酵解过程能量代谢加速,并导致宰后肌肉pH值快速下降[6-8]。因此,宰后初期ATP浓度大小对糖酵解快慢及乳酸的生成起着重要作用。肌肉中绝大多数酶都存在于肌浆中,而糖酵解酶又占到肌浆蛋白的2/3,糖酵解酶的活性是影响宰后肌肉pH值下降速率的主要因素,而糖酵解酶的活性又主要通过磷酸化水平来调控,研究发现宰后肌肉的糖原磷酸化酶、肌酸激酶、丙酮酸激酶等酶类的磷酸化变化能够调节肌肉能量代谢以及影响宰后pH值的下降速率。因此,研究宰后肌肉蛋白质的磷酸化水平对于肉品质量的调控具有重要作用[9-11]。目前关于异质肉的形成与宰后糖酵解和能量代谢相关性的研究缺乏,因此有必要开展进一步研究。
尽管猪、牛、鸡属于不同的物种,肌肉发育和饲养过程、周期等存在诸多差异,但对于肉类生产加工来说,都有共同特点,即肌肉组织和生化变化过程是相同的,宰后早期猪肉、牛肉、鸡肉都经历无氧酵解、肌原纤维蛋白降解(肉的成熟)的过程[12-15]。主要的差异在于能量物质含量及能量代谢的效率不同,因此,比较宰后猪肉、牛肉和鸡肉中能量物质含量及相关蛋白质的磷酸化水平差异,对于进一步认识和了解不同种类肉宰后品质差异具有重要意义。
本研究比较分析了宰后45 min时鸡肉、PSE猪肉、正常猪肉和牛肉中的糖原、ATP/ADP/AMP含量及LDH活性的差异。并采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)方法,分析各组肉的肌浆和肌原纤维蛋白磷酸化水平差异及差异条带蛋白的功能特性,揭示宰后异质肉形成的主要原因。
1.1 材料与试剂
宰后45 min的牛肉(背最长肌腰段) 长春皓月清真肉业股份有限公司;正常猪肉(背最长肌腰段)、PSE猪肉(背最长肌腰段,与正常猪肉来自同一批次)、鸡肉(胸大肌) 江苏省食品集团有限公司。
肌糖原测定试剂盒、LDH测定试剂盒(微板法)南京建成生物工程研究所;5’-ATP钠盐标准品(纯度≥99%)、5’-ADP钠盐标准品(纯度≥95%)、5’-AMP钠盐标准品(纯度≥99%) 美国Sigma公司;0.22 μm滤膜 美国Millipore公司;蛋白酶抑制剂Roche Complete、磷酸酶抑制剂Roche PhosStop 瑞士Roche公司;蛋白浓度测定试剂盒 美国Pierce公司;Pro-Q Diamond染色液、Sypro Ruby染色液 美国Invitrogen公司;SDS-PAGE预制胶、XT Reducing Agent、20×NuPAGE MES电泳缓冲液、SDS、Tris碱 美国Bio-Rad公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒 美国Pierce Biotechnology公司。甲醇为国产色谱纯;高氯酸、磷酸二氢钾、氢氧化钾等均为国产分析纯。
1.2 仪器与设备
Ultra Turrax T-25 BASIS高速匀浆机 德国IKA公司;211型pH计 意大利Hanna公司;Avanti J-E高速冷冻离心机、离心机 美国贝克曼库尔特有限公司;WH-Z微型漩涡混合仪 上海沪西分析仪器有限公司;MUL-9000系列纯水机 美国密理博公司;M2e多功能酶标仪 美国MD公司;SIM-F124制冰机日本Sanyo公司;85-2型恒温磁力搅拌器 上海可乐仪器厂;Mini-PROTEAN Tetra Cell小型垂直电泳槽、Power Pac Basic电泳仪 美国Bio-Rad公司;Typhoon Trio多功能激光成像系统、Imagescaner Ⅲ图像扫描系统美国GE公司;高效液相色谱(high performance liquid chromatography,HPLC)仪 美国安捷伦公司;真空离心浓缩蒸发器装置、NanoLC-LTQ Orbitrap-MS/MS系统美国Thermo Fisher公司。
1.3 方法
1.3.1 取样
实验选取宰后45 min的牛肉、猪肉、鸡肉样,取样部位均为靠近半膜肌一侧,取完立即用液氮冷冻,之后于-80 ℃冻存。
1.3.2 指标测定
1.3.2.1 肌糖原含量测定
称取85~100 mg肉样,每组10 个重复,每次3 个平行。加入试管中,按照1∶3(m/V)加入试剂盒提供浓碱300 μL,沸水浴20 min进行水解,流水冷却后加入1.64 mL蒸馏水,制成5%的糖原检测液。按试剂盒说明书进行测定。
1.3.2.2 LDH活力测定
称取1 g肉样,每组10 个重复,每次3 个平行。放入50 mL离心管中,按照1∶9(m/V)加入0.9%预冷生理盐水。在冰浴条件,13 500 r/min匀浆10 s/次,共3 次,每次间隔30 s,重复3~5 回。于4 ℃、3 000 r/min离心10~15 min。取上清液,用10 倍体积生理盐水稀释成1%匀浆稀释液,以1%的匀浆稀释液测定样本的蛋白质量浓度,再将1%的匀浆稀释液稀释50 倍为0.02%的测定液。按试剂盒说明书进行LDH活力测定。
1.3.2.3 ATP、ADP、AMP含量测定
宰后肌肉中ATP、ADP和AMP的含量测定参照Shen Qianwen等[16]的方法,采用高效液相色谱法。称取1 g冷冻样品,加入5 mL预冷的7%高氯酸(perchloric acid,PCA),13 500 r/min匀浆30 s,4 ℃条件下下15 000×g离心10 min。上清液用0.85 mol/L KOH中和,调节各样品的最终pH值为6.8~7.0,再次在4 ℃条件下15 000×g离心10 min,上清液用0.22 μm滤膜过滤。ATP、ADP和AMP的含量在HPLC仪上进行测定,检测波长254 nm,色谱柱使用反相C18谱柱(4 mm×250 mm,5 μm),86.5%流动相A,13.5%流动相B,流速1 mL/min,进样10 μL。流动相A为磷酸缓冲液(2.5 mmol/L四丁基硫酸氢铵、0.04 mol/L磷酸二氢钾、0.06 mol/L磷酸氢二钾,pH 7.0);流动相B为甲醇。核苷酸测定结果采用外标法,通过保留时间和峰面积对核苷酸进行定性和定量分析。
1.3.2.4 SDS-PAGE
样品制备参照Huang Honggang等[10]的方法。将1.0 g肌肉组织加入6.0 mL预冷的匀浆缓冲液(100 mmol/L Tris、pH 8.3,每50 mL一片Roche Complete,每25 mL一片Roche PhosStop)中,9 500 r/min匀浆匀浆两次,每次30 s,然后13 500 r/min匀浆两次,每次30 s,每次匀浆间隙冰浴15 s。匀浆液在15 000×g、4 ℃离心20 min得到沉淀(主要为肌原纤维蛋白)和上清液(主要为肌浆蛋白)。沉淀溶解于5% SDS溶液(60 ℃)后匀浆30 s(9 500 r/min),80 ℃条件下加热20 min,4 ℃条件下保存。上清液和沉淀的蛋白浓度用BCA试剂盒测定,使用双蒸水将各样品蛋白浓度调至统一。SDS-PAGE后进行ProQ和Sypro染色、电泳图获取和图像分析。同一胶块同一条带在ProQ和Sypro两种染色条件下的荧光密度之比(P/T值)代表蛋白质的磷酸化程度。
1.3.2.5 质谱鉴定
将P/T值差异显著的蛋白条带从凝胶中切下1.5 mm3置于EP管中,整个制样过程注意溶液和器具洁净,防止角蛋白污染。加入50 μL考考马斯亮蓝染色脱色液中(50 mmol/L NH4HCO3和乙腈等体积配制),37 ℃条件下超声5 min,若胶粒仍有蓝色,继续超声直至完全变白。真空抽干10 min。加入10 mmol/L二硫苏糖醇(DL-dithiothreitol,DTT)(10 μL 1 mol/L DTT、 990 μL 25 mmol/L NH4HCO3配制)20 μL,56 ℃水浴1 h降解二硫键。冷却至室温后,吸干,快速加入55 mmol/L碘乙酰胺(iodoacetamide,IAM)共计20 μL(55 μL 1 mol/L IAM、945 μL 25 mmol/L NH4HCO3配制),暗室中反应45 min。随后依次用25 mmol/L NH4HCO3、25 mmol/L NH4HCO3+50%乙腈溶液和乙腈清洗,直至胶粒脱水完全变白,将样品放入旋干机中干燥10 min。用超纯水清洗样品,加入胰蛋白酶37 ℃条件下消化过夜。加入0.2%甲酸终止消化反应,涡旋混匀,离心。消化液中的肽用乙腈超声提取,并在真空离心浓缩蒸发装置中充分干燥。干燥样品重溶于样品缓冲液中(2%乙腈、0.5%甲酸)。制备好的肽样品再通过NanoLCLTQ Orbitrap-MS/MS系统分析。质谱数据使用Proteome Discoverer V 1.4软件在Uniprot KB蛋白质数据库中进行Sequest HT搜索鉴定。
1.4 数据统计分析
所有数据均以 ±s表示,采用SAS 9.2统计分析软件的ANOVA程序进行方差分析和Duncan’s多重比较。
±s表示,采用SAS 9.2统计分析软件的ANOVA程序进行方差分析和Duncan’s多重比较。
2.1 宰后45 min糖原、ATP、ADP、AMP含量和LDH活力的比较
表1 宰后45 min糖原、ATP、ADP、AMP含量和LDH活力的比较(n=10)
Table1 The contents of glycogen and ATP/AADDPP/AMP and LDH activity in meat at 45 min post-mortem (n = 10)
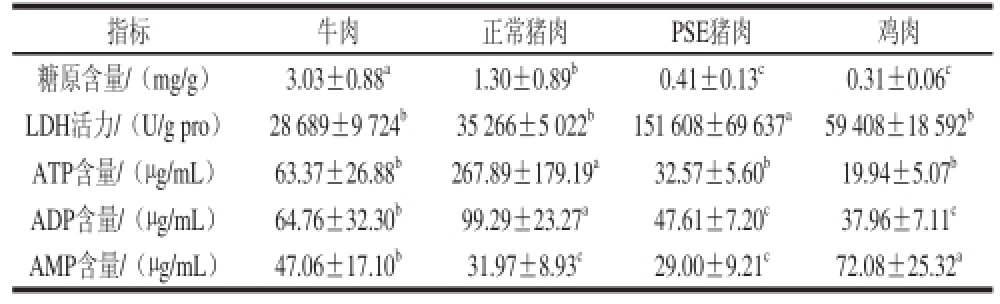
注:同行肩标小写字母不同表示差异显著(P<0.05)。表2、3同。
从表1可以看出,宰后45 min,牛肉中糖原含量显著高于其他组(P<0.05),正常猪肉组显著高于PSE猪肉组和鸡肉组(P<0.05),而PSE猪肉组和鸡肉组之间无显著差异(P>0.05)。PSE猪肉组的LDH活性显著高于其他组(P<0.05),而其他各组之间无显著性差异(P>0.05)。正常猪肉组ATP含量显著高于其他组(P<0.05),而其他各组之间无显著性差异(P>0.05)。正常猪肉组ADP含量显著高于其他组(P<0.05),牛肉组显著高于PSE猪肉和鸡肉组(P<0.05),PSE猪肉和鸡肉组之间无显著性差异(P>0.05)。鸡肉组AMP含量显著高于其他组(P<0.05),牛肉组显著高于正常猪肉和PSE猪肉组(P<0.05),正常猪肉和PSE猪肉组之间无显著性差异(P>0.05)。
2.2 单向SDS-PAGE结果
2.2.1 肌浆蛋白磷酸化
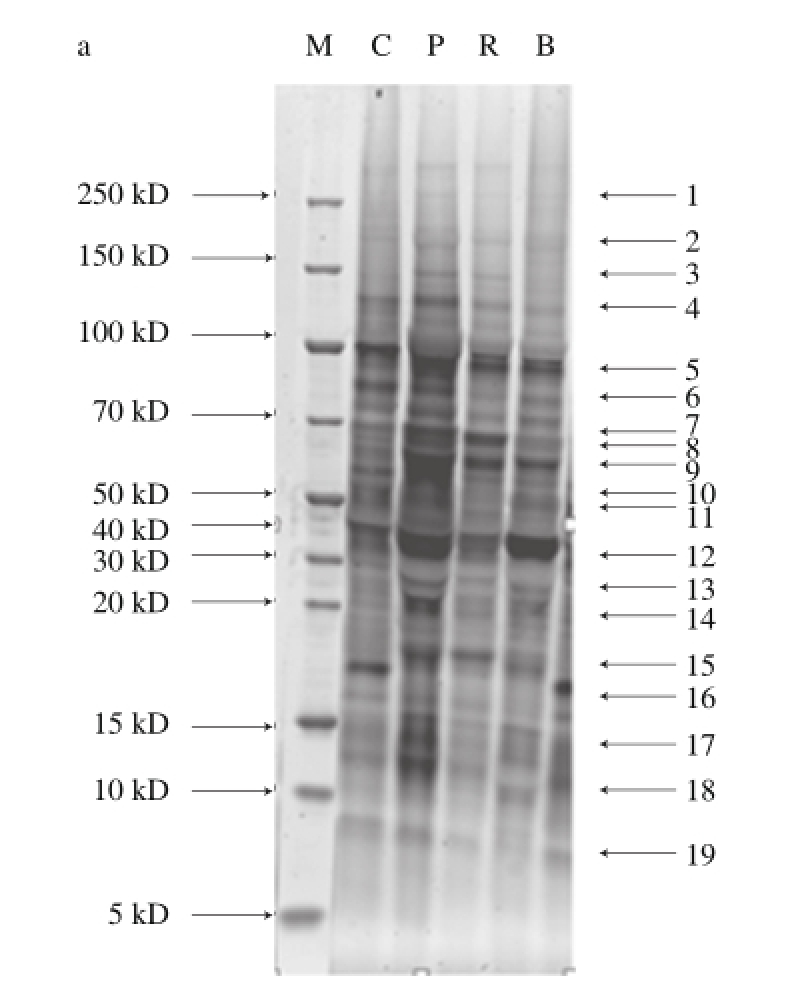

图1 肌浆蛋白的SDS-PAGE图谱
Fig.1 SDS-PAGE of sarcoplasmic proteins
图1 为磷酸化肌浆蛋白和肌浆全蛋白SDS-PAGE的部分图谱。可以看出,两图中的条带平直清晰,分离效果较好。从两种染色的凝胶图中选取19 个较清晰的条带,并使条带在两个图中一一对应。其磷酸化水平如表2所示。
表2 4 组肉的肌浆蛋白磷酸化水平(P/T值)(n=10)
Table2 Phosphorylation levels ((P/T values) of sarcoplasmic proteins in meat from four groups ((n = 1100))

由表2可以看出,宰后45 min,4 种肉类除了条带4、7、13的磷酸化水平无显著差异外,其余条带的磷酸化水平都存在差异;PSE猪肉组中条带1、3、5、11、15、18的磷酸化水平显著低于正常猪肉组(P<0.05);PSE猪肉组条带9、10、12、14、16、19的磷酸化水平显著高于正常猪肉组(P<0.05)。牛肉组中条带6、18、19的磷酸化水平较PSE猪肉和鸡肉组偏低,而条带9的磷酸化水平较其他组偏高;鸡肉组中条带2、3、6、10、13、14、17、19磷酸化水平偏高,而条带11的磷酸化水平明显偏低。
2.2.2 肌原纤维蛋白磷酸化

图2 肌原纤维蛋白的SDS-PAGE图谱
Fig.2 SDS-PAGE of myo fi brillar proteins
图2 为肌原纤维蛋白SDS-PAGE的部分图谱。从两种染色的凝胶图中选取23 个较清晰的、一一对应的条带,其磷酸化水平如表3所示。
表3 4 组肉的肌原纤维蛋白磷酸化水平(P/T值)(n=10)
Table3 Phosphorylation levels ((P/T values) of myo fi brillar proteins in meat from four groups ((n = 1100))
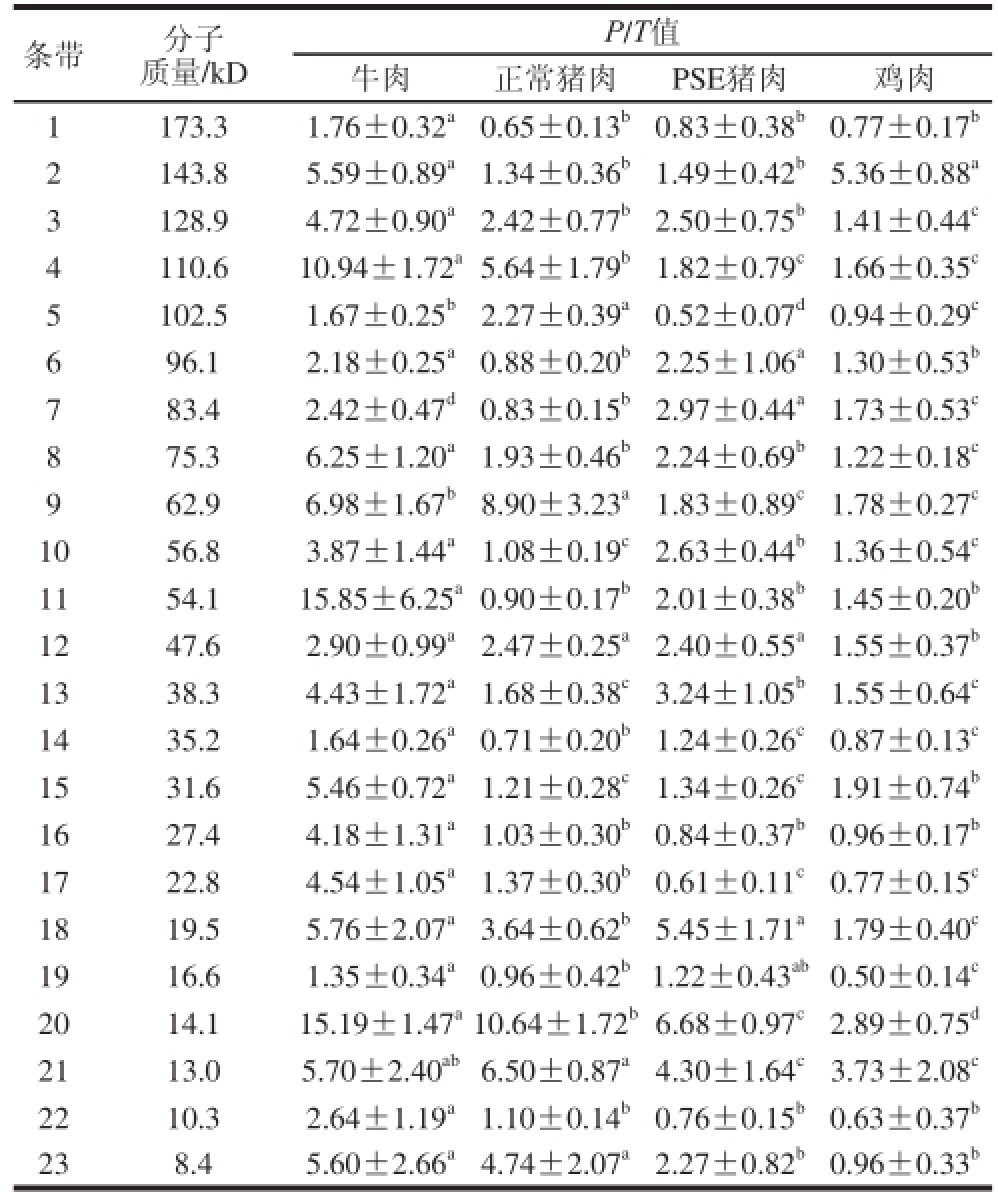
由表3可以看出,总体而言,宰后45 min,牛肉中大部分蛋白质的磷酸化水平处于最高值,而鸡肉组处于最低值,猪肉介于两者之间。这可能与宰后肌肉收缩程度不同有关,一般而言,牛肉收缩程度最大,而鸡肉收缩程度最低。PSE猪肉组和正常猪肉组的条带1、2、3、8、11、12、15、16、19和22的磷酸化水平无显著差异(P>0.05);PSE猪肉组中条带4、5、9、17、20、21、23的磷酸化水平显著低于正常猪肉(P<0.05);条带6、7、10、13、14、18的磷酸化水平显著高于正常猪肉(P<0.05)。2.3 蛋白差异条带的质谱鉴定
肌浆蛋白组分的鉴定结果表明,1、2、3、4、6、14、16这7 个条带为未鉴定蛋白,它们多与ATP结合、肌肉收缩和糖原分解代谢过程有关。其余条带均为酶类或伴侣蛋白,它们主要与ATP和离子结合、糖酵解、肌肉收缩、蛋白折叠等生物过程有关,条带5(6-磷酸果糖激酶)、条带7(丙酮酸激酶)、条带9(磷酸甘油酸激酶)、条带10(醛缩酶)、条带11(3-磷酸甘油醛脱氢酶)、条带12(磷酸丙糖异构酶)、条带15(L-LDH)等均为糖酵解酶,参与催化糖酵解相关反应。
肌原纤维蛋白组分的鉴定结果表明,2、3、4、5、9、10、11这7 个条带为未鉴定蛋白,其余条带多为酶类、细胞骨架蛋白和热应激蛋白,它们多调控能量代谢、肌肉收缩、应激反应等过程。其中参与调控糖酵解过程的酶类主要为:条带8(ATP依赖型6-磷酸果糖激酶)、条带12(磷酸甘油酸激酶)、条带18(磷酸丙糖异构酶、L-LDH)、条带20(醛缩酶A)等。
LDH是糖酵解中可逆催化乳酸生成丙酮酸的一种同工酶,也是机体反映能量代谢的重要生化指标,对动物的心肌损伤具有诊断特异性[17]。本研究发现,与其他3 组肉相比,PSE猪肉的宰后45 min肌肉LDH活性显著升高,而动物在疲劳、肌肉组织或细胞受到损伤后,LDH会明显升高。因此,LDH活性的显著升高反映出生猪宰前受到的应激程度较大。从结果中可以看出,PSE猪肉的宰后45 min糖原、ATP和ADP含量均显著低于正常猪肉,这可能与PSE猪肉宰前所受应激程度较大有关,应激程度大导致生猪糖原的快速消耗,能量代谢过程加速。另外,应激可导致磷脂酶A的释放,进而促进Ca2+的释放,提高了肌浆内Ca2+的浓度,Ca2+可通过激活肌原纤维ATP酶和磷酸化酶而加强糖原酵解[18-20]。另一方面,牛是反刍动物,肌肉中能量物质主要来源于瘤胃微生物发酵产生的乙酸、丁酸等物质,相对而言对糖原的依赖程度较低[21-23]。理论上,宰后牛肉肌糖原酵解程度较低,LDH活性也应相对较低。而猪肉和鸡肉则相反,宰后主要依靠肌糖原酵解功能,LDH活性应相对较高。本实验中,正常牛肉、猪肉和鸡肉,LDH的活性没有显著差异,可能与动物个体差异过大(标准差都较大)有关。不同种类肉之间的差异还有待进一步验证。
宰后45 min时,牛肉组糖原含量显著高于其他3 组,但牛肉组的ATP含量显著低于正常猪肉,与PSE猪肉组和鸡肉组相比无显著性差异。如上所述,牛肉中供能物质主要是乙酸、丁酸等,而不是糖原,因此,糖原酵解酶的活性可能较低,使得残留的糖原含量相对较高。而猪肉和鸡肉中能量消化主要来源于糖原酵解,参与此反应的酶活性较高,糖原消耗明显高于牛肉。
陈韬等[24]研究发现,正常猪肉和PSE猪肉宰后不同时间内的蛋白质溶解性和蛋白质降解程度不同。与正常猪肉相比,PSE猪肉的各种蛋白质溶解性都低于正常猪肉,正常肉和PSE肉的肌浆蛋白和肌原纤维蛋白的SDS-PAGE条带存在差异,PSE肉早期伴肌动蛋白(nebulin)含量明显低于正常肉。而研究表明,肌浆蛋白变性并沉聚于肌原纤维蛋白上是导致PSE猪肉肌蛋白溶解性降低的主要原因,最新的研究表明在猪肉中发生沉淀的主要是磷酸化酶与肌酸激酶[25]。从差异蛋白鉴定结果可以发现,肌原纤维蛋白中确实存在着来自肌浆蛋白组分沉淀的磷酸化酶(条带5和6)和肌酸激酶(条带19)。
Huang Honggang等[26-27]研究表明,pH值下降速率快组(pH3h<6.0)的肌原纤维蛋白总磷酸化水平高于pH值下降慢(pH3h>6.3)和中等速率组(6.0<pH3h<6.3),但宰后24 h的总磷酸化水平却最低。宰后早期pH值的快速下降,容易产生PSE肉,部分PSE猪肉组条带显示肌原纤维蛋白磷酸化水平显著高于正常猪肉组,但肌原纤维蛋白的总磷酸化水平低于正常猪肉组。原因可能在于本实验中将pH45min<6.0判定为PSE猪肉,而上述研究中将pH3h<6.0判定为pH值快速下降。
本研究表明,宰后45 min,PSE猪肉组中肌浆蛋白组分中的条带10(醛缩酶)和条带19(快速骨骼肌蛋白T)的磷酸化水平较高。糖酵解酶的磷酸化水平提高,说明糖酵解过程加快,糖原无氧酵解产生更多乳酸,进一步降低pH值。而PSE猪肉组中条带5(6-磷酸果糖激酶)、条带11(3-磷酸甘油醛脱氢酶)、条带12(磷酸丙糖异构酶)的磷酸化水平较低。从上述结果可以发现,PSE猪肉的发生可能与肌浆蛋白组分中的磷酸甘油酸激酶、肌酸激酶、醛缩酶及L-LDH的宰后磷酸化水平较高有关,这些糖酵解酶的磷酸化水平越高,则PSE肉发生的可能性越大。
宰后45 min,PSE猪肉组中肌原纤维蛋白组分中的条带18(L-LDH)的磷酸化水平较高,说明PSE肉的发生可能与肌原纤维中L-LDH的磷酸化水平较高有关,这与肌浆组分中LDH磷酸化程度的研究结果一致。而PSE猪肉组中条带6(α-1,4-葡聚糖磷酸化酶)、条带17(3-磷酸甘油醛脱氢酶NAD+)、条带23(丙酮酸激酶)的磷酸化水平较低,说明PSE肉的发生可能与肌原纤维组分中这些糖酵解酶的磷酸化水平偏低有关。
热应激蛋白(heat shock protein,HSP)是指细胞在缺氧、高温等应激原的诱导下产生的一组蛋白质,具有重要的细胞保护功能。因其可以促进蛋白质合成、折叠、装配和运输等,所以又被称作分子伴侣蛋白[28-30]。本研究中,PSE猪肉组条带8(热应激蛋白70)的宰后45 min磷酸化水平高于正常猪肉组,而研究认为热应激蛋白与环境应激有关,它可通过磷酸化修饰的方式保护细胞免受损伤。
从上述研究结果可以发现,不同肉中糖酵解酶磷酸化水平有差异,而研究认为糖酵解酶磷酸化水平的变化能够调节糖酵解和能量代谢过程,异质肉的发生与宰后糖酵解和能量代谢有关,因此,异质肉的形成与宰后初期糖酵解酶磷酸化水平大小有关。
宰后异质肉的形成受宰后糖原和ATP消耗速率、LDH活性的影响,同时与肌肉中糖酵解酶的磷酸化水平大小有关。PSE猪肉和类PSE鸡肉宰后糖原消耗及能量代谢速率较快,PSE猪肉宰后LDH活性显著升高。正常猪肉和牛肉宰后肌糖原消耗及能量代谢速率均较低。
参考文献:
[1] 孙皓, 徐幸莲, 黄继超. 禽肉类PSE肉的形成与加工特性研究进展[J]. 食品与发酵工业, 2012, 38(9): 107-111.
[2] 卢骁, 朱立贤, 张一敏, 等. 山东省DFD牛肉发生率的调查研究[J]. 肉类工业, 2015(3): 39-42. DOI:10.3969/j.issn.1008-5467.2015.03.012.
[3] LAMETSCH R, LARSEN M R, ESSEN-GUSTAVSSON B, et al. Postmortem changes in pork muscle protein phosphorylation in relation to the RN genotype[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 11608-11615. DOI:10.1021/jf201936h.
[4] GRAVES J D, KREBS E G. Protein phosphorylation and signal transduction[J]. Pharmacology & Therapeutics, 1999, 82: 111-121. DOI:10.1016/S0163-7258(98)00056-4.
[5] RANDLE P J. Phosphorylation-dephosphorylation cycle and the regulation of fuel selection in mammals[J]. Current Topics in Cellular Regulation, 1981, 18: 107-129. DOI:10.1016/b978-0-12-152818-8.50013-x.
[6] BENDALL J R. Relations between muscle pH and important biochemical parameters during the postmortem changes in mammalian muscles[J]. Meat Science, 1979, 3(2): 143-157. DOI:10.1016/0309-1740(79)90016-0.
[7] DICKENS J A, LYON C E. The effects of electric stimulation and extended chilling times on the biochemical reactions and texture of cooked broiler breast meat[J]. Poultry Science, 1995, 74(12): 2035-2040. DOI:10.3382/ps.0742035.
[8] SAVELL J W, MUELLER S L, BAIRD B E. The chilling of carcasses[J]. Meat Science, 2005, 70(3): 449-459. DOI:10.1016/ j.meatsci.2004.06.027.
[9] 王思丹, 李春保, 温思颖, 等. 禁食处理和宰后时间对鸡肉蛋白磷酸化水平的影响[J]. 食品科学, 2013, 34(19): 270-274. DOI:10.7506/ spkx1002-6630-201319055.
[10] HUANG Honggang, LARSEN M R, KARLSSON A H, et al. Gel-based phosphoproteomics analysis of sarcoplasmic proteins in postmortem porcine muscle with pH decline rate and time differences[J]. Proteomics, 2011, 11(20): 4063-4076. DOI:10.1002/pmic.201100173.
[11] LI C B, ZHOU G H, XU X, et al. Phosphoproteome analysis of sarcoplasmic and myof i brillar proteins in bovine longissimus muscle in response to postmortem electrical stimulation[J]. Food Chemistry, 2015, 175: 197-202. DOI:10.1016/j.foodchem.2014.11.139.
[12] BJARNADOTTIR S G, HOLLUNG K H M, VEISETH-KENT E. Proteome changes in the insoluble protein fraction of bovine longissimus dorsi muscle as a result of low-voltage electrical stimulation[J]. Meat Science, 2011, 89: 143-149. DOI:10.1016/ j.meatsci.2011.04.002.
[13] RHEE M S, KIM B C. Effect of low voltage electrical stimulation and temperature conditioning on postmortem changes in glycolysis and calpains activities of Korean native cattle (Hanwoo)[J]. Meat Science, 2001, 58(7): 231-237. DOI:10.1016/s0309-1740(00)00155-8.
[14] WALSH T P, MASTERS C J, MORTON D J, et al. The reversible binding of glycolytic enzymes in ovine skeletal muscle in response to titanic stimulation[J]. Biochimica et Biophysica Acta, 1981, 675(6): 29-39. DOI:10.1016/0304-4165(81)90066-0.
[15] 孙皓, 徐幸莲, 王鹏. 鸡肉类PSE肉与正常肉功能特性比较研究[J]. 食品科学, 2013, 34(21): 60-63. DOI:10.7506/spkx1002-6630-201321013.
[16] SHEN Qianwen, MEANS W J, THOMPSON S A, et al. Pre-slaughter transport, AMP-activated protein kinase, glycolysis, and quality of pork loin[J]. Meat Science, 2006, 74: 388-395. DOI:10.1016/ j.meatsci.2006.04.007.
[17] 甄少波, 刘奕忍, 郭慧媛, 等. 运输季节对生猪应激及猪肉品质的影响[J]. 农业工程学报, 2015, 31(1): 333-338. DOI:10.3969/ j.issn.1002-6819.2015.01.044.
[18] 冯跃进, 顾宪红. 热应激对猪肉品质的影响及其机制的研究进展[J]. 中国畜牧兽医, 2013, 40(2): 96-99. DOI:10.3969/ j.issn.1671-7236.2013.02.023.
[19] JENSEN T E, RICHTER E A. Regulation of glucose and glycogen metabolism during and after exercise[J]. The Journal of Physiology, 2012, 590(3): 1069-1076. DOI:10.1113/jphysiol.2011.224972.
[20] DRANSFIELD E. Calpains from thaw rigor muscle[J]. Meat Science, 1996, 43(7): 311-320. DOI:10.1016/s0309-1740(96)00022-8.
[21] HOLLUNG K, VEISETH E, FROYSTEIN T, et al. Variation in the response to manipulation of postmortem glycolysis in beefmuscles by low voltage electrical stimulation and conditioning temperature[J]. Meat Science, 2007, 77(11): 372-383. DOI:10.1016/ j.meatsci.2007.03.029.
[22] CLARKE F M, SHAW F D, MORTON D J, et al. Effect of electrical stimulation postmortem of bovine muscle on the binding of glycolytic enzymes: functional andstructural implications[J]. Biochemistry Journal, 1980, 186(1): 105-109. DOI:10.1042/bj1860105.
[23] D’ALESSANDRO A, RINALDUCCI S, MARROCCO C, et al. Love me tender: an omics window on the bovine meat tenderness network[J]. Journal of Proteomics, 2012, 75(7): 4360-4380. DOI:10.1016/j.jprot.2012.02.013.
[24] 陈韬, 崔薇, 邱燕, 等. 正常肉和白肌肉的蛋白质变化[J]. 食品研究与开发, 2012, 33(3): 1-5. DOI:10.3969/j.issn.1005-6521.2012.03.001.
[25] HONIKEL K O. Conversion of muscle to meat, glycolysis. Encyclopedia of Meat Sciences[M]. Oxford, UK: Academic Press, 2014: 353-357. DOI:10.1016/b0-12-464970-x/00127-6.
[26] HUANG Honggang, LARSEN M R, KARLSSON A H, et al. Quantitative phosphoproteomic analysis of porcine muscle within 24 h postmortem[J]. Proteomics, 2014, 106(6): 125-139. DOI:10.1016/ j.jprot.2014.04.020.
[27] HUANG Honggang, LARSEN M R, LAMETSCH R. Changes in phosphorylation of myofibrillar proteins during postmortem development of porcine muscle[J]. Food Chemistry, 2012, 134(4): 1999-2006. DOI:10.1016/j.foodchem.2012.03.132.
[28] CARVALHO M E, GASPARIN G, POLETI M D, et al. Heat shock and structural proteins associated with meat tenderness in Nellore beef cattle, a Bos indicus breed[J]. Meat Science, 2014, 96(3): 1318-1324. DOI:10.1016/j.meatsci.2013.11.014.
[29] ZHANG M H, WANG D Y, GENG Z M, et al. The level of heat shock protein 90 in pig longissimus dorsi muscle and its relationship with meat pH and quality[J]. Food Chemistry, 2014, 165: 337-341. DOI:10.1016/j.foodchem.2014.05.111.
[30] YU J M, TANG S, BAO E D, et al. The effect of transportation on the expression of heat shock proteins and meat quality of M. longissimus dorsi in pigs[J]. Meat Science, 2009, 83(3): 474-478. DOI:10.1016/ j.meatsci.2009.06.028.
Energy Metabolism and Protein Phosphorylation of Pork, Beef and Chicken during the Early Postmortem Period
ZHANG Shuang1,2, ZHANG Nan2,*, ZHU Liangqi2, LI Chunbao2
(1. Wuhu Institute of Technology, Wuhu 241003, China; 2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Objective: To explore the major cause for abnormal meat. Methods: At 45 min postmortem, chicken, pale soft exudative (PSE) pork, normal pork and beef were taken for the analysis of glycogen, ATP/ADP/AMP contents, lactate dehydrogenase (LDH) activity. At the same time, myofibrillar and sarcoplasmic proteins were extracted and separated by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE), and the bands of interest were identi fi ed by liquid chromatography-tandem mass spectrometry (LC-MS/MS). The difference in band intensity was evaluated. Results: Glycogen was higher in beef than three other meats (P < 0.05). Glycogen and ATP contents were higher in PSE pork than normal pork and chicken (P < 0.05). LDH activity in PSE pork was much higher than all other groups (P < 0.05). SDS-PAGE with ProQ staining indicated that, at 45 min postmortem, the phosphorylation levels of sarcoplasmic proteins from 6 bands were lower in PSE pork than those of normal pork (P < 0.05), while sarcoplasmic proteins from other 6 bands had higher phosphorylation levels than normal pork (P < 0.05). In addition, 3 bands in beef and 1 bands in chicken had lower phsophorylation levels, whilst higher phsophorylation levels were observed for 1 bands in beef and 8 bands in chicken. For myo fi brillar proteins, the majority of bands in beef had highest phosphorylation levels, the lowest phosphorylation levels were found for chicken (P < 0.05), and pork was in the middle. Similarly, 7 bands in PSE pork had lower phosphorylation levels than normal pork (P < 0.05), while 6 bands had higher phosphorylation levels than normal pork(P < 0.05). Conclusion: The rates of glycolysis and ATP depletion, and LDH activity had a great contribution to PSE pork, which is also associated with protein phosphorylation of glycolytic enzymes.
Key words:abnormal meat; lactate dehydrogenase (LDH); glycolysis; energy metabolism
DOI:10.7506/spkx1002-6630-201709012
中图分类号:TS251.1
文献标志码:A
文章编号:1002-6630(2017)09-0072-07
收稿日期:2016-11-25
基金项目:“十二五”国家科技支撑计划项目(2014BAD19B01);江苏省农业自主创新项目(CX(15)1006);国家现代农业(生猪)产业技术体系建设专项(CARS36-11);南京农业大学基本业务费专项(KYCYL201502);江苏省优势学科项目
作者简介:张爽(1975—),女,副教授,硕士,研究方向为食品加工与安全。E-mail:goodluck_zs@163.com
*通信作者:张楠(1981—),男,博士研究生,研究方向为畜产品加工与质量控制。E-mail:285913549@qq.com
引文格式:
张爽, 张楠, 朱良齐, 等. 宰后早期猪肉、牛肉和鸡肉中能量代谢及蛋白质磷酸化[J]. 食品科学, 2017, 38(9): 72-78. DOI:10.7506/spkx1002-6630-201709012. http://www.spkx.net.cn
ZHANG Shuang, ZHANG Nan, ZHU Liangqi, et al. Energy metabolism and protein phosphorylation of pork, beef and chicken during the early postmortem period[J]. Food Science, 2017, 38(9): 72-78. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201709012. http://www.spkx.net.cn