陈 红,李彩云,李 侠,李玉扩,邬欣蕾,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
摘 要:以壳聚糖为成膜基质,添加具有抗氧化和抑菌作用的植物甾醇,采用流延法制备壳聚糖/微晶甾醇可食性复合膜,旨在赋予壳聚糖膜抗氧化活性及提高其抑菌性。当甾醇添加量分别为壳聚糖质量的0%~12%时,随着添加比例的增加,复合膜的拉伸强度和断裂伸长率逐渐下降,溶解度和溶胀度逐渐增加,水蒸气透过系数显著降低,对超氧阴离子自由基(O2-·)及羟自由基(·OH)的清除率显著提高,对金黄色葡萄球菌和大肠杆菌的抑菌性能明显增强;采用红外光谱、扫描电子显微镜、X射线衍射和热重分析表征了复合膜的相容性。结果表明:甾醇添加量为9%的壳聚糖/微晶甾醇可食性复合膜各项性能指标良好,且壳聚糖与甾醇分子之间形成了分子间氢键,有较强的相互作用,整个共混体系的相容性良好。
关键词:壳聚糖;植物甾醇;可食性复合膜;性能;结构表征
可食性复合膜中可以添加活性成分,包括抗氧化剂、抗菌剂、色素、营养强化剂和风味物质等[1-2]。随着人们安全意识的增强,目前食品包装材料和添加剂更倾向于无毒、无污染、天然的绿色产品[3-4]。壳聚糖是最具有前景的生物可降解的包装材料之一[5-6],随着现代食品技术的快速发展,壳聚糖基可食性复合膜已经成为包装与保鲜领域研究的热点[1]。壳聚糖是甲壳素经过脱乙酰化得到的天然阳离子多糖[7],是灰白色的粉末状固体,只能溶于某些酸性介质,不溶于水和碱液。壳聚糖无毒且具有抗菌性[8-11],并具有良好的成膜性[12-14]、生物相容性[15]和生物可降解性[16],作为抗菌包装原料有着非常好的发展前景,在食品活性包装领域应用较为广泛,通常作为包装的基本材料之一[17-18]。但由于其不具有抗氧化活性,且抑菌谱又较窄[19],国内外的研究人员通过向壳聚糖溶液中加入一种或多种物质,如抗氧化剂[20]、抗菌剂[21]、油酸[22]、多糖[23]、蛋白质[24-25]等,制备壳聚糖基复合膜来改善膜的各种性质,从而进一步拓宽壳聚糖膜在活性包装领域的应用。王丽岩[26]将具有抗氧化活性的茶多酚添加到壳聚糖中,制备的壳聚糖/茶多酚复合膜与壳聚糖膜相比,其抗氧化性显著提高。
植物甾醇是一种天然的抗氧化剂,具有较强的抗氧化活性,且抑菌效果也很明显,对人体无毒无害。目前,鲜见植物甾醇应用于可食性复合包装膜的报道,本研究以壳聚糖为成膜基质,添加具有抑菌和抗氧化作用的植物甾醇,采用流延法制备壳聚糖/微晶甾醇可食性复合膜,旨在通过添加甾醇赋予壳聚糖膜抗氧化活性及提高其抑菌性,为壳聚糖/微晶甾醇复合膜的生产及应用提供理论和技术依据。
1.1 材料与试剂
植物甾醇:纯度为97%,吉林农业大学粮油加工实验室自制。
壳聚糖(分子质量:4 2 0 k D,脱乙酰度:88.3%)、营养琼脂、蛋白胨、酵母提取物均为生化试剂国药集团化学试剂有限公司;其他试剂均为国产分析纯;金黄色葡萄球菌和大肠杆菌由吉林农业大学发酵工程实验室提供。
1.2 仪器与设备
Nexus670傅里叶变换红外光谱仪 美国尼高力仪器公司;SSX-550扫描电子显微镜、DTG-60H差热-热重同时测定装置 日本岛津公司;DSADVANCE型X射线衍射仪 德国Bruker公司;JJ-1电动搅拌器 江苏省金坛市江南仪器厂;QJ210 电子万能试验机 上海倾技仪器仪表科技有限公司;CL-32L高压蒸汽灭菌器 日本ALP公司;LRH-250生化培养箱 上海一恒科技有限公司;101A-2E数显式电热鼓风干燥箱 上海实验仪器厂有限公司;LBS-64LA恒温恒湿箱 山东省乐陵市华星电子有限公司;HH-S2数显双孔恒温水浴锅 江苏省金坛市瑞华仪器有限公司;300 mm干燥器 天津市天玻玻璃仪器有限公司。
1.3 方法
1.3.1 壳聚糖/微晶甾醇复合膜的制备
将0.8 g壳聚糖溶于45 mL体积分数1%的乙酸溶液中,加入0.3 g的甘油作为增塑剂,置于50 ℃水浴锅中持续低速搅拌40 min,制得壳聚糖溶液;甾醇添加量分别为壳聚糖质量的0%、3%、6%、9%、12%,将不同质量的甾醇分别溶解于5 mL无水乙醇中,制备甾醇-乙醇溶液;将5 mL不同质量分数的甾醇-乙醇溶液加入到壳聚糖溶液中,于50 ℃水浴锅中持续低速搅拌40 min,制得壳聚糖/微晶甾醇复合膜膜液,真空脱气去除气泡;采用流延法制膜,将30 mL经上述步骤制得的壳聚糖/微晶甾醇复合膜膜液倒入玻璃培养皿(直径8 cm)中,并在50 ℃的干燥箱中干燥成膜;揭膜,将膜置于25 ℃、相对湿度50%的恒温恒湿箱中平衡48 h,再测定膜的各项性能指标。
1.3.2 壳聚糖/微晶甾醇复合膜的性能测定
1.3.2.1 机械性能的测定
参照GB/T 1040.3—2006《塑料 拉伸性能的测试》方法[27],采用电子万能试验机测定膜的拉伸强度和断裂伸长率。壳聚糖/微晶甾醇复合膜的厚度用螺旋测微器进行测定,在膜的中心及四周5 个位置测量,结果取平均值。每个膜样品做3 次平行实验,结果取平均值。壳聚糖/微晶甾醇复合膜的TS和E的计算见公式(1)、(2)。
式中:Ft为壳聚糖/微晶甾醇复合膜断裂时承受的最大拉力/N;l为壳聚糖/微晶甾醇复合膜的厚度/mm;d为壳聚糖/微晶甾醇复合膜的宽度/mm。
式中:l1为壳聚糖/微晶甾醇复合膜断裂时达到的最大长度/mm;l0为壳聚糖/微晶甾醇复合膜的初始长度/mm。
1.3.2.2 溶胀度的测定
采用Mayachiew等[28]的方法。将壳聚糖/微晶甾醇复合膜剪成1 cm×4 cm的样品,称其质量记为m1,放入培养皿中,加入30 mL蒸馏水,24 h后小心取出样品,用滤纸吸去膜表面的水分,称质量记为m2。每个膜样品做3 次平行实验,结果取平均值。溶胀度的计算见公式(3)。
式中:m1为溶胀前膜的质量/g;m2为溶胀后膜的质量/g。
1.3.2.3 溶解度的测定
采用Jouki等[29]的方法。将膜剪成1 cm×4 cm的样品,在105 ℃烘箱中干燥24 h,称其质量记为m1,放入培养皿中,加入30 mL蒸馏水,24 h后小心取出样品,用滤纸吸去膜表面的水分,在105 ℃烘箱中干燥24 h,称质量记为m2。每个膜样品做3 次平行实验,结果取平均值。溶解度的计算见公式(4)。
式中:m1为膜样品的初始质量/g;m2为膜样品的最后质量/g。
1.3.2.4 水蒸气透过系数的测定
根据GB/T 1037—1988《塑料薄膜和片材透水蒸气性试验方法 杯式法》[30],采用杯式法测定,准确称取烘干的无水氯化钙(粒径小于2 mm)放入透湿杯中,以提供相对湿度为0%的环境,无水氯化钙与杯口距离约5 mm,选择厚度均匀的膜,测定厚度后,用石蜡密封于透湿杯杯口,并称质量。将称后的透湿杯放入装有饱和氯化钠溶液(相对湿度75%、25 ℃)的干燥器中,使膜两侧保持一定的蒸气压差,每隔24 h取出称质量,实验时间为一周。每个膜样品做3 次平行实验,结果取平均值。水蒸气透过系数(water vapor permeability,WVP)的计算见公式(5)。
式中:Δm为透湿杯质量增加量/g;l为膜的厚度/mm;A为膜的有效面积(为透湿杯口面积)/m2;t为测量时间/d;ΔP为膜两侧水蒸气压差/kPa。
1.3.3 壳聚糖/微晶甾醇复合膜抗氧化性测定
1.3.3.1 超氧阴离子自由基(O2-·)清除率的测定
采用邻苯三酚法,测定对照组邻苯三酚自氧化反应速率(V对照)。称取130 mg的膜样品放入锥形瓶中,再加入一定量无水乙醇,浸泡24 h,得到壳聚糖复合膜浸泡液。样品组邻苯三酚自氧化反应速率(V样品):空白组和样品组均加5 mL的浸泡液、1.0 mL蒸馏水、pH 8.2 5.0 mL 50 mmol/L Tris-HCl缓冲溶液。在25 ℃水浴20 min后,样品组加1.0 mL 0.6 mmol/L邻苯三酚溶液,而空白组加同体积蒸馏水。振荡混匀后即在320 nm波长处测吸光度。以空白管调零,迅速振荡、混匀,并开始计时。每隔30 s读一次吸光度,4 min后结束。求吸光度随时间变化的线性回归方程,其斜率即邻苯三酚自氧化反应速率V样品。每个膜样品做3 次平行实验,结果取平均值。样品对 ·清除率的计算见公式(6)。
·清除率的计算见公式(6)。
式中:V对照为对照组邻苯三酚自氧化反应速率/(ΔA/min);V样品为样品组邻苯三酚自氧化反应速率/(ΔA/min)。
1.3.3.2 羟自由基(·OH)清除率的测定
称取80 mg的膜样品放入锥形瓶中,再加入一定量无水乙醇,浸泡 24 h,得到壳聚糖复合膜浸泡液。采用改进的邻二氮菲法:取编号为1~4的4 支带刻度的50 mL反应试管,在4 支试管中各加pH 7.4 2.0 mL的磷酸盐缓冲溶液。向2、3、4号试管中各加1.0 mL 5 mmol/L邻二氮菲溶液和1.0 mL 7.5 mmol/L FeSO4溶液。向2号试管中加5.0 mL的壳聚糖复合膜浸泡液。向2、4号试管中各加0.5 mL体积分数1%H2O2溶液。所有试管均用蒸馏水定容至10.0 mL,于37 ℃水浴中反应1 h。以1号试管溶液为空白对照,在536 nm波长处分别测2、3、4号试管中溶液吸光度,得A样、A未损、A损。每个膜样品做3 次平行实验,结果取平均值。样品对·OH清除率的计算见公式(7)。
式中:A样为加样品时的吸光度;A未损为未加H2O2时的吸光度;A损为加H2O2未加样品时的吸光度。
1.3.4 壳聚糖/微晶甾醇复合膜抑菌性测定
选取两种常用细菌金黄色葡萄球菌(革兰氏阳性菌)和大肠杆菌(革兰氏阴性菌)作为实验菌种,对壳聚糖/微晶甾醇复合膜的抑菌性进行测定。
把1 g膜样品加入至30 mL菌悬液中,未加膜的原始菌悬液作为对照。将菌悬液在37 ℃、200 r/min的摇床上进行培养,取1 mL培养约40 min的菌悬液,用质量分数0.9%生理盐水逐级稀释至100 000 倍。分别取20 μL稀释适当倍数的菌悬液均匀涂布于无菌培养基上,然后将培养皿放在恒温培养箱中37 ℃条件下培养24 h,记录培养基上的菌落数,按照公式(8)计算抑菌率。每组实验做3次平行,结果取平均值。抑菌率I的计算见公式(8)。
式中:A0为对照的菌落数/(CFU/mL);A为含膜样品的菌落数/(CFU/mL)。
1.3.5 壳聚糖/微晶甾醇复合膜的结构表征
1.3.5.1 傅里叶变换红外光谱分析
进行傅里叶变换红外光谱(Fourier transform infrared spectrum,FT-IR)分析,将壳聚糖/微晶甾醇复合膜黏贴到样品架上,放入仪器中进行扫描。采用红外光谱透射法,扫描范围:4 000~400 cm-1,扫描次数:32,分辨率:4 cm-1。
1.3.5.2 扫描电子显微镜分析
用扫描电子显微镜(scanning electron microscope,SEM)观察膜的表面,将膜用双面胶固定于样品台,真空喷金后,观察膜表面的微观形貌。
1.3.5.3 X射线衍射分析
室温条件下应用X射线衍射(X-ray diffraction,XRD)仪记录膜的XRD图谱,采用Cu-Kα辐射,管电压40 kV,管电流40 mA,扫描范围:5°~40°,扫描速率:5 °/min。
1.3.5.4 热重分析
采用DTG-60H型分析仪测定膜的热稳定性能,样品的质量:7~10 mg,升温速率:10 ℃/min,流量:20 mL/min,测试的温度范围:20~800 ℃。
1.4 统计分析
各项测定数据用 ±s表示,利用SPSS 16.0统计软件对数据进行单因素方差分析,采用Duncan法进行多重比较。
±s表示,利用SPSS 16.0统计软件对数据进行单因素方差分析,采用Duncan法进行多重比较。
2.1 壳聚糖/微晶甾醇复合膜的性能
2.1.1 机械性能

图1 甾醇添加量对壳聚糖/微晶甾醇复合膜拉伸强度(AA)和断裂伸长率(B)的影响
Fig.1 Effect of sterol addition on tensile strength (A) and elongation at break (B) of microcrystalline sterol/chitosan composite fi lms
由图1可知,随着甾醇添加量的增加,壳聚糖/微晶甾醇复合膜的拉伸强度和断裂伸长率均有所下降,与壳聚糖膜相比,甾醇添加量为6%、9%、12%时,壳聚糖/微晶甾醇复合膜的拉伸强度分别降低了4.61%、5.79%和26.34%,与壳聚糖膜差异显著(P<0.05),断裂伸长率分别降低了4.65%、5.76%和16.47%,与壳聚糖膜差异显著(P<0.05)。甾醇添加量为6%和9%时,复合膜间的拉伸强度和断裂伸长率差异不显著(P>0.05)。当壳聚糖溶液与甾醇溶液混合流延成膜时,由于壳聚糖与甾醇分子间的相互作用,壳聚糖分子链的聚集态结构会受到影响,从而改变壳聚糖/微晶甾醇复合膜中壳聚糖分子链的网络结构,导致复合膜的机械性能下降。另一方面,如果壳聚糖与甾醇分子间的相互作用强度小于壳聚糖分子间的相互作用,将导致壳聚糖分子链之间的应力传递能力下降,使壳聚糖/微晶甾醇复合膜的机械性能降低。
2.1.2 壳聚糖/微晶甾醇复合膜的溶胀度
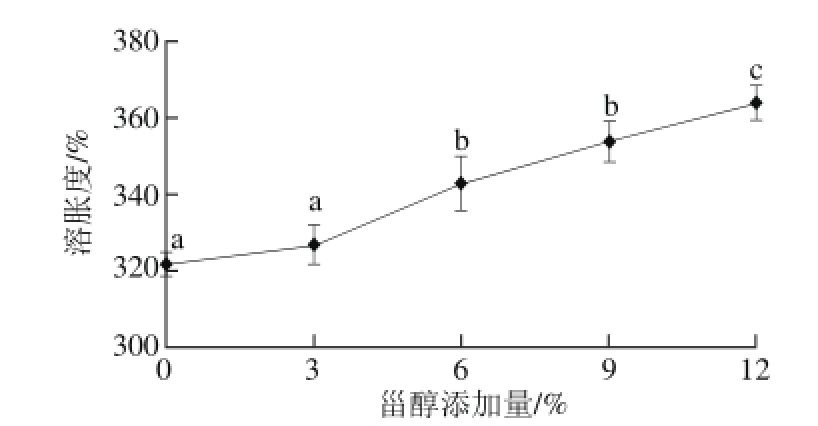
图2 甾醇添加量对壳聚糖/微晶甾醇复合膜溶胀度的影响
Fig.2 Effect of sterol addition on swelling degree of microcrystalline sterol/chitosan composite fi lms
溶胀度可以考察膜在水分充足的条件下的吸水能力,是评价膜性能的重要指标之一。由图2可知,与壳聚糖膜相比,甾醇添加量为6%、9%、12%时,壳聚糖/微晶甾醇复合膜的溶胀度分别提高了6.52%、9.94%和13.04%,与壳聚糖膜差异显著(P<0.05)。甾醇添加量为6%和9%时,复合膜溶胀度间差异不显著(P>0.05)。
2.1.3 壳聚糖/微晶甾醇复合膜的溶解度

图3 甾醇添加量对壳聚糖/微晶甾醇复合膜溶解度的影响
Fig.3 Effect of addition amount of sterol on the solubility of microcrystalline sterol/chitosan composite membrane
溶解度是评价膜性能的重要指标之一,它能反映膜的亲水性能。由图3可知,与壳聚糖膜相比,甾醇添加量为6%、9%、12%时,壳聚糖/微晶甾醇复合膜的溶解度分别提高了6.52%、9.94%和13.04%,与壳聚糖膜差异显著(P<0.05)。甾醇添加量为9%和12%时,复合膜溶解度间差异不显著(P>0.05)。加入甾醇后,甾醇干扰了壳聚糖膜体固有的氢键作用力,降低了壳聚糖的结晶性,增加了分子链之间的距离,从而导致较多的水分进入膜体,促进了膜的溶解和溶胀。
2.1.4 壳聚糖/微晶甾醇复合膜WVP
阻碍食物与周围环境的水分交换是食品包装膜的主要作用之一[31],WVP越低,食品的水分就越不容易流失,膜的保鲜效果就越好,越有利于延长食品的保质期[32]。由图4可知,随着甾醇添加量的增加,WVP显著降低(P<0.05)。降低的原因是甾醇的加入一方面减弱了壳聚糖膜溶液分子间的氢键,而且甾醇与壳聚糖之间的相互作用限制了壳聚糖分子的运动,使壳聚糖分子的网络结构变得更加稳定,使水分子难以扩散,导致膜的WVP降低。
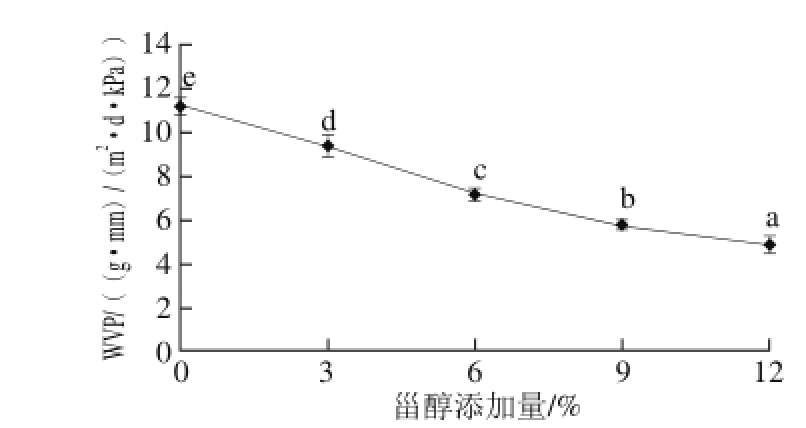
图4 甾醇添加量对壳聚糖/微晶甾醇复合膜WP的影响
Fig.4 Effect of sterol addition on water vapor permeability coef fi cient of microcrystalline sterol/chitosan composite fi lms
2.1.5 抗氧化性
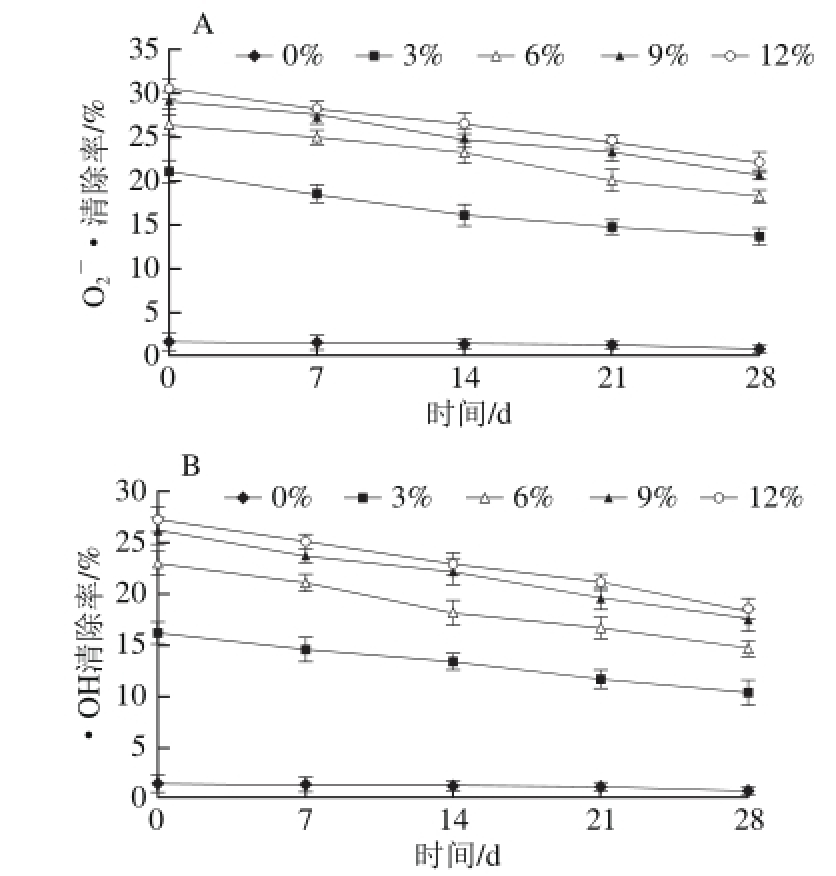
图5 壳聚糖/微晶甾醇复合膜对 (AA)和·OH(B)的清除率及其随时间的变化
(AA)和·OH(B)的清除率及其随时间的变化
Fig.5 Temporal changes in superoxide anion (A) and hydroxyl radical (B) scavenging capacities of chitosan/microcrystalline sterol composite fi lms
由图5可知,未加甾醇的壳聚糖膜,对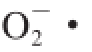 和·OH的清除率都比较低,而加入甾醇后,随着甾醇添加量的增多,壳聚糖/微晶甾醇复合膜对
和·OH的清除率都比较低,而加入甾醇后,随着甾醇添加量的增多,壳聚糖/微晶甾醇复合膜对 和·OH的清除率均显著提高(P<0.05)。甾醇添加量为3%、6%、9%、 12%时,壳聚糖/微晶甾醇复合膜对O2-·的清除率分别是壳聚糖膜的12.99、16.33、18.08、18.83 倍,对·OH的清除率分别是壳聚糖膜的10.63、15.11、17.10、17.82 倍。利用SPSS 16.0统计软件对数据进行方差分析可知,当甾醇添加量为9%和12%时,复合膜对O2-·和·OH的清除率差异均不显著(P>0.05)。随着时间的延长,因空气的氧化作用,壳聚糖/微晶甾醇复合膜对O2-·和·OH的清除率在逐渐下降,抗氧化性会逐渐降低。由于植物甾醇具有较强供氢活性的基团,因此添加甾醇后复合膜的抗氧化活性显著提高,表明添加到膜中的甾醇没有全部与壳聚糖基质形成强交互作用,保留了部分抗氧化特性。
和·OH的清除率均显著提高(P<0.05)。甾醇添加量为3%、6%、9%、 12%时,壳聚糖/微晶甾醇复合膜对O2-·的清除率分别是壳聚糖膜的12.99、16.33、18.08、18.83 倍,对·OH的清除率分别是壳聚糖膜的10.63、15.11、17.10、17.82 倍。利用SPSS 16.0统计软件对数据进行方差分析可知,当甾醇添加量为9%和12%时,复合膜对O2-·和·OH的清除率差异均不显著(P>0.05)。随着时间的延长,因空气的氧化作用,壳聚糖/微晶甾醇复合膜对O2-·和·OH的清除率在逐渐下降,抗氧化性会逐渐降低。由于植物甾醇具有较强供氢活性的基团,因此添加甾醇后复合膜的抗氧化活性显著提高,表明添加到膜中的甾醇没有全部与壳聚糖基质形成强交互作用,保留了部分抗氧化特性。
2.1.6 抑菌性
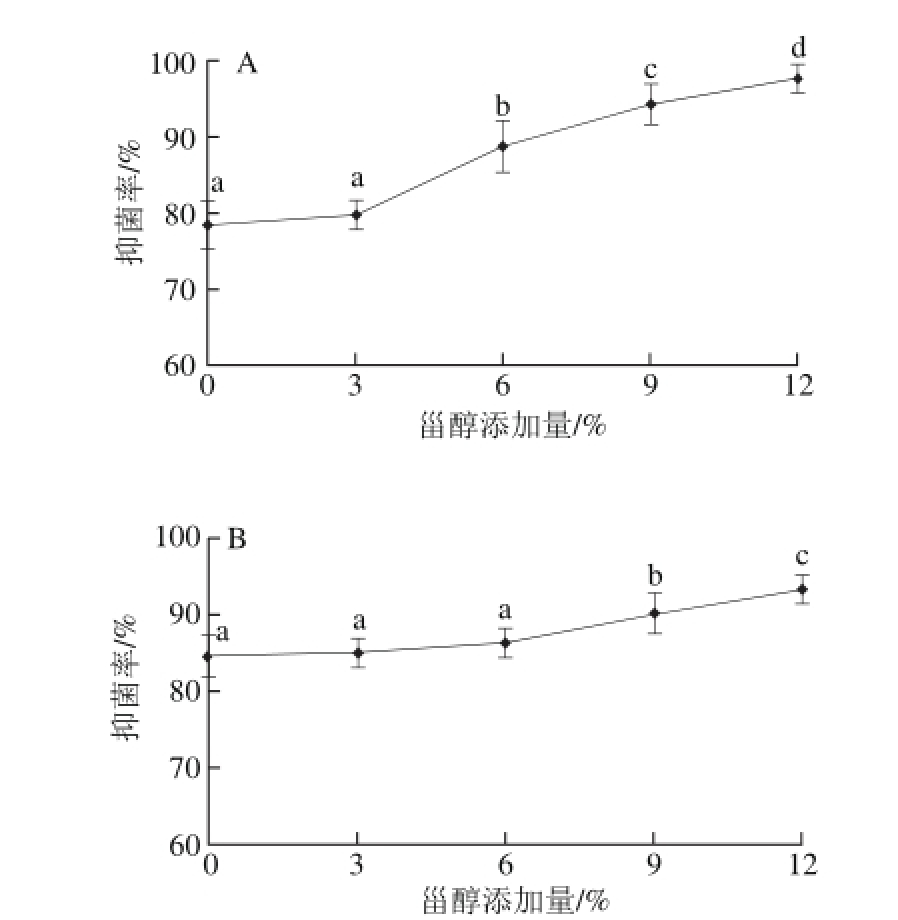
图6 壳聚糖/微晶甾醇复合膜对金黄色葡萄球菌(AA)和
大肠杆菌(B)的抑菌率
Fig.6 Antimicrobial activities of microcrystalline sterol/chitosan composite fi lms against E. coli (B) and Staphylococcus aureus (A)
壳聚糖/微晶甾醇复合膜对金黄色葡萄球菌和大肠杆菌的抑菌率见图6。壳聚糖/微晶甾醇复合膜对两种细菌均具有明显的抑制作用,且抑菌性随着甾醇添加量的增加而增强,壳聚糖/微晶甾醇复合膜对金黄色葡萄球菌的抗菌效果优于大肠杆菌。与壳聚糖膜相比,甾醇添加量为6%、9%、12%时,壳聚糖/微晶甾醇复合膜对金黄色葡萄球菌的抑菌率分别提高了12.95%、20.08%和23.87%,与壳聚糖膜差异显著(P<0.05),甾醇添加量为9%和12%时,壳聚糖/微晶甾醇复合膜对大肠杆菌的抑菌率分别提高了6.88%和10.37%,与壳聚糖膜差异显著(P<0.05)。植物甾醇具有抑菌作用,添加甾醇后复合膜对金黄色葡萄球菌和大肠杆菌的抑制能力得到提高,因为添加甾醇增加了膜的吸湿性,使膜快速吸水溶胀,提高了膜中活性组分的迁移速率。
2.2 壳聚糖/微晶甾醇复合膜的结构表征
2.2.1 FT-IR分析
两种或两种以上的物质混合前后其红外光谱图特征峰的改变,能够反映出物质的化学相互作用以及分子间作用力[33]。图7为壳聚糖膜及不同甾醇添加量的壳聚糖/微晶甾醇复合膜红外光谱图。
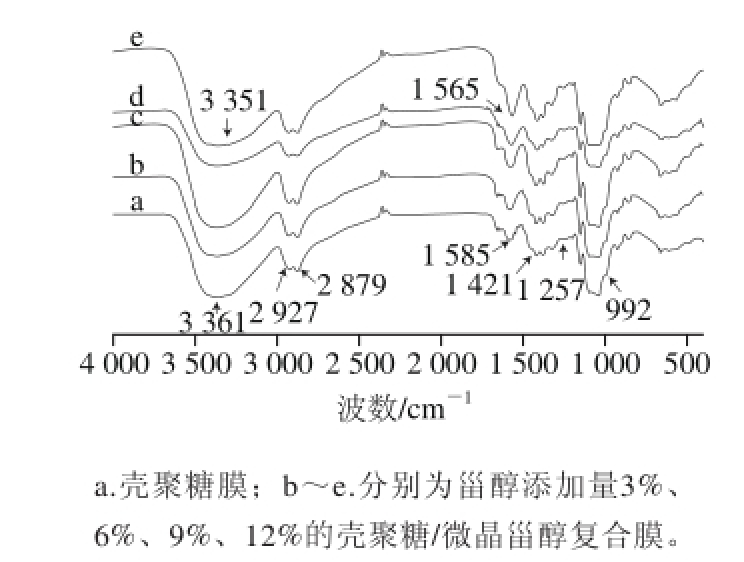
图7 壳聚糖/微晶甾醇复合膜的红外光谱图
Fig.7 Infrared spectra of fi lms
由图7可知,谱线a为壳聚糖膜的红外光谱图,在波数3 361 cm-1处的吸收峰为N—H的伸缩振动吸收峰和O—H伸缩振动吸收峰叠加的多重吸收峰,该吸收峰峰形较宽而且较大。谱线b、c、d、e分别为甾醇添加量为3%、6%、9%、12%的壳聚糖/微晶甾醇复合膜的红外光谱图。壳聚糖膜中3 361 cm-1处的N—H伸缩振动吸收峰向低波数移动到3 351 cm-1,导致吸收峰向低波方向移动,主要是由于壳聚糖分子中氨基上的氮原子与甾醇分子中羟基上的氢原子形成了分子间氢键,氢键的形成使电子云密度平均化,从而使伸缩振动频率降低,导致红外光谱向低波数移动。随着甾醇添加量的增加,壳聚糖膜中1 585 cm-1处的N—H弯曲振动吸收峰变化较大,该吸收峰向低波数移动到1 565 cm-1,吸收强度明显增强,表明甾醇与壳聚糖分子之间有较强的氢键作用,氢键的形成有利于甾醇在壳聚糖膜中的分散,能够使壳聚糖和甾醇之间保持良好的相容性。壳聚糖膜中1 421 cm-1处的饱和碳氢键C—H的弯曲振动峰向低波数移动,吸收强度由弱变强。壳聚糖膜中1 257 cm-1的C—O的伸缩振动峰向低波数移动,吸收强度也逐渐增强,这是由于增塑剂甘油的作用,甘油与壳聚糖、甾醇中的C—O—H基团的C—O形成了氢键,使C—O伸缩振动向低波数移动。与壳聚糖膜相比,添加量为9%壳聚糖/微晶甾醇复合膜吸收峰的变化较明显,说明该比例的复合膜混合效果较好,不同物质的分子间形成的作用力比较强。因而可认为这两种组分具有良好的相容性,且可在下面的XRD图谱分析中得到进一步证实。
2.2.2 SEM分析
由图8可知,制得的壳聚糖/微晶甾醇复合膜表面光滑,呈现壳聚糖膜原有的淡黄色,宏观上没有出现明显的相分离现象,具有良好的相容性。

图8 壳聚糖/微晶甾醇复合膜的数码相机照片
Fig.8 Digital camera photos of chitosan/microcrystalline sterol composite fi lm

图9 壳聚糖/微晶甾醇复合膜的扫描电子显微镜图(×1 000000)
Fig.9 SEM pictures of fi lms (× 1 000)
图9 为壳聚糖膜和不同甾醇添加量的壳聚糖/微晶甾醇复合膜放大1 000倍的表面形貌图。天然功能性物质微晶甾醇呈针状,长约2~8 μm,直径约20~40 nm。由图9可知,壳聚糖膜表面平整光滑,当甾醇加入比例较低时,微晶甾醇较均匀地分散于壳聚糖膜中,没有发生团聚现象,表面光滑均匀,不存在任何裂隙和小孔。随着甾醇添加量的增大,其在壳聚糖膜中的分布也更密集,在添加量为12%时,微晶甾醇出现部分团聚,膜表面的平整度变差,说明两者的相容性下降,致使界面受力不均匀,导致复合膜的机械性能显著降低。
2.2.3 XRD分析
由图10可知,壳聚糖膜在2θ为20.2°的位置出现一个明显的衍射峰,壳聚糖/微晶甾醇复合膜在2θ为20.2°的位置的衍射峰宽度变窄,强度减弱,同时甾醇的特征峰几乎消失。壳聚糖/微晶甾醇复合膜衍射峰强度减弱的程度由大到小依次是e>d>c>b,即添加量为12%壳聚糖/微晶甾醇复合膜强度减弱最明显,添加量为9%壳聚糖/微晶甾醇复合膜强度减弱最小,说明添加量为9%壳聚糖/微晶甾醇复合膜共混体系的相容性良好,该结论与红外光谱分析结果基本是一致的。
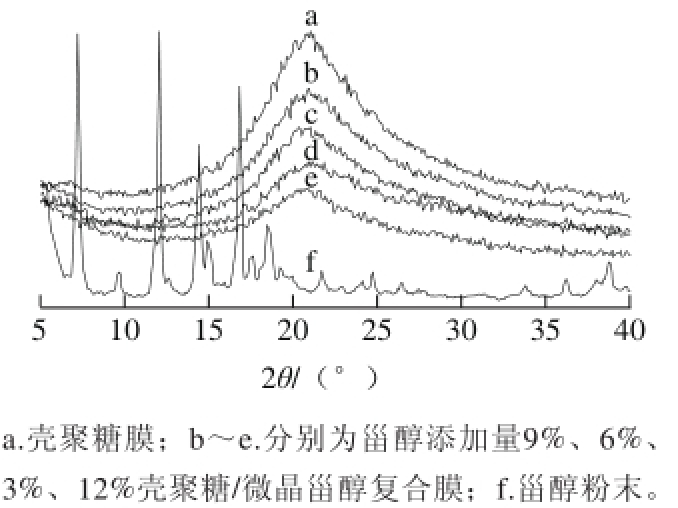
图10 壳聚糖/微晶甾醇复合膜的X射线衍射图
Fig.10 X-ray diffraction diagrams of fi lms
2.2.4 热重分析

图11 壳聚糖/微晶甾醇复合膜的TG图TG
Fig.11 TG diagrams of fi lms
热重(thermogravimetric,TG)分析是评估材料热稳定性的一个重要的方法[34]。由图11可知,各种膜样品早期都有少量的质量损失,这主要是由于非结合水、甘油、乙酸等小分子的挥发。壳聚糖膜在117~290 ℃大量分解,且分解曲线的转折点即最大质量损失速率温度出现在205 ℃,分解速率加快,质量损失最为迅速;4 种壳聚糖/微晶甾醇复合膜在127~320 ℃大量分解,最大质量损失速率温度在210~228 ℃。温度再升高,各种膜质量损失缓慢,样品主要以残渣炭的形式存在。由此可见,壳聚糖/微晶甾醇复合膜的大量分解温度和最大质量损失速率温度均明显高于壳聚糖膜,也就是说壳聚糖/微晶甾醇复合膜的热稳定性能优于壳聚糖膜,尤其是甾醇添加量为9%的壳聚糖/微晶甾醇复合膜的热稳定性最好。
随着甾醇添加量的增加,壳聚糖/微晶甾醇复合膜的拉伸强度和断裂伸长率逐渐下降,溶解度和溶胀度逐渐增加,WVP显著降低,对O2-·及·OH的清除率显著提高,对金黄色葡萄球菌和大肠杆菌的抑菌性能明显增强。甾醇添加量为9%的壳聚糖/微晶甾醇复合膜各项性能指标良好,且壳聚糖分子中氨基上的氮原子与甾醇分子中羟基上的氢原子形成了分子间氢键,氢键的形成有利于甾醇在壳聚糖膜中的分散,能够使壳聚糖和甾醇之间保持良好的相容性,复合膜表面结构光滑,呈淡黄色,具有实际应用价值。
参考文献:
[1] 叶文斌, 樊亮, 贠汉伯. 添加中草药对黄原胶-长角豆半乳甘露聚糖复合膜性质的影响[J]. 食品科学, 2013, 34(13): 24-28. DOI:10.7506/ spkx1002-6630-201313006.
[2] 张宾, 汪东风, 邓尚贵, 等. 壳聚糖-胰蛋白酶抑制剂复合可食性膜的制备及抗黄曲霉活性[J]. 农业工程学报, 2012, 28(4): 287-291. DOI:10.3969/j.issn.1002-6819.2012.04.048.
[3] 吕飞, 丁祎程, 叶兴乾. 肉桂油/海藻酸钠薄膜物理特性和抗菌性能分析[J]. 农业工程学报, 2012, 28(2): 268-272. DOI:10.3969/ j.issn.1002-6819.2012.02.046.
[4] 钟宇, 李云飞. 酸溶剂对葛根淀粉/壳聚糖复合可食膜性能的影响[J]. 农业工程学报, 2012, 28(13): 263-268. DOI:10.3969/ j.issn.1002-6819.2012.13.042.
[5] JINDAL M, KUMAR V, RANA V, et al. Physico-chemical,mechanical and electrical performance of bael fruit gumechitosan IPN films[J]. Food Hydrocolloid, 2013, 30(1): 192-199. DOI:10.1016/ j.foodhyd.2012.05.027.
[6] MOHAMED C, CLEMENTINE K A, DIDIER M, et al. Antimicrobial and physical properties of edible chitosan films enhanced by lactoperoxidase system[J]. Food Hydrocolloid, 2013, 30(2): 576-580. DOI:10.1016/j.foodhyd.2012.07.018.
[7] KHOSHGOZARAN-ABRAS S, AZIZI M H, HAMIDY Z, et al. Mechanical, physicochemical and color properties of chitosan based-coatings as a function of Aloe vera gel incorporation[J]. Carbohydrate Polymers, 2012, 87(3): 2058-2062. DOI:10.1016/ j.carbpol.2011.10.020.
[8] XIE Y, LIU X, CHEN Q. Synthesis and characterization of watersoluble chitosan derivate and its antibacterial activity[J]. Carbohydrate Polymers, 2007, 69(1): 142-147. DOI:10.1016/j.carbpol.2006.09.010.
[9] YU D G, LIN W C, LIN C H, et al. Cytocompatibility and antibacterial activity of a PHBV membrane with surface-immobilized water-soluble chitosan and chondroitin-6-sulfate[J]. Macromolecular Bioscience, 2006, 6(5): 348-357. DOI:10.1002/mabi.200600026.
[10] CHIEN P J, SHEU F, HUANG W T, et al. Effect of molecular weight of chitosans on their antioxidative activities in apple juice[J]. Food Chemistry, 2007, 102(4): 1192-1198. DOI:10.1016/ j.foodchem.2006.07.007.
[11] 陈琼, 邱礼平, 马细兰. 高直链玉米淀粉-壳聚糖复合膜透气透水性能研究[J]. 现代食品科技, 2011, 27(8): 891-895. DOI:10.3969/ j.issn.1673-9078.2011.08.006.
[12] 张洪, 王明力, 和岳, 等. 壳聚糖/纳米SiOx复合膜对艳红桃的保鲜研究[J]. 食品科学, 2012, 33(22): 319-323.
[13] 杨胜平, 谢晶, 钱韻芳, 等. 壳聚糖复合保鲜剂涂膜与MAP保鲜“妃子笑”荔枝[J]. 食品科学, 2013, 34(8): 279-283.
[14] TEMTEM M, CASIMIRO T, MANO J F, et al. Green synthesis of a temperature sensitive hydrogel[J]. Green Chemistry, 2006, 9(1): 75-79. DOI:10.1039/B603930H.
[15] 顾蓉, 穆宝宁, 郭康权. 魔芋粉-壳聚糖-聚乙烯醇共混胶黏剂的结构表征[J]. 农业工程学报, 2013, 29(7): 277-283. DOI:10.3969/ j.issn.1002-6819.2013.07.035.
[16] BONINA P, PETROVA T, MANOLOVA N, et al. pH-sensitive hydrogels composed of chitosan and polyacrylamide: enzymatic degradation[J]. Journal of Bioactive and Compatible Polymers, 2004, 19(3): 197-208. DOI:10.1177/0883911504044455.
[17] 张慧芸, 郭新宇. 丁香精油-壳聚糖复合可食性膜对生肉糜保鲜效果的影响[J]. 食品科学, 2014, 35(18): 196-200. DOI:10.7506/spkx1002-6630-201418038.
[18] 彭勇, 李云飞, 项凯翔. 绿茶多酚提高壳聚糖包装膜的抗氧化性能[J]. 农业工程学报, 2013, 29(14): 269-276. DOI:10.3969/ j.issn.1002-6819.2013.14.034.
[19] 冯永巍. 壳聚糖的化学改性及其衍生物的抑菌活性研究[D]. 无锡:江南大学, 2011: 4.
[20] 张宾, 汪东风, 邓尚贵, 等. 壳聚糖-胰蛋白酶抑制剂复合可食性膜的制备及抗黄曲霉活性[J]. 农业工程学报, 2012, 28(4): 287-291. DOI:10.3969/j.issn.1002-6819.2012.04.048.
[21] 马青青, 曹锦轩, 周光宏. 功能性可食用膜在生鲜肉和肉制品保鲜中的应用研究进展[J]. 食品科学, 2012, 33(7): 331-335.
[22] VARGAS M, ALBORS A, CHIRALT A, et al. Characterization of chitosan-oleic acid composite films[J]. Food Hydrocolloid, 2009, 23(2): 536-547. DOI:10.1016/j.foodhyd.2008.02.009.
[23] VÁSCONEZ M B, FLORES S K, CAMPOS C A, et al. Antimicrobial activity and physical properties of chitosan-tapioca starch based edible fi lms and coatings[J]. Food Research International, 2009, 42(7): 762-769. DOI:10.1016/j.foodres.2009.02.026.
[24] ABUGOCH L E, TAPIA C, VILLAMÁN M C, et al. Characterization of quinoa protein-chitosan blend ediblefilms[J]. Food Hydrocolloid, 2011, 25(5): 879-886. DOI:10.1016/j.foodhyd.2010.08.008.
[25] MA W, TANG C H, YANG X Q, et al. Fabrication and characterization of kidney bean (Phaseolus vulgaris L.) protein isolate: chitosan composite films at acidic pH[J]. Food Hydrocolloid, 2013, 31(2): 237-247. DOI:10.1016/j.foodhyd.2012.10.007.
[26] 王丽岩. 壳聚糖基活性包装膜的性能及其在食品贮藏中应用的研究[D]. 长春: 吉林大学, 2013: 25-39.
[27] 塑料-拉伸性能的测定: GB/T 1040.3—2006[S].
[28] MAYACHIEW P, DEVAHASTIN S. Effects of drying methods and conditions on release characteristics of edible chitosan fi lms enriched with Indian gooseberry extract[J]. Food Chemistry, 2010, 118(3): 594-601. DOI:10.1016/j.foodchem.2009.05.027.
[29] JOUKI M, KHAZAEI N, GHASEMLOU M, et al. Effect of glycerol concentration on edible fi lm production from cress seed carbohydrate gum[J]. Carbohydrate Polymers, 2013, 96(1): 39-46. DOI:10.1016/ j.carbpol.2013.03.077.
[30] 塑料薄膜和片材透水蒸气性试验方法 杯式法: GB/T 1037—1988[S].
[31] BOURTOOM T, CHINNAN M S. Preparation and properties of rice starch-chitosan blend biodegradable film[J]. LWT-Food Science and Technology, 2008, 41(9): 1633-1641. DOI:10.1051/ IUFoST:20060515.
[32] 刘晓菲, 程春生, 覃宇悦, 等. 增塑剂对壳聚糖/纳米蒙脱土复合膜物理性能的影响[J]. 食品与发酵工业, 2011, 37(2): 87-90.
[33] MARTINS J T, CERQUEIRA M A, VICENTE A A. Influence of α-tocopherol on physicochemical properties of chitosan-based films[J]. Food Hydrocolloid, 2012, 27(1): 220-227. DOI:10.1016/ j.foodhyd.2011.06.011.
[34] BISHAY I K, Abd-El-MESSIEH S L, MANSOUR S H. Electrical, mechanical and thermal properties of polyvinyl chloride composites fi lled with aluminum powder[J]. Materials and Design, 2011, 32: 62-68. DOI:10.1016/j.matdes.2010.06.035.
Preparation, Properties and Structural Characterization of Chitosan/Microcrystalline Sterol Composite Edible Films
CHEN Hong, LI Caiyun, LI Xia, LI Yukuo, WU Xinlei ,WANG Dawei*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Abstract:Chitosan/microcrystalline sterol composite edible fi lms were prepared by fl ow casting method using chitosan as a fi lm-forming material, where phytosterols were added for their antioxidant and antimicrobial properties. With increasing addition of phytosterols up to 12% (relative to the mass of chitosan), the tensile strength and elongation at break of composite fi lms declined gradually, the solubility and swelling degree gradually increased, and the water vapour permeability coeff i cient remarkably reduced, indicating an improved moisture barrier property after the addition of sterol. In addition, the superoxide anion and hydroxyl radical scavenging capacities of fi lms were improved remarkably, and the antimicrobial activity against Staphylococcus aureus and Escherichia coli were signif i cantly enhanced. The compatibility of composite fi lms was analyzed by infrared spectroscopy (FT-IR), scanning electron microscopy (SEM), X-ray diffraction (XRD) and thermogravimetry (TG). The fi lms with 9% sterol added showed good performance. Moreover, chitosan-sterol complexes were formed by strong intermolecular hydrogen bonding interactions, and the blend system had good compatibility.
Key words:chitosan; phytosterols; edible composite fi lm; performance; structural characterization
DOI:10.7506/spkx1002-6630-201709015
中图分类号:TS206.4
文献标志码:A
文章编号:1002-6630(2017)09-0091-08
引文格式:
陈红, 李彩云, 李侠, 等. 壳聚糖/微晶甾醇可食性复合膜的制备、性能及结构表征[J]. 食品科学, 2017, 38(9): 91-98. DOI:10.7506/spkx1002-6630-201709015. http://www.spkx.net.cn
CHEN Hong, LI Caiyun, LI Xia, et al. Preparation, properties and structural characterization of chitosan/microcrystalline sterol composite edible films[J]. Food Science, 2017, 38(9): 91-98. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201709015. http://www.spkx.net.cn
收稿日期:2016-03-31
基金项目:“十二五”国家科技支撑计划项目(2011AA100805);吉林省重大科技攻关项目(2012ZDGG007);吉林省青年科研基金项目(20140520181JH);吉林农业大学科研启动基金项目(201639)
作者简介:陈红(1976—),女,副教授,博士,研究方向为粮食、油脂与植物蛋白工程。E-mail:chenhong20070801@163.com
*通信作者:王大为(1960—),男,教授,博士,研究方向为粮食、油脂与植物蛋白工程。E-mail:xcpyfzx@163.com