霍彦雄1,任亚梅1,*,袁春龙2,王 涛1,任小林3,杨军林1
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;
3.西北农林科技大学园艺学院,陕西 杨凌 712100)
摘 要:为了评价酶法合成的新化合物根皮 苷豆蔻酸酯的生物活性,通过探究其对黄嘌呤氧化酶(xanthine oxidase,XOD)和脂质氧化的抑制作用,检测其清除H2O2、HCl O和NO自由基的能力,利用抑制率和清除率评估其抗氧化性能。结果为:根皮苷豆蔻酸酯和根皮苷均是一种可逆的竞争型XOD抑制剂,对XOD的抑制都呈现质量浓度依赖关系,根皮苷豆蔻酸酯、根皮苷的半抑制浓度(half maximal inhibitory concentration,IC50)分别为131.17、172.18 μg/mL,抑制常数(Ki)分别为58.50、104.80 μg/mL;根皮苷豆蔻酸酯抑制脂质氧化的IC50为126.18 μg/mL,显著高于VC的IC5078.10 μg/mL,以及显著低于根皮苷的IC50149.86 μ g/mL;根皮苷豆蔻酸酯清除H2O2和HClO的IC50分别为58.16 μg/mL和157.11 μg/mL,显著高于VC清除H2O2和HClO的IC5032.33 μg/mL和116.23 μg/mL,但显著低于根皮苷清除H2O2和HClO的IC5083.36 μg/mL和213.50 μg/mL;根皮苷豆蔻酸酯、根皮苷以及VC清除NO自由基的IC50分别为232.22、210.86 μg/mL和134.58 μg/mL。根皮苷豆蔻酸酯清除NO自由基的能力弱于根皮苷,但其抑制脂质氧化、清除H2O2和HClO能力强于根皮苷,经豆蔻酸酯化修饰后根皮苷的体外抗氧化能力得到了改善,将为提高根皮苷生物活性提供新的途径和理论依据。
关键词:根皮苷豆蔻酸酯;抗氧化;抑制作用
自由基与人体的许多退行性疾病有关,比如其可以引起DNA损伤[1]、酶失活[2]并且增加细胞通透性[3]最后导致细胞坏死,因此,筛选高效抵御自由基损害的抗氧化剂非常有意义。
根皮苷是一类主要的黄酮糖苷[4],经证实具有多种生物活性,如降血糖、抗氧化[5]、保护心血管和抑制黑色素生成[6]等作用。这些功效促使其在食品添加剂、化妆品和药品领域被广泛利用。
然而,黄酮类物质包括根皮苷,由于在亲水和疏水介质中存在较差的溶解性和稳定性,使得其在实际利用方面受到严重的限制[7-8],研究证实利用酶法酰基化对黄酮类物质进行结构修饰,所得的黄酮类衍生物的溶解性大幅增加并且抗氧化性增强[9-10]。现阶段国内外对黄酮类物质的酯化研究主要是芦丁、橙皮苷、槲皮素和柚苷等物质,并且这些酯化物均表现出高的生物活性,对根皮苷的酯化以及其酯化物产物活性的研究较少,对根皮苷豆蔻酸酯的合成及活性研究更是鲜有报道。因此,本研究通过酶法合成新的化合物根皮苷豆蔻酸酯,并利用对黄嘌呤氧化酶(xanthine oxidase,XOD)活性和脂质氧化的抑制作用以及清 除H2O2、HClO和NO自由基的能力为指标比较了根皮苷豆蔻酸酯和根皮苷的体外抗氧化活性,同时将根皮苷豆蔻酸酯和根皮苷对XOD活性的抑制机理分别做了动力学研究,这将为更加全面、高效地利用根皮苷提供一定的理论参考。
1.1 材料与试剂
根皮苷标准品(纯度≥99%)、豆蔻酸(纯度≥99%)、3Å分子筛 上海阿拉丁生化科技股份有限公司;脂肪酶NovozymÒ 435(10 000 PLU/g月桂酸活力单位)丹麦Novo Nordisk公司;抗坏血酸(VC)(纯度≥99%)天津科密欧化学试剂有限公司;黄嘌呤氧化酶(100 U/g) 苏州天可贸易有限公司;H2O2(分析纯)四川西陇化工有限公司;HClO(分析纯) 广东光华科技有限公司;GF254荧光薄层色谱(thin-layer chromatography,TLC)板 上海研拓生物科技有限公司。
1.2 仪器与设备
AVANCE 500 MHz核磁共振(nuclear magnetic resonance,NMR)仪 美国Bruker公司;ZF-6型三用紫外线分析仪 上海佳鹏科技有限公司;L5紫外-可见分光光度仪 上海仪电分析器有限公司。6050型真空干燥箱 上海精宏仪器有限公司;HC-3018高速冷冻离心机安徽中科中佳科学仪器有限公司;R-200型真空旋转蒸发仪 瑞士Büchi公司。
1.3 方法
1.3.1 根皮苷豆蔻酸酯的合成、分离纯化及结构的鉴定
参照Satvir等[11]的方法并略加修改。以脂肪酶NovozymÒ 435为催化剂,将0.6 g根皮苷和1.03 g豆蔻酸溶于7 mL的丙酮,在46 ℃条件下真空恒温搅拌53 h,搅拌速率120 r/min。反应结束后,除去3 Å分子筛和脂肪酶NovozymÒ 435。反应混合物利用丙酮-甲苯为洗脱剂进行硅胶柱层析,TLC检测柱层析成分,收集纯净化合物溶液,采用1H NMR和13C NMR鉴定结构。
1.3.2 根皮苷豆蔻酸酯与根皮苷对XOD活性抑制及其抑制机理
1.3.2.1 根皮苷豆蔻酸酯与根皮苷对XOD活性的抑制作用
参考Chu等[12]的方法略加修改。配制质量浓度为0、25、50、75、100、125、150、175、200、225 μg/mL的根皮苷豆蔻酸酯与根皮苷溶液,分别取0.35 mL的样液,加入0.15 mL 0.09 U/mL的XOD,混匀,30 ℃条件下保温10 min后,取0.8 mL 0.05 mmol/L的黄嘌呤加入混合液中启动反应,在295 nm波长处每隔20 s测一次,连续测2 min,记录吸光度的变化并计算斜率R。以20 mmol/L pH 7.4磷酸缓冲液代替样品溶液,与上述样品相同处理作为空白对照,记录吸光度的变化并计算斜率R0。相对活性的计算见公式(1)。
1.3.2.2 根皮苷豆蔻酸酯与根皮苷分别对XOD活性抑制的机理
按1.3.2.1节的方法,黄嘌呤的浓度保持0.05 mmol/L不变,分别移取质量浓度为0、50、100、150 μg/mL的根皮苷豆蔻酸酯或根皮苷溶液,再加入活力分别为0.00、0.03、0.06、0.09、0.12 U/mL的XOD,分别测定根皮苷豆蔻酸酯和根皮苷对反应速率的影响,考察根皮苷豆蔻酸酯与根皮苷分别对XOD活性抑制的可逆性。
按1.3.2.1节的方法,XOD的活力为0.09 U/mL,分别移取质量浓度为0、50、100、150 μg/mL的根皮苷豆蔻酸酯或根皮苷溶液,再加入浓度分别为0.05、0.10、0.15、0.20 mmol/L的黄嘌呤,分别测定根皮苷豆蔻酸酯和根皮苷对反应速率的影响,通过Lineweaver-Burk双倒数方程作图,判断其抑制类型。
1.3.3 根皮苷豆蔻酸酯和根皮苷分别对脂质氧化的抑制能力
参考Zhao Xue等[13]的方法略有改动。配制质量浓度为40、80、120、160、200 μg/mL和240 μg/mL的根皮苷豆蔻酸酯和根皮苷溶液,分别取0.5 mL的样液,加入1 mL稀释2.5 倍的新鲜卵黄悬液、0.5 mL pH 7.4磷酸缓冲液和1 mL FeSO4(25 mmol/L)于试管中混合,在37 ℃条件下保温15 min后,加入1 mL 2.5%三氯乙酸静置5 min,最后加入2 mL 0.7%巴比妥酸在100 ℃条件下煮沸10 min,待冷却后,离心,在532 nm波长处测吸光度A,VC作为阳性对照。以10 mmol/L pH 7.4的磷酸缓冲液代替样品溶液,与上述样品相同处理作为空白对照,记录吸光度A0。抑制率的计算见公式(2)。
1.3.4 根皮苷豆蔻酸酯和根皮苷分别对H2O2清除能力的影响
参考Ruch等[14]的方法稍做改动。配制质量浓度为5、20、40、60、80 μg/mL和1 00 μg/mL的根皮苷豆蔻酸酯和根皮苷溶液,分别取10 μL样液,加入2 mL 8 mmol/L的H2O2,混匀,静置10 min,然后在230 nm波长处测定吸光度A,VC作为阳性对照。以50 mmol/L pH 7.4的磷酸缓冲液代替样品溶液,与上述样品相同处理作为空白对照,记录吸光度A0。清除率的计算见公式(3)。
1.3.5 根皮苷豆蔻酸酯和根皮苷分别对HClO清除能力的影响
参考Cecchini等[15]的方法略加修改。配制质量浓度为40、80、140、200、260 μg/mL和320 μg/mL的根皮苷豆蔻酸酯与根皮苷溶液,分别取200 μL的样液,再加入10 μL 4.5%次氯酸钠、200 μL 150 mmol/L牛磺酸和3 mL pH 7.4磷酸缓冲液(0.1 mol/L),混匀,暗反应5 min后加入10 μL 2 mol/L的KI溶液,再于暗处理10 min后在350 nm波长处测定吸光度A,VC作为阳性对照。以0.1 mol/L pH 7.4的磷酸缓冲液代替样品溶液,与上述样品相同处理作为空白对照,记录吸光度A0。清除率的计算同公式(3)。
1.3.6 根皮苷豆蔻酸酯和根皮苷分别对NO自由基清除能力的影响
参考Nambiar等[16]的方法略有修改。配制质量浓度为40、80、140、200、260 μg/mL和320 μg/mL的根皮苷豆蔻酸酯与根皮苷溶液,分别取1.5 mL的样液,加入0.5 mL 120 mmol/L的硝普酸钠,混匀,25 ℃条件下反应150 min,取出1 mL反应液与1 mL的Griess液混合,立即在546 nm波长处测定吸光度A,VC作为阳性对照。以0.1 mol/L pH 7.4的磷酸缓冲液代替样品溶液,与上述样品相同处理作为空白对照,记录吸光度A0。清除率的计算同公式(3)。
1.4 数据分析
实验结果用Excel软件作图,SPSS 18.0软件进行方差分析,采用Duncan多重比较,P<0.05表示差异显著。结果以±s表示。
2.1 根皮苷豆蔻酸酯分子结构分析鉴定
经鉴定,根皮苷豆蔻酸酯的1H NMR和13C NMR的化学位移、化合物形态如下:
6”-O-根皮苷豆蔻酸酯:淡黄色固体。1H NMR(DMSO-d6;500 MHz):δ 10.52(s,1H,ArOH)、9.08(br s,1H,ArOH)、7.04(d,2H,J=7.5 Hz,H-2,H-6)、6.66(d,2H,J=7.5 Hz,H-3,H-5)、6.11(s,1H,H-3’)、5.98(s,1H,H-5’)、5.41(br s,1H,OH)、5.37(br s,2H,2OH)、4.99(d,1H,J=6.8 Hz,H-1”)、4.33(br d,1H,J=11.3 Hz,H-6a”)、4.14(dd,1H,J=11.4 Hz,6.9 Hz,H-6b”)、3.61(br t,J=6.9 Hz,H-4”)、3.36~3.21(m,6H,2×Hα,H-2”,H-3”,H-5”,OH)、2.78(br t,2H,J=6.9 Hz,2×Hβ)、2.28(t,2H,J=6.9 Hz,2×H-2”’)、1.47(m,2H,2×H-3”’)、1.22~1.17(m,20H,2(CH2))、0.87(br t,3H,J=6.8 Hz,CH3);13C NMR(DMSO-d6,125 MHz):δ 205.09(CO)、173.26(OCO)、165.84(C-4’)、164.89(C-6’)、161.07(C-2’)、155.75(C-4)、131.93(C-1)、129.55(C-2、C-6)、115.41(C-3、C-5)、105.66(C-1’)、101.09(C-1”)、97.39(C-3’)、94.99(C-5’)、76.89(C-3”)、74.37(C-5”)、73.58(C-2”)、70.28(C-4”)、63.52(C-6”)、45.43(Cα)、33.87(C-2”’)、31.76(Cβ)、29.52、29.35、29.17(C-4”’、C-5”’、C-6”’、C-7”’、C-8”’、C-9”’、C-10”’、C-11”’、C-12”’)、24.84(C-3”’)、22.55(C-13”’)、14.39(C-14”’)。
6”-O-根皮苷豆蔻酸酯的化学结构式如图1所示。
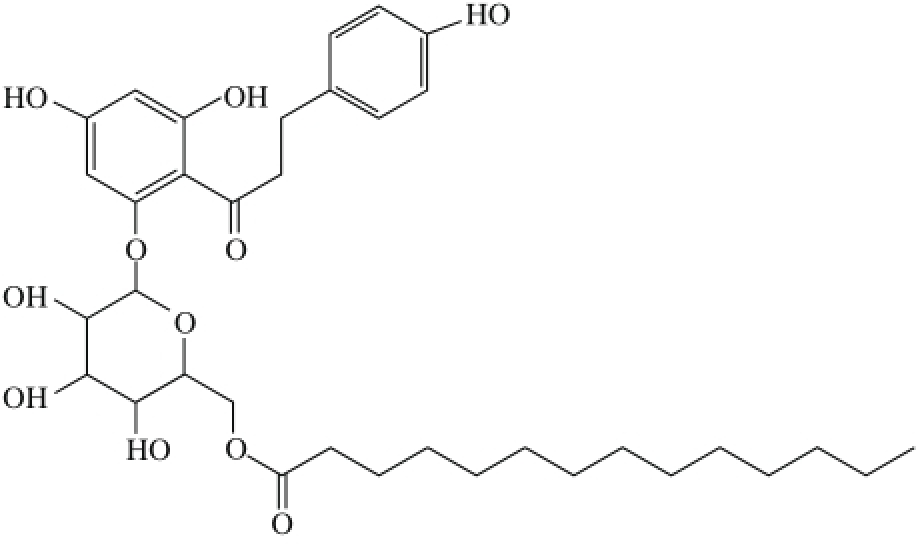
图1 6 1 6”-O-根皮苷豆蔻酸酯的化学结构式
Fig.1 Chemical structure of phloridzin-6”-O-myristate
2.2 根皮苷豆蔻酸酯与根皮苷对XOD活性的抑 制作用及其抑制机理
2.2.1 根皮苷豆蔻酸酯与根皮苷对XOD活性的抑制作用

图2 根皮苷豆蔻酸酯和根皮苷分别对XOD的抑制作用
Fig.2 Inhibitory effects of phloridzin myristate and phloridzin on xant hine oxidase
黄酮类物质是一类重要的天然抗氧化剂,已证明其会抑制与疾病相关的许多酶的活性[17],XOD被认为是生成自由基的重要生物来源[18]。如图2所示,随着根皮苷豆蔻酸酯及根皮苷的质量浓度从0 μg/mL增加到150 μg/mL时,二者均对XOD活性的抑制作用呈增加趋势;质量浓度从150 μg/mL增加到225 μg/mL时,均对XOD活性的抑制作用趋于缓和。Salem等[19]研究发现槲皮素酯比槲皮素具有更高的抑制XOD活性的能力。根皮苷豆蔻酸酯及根皮苷对XOD的半抑制浓度(half maximal inhibitory concentration,IC50)分别为131.17、172.18 μg/mL,说明根皮苷豆蔻酸酯表现出更强的抑制XOD的性质,可能是分子中引入酰基能加强其对酶的抑制活性[20],使其更加容易到达活性中心与钼元素结合钝化XOD。
2.2.2 根皮苷豆蔻酸酯与根皮苷分别对XOD抑制的可逆性判断
由图3A和3B可见,在含有不同质量浓度的根皮苷豆蔻酸酯、根皮苷的体系中,反应速率对XOD活力作图所得的一系列直线均通过原点,且随着根皮苷豆蔻酸酯、根皮苷质量浓度的增加,所得直线的斜率均不断降低,此符合可逆性抑制的条件[21]。
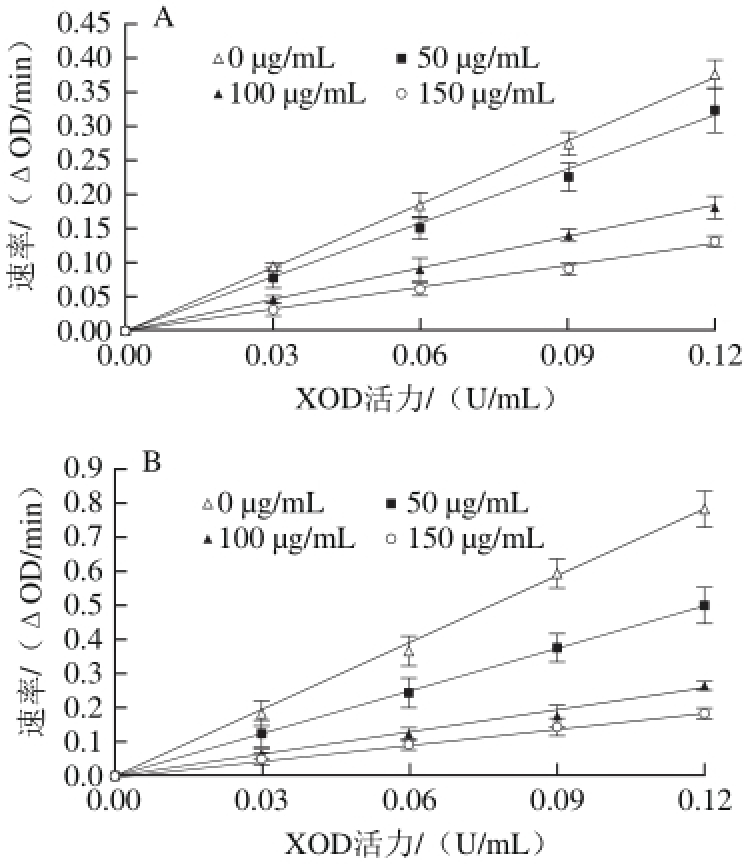
图3 根皮苷豆蔻酸酯(A)和根皮苷(B)抑制XOD的可逆性
Fig.3 Reversible inhibition of phloridzin myristate (A) and phloridzin (B) on xanthine oxidase
2.2.3 根皮苷豆蔻酸酯与根皮苷对X OD的抑制的动力学分析

图4 根皮苷豆蔻酸酯(A)及根皮苷(B)抑制XOD的
Lineweaver-Buurrkk曲线
Fig.4 Lineweaver-Burk plots for the inhibition of phloridzin myristate (A) and phloridzin (B) on xanthine oxidase
如图4所示,在含有不同质量浓度的根皮苷豆蔻酸酯、根皮苷的体系中,通过反应速率的倒数对黄嘌呤浓度的倒数作图所得的直线各自均有相同的Y轴截距,随着根皮苷豆蔻酸酯与根皮苷质量浓度的增加,直线的斜率均增大,可知米氏方程常数(直线在X轴上的截距绝对值的倒数)随着根皮苷豆蔻酸酯和根皮苷质量浓度的增加不断变大,而最大反应速率则保持不变,此现象符合竞争性抑制类型的规律[22-23]。可知,根皮苷豆蔻酸酯及根皮苷对XOD的抑制皆为竞争性抑制,其抑制常数(Ki)分别为58.50、104.80 μg/mL。
2.3 根皮苷豆蔻酸酯、根皮苷及VC对脂质氧化的抑制作用
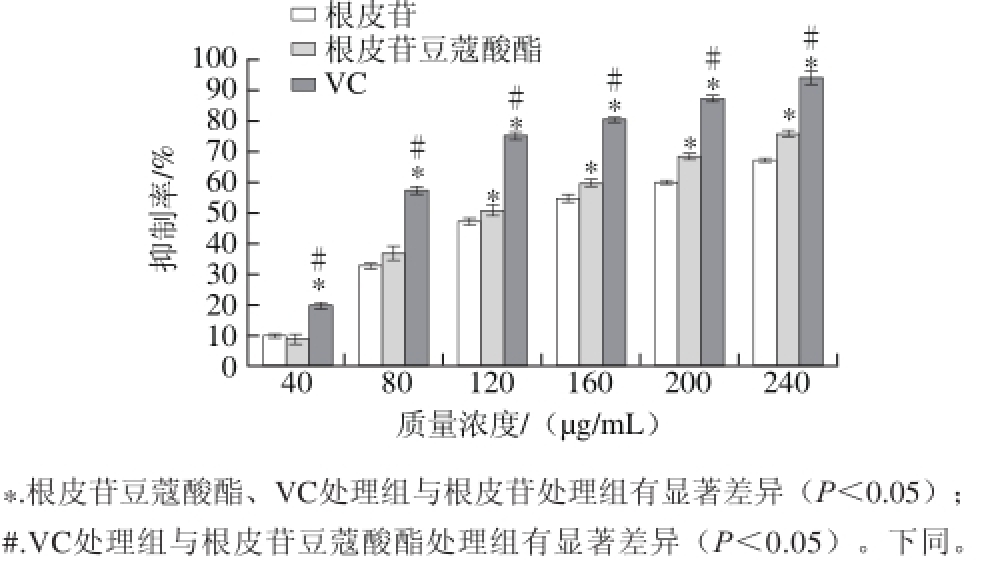
图5 根皮苷豆蔻酸酯、根皮苷及VC对脂质氧化的抑制作用
Fig.5 Inhibitory effects of phloridzin myristate, phloridzin and vitamin C on lipid peroxidation
由图5可知,在一定的质量浓度变化范围内,根皮苷豆蔻酸酯、根皮苷以及VC对卵磷脂氧化的抑制率与其质量浓度之间有一定的正相关性,对卵磷脂氧化的抑制率均呈现上升趋势。根皮苷豆蔻酸酯、根皮苷及VC分别对卵磷脂氧化抑制的IC50为126.18、149.86 μg/mL和78.10 μg/mL。根皮苷豆蔻酸酯及根皮苷质量浓度从40 μg/mL增加到80 μg/mL时,对卵磷脂氧化的抑制作用差异不显著;质量浓度从120 μg/mL增加到240 μg/mL时,二者对卵磷脂氧化的抑制作用差异显著。Mellou等[24]发现金圣草素苷酯能提高对低密度脂蛋白和血清氧化的抑制能力,增强其在油料中的抗氧化性。可能是根皮苷分子中引入了豆蔻酸使根皮苷豆蔻酸酯分子在反应体系中形成了反胶团,反胶团的形成有助于提高抗氧化剂的活性[25];在根皮苷豆蔻酸酯低质量浓度时,体系中形成的反胶团较少,其抗氧化作用与根皮苷相当;当根皮苷豆蔻酸酯质量浓度升高时,体系中形成大量的反胶团,促使根皮苷豆蔻酸酯呈现出较高的活性;再者,根皮苷豆蔻酸酯结构中的羟基易与自由基结合,生成较稳定的半醌式自由基,从而终止脂质氧化的链式反应。在整个过程中,VC对卵磷脂氧化的抑制作用显著强于根皮苷豆蔻酸酯或根皮苷。
2.4 根皮苷豆蔻酸酯、根皮苷及VC对H2O2的清除能力
酚类物质的多不饱和脂肪酸酯表现出比酚类物质本身更强的抗癌、抗病毒作用,并且有显著提高抗炎症能力[26]。H2O2作为氧自由基的一种,在炎症发病机制中起着非常重要的角色[27],由图6可知,根皮苷豆蔻酸酯、根皮苷以及VC的质量浓度从5 μg/mL增加到100 μg/mL时,三者分别对H2O2的清除率与质量浓度之间存在一定的量效关系,质量浓度为5 μg/mL时,三者对H2O2的清除率差异不显著;随着三者的质量浓度从20 μg/mL增加到100 μg/mL,根皮苷豆蔻酸酯较根皮苷对H2O2的清除能力有显著性提高,但显著低于VC对H2O2的清除能力;根皮苷豆蔻酸酯、根皮苷及VC对H2O2清除的IC50分别为58.16、83.36 μg/mL和32.33 μg/mL。研究表明酚类衍生物中的酰基可以有助于降低羟基键解离焓[28],提高抗氧化能力。根皮苷豆蔻酸酯可能通过酰基使其结构中的功能性羟基更容易解离并与自由基进行结合,以及根皮苷豆蔻酸酯的酰基作为良好的电子供体,可加速H2O2生成水,从而提高了其对H2O2的清除能力。
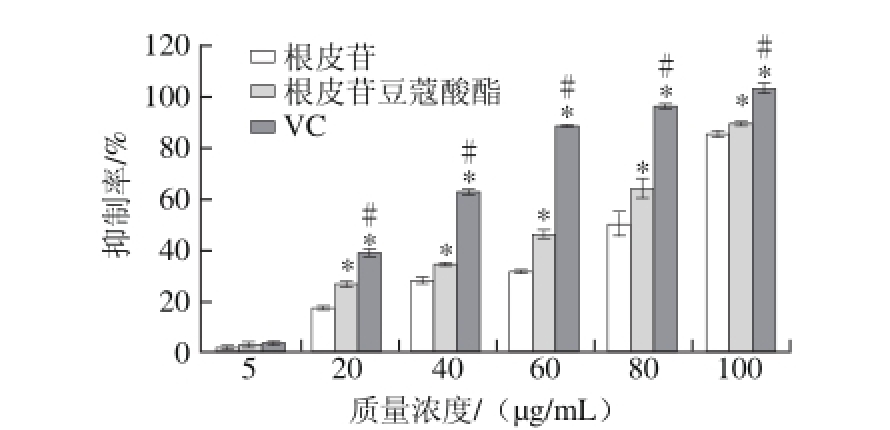
图6 根皮苷豆蔻酸酯、根皮苷及VCH2O2清除能力
Fig.6 Hydrogen peroxide scavenging effects of phloridzin myristate, phloridzin and vitamin C
2.5 根皮苷豆蔻酸酯、根皮苷及VC对HClO的清除能力
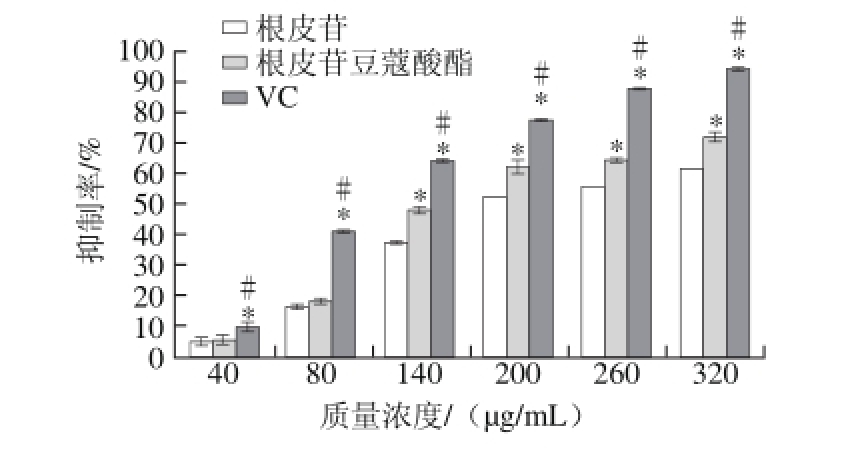
图7 根皮苷豆蔻酸酯、根皮苷及VC对HClO清除能力
Fig.7 Hypochlorous acid scavenging effects of phloridzin myristate, phloridzin and vitamin C
由图7可知,在一定的质量浓度变化范围内,根皮苷豆蔻酸酯、根皮苷以及VC对HClO的清除能力与其质量浓度呈正相关,故可通过提高各自的质量浓度增加其抗氧化性,三者的质量浓度从40 μg/mL增加到80 μg/mL时,根皮苷豆蔻酸酯与根皮苷对HClO的清除率差异不显著,二者均与VC差异显著;质量浓度从140 μg/mL增加到320 μg/mL时,根皮苷豆蔻酸酯比根皮苷清除HClO的能量更强,却显著低于VC对HClO的清除能力;根皮苷豆蔻酸酯、根皮苷及VC清除HClO的IC50分别为157.11、213.50 μg/mL和116.23 μg/mL。酰基化后根皮苷所得的根皮苷豆蔻酸酯,其抗氧化活性提高,可能是黄酮类化合物的抗氧化反应受最高 占据分子轨道和最低未占据分子轨道能隙总和大小的影响,能隙的大小决定了发生抗氧化反应的能力,酰基化的根皮苷可能引起结构中羟基 的能隙降低,使羟基容易与自由基结合,从而引起其抗氧化能力的增强。
2.6 根皮苷豆蔻酸酯、根皮苷及VC对NO自由基的清除能力
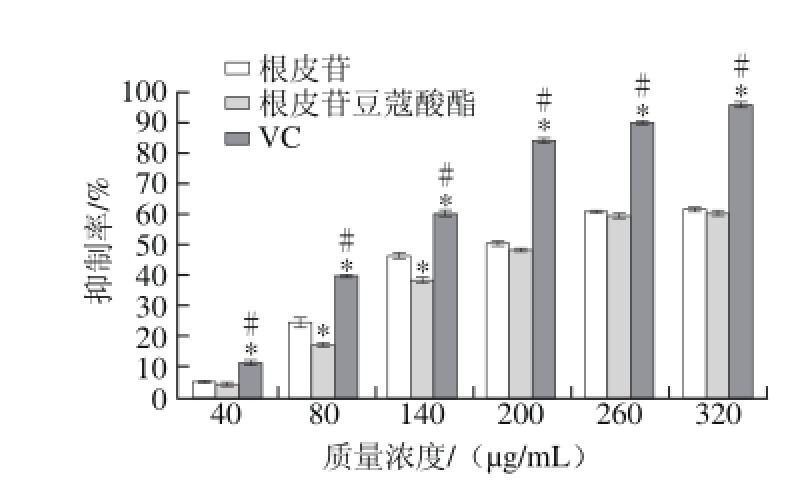
图8 根皮苷豆蔻酸酯、根皮苷及VC对NO自由基清除能力
Fig.8 Nitrite radical scavenging effects of phloridzin myristate, phloridzi n and vitamin C
由图8可知,根皮苷豆蔻酸酯、根皮苷以及VC的质量浓度从40 μg/mL增加到320 μg/mL,三者均对NO自由基的清除能力逐渐增加,根皮苷豆蔻酸酯和根皮苷的质量浓度均为40 μg/mL时,二者对NO自由基的清除能力差异不显著;质量浓度从80 μg/mL增加到140 μg/mL时,根皮苷豆蔻酸酯显著低于根皮苷对NO自由基的清除能力;质量浓度从200 μg/mL增加到320 μg/mL时,二者对NO自由基的清除能力差异不显著。在相同质量浓度下,VC较根皮苷豆蔻酸酯和根皮苷均有更强的清除NO自由基的能力,根皮苷豆蔻酸酯、根皮苷及VC清除NO自由基的IC50分别是232.22、210.86 μg/mL和134.58 μg/mL。黄酮类物质清除NO是利用抗氧化剂在反应体系中与氧气或氮氧化物发生竞争性作用达到抑制亚硝酸盐的效果[29],活性物质分子中引入烷酰基基团,使分子体积增大,使其在体系中出现反应阻碍作用[30],根皮苷豆蔻酸酯中的烷酰基阻碍了其与氧气和氮氧化物的结合,致使在相同质量浓度时,其对NO自由基的清除能力低于根皮苷。
3
根皮苷豆蔻酸酯和根皮苷皆通过竞争性方式对XOD产生抑制作用,其中,根皮苷豆蔻酸酯对XOD的抑制作用更强,根皮苷豆蔻酸酯显著低于根皮苷的IC50和Ki,二者的IC50分别为131.17、172.18 μg/mL,Ki分别为58.50、104.80 μg/mL;根皮苷豆蔻酸酯抑制脂质氧化的IC50为126.18 μg/mL,显著高于VC的IC5078.10 μg/mL,以及显著低于根皮苷的IC50149.86 μg/mL;根皮苷豆蔻酸酯清除H2O2和HClO的IC50分别为58.16、157.11 μg/mL,显著高于VC清除H2O2和HClO的IC5032.33、116.23 μg/mL,显著低于根皮苷清除H2O2和HClO的IC5083.36、213.50 μg/mL;对NO自由基的清除能力,根皮苷豆蔻酸酯、根皮苷以及VC的IC50分别为232.22、210.86 μg/mL和134.58 μg/mL,根皮苷豆蔻酸酯不及根皮苷和VC对NO自由基的清除能力。相比于根皮苷,根皮苷豆蔻酸酯具有更强的抑制脂质氧化和清除H2O2和HClO能力,抗氧活性得到了改善,究其原因是根皮苷豆蔻酸酯分子中引入酰基使其更加容易到达酶的活性中心、增加了体系中反胶团的形成、降低了羟基键解离焓和轨道能隙,并作为良好的电子供体,这些因素促使其抗氧化性增强,鉴于根皮苷豆蔻酸酯具有较强的体外抗氧活性,作为新型抗氧化剂,其在医疗和食品领域的应用将有广阔的前景。由于实验条件限制,未能对其体内抗氧化活性和机制进行研究,有待后续进一步完善。
参考文献:
[1] WARIS G, AHSAN H. Reactive oxygen species: role in the development of cancer and various chronic conditions[J]. Journal of Carcinogenesis, 2006, 5(7): 14. DOI:10.1186/1477-3163-5-14.
[2] SASTRE J, PALLARDÓ F V, VIÑA J. Mitochondrial oxidative stress plays a key role in aging and apoptosis[J]. Iubmb Life, 2000, 49(5): 427-435. DOI:10.1080/152165400410281.
[3] KIM R, EMI M, TANABE K, et al. Regulation and interplay of apoptotic and non-apoptotic cell death[J]. Journal of Pathology, 2006, 208(3): 319-326. DOI:10.1002/path.1885.
[4] EHRENKRANZ J R L, LEWIS N G, KAHN C R, et al. Phlorizin: a review[J]. Diabetes/Metabolism Research & Reviews, 2005, 21(1): 31-38. DOI:10.1002/dmrr.532.
[5] MILISAVLJEVIĆ A, STOJANOVIĆ M, CAREVIĆ M, et al. Lipase-catalyzed esterification of phloridzin: acyl donor effect on enzymatic affinity and antioxidant properties of esters[J]. Industrial & Engineering Chemistry Research, 2014, 53(43): 16644-16651. DOI:10.1021/ie5027259.
[6] ZIAULLAH, BHULLAR K S, WARNAKULASURIYA S N, et al. Biocatalytic synthesis, structural elucidation, antioxidant capacity and tyrosinase inhibition activity of long chain fatty acid acylated derivatives of phloridzin and isoquercitrin[J]. Bioorganic & Medicinal Chemistry, 2012, 21(3): 684-692. DOI:10.1016/j.bmc.2012.11.034.
[7] MELLOU F, LOUTRARI H, STAMATIS H, et al. Enzymatic esterif i cation of fl avonoids with unsaturated fatty acids: Effect of the novel esters on vascular endothelial growth factor release from K562 cells[J]. Process Biochemistry, 2006, 41(9): 2029-2034. DOI:10.1016/ j.procbio.2006.05.002.
[8] TOMMASINI S, CALABRÒ M L, STANCANELLI R, et al. Improvement in solubility and dissolution rate of flavonoids by complexation with β-cyclodextrin[J]. Journal of Pharmaceutical & Biomedical Analysis, 2004, 35(2): 379-387. DOI:10.1016/S0731-7085(03)00647-2.
[9] FOSSEN T, CABRITA L, ANDERSEN O M. Colour and stability of pure anthocyanins inf l uenced by pH including the alkaline region[J]. Food Chemistry, 1998, 63(4): 435-440. DOI:10.1016/S0308-8146(98)00065-X.
[10] ISHIHARA K, NAKAJIMA N. Structural aspects of acylated plant pigments: stabilization of flavonoid glucosides and interpretation of their functions[J]. Journal of Molecular Catalysis B Enzymatic, 2003, 23(2/3/4/5/6): 411-417. DOI:10.1016/S1381-1177(03)00106-1.
[11] SATVIR S L, RUPASINGHE H P V. Docosahexaenoic acid ester of phloridzin inhibit lipopolysaccharide-induced inf l ammation in THP-1 differentiated macrophages[J]. International Immunopharmacology, 2015, 25(1): 199-206. DOI:10.1016/j.intimp.2015.01.019.
[12] CHU Y H, CHEN C J, WU S H, et al. Inhibition of xanthine oxidase by Rhodiola crenulata extracts and their phytochemicals[J]. Journal of Agricultural and Food Chemistry, 2014, 62(17): 3742-3749. DOI:10.1021/jf5004094.
[13] ZHAO Xue, LI Bafang, XUE Changhu, et al. Effect of molecular weight on the antioxidant property of low molecular weight alginate from Laminaria japonica[J]. Journal of Applie d Phycology, 2012, 24(2): 295-300. DOI:10.1007/s10811-011-9679-y.
[14] RUCH R J, CHENG S J, KLAUNIG J E. Prevention of cytotoxicity and inhibition of intercellular communication by antioxidant catechins isolated from Chinese green tea[J]. Carcinogenesis, 1989, 10(6): 1003-1008. DOI:10.1093/carcin/10.6.1003.
[15] CECCHINI C, COMAN M M, CRESCI A, et al. Essential oil from frui ts and roots of Ferulago campestris (Besser) Grecescu (Apiaceae): composition and antioxidant and anti-Candida activity[J]. Flavour and Fragrance Journal, 2010, 25(6): 493-502. DOI:10.1002/ffj.2010.
[16] NAMBIAR S S, PARAMESHA M, SHETTY N P. Comparative analysis of phytochemical profile, antioxidant activities and foam prevention abilities of whole fruit, pulp and seeds of emblica off i cinalis[J]. Journal of Food Science and Technology-Mysore, 2015, 52(11): 7254-7262. DOI:10.1007/s13197-015-1844-x.
[17] de BRUYNE T, PIETERS L, DEELSTRA H, et al. Condensed vegetable tannins: biodiversity in structure and biological activities[J]. Biochemical Systematics and Ecology, 1999, 27(4): 445-459. DOI:10.1016/S0305-1978(98)00101-X.
[18] KWEON M H, HWANG H J, SUNG H C. Identification and antioxidant activity of novel chlorogenic acid derivatives from bamboo (Phyllostachys edulis)[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4646-4655. DOI:10.1021/jf010514x.
[19] SALEM J H, HUMEAU C, CHEVALOT I, et al. Effect of acyl donor chain length on isoquercitrin acylation and biological activities of corresponding esters[J]. Process Biochemistry, 2010, 45(3): 382-389. DOI:10.1016/j.procbio.2009.10.012.
[20] KUBO I, MASUOKA N, XIAO P, et al. Antioxidant activity of dodecyl gallate[J]. Journal of Agricultural and Food Chemistry, 2002, 50(12): 3533-3539. DOI:10.1021/jf011250h.
[21] LIN S Y, ZHANG G W, PAN J H, et al. Deciphering the inhibitory mechanism of genistein on xanthine oxidase in vitro[J]. Journal of Photochemistry and Photobiology B-Biology, 2015, 153: 463-472. DOI:10.1016/j.jphotobiol.2015.10.022.
[22] LIN C M, CHEN C S, CHEN C T, et al. Molecular modeling of flavonoids that inhibits xanthine oxidase[J]. Biochemical & Biophysical Research Communications, 2002, 294(1): 167-172. DOI:10.1016/S0006-291X(02)00442-4.
[23] BHULLAR K S, WARNAKULASURIYA S N, RUPASINGHE H P V. Biocatalytic synthesis, structural elucidation, antioxidant capacity and tyrosinase inhibition activity of long chain fatty acid acylated derivatives of phloridzin and isoquercitrin[J]. Bioorganic & Medicinal Chemistry, 2013, 21(3): 684-692. DOI:10.1016/j.bmc.2012.11.034.
[24] MELLOU F, LAZARI D, SKALTSA H, et al. Biocatalytic preparation of acylated derivatives of flavonoid glycosides enhances their antioxidant and antimicrobial activity[J]. Journal of Biotechnology, 2005, 116(3): 295-304. DOI:10.1016/j.jbiotec.2004.12.002.
[25] LAGUERRE M, CHEN B C, LECOMTE J, et al. Antioxidant properties of chlorogenic acid and its alkyl esters in stripped corn oil in combination with phospholipids and/or water[J]. Journal of Agricultural and Food Chemistry, 2011, 59(18): 10361-10366. DOI:10.1021/jf2026742.
[26] SHAHIDI F, ZHONG Y. Novel antioxidants in food quality preservation and health promotion[J]. European Journal of Lipid Science & Technology, 2010, 112(9): 930-940. DOI:10.1002/ ejlt.201000044.
[27] ROJKIND M, DOMÍNGUEZ-ROSALES J A, NIETO N, et al. Role of hydrogen peroxide and oxidative stress in healing responses[J]. Cellular & Molecular Life Sciences CMLS, 2002, 59(11): 1872-1891. DOI:10.1007/PL00012511.
[28] BENTES A L A, BORGES R S, MONTEIRO W R, et al. Structure of dihydrochalcones and related derivatives and their scavenging and antioxidant activity against oxygen and nitrogen radical species[J]. Molecules, 2011, 16(2): 1749-1760. DOI:10.3390/ molecules16021749.
[29] CESARETTIN A, MAGDALENA K, RYSZARD A, et al. Antioxidant and antiradical activities in extracts of hazelnut kernel (Corylus avellana L.) and hazelnut green leafy cover[J]. Journal of Agricultural and Food Chemistry, 2006, 54(13): 826-832. DOI:10.1021/jf0601259.
[30] PAJUNEN T I, JOHANSSON M P, HASE T, et al. Autoxidation of conjugated linoleic acid methyl ester in the presence of alphatocopherol: the hydroperoxide pathway[J]. Lipids, 2008, 43(7): 599-610. DOI:10.1007/s11745-008-3195-0.
Antioxidant Activities of Phloridzin Myristate
HUO Yanxiong1, REN Yamei1,*, YUAN Chunlong2, WANG Tao1, REN Xiaolin3, YANG Junlin1
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China; 2. College of Enology, Northwest A&F University, Yangling 712100, China; 3. College of Horticulture, Northwest A&F University, Yangling 712100, China)
Abstract:The antioxidant activities of phlorizin myristate, a new compound synthesized enzymatically, were assessed by measuring its capacity to inhibit xanthine oxidase (XOD) and lipid perioxidation and scavenge hydrogen peroxide (H2O2), hypochlorous acid (HClO), and nitrite radical. Results showed that phlorizin myristate and phlorizin were a reversible competitive inhibitor of XOD and their effects on XOD were in a dosage-dependent manner. The half inhibitory concentrations (IC50) of phlorizin myristate and phlorizin were 131.17 and 172.18 μg/mL, and the inhibitory constants (Ki) were 58.50 and 104.80 μg/mL, respectively. Phlorizin myristate inhibited lipid oxidation with IC50of 126.18 μg/mL, which was signif i cantly higher than that of vitamin C (78.10 μg/mL) and lower than that of phlorizin (149.86 μg/mL). Phlorizin myristate scavenged H2O2and HClO with IC50of 58.16 and 157.11 μg/mL, respectively, which was signif i cantly higher than those of vitamin C (32.33 and 116.23 μg/mL) and lower than those of phlorizin (83.36 and 213.50 μg/mL). Nitrite radical scavenging activity of phlorizin myristate was weaker than that of phlorizin and vitamin C. Phlorizin myristate, phlorizin and vitamin C scavenged nitrite radical with IC50of 232.22, 210.86 and 134.58 μg/mL, respectively. Conclusively, the antioxidant capacity of phlorizin was im proved after modif i cation with myristate. These results will provide a new method and theoretical basis for improving the biological activity of phlorizin.
Key words:phlorizin myristate; antioxidation; inhibition
DOI:10.7506/spkx1002-6630-201709019
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)09-0119-07
收稿日期:2016-05-20
基金项目:陕西省农业科技创新与攻关项目(2015NY004);农业部现代农业技术体系苹果专项(Z225020701);“十二五”国家科技支撑计划项目(2015BAD16B02);西北农林科技大学科技创新与成果转化项目(Z222021313)作者简介:霍彦雄(1990—),男,硕士研究生,研究方向为果蔬贮藏与加工。E-mail:1551895711@qq.com
*通信作者:任亚梅(1970—),女,副教授,博士,研究方向为果蔬加工与贮藏。E-mail:715189648@qq.com
引文格式:
霍彦雄, 任亚梅, 袁春龙, 等. 根皮苷豆蔻酸酯的抗氧化活性[J]. 食品科学, 2017, 38(9): 119-125. DOI:10.7506/spkx1002-6630-201709019. http://www.spkx.net.cn
HUO Yanxiong, REN Yamei, YUAN Chunlong, et al. Antioxidant activities of phloridzin myristate[J]. Food Science, 2017, 38(9): 119-125. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201709019. http:// www.spkx.net.cn