王长远,全 越,李玉琼,冯玉超,曹龙奎,张东杰*
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
摘 要:在氨基葡萄糖存在的条件下,利用转谷氨酰胺酶(transglutaminase,TG)对燕麦麸皮球蛋白糖基化结构修饰,进而探讨糖基化蛋白功能性质与结构之间的关系。结果表明,糖基化交联球蛋白的溶解性、乳化稳定性、起泡性及泡沫稳定性相比于未修饰的球蛋白都有明显的改善,但表面疏水性明显下降;另外,酶促糖基化球蛋白的变性温度和焓变值都有所下降,其二级结构变化为:α-螺旋结构相对含量呈增加趋势,β-折叠和β-转角结构相对含量呈下降趋势,无规卷曲结构相对含量几乎没变。经糖基化处理的球蛋白酪氨酸分子主要呈现“暴露态”,色氨酸相对拉曼强度更趋近于“包埋态”。酶促糖基化球蛋白二硫键振动模式为t-g-t。通过对球蛋白、修饰球蛋白的功能特性与空间构象的比较分析,明确TG催化葡萄糖结合在燕麦麸球蛋白上,进一步明晰修饰蛋白功能特性与空间构象之间的构效关系。结果可为延长杂粮产业链提供良好的理论依据,同时可以为今后制备燕麦蛋白特定产品进行分子设计和重组提供基础数据。
关键词:燕麦麸皮;球蛋白;转谷氨酰胺酶;功能特性;结构
燕麦麸皮蛋白中球蛋白是主要蛋白[1],具有较好的营养和保健作用,是优质营养蛋白。糖基化修饰蛋白质使其分子的侧链与糖基相连,这样引起了蛋白质的结构发生变化,转谷氨酰胺酶(transglutaminase,TG)是催化酰基发生转移反应的转移酶,引起的蛋白质分子内部或蛋白质分子间共交联的这些催化反应可以修改食品蛋白质的性质。已报道的文献中,有利用TG与氨基葡萄糖实现酪蛋白和大豆蛋白糖基化交联,并改善了蛋白质的部分功能 特性[2-5]。探讨燕麦麸皮球蛋白、修饰燕麦麸皮球蛋白功能特性与空间构象之间的构效关系,是开发高稳定燕麦麸皮球蛋白的关键问题。这是由于蛋白质结构决定了其理化及功能特性,与蛋白分子质量的分布、亚基组成、二硫键振动模式等有着密切的联系。因此,通过分析,不仅能了解改性蛋白的结构与功能的变化,并且能增加对结构修饰机理的了解,更进一步为TG催化植物蛋白改性的研究打下基础,也为今后开发燕麦麸皮球蛋白特定产品而进行分子设计与重组提供重要的理论指导和技术支持。
1.1 材料与试剂
燕麦麸皮中球蛋白由黑龙江八一农垦大学微生物实验室自行制备:按照Osborne蛋白质分级法提取,盐浓度1.2 mol/L,料液比1∶16(m/V),提取温度26.5 ℃,提取时间2.0 h[6]。
TG、氨基葡萄糖、碱性品红、偏重亚硫酸钾、偏重亚硫酸钠、高碘酸(均为分析纯) 天津市博迪化工有限公司。
1.2 仪器与设备
TDL5M高速冷冻离心机、UV-3500S紫外-可见分光光度计 上海精密仪器表有限公司;6175-3C精密酸度计 上海任氏电子有限公司;VDTC超纯水制备系统美国Labinstru公司产品;FD-1D-50冷冻干燥机 上海析宇仪器有限公司。
1.3 方法
1.3.1 酶促糖基化球蛋白的制备
根据参考文献[5,7]报道的方法,并加以改动。球蛋白溶于0.2 mol/L的磷酸盐缓冲液中,溶液pH 7.65时,氨基葡萄糖与球蛋白浓度比为0.94∶1,TG添加量为57.59 U/g,充分混匀,在50 ℃水浴锅内反应4 h后,于90 ℃水浴锅中灭酶10 min,冷却。以不加TG液的糖基化交联球蛋白为对照。
1.3.2 蛋白溶解性的测定
依据氮溶解指数(nitrogen soluble index,NSI)法[8]加以改进,取各蛋白溶于20 mL样品缓冲液里,用0.5 mol/L盐酸溶液或0.5 mol/L氢氧化钠溶液分别调pH值至2.0、4.0、6.0、7.0、8.0、10.0后,磁力搅拌1 h,4 000 r/min离心20 min,用福林-酚法测定上清液中的可溶性蛋白质的含量,并绘制NSI-pH曲线[9]。NSI按式(1)计算。
式中:c为可溶性蛋白溶液浓度/(mol/L);V为离心后蛋白溶液体积/L;m为样品蛋白质量/g;S为蛋白纯度/%。
1.3.3 乳化活性及乳化稳定性的测定
取蛋白样加入pH 7.0的磷酸盐缓冲液20 mL,磁力搅拌1 h后4 000 r/min离心20 min,上清液加入5 mL大豆色拉油(V(上清液)∶V(色拉油)=4∶1),然后以9 500 r/min高速搅打2 min,立即取50 μL乳状液,加入5 mL的0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中,立即混匀,在500 nm波长处测定吸光度A0,以0.1% SDS溶液作为空白,室温放置30 min后再次取样测定A1。乳化活性(emulsifying activity index,EAI)及乳化稳定性(emulsifying stability index,ESI)按式(2)和(3)计算[10]。
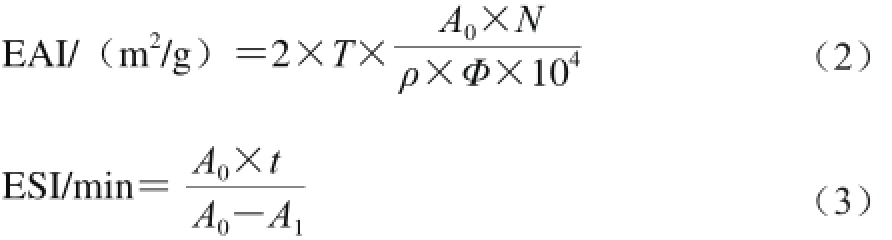
式中:ρ为蛋白样品质量浓度/(g/mL);T=2.303;Φ为乳化液中油相的体积分数(本实验为25%);N为稀释倍数(本实验为100);t为放置时间/min。
1.3.4 起泡性及泡沫稳定性的测定
取蛋白样品加入pH 7.0的磷酸盐缓冲液20 mL,磁力搅拌1 h后,4 000 r/min离心20 min,上清液以9 500 r/min高速搅打2 min,测量此时的泡沫总体积V0,溶液静止30 min后再次测量泡沫体积V1;起泡性(foam ability,FA)及泡沫稳定性(foam stability,FS)[11]按式(4)和式(5)计算。
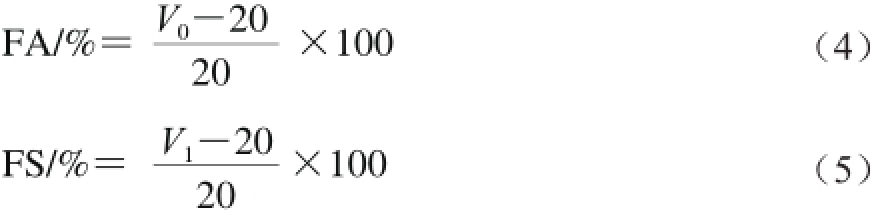
1.3.5 表面疏水性的测定
参照Hayakawa等[12]的方法,采用ANS荧光探针法测定蛋白样品的表面疏水性。分别将样品溶于0.01 mol/L pH 7.5的磷酸盐缓冲液中,配制成质量浓度为0.2 g/mL的溶液,取4.0 mL试液加入20 μL 8.0 mmol/L ANS的磷酸盐缓冲液,25 ℃条件下保温1 h。以磷酸盐缓冲液作为空白[13]。
1.3.6 热变性的测定
取10 mg蛋白样,加入0.01 mol/L的磷酸盐缓冲液20 μL,压制成薄片,室温放置6 h,备用。扫描温度范围:30~150 ℃;升温速率:10 ℃/min;最高温度150 ℃保持1 min;降温速率:30 ℃/min。记录变性温度T[14]。
d
1.3.7 聚丙烯酰胺凝胶电泳
糖蛋白电泳采用酸性品红方法染色。1)染色液配制:将碱性品红溶于煮沸的蒸馏水中,配制成0.5%的碱性品红溶液,不停搅拌溶解后,室温冷却至50 ℃时过滤,加1 mol/L的盐酸40 mL搅拌过滤;然后室温冷却,加入2 g偏重亚硫酸钾,避光放置1 d,再加入4 g活性炭,搅拌后过滤,避光冷藏保存。2)样品处理:球蛋白10 mg,溶于1 mL磷酸盐缓冲液溶液(pH 7.5)中,于4 000 r/min离心20 min,上清液与样品缓冲液按体积比1∶1混匀后,沸水中加热3 min,于10 000 r/ min离心1 min。3)灌胶和电泳过程:浓缩胶为体积分数5%、分离胶为体积分数12%,上样量为15 μL。采用稳压电泳,蛋白样品在浓缩胶时电压为80 V,样品进入分离胶后电压改为100 V,当溴酚蓝指示剂迁移到凝胶板底部时,停止电泳关闭电源[15]。4)糖蛋白染色: 电泳结束后,将凝胶置于50%的乙醇固定液中固定30 min后,蒸馏水漂洗3 次,放置于质量分数1%的高碘酸和体积分数3%的乙酸混合液中氧化30 min,蒸馏水漂洗5 次,再置于质量分数0.1%的偏重亚硫酸钠和10 mmol/L的盐酸混合液中漂洗2 次,每次10 min,再将凝胶置于希夫试剂中避光染色1 h后,再放入质量分数0.1%的偏重亚硫酸钠和10 mmol/L的盐酸混合液中,避光漂洗1 h,用质量分数0.5%的偏重亚硫酸钠溶液漂洗数次,每次20 min[16-17]。5)考马斯亮蓝复染:经过糖染色之后的凝胶板,放入考马斯亮蓝染色液中振荡染色2 h后,蒸馏水振荡漂洗两次,再加入甲醇-冰乙酸脱色液,直至蛋白亚基条带清晰。
1.3.8 红外光谱的测定
将蛋白粉用P2O5放在干燥器内充分干燥,蛋白样品2 mg,加入200 mg溴化钾,用研钵研磨成细小粉末,压制成薄片,用红外光谱仪做全波段扫描,持续用干燥的N2淋洗测量室,扫描次数32 次[18]。
1.3.9 拉曼光谱的测定
将蛋白样配制成100 mg/mL溶液,激发光波长785 nm,发射功率为300 mW,测量拉曼光谱范围为600~1 800 cm-1。每个样品都重复扫描3 次以上,峰位误差小于±3 cm-1[19]。
1.4 数据统计分析
实验重复3 次,结果表示为 ±s。用SAS 8.12软件进行相关分析和方差分析。
±s。用SAS 8.12软件进行相关分析和方差分析。
2.1 蛋白溶解性分析
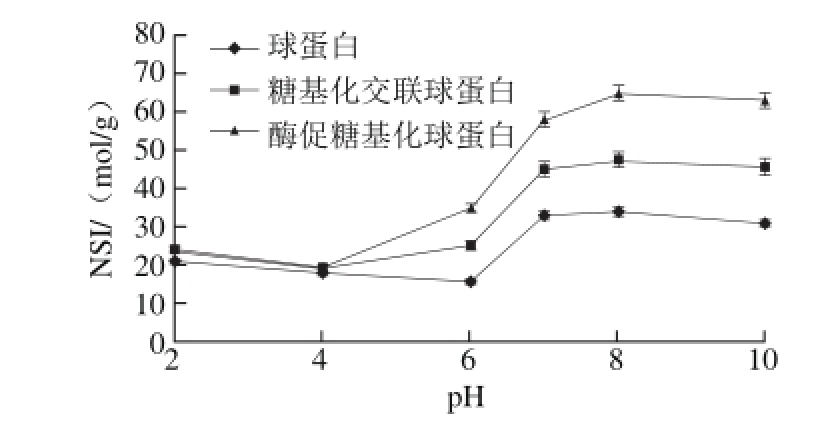
图1 球蛋白、糖基化交联球蛋白及酶促糖基化球蛋白的溶解性比较
Fig.1 Solubility-pH prof i les of globulin, cross-linked globulin and glycosylated globulin
如图1所示,3 种蛋白的溶解性差异大,酶促糖基化球蛋白的溶解性最好;在碱性条件下,糖基化交联蛋白的溶解性有明显改善,但是在酸性条件下的溶解性变化较小。可能是因为糖交联时,球蛋白分子与糖分子接触慢,而酶促条件下更多的糖基与蛋白质相结合,更多的疏水性残基被掩埋,糖链亲水基团的引入增加了球蛋白的亲水性,进而球蛋白的溶解性变好。有资料显示,酶促糖基化大豆蛋白的溶解性要低于大豆蛋白[20],而本实验的球蛋白溶解性有明显改善。蛋白质常被应用于饮料中,利用溶解度性质,可提高饮料中营养物质的含量,混浊物减少,还可保持透明度和黏度。
2.2 蛋白乳化活性及乳化稳定性分析

图2 球蛋白、糖基化交联球蛋白及酶促糖基化球蛋白的乳化活性及乳化稳定性比较
Fig.2 Emulsifying activity and emulsion stability of globulin, crosslinked globulin and glycosylated globulin
如图2所示,3 种蛋白的乳化活性依次有所升高,酶促糖基化蛋白的乳化稳定性明显提高;糖基化蛋白能吸附在水油界面上,糖基能在膜周围形成网状结构,增加膜强度,说明蛋白质分子中导入糖基可增大蛋白的乳化性;这也证明了TG催化氨基糖更多更快地导入到球蛋白分子中,这与文献[19]报道有所不同,TG处理的大豆蛋白的乳化活性明显提高,处理后的芸豆蛋白乳化活性下降,但相同的是,乳化稳定性都有提高。蛋白质乳化性常被应用于乳制品、肉肠制品中,其中乳化稳定性好,可提高冰淇淋、肉肠等的口感。
2.3 蛋白起泡性及泡沫稳定性分析
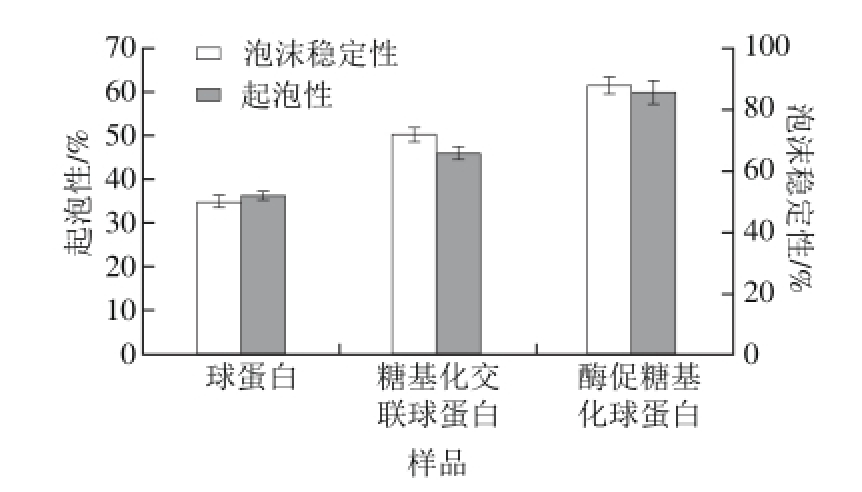
图3 球蛋白、糖基化交联球蛋白及酶促糖基化球蛋白的起泡性及泡沫稳定性分析
Fig.3 Foaming capacity and foam stability of globulin, cross-linked globulin and glycosylated globulin
如图3所示,酶促糖基化球蛋白的起泡性和泡沫稳定性都有所提高;这说明糖基导入到球蛋白分子中,能够使蛋白的起泡性和泡沫稳定性增强;糖蛋白能在气-液界面形成有黏弹性的厚膜;糖链亲水基团的引入,增加了球蛋白的亲水性,也促使界面稳定性提高。TG处理后的大豆蛋白的起泡性下降,泡沫稳定性增大,与大豆蛋白相比较,TG处理后的球蛋白起泡及泡沫稳定性都有所提高[21],这更有利于添加到食品中,提高食品的营养物质含量。
2.4 蛋白表面疏水性分析
表1 球蛋白、糖基化交联球蛋白及酶促糖基化球蛋白的表面疏水性
Table1 Surface hydrophobicity of globulin, cross-linked globulin and glycosylated globulin
注:同行不同肩标字母表示差异显著(P<0.05)。
从表1可以看出,与未修饰球蛋白相比,酶促糖基化球蛋白的表面疏水性有所下降,并且相比较之下,酶促糖基化球蛋白的表面疏水性比糖基化交联球蛋白的表面疏水性低。一方面说明,糖基导入球蛋白降低了球蛋白的表面疏水性;另一方面说明,TG促糖基化导入的糖基更多。当氨基糖连接到球蛋白分子上,球蛋白的空间分子结构发生变化,羟基增多,表面疏水性降低。这一结论,与TG处理后的大豆蛋白表面疏水性结果相一致[22]。2.5 蛋白热变性分析
从表2可以看出,糖基化交联球蛋白的热变性温度和焓变值(ΔH)都有所下降。这说明在球蛋白糖基化过程中蛋白质结构受到了影响,局部蛋白结构发生折叠,球蛋白分子的内部力作用降低;内部的疏水基团发生包埋和引入了糖基的亲水基团[21]。由此可以进一步解释,酶促糖基化球蛋白的表面疏水性下降。
表2 球蛋白、糖基化交联球蛋白及酶促糖基化球蛋白的DSC分析结果
Table2 DSC characteristics of globulin, cross-linked globulin and glycosylated globulin

注:同列不同肩标字母表示差异显著(P<0.05)。下同。
2.6 电泳图谱的分析

图4 球蛋白、酶促糖基化球蛋白及糖基化交联球蛋白的电泳图
Fig.4 Electrophoretograms of globulin, cross-linked globulin and glycosylated globulin
如图4所示,球蛋白的两条主要亚基带减少,并且酶促糖基化球蛋白的大于20 kD附近的亚基带要较明显于糖基化交联球蛋白。同时伴随形成了蛋白的共聚物,由于该共聚物分子质量变大,进入胶带的速度慢,共聚物截留在浓缩胶附近[23]。结果表明,TG催化球蛋白与氨基糖发生了交联反应,生成了蛋白质共聚物,即为糖基化交联球蛋白。这直接证实了TG催化氨基糖连接到球蛋白分子中。
2.7 蛋白红外光谱分析
在红外图谱中,蛋白质二级结构重叠在酰胺Ⅰ带(1 600~1 700 cm-1);对蛋白质酰胺Ⅰ带的分析,首先对其进行傅里叶去卷积处理[24],然后对3 种蛋白的二级结构含量进行定量,结果见表3。β-折叠是球蛋白的主要二级结构单元,经TG处理后,α-螺旋结构相对含量呈增加趋势,β-折叠结构和β-转角结构相对含量均呈下降趋势,无规卷曲结构相对含量几乎没变化,这种变化趋势可能与球蛋白的变性有关;由于氢键作用,β-折叠结构易存在于蛋白质聚合物内部;另外,由于β-折叠结构具有疏水性,β-折叠结构含量降低,导致疏水作用亦降低[25]。α-螺旋结构相对含量的升高和β-折叠结构相对含量的减少,解释了糖基化促使球蛋白表面疏水性降低的原因。这一结果进一步证明,TG催化氨基葡萄糖连接到球蛋白分子上。
表3 红外光谱法利用酰胺Ⅰ带拟合球蛋白二级结构组成
Table3 Secondary structures of globulin determined by amide I band fi tting of infrared spectra %

2.8 蛋白拉曼光谱分析
2.8.1 主链结构变化分析
蛋白质的酰胺Ⅰ带常被用于检测蛋白质的主链结构,采用软件对球蛋白拉曼光谱的酰胺Ⅰ区分析,酰胺Ⅰ带拉曼特征峰:α-螺旋结构为1 645~1 660 cm-1,β-折叠结构为1 665~1 680 cm-1,β-转角结构为1 680~1 690 cm-1,无规卷曲结构为1 660~1 670 cm-1[26]。进一步分析得到相应结果如表4所示。
表4 拉曼光谱法利用酰胺Ⅰ带拟合球蛋白二级结构组成
Table4 Secondary structures of globulin protein determined by amide I band fi tting of Raman spectra %

由表4可知,由拉曼光谱分析得到的经过酶处理后球蛋白二级结构变化规律与红外光谱分析结果相比较,结构变化趋势基本一致。反应后球蛋白的β-折叠结构和β-转角结构相对含量发生明显下降,并伴随着α-螺旋结构相对含量的增加。说明糖基化对球蛋白二级结构主链有影响。
2.8.2 糖基化对侧链结构的影响
表5 球蛋白、糖基化交联球蛋白和酶促糖基化球蛋白的色氨酸、酪氨酸谱带强度
Table5 Normalized intensities of tryptophan band (I76600ccmm--11/I10033ccmm--11)),, and tyrosyl doublet ( glycosylated globulin
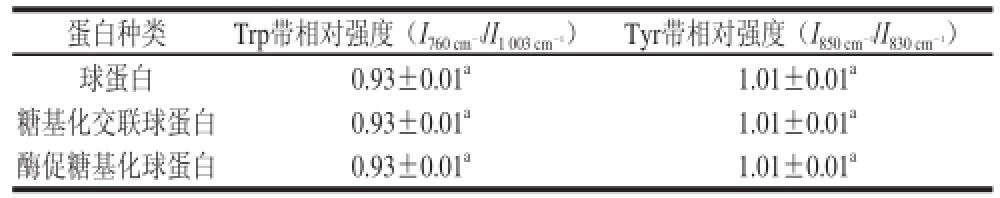
760 cm-1和1 003 cm-1是色氨酸残基的伸缩振动[27],由表5可知,色氨酸的相对拉曼强度经TG处理后没有变化,说明球蛋白糖基化没有改变色氨酸相应谱带强度变化,色氨酸相对拉曼强度更趋近于“包埋态”。
850 cm-1和830 cm-1两谱带强度比为1.01,表明测试蛋白的酪氨酸残基暴露于溶液的极性微环境下作为中性强度氢键的供体或受体[28],酪氨酸残基苯环呼吸振动和面外弯曲倍频之间的费米共振[23],可进一步精确酪氨酸分子暴露与包埋数[29]。由表6可知,球蛋白酪氨酸主要呈“暴露态”,而糖基化处理对酪氨酸分子的分布状态没有显著影响。
表6 酪氨酸费米共振线I85500ccmm--11/I83300ccmm--11以及残基暴露/包埋分子数
Table6 Intensity ratio of the Fermi-resonance doublet of tyrosine and the numbers of exposed and buried tyrosine per molecule

注:N表示分子数。
2.8.3 糖基化对二硫键振动模式的影响
表7 二硫键振动模式分析结果
Table7 Conformation of S-S bonds in globulin and its modi fi ed products %

蛋白质三级结构的重要维持力是二硫键[30]。从表7可以看出,球蛋白的最主要二硫键振动模式为t-g-t模式,酶促糖基化球蛋白的t-g-t和g-g-t振动模式百分比明显增加,g-g-g振动模式百分比减少。糖基化交联球蛋白促进了分子间二硫键的形成,即促进了由g-g-g模式向t-g-t和g-g-t模式的转变。
针对球蛋白及糖基化修饰球蛋白功能性质及结构的比较影响进行研究,研究得到以下结论:1)糖基化总体增加了球蛋白的溶解性、乳化稳定性、起泡性及泡沫稳定性。酶促糖基化球蛋白溶解性在碱性条件下最高可达66.67 mol/g,乳化稳定性与未修饰球蛋白相比较提高了44.87%,起泡性相比较提高了36.21%,泡沫稳定性提高了39.29%;但表面疏水性明显下降,降低了41.02%。另外,酶促糖基化球蛋白的变性温度和焓变值都有所下降,其中变性温度下降了5%,焓变下降了4%。2)糖基化交联球蛋白主要二级结构仍是β-折叠结构;α-螺旋结构相对含量呈增加趋势,β-转角结构相对含量呈下降趋势,无规卷曲结构相对含量几乎没变。这说明TG催化球蛋白糖基化对蛋白二级结构的主链结构有影响。3)球蛋白糖基化并未引起色氨酸和酪氨酸相应谱带强度发生变化,糖基化处理的球蛋白酪氨酸分子主要呈“暴露态”,色氨酸相对拉曼强度更趋近于“包埋态”。这说明TG催化球蛋白糖基化对蛋白二级结构的侧链结构几乎没有影响。4)酶促糖基化球蛋白最主要二硫键振动模式为t-g-t模式,g-g-t模式百分比明显增加,g-g-g振动模式百分比减少。糖基化交联球蛋白促进了分子间二硫键的形成,即促进了由g-g-g模式向t-g-t模式的转变。这说明TG催化球蛋白糖基化对蛋白二硫键振动模式有影响。由以上总结可得:β-折叠含量与蛋白质的表面疏水性呈正相关,α-螺旋含量与蛋白质的表面疏水性呈负相关,溶解性与表面疏水性呈负相关。
参考文献:
[1] MOHAMED A, BIRESAW G, XU J Y, et al. Oats protein isolate: thermal, rheological, surface and functional properties[J]. Food Research International, 2009, 42(1): 107-114. DOI:10.1016/ j.foodres.2008.10.011.
[2] DONG S, WEI B, CHEN B, et al. Chemical and antioxidant properties of casein peptide and its glucose Maillard reaction products in fi sh oilin-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 13311-13317. DOI:10.1021/jf203778z.
[3] MU L X, ZHAO H F, ZHAO M M, et al. Physicochemical properties of soy protein isolates-acacia gum conjugates[J]. Czech Journal of Food Sciences, 2011, 29(2): 129-136.
[4] JIANG S J, ZHAO X H. Modif i cation of casein by transglutaminase and glucosamine and the impacts on some functional properties of the product[J]. China Dairy Industry, 2010, 38(9): 8-11.
[5] JIANG S J, ZHAO X H. Transglutaminase-induced cross-linking and glucosamine conjugation in soybean protein isolates and its impacts on some functional properties of the products[J]. European Food Research and Technology, 2010, 231(5): 679-689. DOI:10.1007/s00217-010-1319-2.
[6] 全越, 王长远. Osborne分级法提取燕麦麸球蛋白的响应面分析[J].粮食加工, 2015, 40(5): 34-38.
[7] 孙鹏, 程建军, 郑存汐, 等. 干燥方式对不同接枝度的大豆分离蛋白-麦芽糊精聚合物性质影响[J]. 食品工业科技, 2012, 33(11): 157-160.
[8] 刘颖, 田文娟, 王佳瑞, 等. 酶改性制备米糠浓缩蛋白的研究[J]. 食品工业, 2011, 32(3): 47-50.
[9] 陈晓萌, 王常青, 訾艳. 2种红芸豆蛋白的提取及组分分析[J]. 食品科学, 2015, 36(2): 149-154. DOI:10.7506/spkx1002-6630-201502029. [10] 张根生, 岳晓霞, 李继光, 等. 大豆分离蛋白乳化性影响因素的研究[J].食品科学, 2006, 27(7): 48-51.
[11] MOTOI H, FUKUDOME S, URABE I. Continuous production of wheat gluten peptide with foaming properties using immobilized enzymes[J]. European Food Research and Technology, 2004, 219(5): 522-528. DOI:10.1007/s00217-004-0986-2.
[12] HAYAKAWA S, NAKAI S. Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J]. Journal of Food Science, 1985, 50(2): 486-491. DOI:10.1111/j.1365-2621.1985. tb13433.x.
[13] 吴海波, 齐宝坤, 江连洲, 等. 大豆分离蛋白热性质及其空间构象对表面疏水性的影响[J]. 中国粮油学报, 2014, 29(10): 42-46.
[14] ALEXANDER M, GEOFFREY L. Changes in the amide I FTIR bands of poly-L-lysine on spray-drying from α-helix, β-sheet or random coil conformations[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2006, 62(2): 131-142. DOI:10.1016/ j.ejpb.2005.08.005.
[15] 袁丽杰, 高兴政. 中国大陆不同地域阴道毛滴虫品系的研究II蛋白质组分的SDS-PAGE分析[J]. 中国寄生虫病防治杂志, 2003, 16(3): 147-148.
[16] 张世雄, 程立均. 一种改进的糖蛋白染色鉴别方法得建立[J]. 中国生物制品学杂志, 2012, 25(1): 108-110.
[17] 张英, 黄林娟, 王仲孚. 糖蛋白的凝胶电泳和电印迹染色鉴定技术[J].化学进展, 2008, 20(7/8): 1158-1164.
[18] 张忠慧, 华欲飞. 大豆分离蛋白与低浓度尿素相互作用红外光谱分析[J]. 粮食与油脂, 200(7): 20-21. DOI:10.3969/ j.issn.1008-9578.2007.07.007.
[19] ZHANG X, HUANG L X, NIE S Q, et al. FTIR characterization of the secondary structure of insulin encapsulated within liposome[J]. Journal of Chinese Pharmaceutical Science, 2003, 12(1): 11-14.
[20] 郭荣佳. 酶解对大豆蛋白结构功能性影响及高乳化起泡性蛋白制备[D]. 哈尔滨: 东北农业大学, 2014: 28-34.
[21] TANG C H, CHOI S M, MA C Y. Study of thermal properties and heat-induced denaturation and aggregation of soy proteins by modulated differential scanning calorimetry[J]. International Journal of Biological Macromolecules, 2007, 40(2): 96-104. DOI:10.1016/j.ij biomac.2006.06.013.
[22] 张海均, 程仲毅, 贾冬英, 等. 转谷氨酰胺酶聚合改性大豆分离蛋白的功能特性研究[J]. 食品科技, 2013, 38(2): 233-237.
[23] 鹿振武. 两亲性蛋白质: 高分子杂化体的制备及其自组装性能研究[D].兰州: 兰州交通大学, 2016: 34-43.
[24] 王长远, 郝天舒, 张敏. 干热处理对米糠蛋白结构与功能特性的影响[J]. 食品科学, 2015, 36(7): 13-18. DOI:10.7506/spkx1002-6630-201507003.
[25] 王中江. 理化因素对大豆分离蛋白结构及表面疏水性影响的研究[D].哈尔滨: 东北农业大学, 2012: 47-51.
[26] 许晶, 齐宝坤, 赵青山, 等. 大豆分离蛋白结构特征与表面疏水性的关系[J]. 中国粮油学报, 2015, 30(8): 32-36. DOI:10.3969/ j.issn.1003-0174.2015.08.006.
[27] FERRER E G, GOMEZ A V, ANON M C, et al. Structural changes in gluten protein structure after addition of emulsifier. A Raman spectroscopy study[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Oscopy, 2011, 79(1): 278-281. DOI:10.1016/ j.saa.2011.02.022.
[28] HERRERO A M, JIMENEZ C F, CARMONA P. Elucidation of structural changes in soy protein isolate upon heating by Raman spectroscopy[J]. Internationnal Journal Food Sciences and Technology, 2009, 44(4): 711-717. DOI:10.1111/j.1365-2621.2008.01880.x.
[29] 王中江, 江连洲. 大豆分离蛋白在不同pH下的拉曼光谱分析[J]. 食品工业科技, 2012, 33(11): 63-66.
[30] TSUMURA K, ENATSU M, KURAMORI K, et al. Conformational change in a single molecular species, β3 of β-conglycinin in acidic ethanol solution[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(2): 292-297. DOI:10.1023/B:JOPC.00000 39550.61082.d4.
Structural Modif i cation of Oat Bran Globulin by Glycosylation and Change in Its Functional Properties
WANG Changyuan, QUAN Yue, LI Yuqiong, FENG Yuchao, CAO Longkui, ZHANG Dongjie*
(College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China)
Abstract:In the presence of glucosamine, oat bran globulin was subjected to glycosylation using transglutaminase (TG) for analyzing and correlating the structural and functional characteristics of the modif i ed protein. The results showed that some properties of the glycosylated protein were improved when compared to the unmodified one, such as solubility, emulsion stability, foaming ability and foam stability. However, the surface hydrophobicity was signif i cantly decreased. Additionally, the denaturation temperature and enthalpy change of the protein declined after glycosylation. The secondary structure contents changed, as indicated by an increase in α-helix, a decrease in β-sheet and β-turn and almost no change in random coil. The tyrosine residues of the glycosylated globulin were exposed, whereas the tryptophan residues were buried. Moreover, the disulf i de stretching vibration mode was t-g-t. A comparison of functional properties and spatial conformation between the modif i ed and unmodif i ed globulin demonstrated that TG catalyzed the binding of glucose to oat bran globulin, further conf i rming the relationship between its functional characteristics and spatial conformation. The fi ndings of this study may provide a theoretical basis for extending the minor grain industry chain, and offer basic data to study molecular design and intermolecular recombination for the production of special products based on oat bran protein.
Key words:oat bran; globulin; transglutaminase (TG); functional characteristics; structure
DOI:10.7506/spkx1002-6630-201709023
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)09-0143-06
引文格式:
王长远, 全越, 李玉琼, 等. 燕麦麸皮球蛋白的糖基化结构修饰及功能性变化[J]. 食品科学, 2017, 38(9): 143-148. DOI:10.7506/spkx1002-6630-201709023. http://www.spkx.net.cn
WANG Changyuan, QUAN Yue, LI Yuqiong, et al. Structural modification of oat bran globulin by glycosylation and change in its functional properties[J]. Food Science, 2017, 38(9): 143-148. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201709023. http://www.spkx.net.cn
收稿日期:2016-04-29
基金项目:黑龙江省政府博士后基金资助项目(LBH-Z15217);黑龙江省科技厅重大项目(ga15b301)
作者简介:王长远(1976—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:byndwcy@163.com
*通信作者:张东杰(1966—),男,教授,博士,研究方向为食品加工与安全。E-mail:byndzdj@126.com