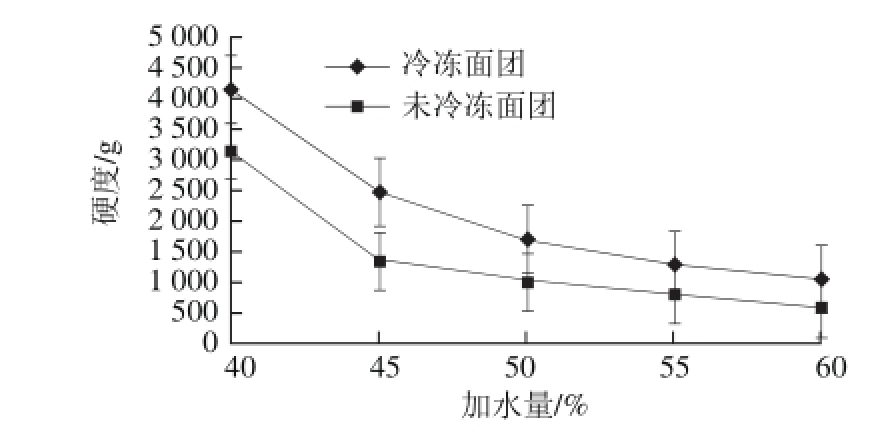
图1 加水量对面团硬度的影响
Fig.1 Effect of water addition on the hardness of dough
王世新,杨 强,李新华*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
摘 要:应用质构分析仪和傅里叶变换红外光谱仪测定小麦面团质构特性和微观结构(面筋蛋白二级结构),分析不同加水量对冷冻和未冷冻面团品质的影响。结果表明:加水量和冷冻对小麦面团的质构特性和面筋蛋白二级结构影响显著。随着加水量的增加,冷冻后小麦面团与未冷冻相比硬度增加、黏性升高、内聚性下降、弹性降低,而对面团的回复性影响很小。经冷冻后面团面筋蛋白的二级结构β-折叠和α-螺旋的相对含量增加,β-转角的相对含量降低,使面筋蛋白的网状结构趋于稳定。以上结果可以说明水分可能是影响冷冻面团品质的一个重要因素,也为进一步揭示加水量在小麦冷冻面团中的作用机理提供了重要的研究参考。
关键词:冷冻;加水量;质构特性;面筋蛋白二级结构
目前冷冻在面制品中应用越来越广泛,冷冻不仅延长了面制品的贮藏时间而且提高了贮藏稳定性,但冷冻后面制品的品质在一定程度上发生变化,普遍存在抗冻裂能力差、蒸煮质量存在缺陷,严重制约冷冻面制品的发展[1-2]。在面团形成过程中,面团水分含量与面粉成团后本身蛋白质的性质紧密相关,对面制品的结构、物化性质及感官品质有着很大的影响[3-4]。大量研究结果表明,冷冻使小麦面团的网络结构发生改变,进而改变面团的性能。现在关于小麦面团的研究主要集中于产品和添加剂对其影响的研究,而对冷冻未发酵原面团的研究还不够,尤其是和面时加水量对其产品品质的影响研究较少。和面的条件会改变面团面筋蛋白的网络结构,面筋蛋白网络结构的改变使面团的质构特性发生改变,最终导致食品的品质受到影响[5]。傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定蛋白质的二级结构、蛋白质在红外区有若干个吸收带、酰胺Ⅰ带(1 600~1 700 cm-1)对研究蛋白质的二级结构最具有价值[6],可以利用波段缩小的技术将FTIR图谱中的酰胺Ⅰ带细分,并得到蛋白质二级结构α-螺旋、β-折叠、β-转角及无规卷曲结构等信息,从而有效地对蛋白质结构进行分析[7-8]。本实验利用质构仪测定面团的质构特性,FITR测定蛋白质的二级结构,探讨加水量对面团质构特性和面筋蛋白质的结构变化影响和机理,以期为改善小麦面团工艺性能提供理论参考。
1.1 材料与试剂高筋小麦面粉 河北金沙河面业集团有限责任公司。氯化钠、溴化钾(光谱纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
HH-4电热恒温水浴锅 上海予华仪器设备有限公司;BD/BC-308H低温冰柜 浙江杭州云冰制冷设备有限公司;MP2002电子天平 上海精密仪器仪表有限公司;DHG-9241A恒温干燥箱 上海精宏试验设备有限公司;IR200 FTIR分析仪 美国尼高力仪器公司;CT3质构仪美国Brookfield公司;DF-4压片机 天津港东科技发展股份有限公司。
1.3 方法
1.3.1 面团的制作
分别准确称取小麦面粉100.0 g,然后保持水温为30 ℃,加水量为40%、45%、50%、55%、60%的条件下进行和面,将和好的面团用模具制成半径为5.0 cm的圆柱形,再用保鲜膜包裹住,分别放在-20 ℃冰柜中冷冻12 h,空白对照在5 ℃冰箱中贮藏6 h,备用。
1.3.2 面筋蛋白的提取
采用马丁法[9-11]略有改动。将冷冻后的面团放在5 ℃冰箱中解冻6 h备用,然后分别将解冻后的面团和贮藏的面团(空白对照)放在2%的氯化钠溶液中静置20 min,再进行反复轻轻揉洗,揉洗过程中尽可能保持面团的完整性,直到揉洗至清洗液无混浊,无乳白色,揉洗完成后,将揉洗出的面筋蛋白放在40 ℃恒温干燥箱中干燥,再将面筋蛋白粉碎,过120 目筛,即得到面筋蛋白成品备用。
1.3.3 面团质构特性的测定
将冷冻的面团在5 ℃冰箱中解冻后和未冷冻的面团放在CT3型物性分析仪的载样台中央,用TA35探头测定两种面团的质构特性,从质构仪测定结果可得到硬度、黏性、内聚性、回复性和弹性等数值。基本参数为:测试前速率2.0 mm/s,测试速率1.0 mm/s,测试后速率1.0 mm/s,试样变形为70%,采用两次压缩且停顿时间为5 s,每个样品重复测定3 次取平均值[12-15]。
1.3.4 面筋蛋白的FTIR测定
先将KBr放在培养皿中40 ℃恒温干燥6 h后备用。准确称取2.0 mg粉碎后的面筋蛋白样品,加入0.2~0.4 g的KBr,将面筋蛋白和KBr混合后用玛瑙研钵将混合固体研磨均匀。背景采集使用KBr固体作为空白,再用红外专用的压片机进行压片,使压片压力保持15 kPa, 5 min后装样品进行FTIR扫描,扫描波段为400~4 000 cm-1,扫描次数为32 次,分辨率为4[16-17]。
1.3.5 面筋蛋白FTIR图谱测定
先采用Omnic 7.1软件对所得到的图谱进行分析找到酰胺Ⅰ带的位置(1 600~1 700 cm-1),再采用Perkfit 4.1软件对酰胺Ⅰ带进行去卷积处理,并求其二级导数得到特征峰,再以特征峰的位置为参数对酰胺Ⅰ带进行曲线拟合计算峰面积并确定面筋蛋白二级结构含量所占比例[18-19],各特征峰与面筋蛋白二级结构对应关系为:1 615~1 637 cm-1和1 682~1 700 cm-1为β-折叠;1 646~1 664 cm-1为α-螺旋;1 637~1 645 cm-1为无规卷曲;1 664~1 681 cm-1为β-转角[20]。
2.1 加水量对和面面团质构特性的影响
2.1.1 加水量对面团硬度的影响

图1 加水量对面团硬度的影响
Fig.1 Effect of water addition on the hardness of dough
由图1可知,对于冷冻和未冷冻的面团随着加水量的增加硬度都呈现下降的趋势,且下降的速率不断减慢,从总体上看同一加水量条件下冷冻后的面团硬度比未冷冻的面团高,所以冷冻对小麦面团的硬度影响显著。造成硬度增加的原因是由于面团的主要成分淀粉和面筋蛋白经过和面以后冷冻,使淀粉的线性分子重新排列并通过氢键使网络结构发生改变以及面筋的网状结构发生变化,淀粉溶解度减小最终导致面团的硬度比未冷冻条件下的面团硬度增加。
2.1.2 加水量对面团黏性的影响

图2 水的添加量对面团黏性的影响
Fig.2 Effect of water addition on the viscosity of dough
由图2可知,面团在冷冻和未冷冻条件下随着加水量的增加黏性都有增加的趋势,冷冻状态下面团的加水量大于45%时黏性增加缓慢,而未冷冻面团的加水量大于45%时面团的黏性增加速率有所提高。总体来看,冷冻条件与未冷冻条件下相比面团的黏性都增加,说明冷冻对小麦面团的物理特性具有显著的影响,这是由于面团经冷冻后线性分子的重排,面团内部淀粉和面筋的结构发生变化导致其内部水分流出从而使面团的黏性比未冷冻的面团高。
2.1.3 加水量对面团内聚性的影响

图3 加水量对面团内聚性的影响
Fig.3 Effect of water addition on the cohesiveness of dough
内聚性指样品通过第1次压缩变形后所表现出来的对第2次压缩的相对抵抗能力。由图3可知,面团的内聚性在冷冻和未冷冻条件下的随着加水量的增加都呈现下降的趋势但下降缓慢,整体而言,未冷冻的面团比冷冻的面团的内聚性高,说明冷冻对小麦面团的内聚性产生影响。由图2可知冷冻会使面团的黏性增加,导致面团的抵抗能力减小,从而造成冷冻后面团的内聚性小于未冷冻面团的内聚性。
2.1.4 加水量对面团回复性的影响
由图4可知,冷冻和未冷冻面团的回复性随着加水量的增加都出现下降的趋势,从总体上看,未冷冻条件下面团的回复性比冷冻条件下回复性高,这是由于面团经冷冻和解冻后面团内部的分子结构发生改变使部分水分从面团内部流出,面团的黏性增大进而造成冷冻后面团的回复性降低,但从实际应用来看冷冻和未冷冻对小麦面团的质构性能中的回复性影响不大。

图4 加水量对面团回复性的影响
Fig.4 Effect of water addition on the resilience of dough
2.1.5 加水量对面团弹性的影响

图5 加水量对面团弹性的影响
Fig.5 Effect of water addition on the elasticity of dough
由图5可知,随着加水量的增加冷冻面团的弹性会出现逐渐下降的趋势,而未冷冻面团的弹性变化趋于平稳降低的状态。总体来说同一加水量条件下未冷冻面团的弹性比冷冻面团的弹性高,造成这种情况的原因由于面团冷冻后硬度增大,黏性增加面团表面水分增多,使面团的弹性随着加水量的增加而减小。
2.2 面团面筋蛋白的FTIR图谱分析
2.2.1 不同加水量的面团面筋蛋白红外图谱
由图6和表1可知,在3 100~3 500 cm-1处有吸收带,这是典型的碳水化合物缔合O—H伸缩振动吸收,是与分子间的氢键连接有关[17]。3 401 cm-1处是蛋白的特征吸收峰,它是蛋白质或氨基酸中N—H键的伸缩振动,当N—H键与氢键缔合后,将向低波数位移,从而确定表1中冷冻后面团面筋蛋白的吸收峰向低波长位置发生了偏移。从图6吸收光图谱可以发现1 600~1 700、 1 530~1 550 cm-1和1 200~1 300 cm-1附近均出现相应的蛋白特征吸收峰[21],990~1 160 cm-1既是淀粉的特征谱带也是蛋白质的特征谱带,其中1 550~1 700 cm-1波段冷冻面团面筋蛋白的波长发生偏移,说明改变加水量可能造成面筋蛋白的结构发生改变[22]。但990~1 450 cm-1波段只有1 000 cm-1附近对冷冻面团面筋蛋白结构影响显著,说明水分改变使冷冻后面团的淀粉与面筋蛋白分子之间的氢键发生变化,可能是由于加水量的增加,使面团经冷冻后冰晶形成影响了淀粉与面筋蛋白的结合,特征集团含量降低,最终导致特征峰吸收强度的变化[22-25]。

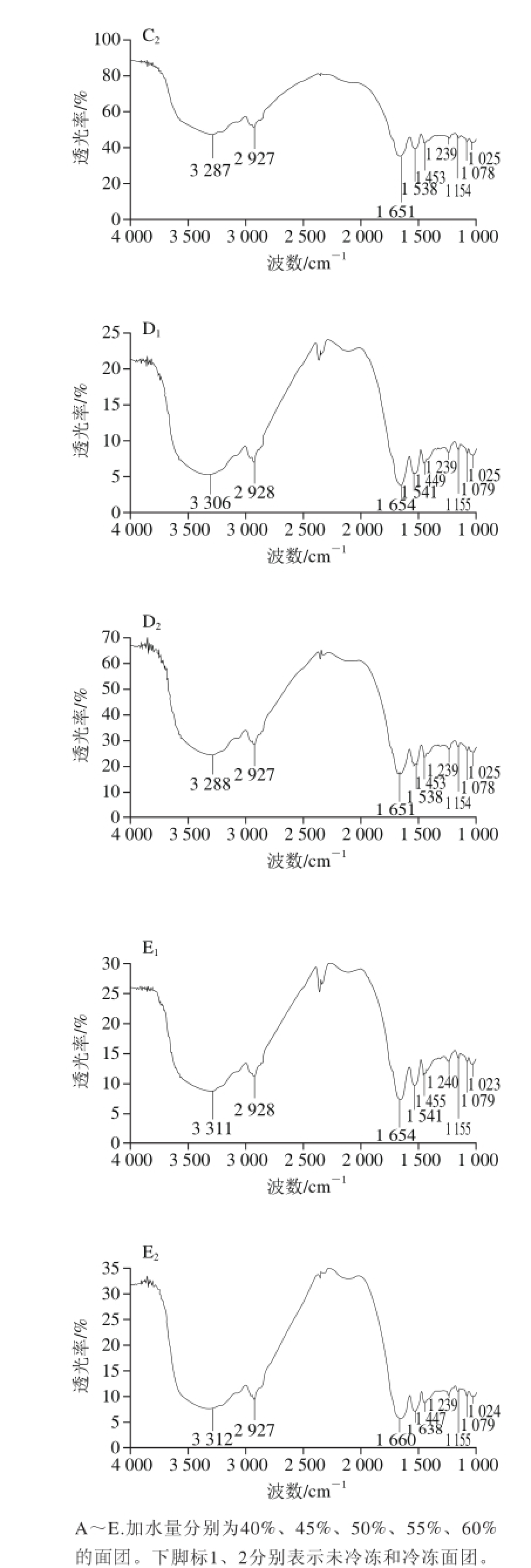
图6 不同加水量面团面筋蛋白FTIR图谱
Fig.6 FTIR spectra of gluten protein in dough with different amounts of added water
表1 FTIR特征峰以及样品吸收波数[[2200]]
Table1 FTIR Characteristic peaks and absorption wavenumbers of dough with different amounts of added water[[2200]]
2.2.2 加水量对面团面筋蛋白二级结构的影响
表2 未冷冻面团面筋蛋白酰胺Ⅰ带拟合结果
Table2 Amide I band fi tting results of gluten proteins in nonfrozen dough

面团的面筋蛋白经过Omnic 7.1软件所得到的图谱选取酰胺Ⅰ带(1 600~1 700 cm-1)的波段,再采用Perkfit 4.1软件对酰胺Ⅰ带进行去卷积处理,并求其二级导数得到5 个特征峰,然后以特征峰的位置为参数对酰胺Ⅰ带进行曲线拟合计算峰面积并确定面团面筋蛋白二级结构含量所占比例,各特征峰与面筋蛋白二级结构对应关系为:1 615~1 637 cm-1和1 682~1 700 cm-1为β-折叠;1 646~1 664 cm-1为α-螺旋;1 637~1 645 cm-1为无规卷曲;1 664~1 681 cm-1为β-转角[20]。表2和表3分别表示在不同加水量条件下未冷冻和冷冻面团面筋蛋白二级结构酰胺Ⅰ带拟合结果,图7为对面团面筋蛋白酰胺Ⅰ带拟合结果的折线图。
表3 冷冻面团面筋蛋白酰胺Ⅰ带拟合结果
Table3 Amide I band fi tting results of gluten proteins in frozen dough

由表2、3和图7可知,小麦面团的面筋蛋白二级结构中不存在无规卷曲结构,只包含β-折叠、α-螺旋和β-转角3 种结构。Choi等[26]报道α-螺旋和β-折叠是比较有序的蛋白二级结构,具有较高的稳定性,β-转角和无规卷曲是无序结构。随着加水量的增加,小麦面团面筋蛋白的二级结构含量会出现明显的变化,在冷冻条件下面筋蛋白的二级结构中β-折叠和α-螺旋所占的比例增加,而β-转角的比例降低,这使面筋蛋白的网状结构更趋于稳定,面团面筋蛋白二级结构的稳定可能使面团的质构性能硬度增加、黏性升高、内聚性升高、弹性降低。这可能是由于随着加水量的增加,经过冷冻后面团面筋蛋白在低温条件下冰晶的形成,使面筋蛋白的网状结构发生改变,一部分β-转角转化为β-折叠和α-螺旋,导致面团面筋蛋白二级结构变得更为有序,最终可能使面团的质构性能发生改变[28-30]。
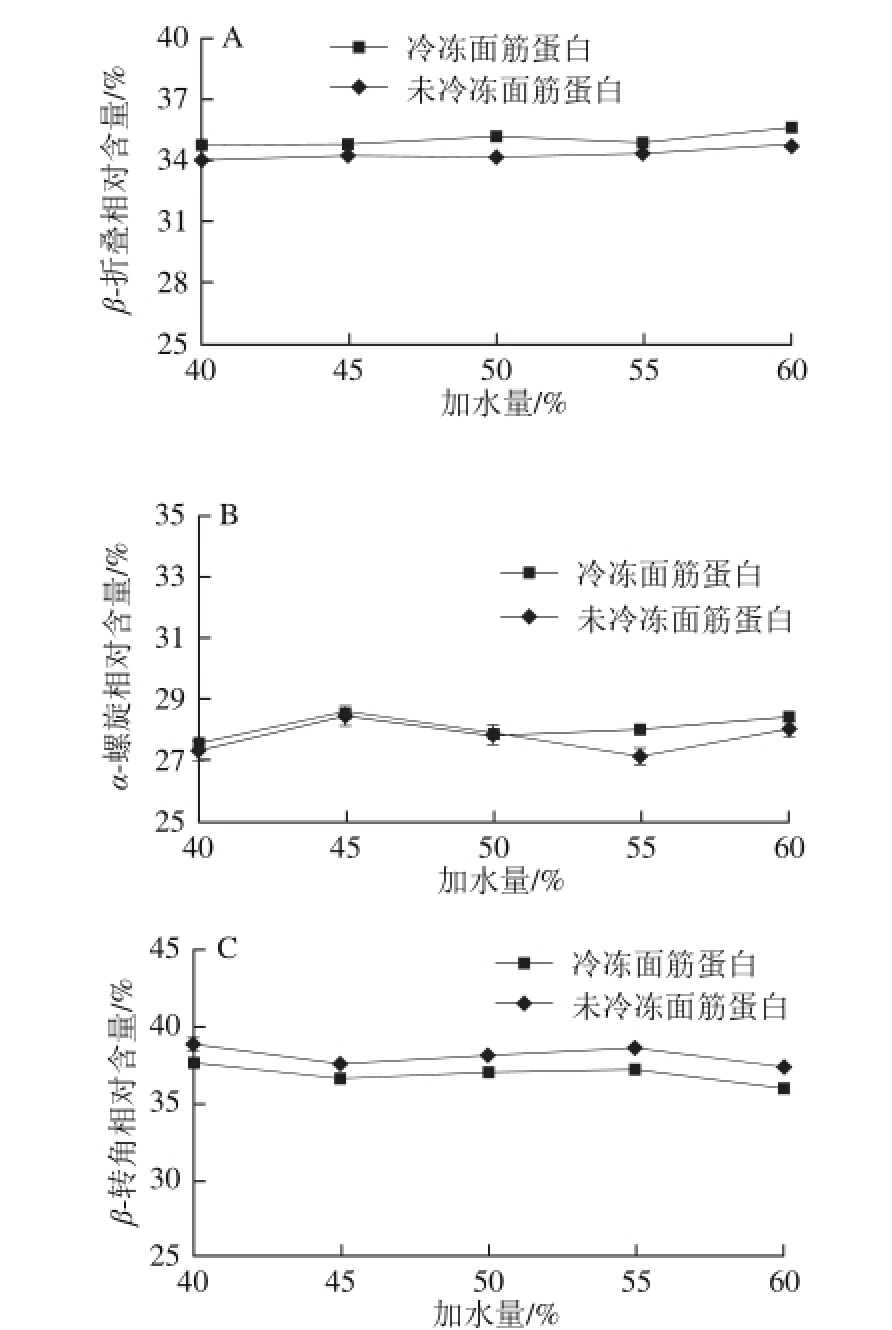
图7 加水量对面团面筋蛋白二级结构相对含量影响
Fig.7 Effect of water addition on secondary structure contents of gluten proteins in dough
本实验结果表明:通过改变加水量对冷冻后小麦面团的研究,可以得出加水量和冷冻对小麦面团的质构特性和面团面筋蛋白二级结构影响显著。随着加水量的增加冷冻后小麦面团与未冷冻相比硬度增加、黏性升高、内聚性下降、弹性降低。经冷冻后面团面筋蛋白的二级结构会出现β-折叠和α-螺旋的比例增加,β-转角的比例降低,使面筋蛋白的网状结构趋于稳定。以上结果可以说明水分可能是影响冷冻面团品质的一个重要因素,也为进一步揭示加水量在小麦冷冻面团中的作用机理提供重要的研究基础。
参考文献:
[1] 叶晓枫, 韩永斌, 赵黎平, 等. 冻融循环下冷冻非发酵面团品质的变化及机理[J]. 农业工程学报, 2013, 29(21): 271-278. DOI:10.3969/ j.issn.1002-6819.2013.21.034.
[2] 俞学锋, 杨子忠, 冷建新, 等. 冷冻面团加工技术与中国传统食品现代化[J]. 西部粮油科技, 2007, 32(1): 18-20. DOI:10.3969/ j.issn.1007-6395.2007.01.004.
[3] 刘建峰, 周新丽, 苏鹏, 等. 水分含量及添加剂对面团流变学性能的影响[J]. 食品工业科技, 2008, 29(11): 86-89. DOI:10.13386/ j.issn1002-0306.2008.11.067.
[4] 崔丽琴, 崔素萍, 马平, 等. 豆渣粉对小麦面团、馒头质构特性及馒头品质的影响[J]. 食品科学, 2014, 35(5): 85-88. DOI:10.7506/ spkx 1002-6630-201405017.
[5] 宋国胜, 胡松青, 李琳. 超声辅助冷冻对湿面筋蛋白中冰晶粒度分布及总水含量的影响[J]. 化工学报, 2009, 60(4): 978-983. DOI:10.3321/j.issn:0438-1157.2009.04.025.
[6] 戈志成, 张燕萍. 对改性小麦面筋蛋白二级结构的红外光谱研究[J]. 中国粮油学报, 2006, 21(3): 37-38. DOI:10.3321/ j.issn:1003-0174.2006.03.009.
[7] 刘燕燕, 曾新安, 陈晓东, 等. FTIR分析脉冲电场和热处理后的大豆分离蛋白结构变化[J]. 光谱学与光谱分析, 2010, 30(9): 2340-2344. DOI:10.3964/j.issn.1000-0593(2010)09-2340-05.
[8] 刘国琴, 阎乃珺, 赵雷, 等. 冻藏对面筋蛋白二级结构的影响[J]. 华南理工大学学报(自然科学版), 2012, 40(5): 116-120. DOI:10.3969/ j.issn.1000-565X.2012.05.020.
[9] 王世伟. 不同来源小麦淀粉的糊化特性比较研究[J]. 现代面粉工业, 2015(4): 14-16. DOI:10.3969/j.issn.1674-5280.2015.04.005.
[10] 钟昔阳, 姜绍通, 潘丽军, 等. 高活性小麦谷朊粉产业化加工技术研究及其应用概述[J]. 食品科学, 2004, 25(增刊1): 95-100. DOI:10.3321/j.issn:1002-6630.2004.z1.022.
[11] 郭俊杰, 吴宏, 张楠, 等. 面筋蛋白的组成、分离方法及应用研究进展[J]. 食品工业科技, 2013, 34(19): 383-390. DOI:10.13386/ j.issn1002-0306.2013.19.060.
[12] 王婷, 李文钊, 张强. 青稞粉主要成分及其面团质构特性的研究[J]. 粮食与饲料工业, 2012(7): 41-43. DOI:10.3969/ j.issn.1003-6202.2012.07.012.
[13] 孙辉, 姜薇莉, 田晓红, 等. 利用物性测试仪分析小麦粉馒头品质[J]. 中国粮油学报, 2005, 20(6): 121-125. DOI:10.3321/ j.issn:1003-0174.2005.06.030.
[14] 杜浩冉, 郑学玲, 刘翀, 等. 预醒发酵子冷冻面团馒头发酵工艺的优化研究[J]. 粮食与油脂, 2014, 27(11): 30-34. DOI:10.3969/ j.issn.1008-9578.2014.11.008.
[15] ZHANG Chao, ZHANG Hui. Effect of carrot (Daucus carota) antifreeze proteins on texture properties of frozen dough and volatile compounds of crumb[J]. LWT-Food Science and Technology, 2008, 47(6): 1029-1036. DOI:10.1016/j.lwt.2007.07.010.
[16] 汪兰, 吴文锦, 乔宇, 等. 冻藏条件下魔芋葡甘聚糖降解产物对肌原纤维蛋白结构的影响[J]. 食品科学, 2015, 36(22): 244-249. DOI:10.7506/spkx1002-6630-201522046.
[17] 何建川. 蛋白质和变性蛋白质二级结构的FTIR分析进展[J].化学研究与应用, 2012, 24(8): 1176-1180. DOI:10.3969/ j.issn.1004-1656.2012.08.002.
[18] GAO Xin, LIU Tianhong, YU Jing, et al. Influence of high-molecularweight glutenin subunit composition at Glu-B1 locus on secondary and micro structures of gluten in wheat (Triticum aestivum L.)[J]. Food Chemistry, 2016, 197(15): 1184-1190. DOI:10.1016/j.foodchem.2016.07.043.
[19] GEORQET D M, BELTON P S. Effects of temperatur e and water content on the secondary structure of wheat gluten studied by FTIR spectroscopy[J]. Biomacromolecules, 2006, 7(2): 469-475. DOI:10.1021/bm050667j.
[20] 宋国胜, 胡娟, 沈兴, 等. 超声辅助冷冻对面筋蛋白二级结构的影响[J]. 现代食品科技, 2009, 25(8): 860-864. DOI:10.13982/ j.mfst.1673-9078.2009.08.010.
[21] 卢雁, 张玮玮, 王公轲, 等. FTIR用于变性蛋白质二级结构的研究进展[J]. 光谱学与光谱分析, 2008, 28(1): 88-93. DOI:10.3964/ j.issn.1000-0593.2008.01.021.
[22] 宋国胜. 超声辅助冷冻对面筋蛋白二级结构影响的红外光谱研究[J]. 陕西科技大学学报(自然科学版), 2008, 26(3): 132-137. DOI:10.3969/j.issn.1000-5811.2008.03.031.
[23] 安志丛, 周惠明, 朱科学. 预处理对小麦面筋蛋白二级结构及其酶解产物螯合亚铁离子能力的影响[J]. 粮食与饲料工业, 2009(8): 18-20. DOI:10.3969/j.issn.1003-6202.2009.08.008.
[24] 刘斌, 马海乐, 李树君, 等. 应用FTIR研究超声对牛血清白蛋白二级结构的影响[J]. 光谱学与光谱分析, 2010, 30(8): 2073-2076. DOI:10.3964/j.issn.1000-0593(2010)08-2072-05.
[25] KEIDERLING T A. Protein and peptide secondary structure and conformational determination with vibrational circular dichroism[J]. Current Opinion in Chemical Biology, 2002, 6(5): 682-688. DOI:10.1016/s1367-5931(02)00369-1.
[26] CHOI S, MA C. Structural characterization of globulin from common buckwheat (Fagopyrum esculentum Moench) using circular dichroism and Raman spectroscopy[J]. Food Chemistry, 2007, 102(1): 150-160. DOI:10.1016/j.foodchem.2006.05.011.
[27] 李学红, 胡钟毓, 陆勇, 等. 冻藏时间对麦谷蛋白和麦醇溶蛋白二级结构及面团性能的影响研究[J]. 食品工业科技, 2014, 35(1): 83-97. D OI:10.13386/j.issn1002-0306.2014.01.059.
[28] BAO Yuru, WANG Xianlun. Research on water’s inf l uences on the quality of frozen dough[J]. Procedia Enviro nmental Sciences, 2011, 8: 313-318. DOI:10.1016/j.proenv.2011.10.050.
[29] 赵永会, 史义静, 冯俊霞, 等. 面粉中蛋白质二级结构的红外光谱研究[J]. 光散射学报, 2015, 27(1): 82-86. DOI:10.13883/ j.issnl004-5929.201501016.
[30] 丁珊珊, 贾春利, 张峦, 等. 聚谷氨酸提高冷冻甜面团面包质构和感特性研究[J]. 食品工业科技, 2014, 35(16): 308-311. DOI:10.13386/ j.issn1002-0306.2014.16.059.
Effect of Moisture on Texture and Gluten Protein Secondary Structure in Frozen Wheat Dough
WANG Shixin, YANG Qiang, LI Xinhua*
(School of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Abstract:The texture and microstructure (gluten protein secondary structure) of wheat dough were determined by texture analyzer and Fourier transform infrared spectrometer (FTIR) to analyze the effect of adding different amounts of water on the quality of frozen wheat dough. The results showed the signif i cant impact of water addition and freezing on texture characteristics of wheat dough and the secondary structure of gluten proteins. With increasing water addition, the hardness, and viscosity of frozen wheat dough increased, cohesion and the elasticity decreased when compa red with the nonfrozen one. However , water addition had little effect on the resilience of frozen wheat dough. After fr eezing, the contents of β-sheet and α-helix of gluten prote ins increased, and the content of β-turn decreased, resulting in a stable network structure of gluten proteins. These results indicated that water is an important factor affecting the quality of f rozen wheat dough. This study can provide a theoretical basis for further studies aimed at revealing the mechanism of the effect of water addition on the quality of frozen wheat dough.
Key words:freeze; water addition; texture characteristics; gluten protein secondary structure
DOI:10.7506/spkx1002-6630-201709024
中图分类号:TS210.1
文献标志码:A
文章编号:1002-6630(2017)09-0149-07
引文格式:
王世新, 杨强, 李新华. 水分对冷冻小麦面团质构及面筋蛋白二级结构的影响[J]. 食品科学, 2017, 38(9): 149-155. DOI:10.7506/spkx1002-6630-201709024. http://www.spkx.net.cn
WANG Shixin, YANG Qiang, LI Xinhua. Effect of moisture on texture and gluten protein secondary structure in frozen wheat dough[J]. Food Science, 2017, 38(9): 149-155. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201709024. http://www.spkx.net.cn
收稿日期:2016-05-02
作者简介:王世新(1990—),男,硕士研究生,研究方向为粮油食品加工。E-mail:963823884@qq.com
*通信作者:李新华(1955—),男,教授,硕士,研究方向为粮油加工与转化。E-mail:lixh.syau@163.com