咖啡碱和绿原酸对高脂饮食小鼠 体质量、脂类沉积及肝脏脂质代谢基因表达的影响
朱艳萍,杨丽聪,林乐珍,淦述翔,郑国栋*
(江西农业大学食品科学与工程学院,江西省天然产物与功能性食品重点实验室,江西 南昌 330045)
摘 要:研究咖啡主要成分咖啡碱和绿原酸对高脂饮食诱导的肥胖小鼠体质量、脂类沉积及肝脏脂类代谢基因表达的影响。50 只雌性ICR小鼠被随机分成5 组:对照组、高脂组、咖啡碱、绿原酸、咖啡碱+绿原酸,给药组分别在饮水中添加0.05%咖啡碱、0.2%绿原酸、0.05%咖啡碱+0.2%绿原酸,饲养14 周。饲养期间每周测1 次体质量。饲养结束后心脏采血,摘取脏器和腹腔内脂肪(intraperitoneal adipose tissues,IPAT)并称质量。 测定血糖浓度、血中及肝脏中脂质含量。通过实时定量聚合酶链式反应测定肝脏中脂质代谢相关基因AMPK、HMG-CoAr、FASN、ACO的mRNA表达量。与高脂组相比,咖啡碱+绿原酸能明显抑制小鼠体质量和IPAT质量的增加;咖啡碱、咖啡碱+绿原酸明显降低血糖和总胆固醇浓度;绿原酸投喂小鼠血中低密度脂蛋白胆固醇浓度显著降低,而血中游离脂肪酸浓度上升;咖啡碱、咖啡碱+绿原酸显著降低肝脏中总胆固醇和甘油三酯的含量;咖啡碱和咖啡碱+绿原酸使AMPK基因相对表达量显著上升,FASN基因相对表达量显著下降;3 组给药组的ACO基因相对表达量显著上升,HMG-CoAr基因相对表达量显著下降。 咖啡碱+绿原酸的减肥作用可能通过调节肝脏脂质代谢相关基因的表达,来降低血中和肝脏中脂类的含量,抑制脂肪沉积,抑制小鼠体质量增加,且它们有协同作用。
关键词:咖啡碱;绿原酸;脂肪沉积;脂类代谢;基因表达
随着食品生产的现代化程度越来越高,饮食结构的巨大变迁导致一些全球营养安全问题如肥胖症。肥胖症的发生日趋低龄化,将影响数代人的健康同时给国民经济带来沉重负担。其引起的并发症主要是胰岛素抵抗、2型糖尿病、 心血管疾病及某些癌症等相关营养性疾病[1-4]。肥胖患者通过减少体脂肪率,就能有效降低血脂和血压、改善能量代谢、减少心脑血管疾病的发病率,从而降低死亡率[5]。
咖啡是世界三大饮品之一,在世界范围内广泛饮用,近年我国消费量也在不断增加。咖啡有降低肝脏疾病、调节血压、预防2型糖尿病等功效[6-7]。咖啡主要功能成分有 咖啡碱、绿原酸等,其中 咖啡碱占咖啡干质量的1%~2%,绿原酸约为6%~8%[8]。咖啡碱有兴奋神经中枢、刺激胃酸分泌、助消化、促进产热、减少脂肪沉积等作用[9]。研究证实咖啡碱能降低高脂饮食诱导的小鼠血中总胆固醇、甘油三酯的浓度,减小脂肪组织的体积,减少脂肪沉积[10]。绿原酸,又名咖啡鞣酸,由咖啡酸与奎尼酸酯化而成,是许多植物次生代谢产物,有抗菌消炎、清热解毒的功效,另外绿原酸还能清除自由基和抗氧化、预防酒精引起的肝损伤、预防动脉粥样硬化、降低2型糖尿病发病率[11-12]。用含0.02% 绿原酸的高脂饮食干预正常小鼠8 周 后,绿原酸干预组小鼠的体质量、附睾和肾周脂肪量均显著下降,血浆中甘油三酯和胆固醇浓度降低[13]。
肝脏是动物体内脂肪酸代谢的重要产所之一,涉及多个环节,包括脂肪酸、固醇类的合成、脂肪 酸β-氧化和固醇转运等。腺苷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)是动物体内关键的细胞能量传感器,在调控糖、脂代谢中起重要作用[14]。长期高脂饮食能激活AMPK,激活的AMPK通过影响固醇调节原件结合蛋白(sterol regulatory elementbinding protein1c,SREBP1c)的表达,抑制脂肪酸合成酶(fatty acid synthase,FASN)、3-羟基-3-甲基戊二酰辅酶A还原酶( 3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoAr)的表达[15-17]。酰基辅酶A氧化酶(acyl-CoA oxidase,ACO)是催化细胞内脂肪酸β-氧化过程中的第一限速酶[18]。
以上研究表明了咖啡碱和绿原酸有降脂减肥作用,但针对它们组合降脂减肥作用研究还较少见,本实验利用在饮水中添加咖啡碱、绿原酸、咖啡碱+绿原酸喂养高脂饮食小鼠14 周,测定小鼠体质量、采食量、摄水量、脏器和腹腔内脂肪(intraperitineal adipose tissues,IPAT)质量,分析血中和肝脏中脂类相关生化指标。 此外,采用 实时定量聚合酶链式反应(real time-quantifed PCR,RT-qPCR)测定小鼠肝脏中脂质合成基因FASN、HMG-CoAr、脂类氧化基因ACO,以及脂类分解基因AMPK的表达水平。进一步从基因水平探讨绿原酸和咖啡碱是否有降脂减肥作用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
绿原酸(纯度为87.5%) 湖南浏阳艾特天然产物研究与开发有限公司;咖啡碱(纯度为99%) 美国Johnson Matthey公司。
1.1.2 动物饲料
普通饲料(许可证号:SCXK(湘)2014-0002)湖南斯莱克景达实验动物有限公司;牛油(生产许可证号:Q5420602013567) 襄阳市襄州区奥杰星油脂生产有限公司。高脂饲料 按85%普通饲料+15%牛油配方制作。
1.1.3 动物
50 只4 周龄的雌性ICR小鼠,体质量为(20±2)g,许可证号:SCXK(湘)2013-0003,购自湖南斯 莱克景达实验动物有限公司。
1.1.4 试剂
葡萄糖(g l u c o s e,G L U)试剂盒、甘油三酯(triglyceride,TG)试剂盒、总胆固醇(total cholesterols,TC)试剂盒、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)试剂盒、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)试剂盒 中生北控生物科技股份有限公司;游离脂肪酸(free fatty acids,FFA)试剂盒 南京建成生物技术研究所;动物组织/细胞RNA提取试剂盒CW0584北京康为生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
AUY120型电子天平 日本岛津公司;V-5600型可见分光光度计 上海元析仪器有限公司;Platinum®定量PCR SuperMix-UDG 上海英骏生物技术有限公司;CFX 96 PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 动物分组及饲养
50 只4 周龄的雌性ICR小鼠,体质量(20±2)g,适应性喂养1 周后,随机分成5组:对照组、高脂组、0.05%咖啡碱组、0.2%绿原酸组、0.05%咖啡碱+0.2%绿原酸组。对照组喂食普通饲料,其余4 组喂食高脂饲料。每组都饮用5%的蔗糖水,给药组的饮水中分别添加0.05%咖啡碱、0.2%绿原酸、0.05%咖啡碱+0.2%绿原酸。每组10 只,自由采食和饮水,喂养14 周,每周测体质量一次,采食量和饮水量每周测定2 次。饲养条件:室温(22±2)℃,光暗周期12 h/12 h。
1.3.2 动物解剖
投喂结束后,麻醉小鼠,心脏采血,以3 000 r/min离心,分装血清,保存在-80 ℃超低温冰箱中。摘取肝脏、肾脏、脾脏、肾上腺及IPAT并称质量。
1.3.3 血清指标的测定
血清中GLU、TG、TC、HDL-C、LDL-C、FFA的浓度分别用其试剂盒进行测定。
1.3.4 肝脏和粪便中脂类含量的测定
肝脏脂类按Folch等[19]方法提取,TG、TC含量用其试剂盒测定。
1.3.5 肝脏中AMPK、FASN、ACO、HMG-CoAr基因表达的测定
按总RNA提取试剂盒说明书操作,分别从30~50 mg小鼠肝脏提总RNA。以总RNA 1 μg为模板用Platinum®定量PCR SuperMix-UDG逆转录成cDNA。用CFX 96 PCR仪进行RT-qPCR扩增,以逆转录产物800 ng为模板,加入上游引物、下游后引物、探针各0.2 μL,引物系列见表1,Taq DNA聚合酶5.0 μL,去RNA酶水补足总体积20 μL。PCR条件是95 ℃变性150 s,94 ℃延伸20 s,退火温度分别为AMPK 61 ℃、HMG-CoAr 61 ℃、FASN 56 ℃、ACO 59 ℃,45 s,45 个循环,β-actin作为内参基因。用RQ manage 1.2.1软件进行数据分析,得出Ct和RQ值。Δ ΔCt =(Ct目的基因-Ctβ-actin)给药组-(Ct目的基因– Ctβ-actin)对照组;RQ=2-ΔΔCt。
表1 基因PCR引物序列
Table1 PCR primer sequences used in this study
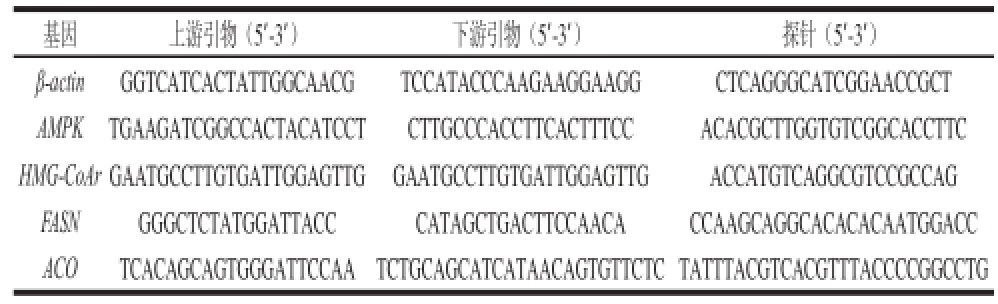
基因上游引物(5’-3’)下游引物(5’-3’)探针(5’-3’)β-actinGGTCATCACTATTGGCAACGTCCATACCCAAGAAGGAAGGCTCAGGGCATCGGAACCGCT AMPK TGAAGATCGGCCACTACATCCTCTTGCCCACCTTCACTTTCCACACGCTTGGTGTCGGCACCTTC HMG-CoAr GAATGCCTTGTGATTGGAGTTGGAATGCCTTGTGATTGGAGTTGACCATGTCAGGCGTCCGCCAG FASN GGGCTCTATGGATTACCCATAGCTGACTTCCAACACCAAGCAGGCACACACAATGGACC ACOTCACAGCAGTGGGATTCCAATCTGCAGCATCATAACAGTGTTCTC TATTTACGTCACGTTTACCCCGGCCTG
1.4 数据统计
实验数据采用DPS统计软件(Version. 7.5)进行Duncan新复极差法比较分析,P<0.05为差异显著,各项指标以±s表示。
2 结果与分析
2.1 咖啡碱和绿原酸对小鼠体质量增加量、脏器和IPAT质量的影响
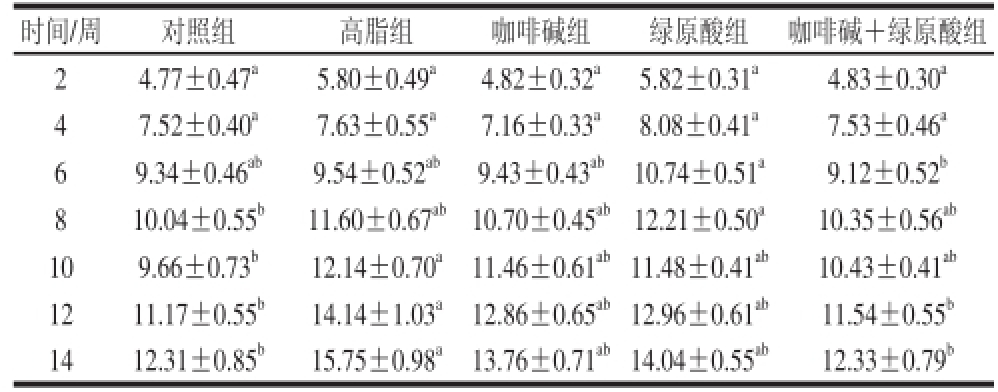
表2 咖啡碱和绿原酸对小鼠体质量增加量的影响(n=10)
Table2 Effect of caffeine and CGA on body weight gain in mice (n = 10)
g
注:同行肩标不同字母表示差异显著(P<0.05),下同。
时间/周 对照组高脂组咖啡碱组绿原酸组咖啡碱+绿原酸组24.77±0.47a5.80±0.49a4.82±0.32a5.82±0.31a4.83±0.30a47.52±0.40a7.63±0.55a7.16±0.33a8.08±0.41a7.53±0.46a69.34±0.46ab9.54±0.52ab9.43±0.43ab10.74±0.51a9.12±0.52b810.04±0.55b11.60±0.67ab10.70±0.45ab12.21±0.50a10.35±0.56ab109.66±0.73b12.14±0.70a11.46±0.61ab11.48±0.41ab10.43±0.41ab1211.17±0.55b14.14±1.03a12.86±0.65ab12.96±0.61ab11.54±0.55b1412.31±0.85b15.75±0.98a13.76±0.71ab14.04±0.55ab12.33±0.79b
表3 绿原酸和咖啡碱对小鼠各脏器及其IPAT质量的影响(n=10)
Table3 Effect of caffeine and CGA on visceral organ weights and IPAT weight in mice (
mg

脏器对照组高脂组咖啡碱组绿原酸组咖啡碱+绿原酸组脾脏128±9a140±11a142±8a127±6a134±9a肾脏240±9a241±10a230±7a234±8a248±6a肾上腺7.9±1.0a8.1±1.2a6.9±1.2a9.6±1.2a7.3±0.7a肝脏1 536±67b1 797±63a1 765±50a1 771±64a1 761±58aIPAT 1 440±210bc2 395±577a993±162bc1 818±200ab648±109c
从表2可以看出,咖啡碱+绿原酸投喂的小鼠体质量增加量与高脂组相比呈下降趋势,特别是喂养12 周开始,小鼠体质量增加显著减少(P<0.05)。表3表示绿原酸和咖啡碱喂养14 周后小鼠脏器及IPAT的质量。与高脂组相比,咖啡碱和咖啡碱+绿原酸组的小鼠IPAT质量显著降低(P<0.05),脏器质量无明显差异。表2和表3的结果显示,咖啡碱+绿原酸抑制体质量增加可能主要是由于体内脂肪沉积减少。
2.2 小鼠采食量、饮水量及相应摄入能量的比较
表4 小鼠14 周内平均采食量、饮水量及相应能量(n=14)
Table4 Average feed intake, water intake and corresponding energy of mice during 14 weeks (n=14)
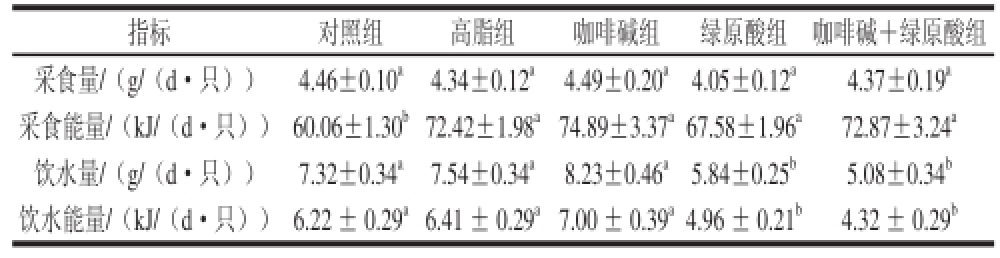
指标对照组高脂组咖啡碱组绿原酸组咖啡碱+绿原酸组采食量/(g/(d·只))4.46±0.10a4.34±0.12a4.49±0.20a4.05±0.12a4.37±0.19a采食能量/(kJ/(d·只))60.06±1.30b72.42±1.98a74.89±3.37a67.58±1.96a72.87±3.24a饮水量/(g/(d·只))7.32±0.34a7.54±0.34a8.23±0.46a5.84±0.25b5.08±0.34b饮水能量/(kJ/(d·只))6.22 ± 0.29a6.41 ± 0.29a7.00 ± 0.39a4.96 ± 0.21b4.32 ± 0.29b
由于体质量变化可能与能量摄入有关,本实验统计了小鼠饲养期间平均每只每天的采食量和饮水量及其相应摄入的能量。由表4可知,与高脂组相比,给药组的采食量及采食能量均无显著差异,排除了采食量的差异对绿原酸和咖啡碱降脂减肥效果的影响;绿原酸、绿原酸+咖啡碱两组的饮水量、饮水能量均显著下降(P<0.05)。饮水能量虽然有差异,但统计学上只相差2 kJ/(d·只),与进食饲料摄入能量70 kJ/(d·只)相比,其影响甚微。
2.3 咖啡碱和绿原酸对小鼠血清中脂类和血糖浓度的影响
表5 咖啡和绿原酸对小鼠血清中脂类和血糖浓度的影响(n=10)
Table5 Effect of caffeine and CGA on the concentrations of serum lipids and glucose in mice (n = 10)
mmol/L
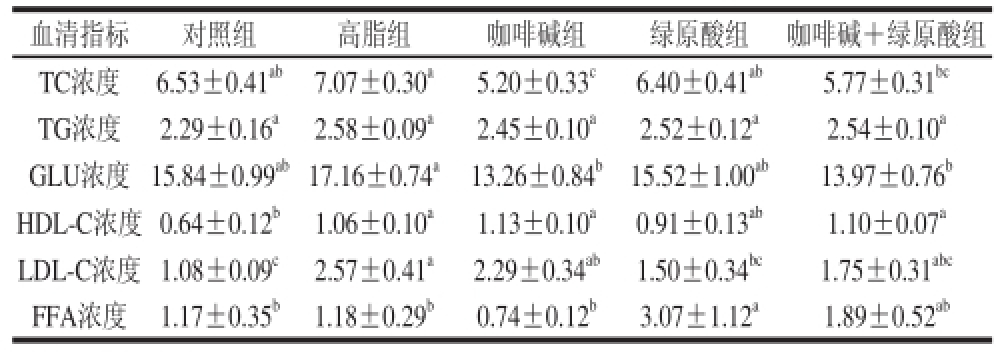
血清指标对照组高脂组咖啡碱组绿原酸组咖啡碱+绿原酸组TC浓度6.53±0.41ab7.07±0.30a5.20±0.33c6.40±0.41ab5.77±0.31bcTG浓度2.29±0.16a2.58±0.09a2.45±0.10a2.52±0.12a2.54±0.10aGLU浓度15.84±0.99ab17.16±0.74a13.26±0.84b15.52±1.00ab13.97±0.76bHDL-C浓度0.64±0.12b1.06±0.10a1.13±0.10a0.91±0.13ab1.10±0.07aLDL-C浓度1.08±0.09c2.57±0.41a2.29±0.34ab1.50±0.34bc1.75±0.31abcFFA浓度1.17±0.35b1.18±0.29b0.74±0.12b3.07±1.12a1.89±0.52ab
表5显示,咖啡碱和绿原酸对小鼠血清中脂类和血糖浓度的影响。与高脂组比较,给药组小鼠血中GLU、TC、LDL-C的浓度均有下降趋势,咖啡碱组和咖啡碱+绿原酸组的血清中TC与GLU浓度显著降低(P<0.05),绿原酸组的LDL-C浓度显著降低(P<0.05),FFA浓度显著上升(P<0.05)。
2.4 咖啡碱和绿原酸对小鼠肝脏和粪便中脂质含量的影响
由图1可知,与高脂组相比,咖啡碱组、咖啡碱+绿原酸组的小鼠肝脏中TC和TG含量显著降低(P<0.05)。由于有报道显示绿原酸会降低小鼠肠道脂质吸收,所以实验检测了10~14 周小鼠粪便中TC、 TG的含量,对照、高脂、咖啡碱、绿原酸、咖啡碱+绿原酸组粪便中TC含量分别是:(11.30±0.53)、(12.13±0.49)、(11.51±0.63)、(10.82±0. 47)、(10.69±0.28)mmol/g;TG含量分别是:(11.11±0.10)、(12.58±0.33)、(11.28±0.38)、(11.53±0.77)、(11.87±0.49)mmol/g。各组TC、TG含量无显著性差异。

图1 绿原酸和咖啡碱对小鼠肝脏脂质含量的影响(n=5)
Fig.1 Effect of caffeine and CGA on liver lipid levels in mice (n = 5)
2.5 咖啡碱和绿原酸对小鼠肝脏脂质代谢相关基因表达量的影响
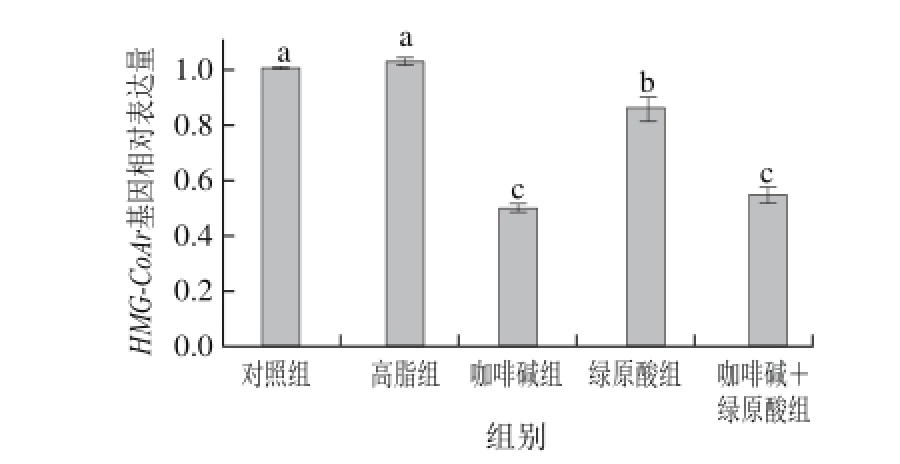
图2 绿原酸和咖啡碱对小鼠肝脏脂质代谢相关基因表达的影响(n=12)=12
Fig.2 Effect of caffeine and CGA on the mRNA expression of lipid metabolism-related genes in liver of mice (n = 12)
由图2可知,与高 脂组相比,咖啡碱组和咖啡碱+绿原酸组的AMPK基因相对表达量显著升高(P<0.05),FASN基因相对表达量显著下降(P<0.05);3 组给药组的ACO基因相对表达量显著上升(P<0.05),HMGCoAr基因相对表达量显著下降。
3 讨 论
研究表明咖啡碱能抑制小鼠的体质量和IPAT质量增加[20],减小高脂饮食喂养的大鼠脂肪细胞体积[10],从而抑制脂肪沉积。同时咖啡碱能协同儿茶素抑制3T3-L1细胞的脂肪合成,且脂肪细胞的脂肪含量跟咖啡碱的添加浓度呈负相关性[21]。王建 辉等[22]研究发现了杜仲叶绿原酸能显著降低高脂血症小鼠血清中TC、TG、LDL-C浓度和肝脏TC、TG水平。Hiroshi等[23]研究发现咖啡因是抑制肝脏脂质吸收有效的抑制剂,而绿原酸对绿咖啡豆降低肝脏中TG含量有部分辅助作用。
本研究结果显示与高脂组相比,咖啡碱、咖啡碱+绿原酸显著降低小鼠IPAT质量,降低血清中GLU和TC浓度,以及肝脏中TC和TG水平(P<0.05)。由于抑制体质量可能与采食量减少有关,检测了14 周内喂食高脂饲料的小鼠日均采食量及其相应摄入的能量,结果并无差异,排除了采食量差异对体质量影响的可能。在本研究中,纯度 约为87.5%的绿原酸添加在饮水中对小鼠体质量和脂肪沉积无明显变化,这可能与投喂方式和饮水量减 少有关。与高 脂组相比,绿原酸、咖啡碱+绿原酸小鼠通过饮用5%的蔗糖水摄入的能量显著减少(P<0.05),摄水能量虽然有差异,但统计学上只相差2 kJ/(d·只),与进食饲料摄入能量70 kJ/(d·只)相比,其影响甚微。由此推测咖啡碱+绿原酸可以抑制体质量和IPAT增加,与采食量、饮水量无关,而可能是与促进脂类代谢有关。李文娜等[24]研究发现绿原酸含量为42.43%的杜仲叶绿原酸提取物能抑制肠道胆固醇的吸收,且其降脂作用约等于甚至高于现有的减肥、调脂药物和绿原酸。本实验中各组小鼠干粪便TC、TG含量并无明显差异,可能是绿原酸纯度不同造成的,绿原酸提取物里可能有其他抑制肠道脂质吸收的成分。由此推测咖啡碱+绿原酸减少体质量增加与抑制肠道脂质吸收无关。以上分析表明咖啡碱、咖啡碱+绿原酸可能主要通过降低血清中TC浓度、肝脏中TC、TG含量,来抑 制体内脂肪沉积,从而达到减肥效果,且绿原酸和咖啡碱组合效果更好。
课题组从基因水平探讨了咖啡碱和绿原酸对高脂饮食诱导的小鼠肝脏脂质代谢相关基因表达的影响(图2)。有报 道称绿原酸能通过AMPK信号通路显著 抑制FASN、HMG-CoAr基因的表达,提高脂肪酸β-氧化,减少脂肪酸和胆固醇的沉积,从而降低小鼠体质量[11,25-26]。研究表明咖啡碱能刺激AMPK的激 活,通过显著抑制人肝脏中FASN、HMG-CoAr基因表达,减少肝脏脂质沉积[27-28]。Sugiura等[29]发现咖啡碱和儿茶素组合可以提高小鼠肝脏组织ACO活性,促进脂肪酸氧化分解。此外,邱阳阳[30]用咖啡碱和绿原酸干预3T3脂肪细胞,发现咖啡碱+绿原酸能增加分化14 d的脂肪细胞的AMPK、ACO的mRAN水平,从而促进脂类分解。本研究结果显示咖啡碱、绿原酸+咖啡碱既能明显降低肝脏中FASN、HMG-CoAr的基因相对表达量(P<0.05),抑制肝脏中TC、TG的合成及血清中TC沉积,降低血糖浓度;又能显著提高肝脏AMPK、ACO的基因相对表达量(P<0.05),促进脂肪氧化分解,从而达到降脂减肥的效果。与高脂组相比,绿原酸显著抑制HMG-CoAr基因的表达,明显促进ACO基因的表达(P<0.05),其体质量、IPAT质量、血中GLU、TC以及肝脏脂质含量均有下降趋势,但差异不显著。
咖啡碱+绿原酸抑制高脂饮食诱导的小鼠体质量增加可能是通过降低脂质合成基因FASN、HMG-CoAr的表达,提高脂质分解基因AMPK、ACO的表达量,从而降低血中TC含量、血糖浓度及肝脏TC与TG含量,抑制IPAT沉积来达到,且组合效果比绿原酸或咖啡碱单独效果更好。总之,本实验表明咖啡碱和绿原酸可能有协同抑制脂质沉积和减肥的效果。
参考文献:
[1] ASGHAR A, SHEIKH N. Role of immune cells in obesity induced low grade inflammation and insulin resistance[J]. Cellular Immunology, 2017, 315: 2-3. DOI:10.1016/j.cellimm.2017.03.001.
[2] ANGELA K W, LYNNE M M. Ob esity and type 2 diabetes in our youth: a recipe for cardiovascular disease[J]. The Journal for Nurse Practitioners, 2017, 13(3): 222-227. DOI:10.1016/ j.nurpra.2016.08.035.
[3] FRANCESCO O, GIOVANNA M, CINAR N, et al. O b esity, type 2 diabetes mellitus and cardiovascular disease risk: an uptodate in the management of polycystic ovary syndrome[J]. European Journal of Obstetrics & Gynecology and Reproductive Biology, 2016, 207: 214-219. DOI:10.1016/j.ejogrb.2016.08.026.
[4] CARLOS N, ADRIAN B, SAM E, et al. Ob esity, physical activity and cancer risks: Results from the Cancer, Lifestyle and Evaluation of Risk Study (CLEAR)[J]. Cancer Epidemiology, 2017, 47: 56-63. DOI:10.1016/j.canep.2017.01.002.
[5] REITER R J, TAN D X, KORKMAZ A, et al. Obesity and metabolic syndrome: association with chronodisruption, sleep deprivation, and melatonin suppression[J]. Annals of Medicine, 2012, 44(6): 564-577. DOI:10.3109/07853890.2011.586365.
[6] BRAVI F, BOSETTI C, TAVANI A, et al. Coffee drinking and hepatocellular carcinoma risk: a meta-analysis[J]. Hepatology, 2007, 46(2): 430-435. DOI:10.1002/hep.21708.
[7] INOUE M, YOSHIMI I, SOBUE T, et al. Inf l uence of coffee drinking on subsequent risk of hepatocellular carcinoma: a prospective study in Japan[J]. Journal of the National Cancer Institute, 2005, 97(4): 293-300. DOI:10.1093/jnci/dji040.
[8] VIANI R. Ph ysiologically active substances in coffee[J]. Physiology, 1988, 3: 1-31.
[9] 吴命燕, 范方媛, 梁月荣, 等. 咖 啡 碱的生理功能及其作用机制[J].茶叶科学, 2010, 30(4): 235-242. DOI:10.13305/j.cnki.jts.2010.04.013.
[10] HYANG Y K, MEE Y L, HYE M P, et al. Urine and serum metabolite profiling of rats fed a high-fat diet and the anti-obesity effects of caffeine consumption[J]. Molec ules, 2015, 20(2): 3107-3128. DOI:10.3390/molecules20023107.
[11] MENG S X, CAO J M, FENG Q, et al. Ro les of chlorogenic acid on regulating glucose and lipids metabolism: a review[J]. Ev idence-Bases Complementary and Alternative Medicine, 2013: 1-11. DO I:10.1155/2013/801457.
[12] 庞美蓉, 刘零怡, 高汪磊, 等. 绿原酸调节糖脂代谢的作用机制研究进展[J]. 中草药, 2015, 46(2): 305-312. DOI:10.7501/ j.issn.0253-2670.2015.02.027.
[13] CHO A S, JEON S M, KIM M J, et al. Ch lorogenic acid exhibits anti-obesity property and improves lipid metabolism in high-fat dietinduced-obese mice[J]. Food Chemical Toxicology, 2010, 48(3): 937-943. DOI:10.1016/j.fct.2010.01.003.
[14] HARDIE D G, ROSS F A, HAWLEY S A. A M PK: a nutrient and energy sensor that maintains energy homeostasis[J]. Nature Reviews Molecular Cell Biology, 2012, 13(4): 251-262. DOI:10.1038/nrm3311.
[15] ZHOU G, MYERS R, LI Y, et al. R ole of AMP-act ivated protein kinase in mechanism of metformin action[J]. Journal of Clinical Investigation, 2001, 108: 1167-1174. DOI:10.1172/JCI13505.
[16] 李文全, 王子花, 申瑞玲. HMG-CoA还原酶的结构和调节[J]. 动物医学进展, 2006, 27(2): 38-40. DOI:10.16437/ j.cnki.1007-5038.2006.02.011.
[17] SHIMANO H. SREBP-1c and TFE3, energy transcription factors that regulate hepatic insulin signaling[J]. Journal of Molecular Medicine, 2007, 85(5): 437-444. DOI:10.1007/s00109-007-0158-5.
[18] MORAIS S, KNOLLG A, ANDRÉ M, et al. Conserved expression of alternative splicing variants of peroxisomalacyl-CoA oxidase 1 in vertebrates and developmental and nutritional regulation in fish[J]. Physiological Genomics, 2007, 28(3): 239-252. DOI:10.1152/ physiolgenomics.00136.2006.
[19] FOLCH J, LEES M, SLOANE S G. A simple method for the isolation and purif i cation of total lipids from animal tissues[J]. The Journal of Biological Chemistry, 1957, 226(1): 497-509.
[20] Z HENG G, SAYAMA K, OKUBO T, et al. Anti-obesity effects of three major components of green tea, catechins, caffeine and theanine in mice[J]. In Vivo, 2004, 18(1): 55-62.
[21] 郑国 栋, 邱阳阳, 张清峰, 等. 儿茶 素和咖啡碱组合对3T3-L1细胞增殖及脂肪代谢的影响[J]. 营养学报, 2013, 35(1): 60-63.
[22] 王建 辉, 刘永乐, 李赤翎, 等. 杜仲绿原酸对高脂模型小鼠降血脂作用研究[J]. 食品工业科技, 2012, 33(15): 360-362. DOI:10.13386/ j.issn1002-0306.2012.15.019.
[23] HIROSHI S, EMI S, MICHIO A, et al. Inhibitory effect of green coffee bean extract on fat accumulation and body weight gain in mice[J]. B M C Complementary and Alternative Medicine, 2006, 6: 9. DOI:10.1186/1472-6882-6-9.
[24] 李文娜, 韩宇东, 刘银花, 等. 杜仲叶绿原酸提取物对脂代谢关键酶活性的影响[J]. 中药新药与临床药理, 2012, 23(1): 30-33. DOI:10.3969/j.issn.1003-9783.2012.01.008.
[25] ZHANG Xu, HUANG Huang, YANG Tingting, et al. C hlorogenic acid protects mice against lipopoly-saccharide-induced acute lung injury[J]. Injury, 2010, 41(7): 746-752. DOI:10.1016/j.injury.2010.02.029.
[26] WU C, LUAN H, ZHANG X, et al. Chlorogenic acid protects against atherosclerosis in ApoE-/-mice and promotes cholesterol eff l ux from raw 264.7 macrophages[J]. PLoS ONE, 2014, 9(9): 1-9. DOI:10.1371/ 2014/0095452.
[2 7] Q UAN H Y, KIM D Y, CHUNG S H, et al. Caffeine attenuates lipid accumulation via activation of AMP-activated protein kinase signaling pathway in HepG2 cells[J]. Biochemistry and Molecular Biology Reports, 2013, 46(4): 207-212. DOI:10.5483/BMBRep.2013.46.4.153.
[28] TSUDA S, EGAWA T, KITANI K, et al. Caffeine and contraction synergistically stimulate 5-AMP-activated protein kinase and insulinindependent glucose transport in rat skeletal muscle[J]. Physiological Reports, 2015, 3(10): 1-12. DOI:10.14814/phy2.12592.
[29] SUGIURA C, NISHIMATSU S, MORIYAMA T, et al. Catechins and caffeine inhibit fat accumulation in mice through the improvement of hepatic lipid metabolism[J]. Journal of Obesity, 2012: 510-520. DOI:10.1155/2012/520510.
[30] 邱阳阳. 咖 啡碱和绿原酸对小鼠和3T3-L1细胞脂肪代谢的影响[D].南昌: 江西农业大学, 2013: 3-7.
E ffect of Caffeine and Chlorogenic Acid on Body Weight, Lipid Accumulation and the Expression of Lipid Metabolism-Related Genes in High-Fat Diet-Fed Mice
ZHU Yanping, YANG Licong, LIN Lezhen, GAN Shuxiang, ZHENG Guodong*
(Jiangxi Key Laboratory of Natural Product and Functional Food, College of Food Science and Engineering, Jiangxi Agricultural University, Nanchang 330045, China)
Abstract:This study was undertaken to investigate the effects of caffeine and chlorogenic acid (CGA), two major components in coffee, on body weight, lipid accumulation and the expression of lipid metabolism-related genes in obese mice fed a high-fat diet. With this aim, 50 female ICR mice were randomly divided into fi ve groups: control, high-fat diet (HFD), caffeine, CGA, and caffeine + CGA groups. The animals in the experimental groups were given drinking water supplemented with 0.05% caffeine, 0.2% CGA and 0.05% caffeine + 0.2% CGA, respectively for 14 consecutive weeks. Body weight was measured daily during the experimental period. Visceral organs and intraperitoneal adipose tissues (IPAT) were harvested and weighed at the end of the experimental period, and blood samples from the heart were collected for measurement of serum glucose and lipid concentrations and liver lipid levels. The mRNA expression levels of lipid metabolism-related genes in liver (AMPK, HMG-CoAr, FASN, and ACO) were determined by real time- quantitative PCR (RT-qPCR). Compared with the HFD group, caffeine + CGA remarkably reduced body weight gain and IPAT weight. The serum glucose and TC levels were decreased signif i cantly by caffeine, and caffeine + CGA. The serum low-density lipoprotein cholesterol (LDL-C) concentration was remarkably lower in mice administrated with CGA, while CGA could result in an increase in serum free fatty acid concentration. Caffeine alone and in combination with CGA remarkably reduced the liver total cholesterols (TC) and triglyceride (TG) levels, signif i cantly increased the mRNA expression of AMPK and signif i cantly reduced the mRNA expression of FASN in liver. A signif i cant up-regulation in the mRNA expression of ACOand a signif i cant down-regulation in the mRNA expression of HMG-CoAr in liver were observed for all three experimental groups. Conclusions: The anti-obesity effects of caffeine + CGA may be achieved through regulating the mRNA expression of lipid metabolism-related genes in liver, modulating serum and liver lipid levels in, and inhibiting body weight gain and fat accumulation in mice in a synergistic manner.
Key words:caffeine; chlorogenic acid; fat accumulation; lipid metabolism; mRNA expression
DOI:10.7506/spkx1002-6630-201709026
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)09-0162-06
收稿日期:2016-05-12
基金项目:国家自然科学基金地区科学基金项目(31160320);江西省自然科学基金项目(20142BAB204003)
作者简介:朱艳萍(1988—),女,硕士研究生,研究方向为功能性食品。E-mail:m13576971074@163.com
*通信作者:郑国栋(1969—),男,教授,博士,研究方向为天然产物功能性食品。E-mail:zrs150716@aliyun.com
引文格式:
朱艳萍, 杨丽聪, 林乐珍, 等. 咖啡碱和绿原酸对高脂饮食小鼠体质量、脂类沉积及肝脏脂质代谢基因表达的影响[J]. 食品科学, 2017, 38(9): 162-167. DOI:10.7506/spkx1002-6630-201709026. http://www.spkx.net.cn
ZHU Yanping, YANG Licong, LIN Lezhen, et al. Effect of caffeine and chlorogenic acid on body weight, lipid accumulation and the expression of lipid metabolism-related genes in high-fat diet-fed mice[J]. Food Science, 2017, 38(9): 162-167. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201709026. http://www.spkx.net.cn







