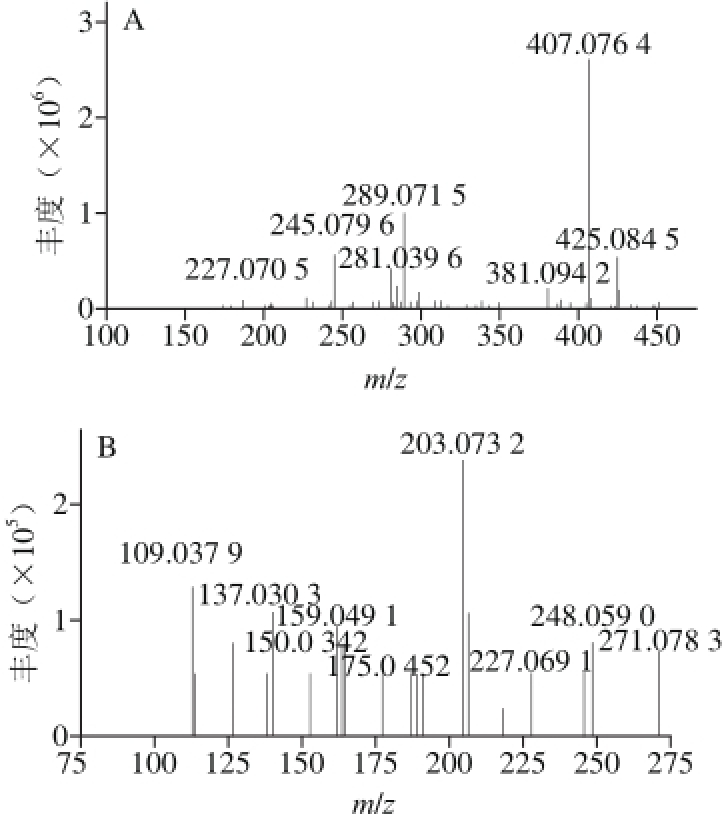
图1 负离子模式下原花青素BB2(A)和表儿茶素(BB)裂解片段质谱信息
Fig.1 MS2fragmentation data obtained in negative ion detection mode for procyanidin B2(A) and epicatechin (B)
肖 瀛,尹志婷,胡中志,刘泰驿,周一鸣,周小理
(上海应用技术大学香料香精技术与工程学院食品科学与工程系,上海 201418)
摘 要:为了探究原花青素B2在小鼠体内主要代谢产物形式及其组织分布。采用高效液相色谱-二级阵列-电喷雾-离子阱-飞行时间质谱技术测定分析原花青素B2灌胃小鼠的血浆、肝、心、脾、肺、肾、脑、小肠样品中代谢产物。结果表明,原花青素B2在小鼠体内结合代谢产物 形式主要包括:甲基化(8 种)、磺酸化(7 种)、水合(5 种)、羟基化(1 种)、葡糖苷酸化(1 种);在血浆、肝、小肠、肾、肺、心、脑和脾中检出的原花青素B2代谢产物的种类分别为6、8、8、6、3、6、2、2 种,且发现3 种单体表儿茶素及其代谢产物。原花青素B2结合型代谢产物多样,在小鼠体内组织分布范围广,甲基化、磺酸化和水合代谢是主要的结合型 产物形式,肝脏是原花青素B2结合产物(Mr>577.13)形成的主要器官,黄烷键(4β→8)的断裂产物是原花青素B2重要的吸收形式之一。
关键词:原花青素B2;HPLC-DAD-ESI-IT-TOF-MSn技术;代谢产物;组织分布
原花青素是一种在食物(如葡萄、苹果、花生等)中广泛存在的多酚化合物,是强有效的自由基清除剂[1-2]。此外,还具有改善人体微循环、抗癌、抗辐射、抗炎、氧化损伤保护、抗衰老等功能,具有较强的生理活性,是一种具有广阔开发前景的食品功能因子[3-4]。原花青素B2(Mr=578.52,C30H26O12)作为食物中主要的原花青素二聚体形式[5-6],已引起研究者较多的关注。人体摄入的原花青素二聚体一部分在小肠被直接吸收,一部分亦可被肠道微生物转化为小分子后吸收,其吸收与代谢过程复杂。原花青素的代谢产物探究引起较多体外与体内研究者的关注,但代谢途径仍不清楚,且目前对原花青素B2代谢的研究主要是通过代谢物对照品或液相色谱-串联质谱(liquid chromatography coupled with tandem mass spectrometry,LC-MS/MS)联用技术,虽然准确性高,但存在生物样品量少、内源性物质干扰多、对照品难以获得等缺点。高效液相色谱-二级阵列-电喷雾-离子阱-飞行时间质谱(high performance liquid chromatography with diode array detector and combined with electrospray ionization ion trap time-of-f l ight multistage mass spectrometry,HPLC-DAD-ESI-IT-TOF-MSn)作为近年来兴起的新型质谱仪,结合QIT(离子阱)和TOF(飞行时间)技术,具有较高分辨率、可以获取多级质谱信息,在数据分析上结合MetID solution代谢物寻找软件,快速推测复杂生物基质中代谢产物[7]。近年来,已有研究者采用此技术对单体原花青素进行结构鉴定,但在负离子模式下有关原花青素B2化合物的质谱分析研究鲜见报道。
本研究为了探究原花青素B2(epicatechin-(4β→8)-epicatechin)在小鼠体内主要代谢产物形式(原花青素B2结合型代谢产物与单体代谢产物)及其组织分布,通过HPLC-DAD-ESI-IT-TOF-MSn技术测定原花青素B2灌胃小鼠的心、肝、脾、肺、肾、脑、小肠、血浆等样本获取负离子模式下代谢产物的多级质谱信息,并根据质谱信息分析代谢产物的可能结构。
1.1 材料、实验动物与试剂
表儿茶素标品、原花青素B2标品(纯度≥99%)海同田生物技术有限公司。
18 只8 周龄C57BL/6雄性小鼠(25±2)g,许可证号:SCXK(沪)2013-0018,SPF级,购自上海灵畅生物科技有限公司。
肝素钠、羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)(均为分析纯) 上海阿拉丁生化科技股份有限公司;乙腈、甲醇(均为色谱级) 美国Honeywell试剂;氢氧化钠、三氟乙酸、甲酸(色谱纯)美国Sigma公司。
1.2 仪器与设备
SK2 200HP型数控超声波清洗仪 上海科导超声仪器有限公司;FD-80型冷冻干燥机 北京博医康实验仪器有限公司;MDF-1 156型超低温冰箱 三洋电机有限公司;PRO 200型匀浆机 牛津仪器有限公司;3k-18型离心机 德国Sigma公司;HPLC-DAD-ESI-IT-TOF设备 日本岛津公司;PURELAB Classic型超纯水机英国Elga公司;真空干燥箱 上海恒黔科技有限公司。
1.3 方法
1.3.1 动物实验
参考文献:[8]方法,动物在整个实验过程中饲养于温度恒定在(22±2)℃的动物房内,自由取食和饮水。小鼠随机均分为对照组与实验组,适应饲养1 周,实验组以原花青素B2800 mg/kg(0.5% CMC-Na溶液溶解,以体质量计)剂量灌胃,对照组灌胃对应体积的CMC-Na溶液,灌胃3 d,每天(上午9:00)灌胃1 次,灌胃前禁食12 h。第3天灌胃后每组分别于1.0、1.5、2.0 h处死3 只小鼠,摘眼球取血并收集组织样。所有未处理样品在-80 ℃条件下保藏。
1.3.2 样品处理
样品采集与前处理参考文献[8-9]的方法并略有改动。
血浆样品处理:采血于肝素钠抗凝管,3 000 r/min、4 ℃离心15 min,取上清液同组合并后,取3 mL血浆加冰乙腈9 mL超声20 min脱蛋白,5 000 r/min、4 ℃离心15 min,取上清液,沉淀用冰乙腈反复冲洗3 次,混合液氮气流吹干后加入5 mL甲醇复溶,0.45 μm膜过滤,氮气流吹干后加入200 μL甲醇复溶,超声30 min,5 000 r/min、4 ℃离心15 min,取上清液进行分析测定。
组织样品处理:取1 g组织样品加入10 mL甲醇冰浴条件下匀浆,超声30 min,5 000 r/min、4 ℃离心15 min,取上清液,在45 ℃条件下真空干燥,固形物加2 mL甲醇复溶,分析测定前用0.45 μm膜过滤。
1.3.3 HPLC-DAD-ESI-IT-TOF分析
HPLC系统配备LC-30AD泵,SIL-30AC自动进样器,CBD-20A控制系统,SPD-M20A检测器,色谱柱Shim-pack XR-ODS Ⅲ系列反相C18柱(75 mm×2.0 mm,1.6 μm);流动相:乙腈(B)-0.1% 甲酸水(A),洗脱梯度为:0 min(5% B)-2 min(10% B)-4 min(12% B)-7 min(18% B)-13 min(27% B)-32 min(56% B)-37 min(100% B)-47 min(100% B)-49 min(5% B);流速:0.2 mL/min,进样量:3 μL;检测波长:280 nm;柱温:30 ℃;TOF在正负离子模式下进行数据采集,MS1采集m/z 100~900,MS2、MS3采集m/z 50~900,离子富集时间15 ms,雾化气(N2)流速1.5 L/min,检测电压1.8 kV,离子阱压力为3.8× 10-3Pa,碰撞气(Ar)能量为50%,三氟乙酸钠调谐范围50~900 D。
1.4 数据分析
分子式预测采用岛津Formula Predictor version;代谢物结构分析采用岛津MetID solution;代谢组学软件采用岛津Pro fi ling solution。
2.1 原花青素B2代谢产物鉴定分析

图1 负离子模式下原花青素BB2(A)和表儿茶素(BB)裂解片段质谱信息
Fig.1 MS2fragmentation data obtained in negative ion detection mode for procyanidin B2(A) and epicatechin (B)

图2 小鼠肝脏样品中代谢产物片段m/z 577.135 2提取离子
(SIM)对比图
Fig.2 SIM spectra of characteristic fragmentations at m/z 577.135 2 of metabolites in mice liver

图3 小鼠肝脏样品中代谢产物片段m/z 289.072 6提取离子(SIM)对比图
Fig.3 SIM spectra of characteristic fragmentations at m/z 289.072 6 of metabolites in mice liver
表1 主要结合型代谢产物的质谱信息及其在小鼠血浆和组织中的分布
Table1 MS data obtained in negative ion detection mode for the identi fi cation of major conjugated metabolites in mouse plasma and distribution in mouse organs

注:+.检测出;—.未检测出。
原花青素B2代谢产物的筛选与结构鉴定主要是通过比较代谢产物质谱信息和原花青素B2、表儿茶素标准品的特征离子碎片来确定为其代谢产物,根据中性丢失片段确定其可能的配基结合形式[9-11]。负离子模式下进行全扫描(m/z 100~900),获得原花青素B2标品与表儿茶素标品二级质谱信息见图1。原花青素B2标品二级质谱中检测到m/z 425.08、407.07、289.07等特征裂解碎片[12],在表儿茶素的二级质谱中检测到m/z 245.07、203.07、137.03等特征裂解碎片[8]。因此,在小鼠血浆及组织样品总离子流图中提取原花青素B2和表儿茶素的分子离子片段m/z 577.13、289.07得到提取离子流图(肝脏样品见图2、3),并根据原花青素B2与表儿茶素上述特征裂解片段质荷比来初步筛选代谢产物,同时结合多级质谱信息、分子式推测软件分析结果与文献报道等多种方式解析鉴定代谢产物,结果见表1。
在代谢产物M2~M11质谱数据中检测到共同的离子碎片m/z 577.13,且其裂解规律和原花青素B2标准品相似,确定其为原花青素B2的代谢产物;在代谢产物M12质谱数据中检测到相似的离子碎片m/z 579.14,比m/z 577.13大2.01,确定其为原花青素B2分子离子获得两个H所得,在其MS2中检测到m/z 291.08、289.06,确定其为原花青素B2的C环裂解后的结合产物[9];代谢产物M14~M15二级质谱中检出共同的碎片离子m/z 289.07,且其裂解规律与表儿茶素相似,确定其为表儿茶素结合型产物[8-9]。根据二级质谱数据,在SIM模式下,质荷比m/z 591.15、657.09、 689.12、673.08在不同的保留时间被检测到,说明M2、M5、M7、M9可能存在同分异构体,但是由于原花青素B2的结合位点的复杂性而无法确定[12]。
通过m/z 577.13、289.07等特征裂解片断检索,分析鉴定得到15 种原花青素B2代谢产物,包括甲基化(8 种)、磺酸化(7 种)、水合(5 种)、羟基化(1 种)、葡糖苷酸化(1 种)。表明甲基化、磺酸化和水合代谢是原花青素B2主要的结合代谢形式。且有3 种代谢产物(M13~M15)被确定为表儿茶素形式代谢产物,表明黄烷键(4β→8)的断裂是原花青素B2重要的代谢形式之一。
2.2 原花青素B2及其代谢产物组织分布分析
原花青素B2及其代谢产物组织分布见表1,原花青素B2原体(M1)在小鼠血、小肠、肝、心、肾组织中被检出;其代谢产物在血浆、肝、小肠、肾、肺、心、脑和脾中的种类分别为6、8、8、6、3、6、2、2 种。原花青素B2的结合型代谢产物在肝组织被检出种类最多,表明原花青素B2原体可直接被吸收,进入肝脏代谢,肝脏是原花青素B2结合代谢(Mr>577.13)的主要器官组织。而原花青素B2原体亦有少部分被肝组织转化,经过血液循环可能被肾组织富集后排泄。表儿茶素(M13)仅在小肠组织中被检出,表明原花青素B2在小肠中可能由于肠道微生物分解原花青素B2,发生黄烷键(4β→8)的断裂[13-15]。且水合、葡糖苷酸化、磺酸化等反应形式促进了原花青素B2的亲水性,有助于其在组织器官的分布。
原花青素B2在体内一部分被小肠直接吸收,一部分通过肠道微生物降解为单体表儿茶素后被吸收,其代谢产物形式复杂。Déprez[16]、Spencer[17]等通过体外建立小肠环境模型研究表明原花青素B2主要是通过解聚作用生成具有生物活性的表儿茶素。Baba[18]、Appeldoom[19]等采用体内实验形式表明摄入体内的原花青素B2很大部分进入小肠通过微生物作用分解为表儿茶素单体形式,进而发生脱羟基、氧化、内酯化。Shoji等[20]通过体外实验采用LC-MSn技术检测出羟基化产物,C环裂解产物,表明原花青素B2的产物不仅有解聚产物还有结合形式产物。与单体原花青素相比,原花青素B2的结合型代谢产物鲜有文献报道,仅发现原花青素B2的甲基化代谢产物[12,21-22],但磺酸化产物、葡糖苷酸化产物尚未报到,本研究发现的10 种代谢产物(M3~M12)在先前的研究鲜见报道。大量研究表明,原花青素产物的生物学活性主要来源于其代谢产物而非其原体物质[23-25],本研究分析8 种甲基化产物、7 种磺酸化产物、1 种葡糖苷酸化产物、5 种水合产物、1 种羟基化产物。其中磺酸化、葡糖苷酸化产物一般可增强其生物活性[25],可能是原花青素B2在体内起重要活化功能代谢产物的形式。研究表明原花青素B2能够降低冠心病风险[26-27],在心血管、脑等方面具有保护作用[28-30]。本研究在心、脑组织中分别检出5、 2 种代谢产物,可能这些原花青素B2代谢产物在心、脑等组织中起了重要的生理活性作用。
原花青素B2除通过黄烷键(4β→8)断裂为表儿茶素重要的吸收途径之外,原花青素B2(或结合型代谢产物)亦可以二聚体形式直接吸收,肝组织可能是原花青素B2结合代谢(Mr>577.13)的主要器官,其代谢产物具有多样性的特点,体内组织分布范围广;甲基化、磺酸化和水合代谢是原花青素B2主要的结合型产物形式。由于原花青素B2代谢产物结构复杂且丰度低、内源性物质干扰多、标准品难以获得等原因,采用HPLC-DAD-IT-TOF-MSn技术推测其代谢产物结构具有一定的局限性,代谢产物准确结构的验证还有待进一步研究。
参考文献:
[1] 赵超英, 姚小曼. 葡萄籽提取物原花青素的营养保健功能(综述)[J]. 中国食品卫生杂志, 2000(12): 38-41. DOI:10.3969/ j.issn.1004-8456.2000.06.015.
[2] BAGCHI D, GARG A, KROHN L, et al. Oxygen free radical scavenging abilities of vitamins C and vitamins E, and a grape seed proanthocyanidins extract in vitro research[J]. Communications in Molecular Pathology and Pharmacology, 1997, 95(2): 179-189. DOI: 10.1533/9781845698409.3.178.
[3] BAGCHI D, GARG A, KROHN R L, et al. Protection effects of grape seed proanthocyanidins and selected antioxidant against TPA -induced hepatic and brain lipid peroxidation and DNA fragmentation, and peritoneal macrophage activation in mice[J]. General Pharmacology, 1998, 30(5): 771-776. DOI:10.1016/S0306-3623(97)00332-7.
[4] TAUBERT D, ROESEN R, LEHMANN C, et al. Effects of low habitual cocoa intake on blood pressure and bioactive nitric oxide[J]. Jama the Journal of the American Medical Association, 2007, 298(1): 49-60. DOI:10.1001/jama.298.1.49.
[5] STOUPI S, WILLIAMSON G, VITON F, et al. In vivo bioavailability, absorption, excretion, and pharmacokinetics of [14C]proscyanidin B2in male rats[J]. Drug Metabolism and Disposition, 2010, 38(2): 287-291. DOI:10.1124/dmd.109.030304.
[6] 崔介君, 孙培龙, 马新. 原花青素的研究进展[J]. 食品科技, 2003, 28(2): 92-95. DOI:10.3969/j.issn.1005-9989.2003.02.034.
[7] ZHANG J M, BRODBELT J S. Screening flavonoid metabolites of naringin and narirutin in urine after human consumption of grape fruit juice by LC-MS and LC-MS/MS[J]. Analyst, 2004, 129: 1227-1233. DOI:10.1039/B412577K.
[8] LIANG J, XU F, ZHANG Y Z, et al. The prof i ling and identif i cation of the metabolites of (+)-catechin and study on their distribution in rats by HPLC-DAD-ESI-IT-TOF-MSntechnique[J]. Biomedical Chromatography, 2013, 28(3): 401-411. DOI:10.1002/bmc.3034.
[9] LIANG J, XU F, ZHANG Y Z, et al. The prof i ling and identif i cation of the absorbed constituents and metabolites of Paeoniae Radix rubra decoction in rat plasma and urine by the HPLC-DAD-ESI-IT-TOFMSntechnique: A novel strategy for the systematic screening and identif i cation of absorbed constituents and metabolites from traditional Chinese medicines[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 83(5): 108-121. DOI:10.1016/j.jpba.2013.04.029.
[10] 胡洪华, 蒋婷, 宋海星, 等. 四种检测法在乙腈沉淀法去除血清蛋白中的比较[J]. 中国医学导报, 2012, 9(23): 85-86. DOI:10.3969/ j.issn.1673-7210.2012.23.035.
[11] 李辰辰, 陆小腾驾, 童华荣. HPLC-Q-TOF-MS-MS测定桑葚中多酚物质[J]. 食品科学, 2015, 36(2): 101-104. DOI:10.3969/ j.issn.1008-7826.2013.03.016.
[12] STOUPI S, WILLIAMSON G, DRYNAN J W, et al. Procyanidin B2catabolism by human fecal microflora: partial characterizationof‘dimeric’ intermediates[J]. Archives of Biochemistry and Biophysics, 2010, 501: 73-78. DOI:10.1016/j.abb.2010.02.009.
[13] AURA A M. Microbial metabolism of dietary phenolic compounds in the colon[J]. Phytochemistry Reviews, 2008, 7(3): 407-429. DOI:10.1142/S0218196706002925.
[14] LAPARRA J M, SANZ Y. Interactions of gut microbiota with functional food components and nutraceuticals[J]. Pharmacological Research, 2010, 61(3): 219-225. DOI:10.1016/j.phrs.2009.11.001.
[15] GONTHIER M, CHEYNIER V, DONOVAN J L, et al. Microbial aromatic acid metabolites formed in the gut account for a major fraction of the polyphenols excreted in urine of rats fed red wine polyphenols[J]. Journal of Nutrition, 2003, 133(2): 461-467.
[16] DÉPREZ S, BREZILLON C, RABOT S, et al. Polymeric proanthocyanidins are catabolized by human colonic microf l ora into low-molecular-weight phenolic acids[J]. Journal of Nutrition, 2000, 130(11): 2733-2738.
[17] SPENCER J P, SCHROETER H, SHENOY B, et al. Epicatechin is the primary bioavailable form of the procyanidin dimers B2and B5after transfer across the small intestine[J]. Biochemical & Biophysical Research Commuications, 2001, 285: 588-593. DOI:10.1006/ bbrc.2001.5211.
[18] BABA S, OSAKABA N, NATSUME M, et al. Absorption and urinary excretion of procyanidin B2[epicatechin-(4β-8)-epicatechin] in mice[J]. Free Radical Biology and Medicine, 2002, 33(1): 142-148. DOI:10.1016/S0891-5849(02)00871-7.
[19] APPELDOOM M M, VINCKEN J P, GRUPPEN H, et al. Procyanidin dimers A1, A2, and B2are absorbed without conjugation or methylation from the small intestine of rats[J]. Journal of Nutrition, 2009, 139: 1469-1473. DOI:10.3945/jn.109.106765.
[20] SHOJI T, MASUMOTO S, MORIICHI N, et al. Apple procyanidin oligomers absorption in rats after oral administration: analysis of procyanidins in plasma using the po r ter method and high-performance liquid chromatography/tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2006, 54: 884-892. DOI:10.1021/ jf052260b.
[21] HOLT R R, LAZARUS S A, SULLARDS M C, et al. Procyanidin dimer B2[epicat echin-(4beta-8)-epicatechin] in human plasma after the consumption of a fl avanol-rich cocoa[J]. American Journal of Clinical Nutrition, 2002, 76(4): 798. DOI:10.1016/j.bbrc.2006.04.085.
[22] YAMAKOSHI J, SAITO M, KATAOKA S, et al. Procyanidin-rich extract from grape seeds prevents cataract formation in hereditary cataractous (ICR/f) mice[J]. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4983-4988. DOI:10.1021/jf0201632.
[23] MONAGAS M, URPISARDA M, SÁNCHEZPATÁN F, et al. Insights into the metabolism and microbial biotransformation of dietary fl avan-3-ols and the bioactivity of their metabolites[J]. Food & Function, 2010, 1(3): 233-253. DOI:10.1039/c0fo00132e.
[24] STOUPI S, WILLIAMSON G, DRYNAN J W, et al. A comparison of the in vitro biotransformation of (-)-epicatechin and procyanidin B2by human faecal microbiota[J]. Molecular Nutrition & Food Research, 2010, 54(6): 747-759. DOI:10.1002/mnfr.200900123.
[25] JANISCH K M, WILLIAMSON G, NEEDS P, et al. Properties of quercetin conjugates: modulation of LDL oxidation and binding to human serum albumin[J]. Free Radical Research, 2004, 38(8): 877-884. DOI:10.1080/10715760410001728415.
[26] ARTS M J, HAENEN G R, VOSS H P, et al. Masking of antioxidant capacity by the interaction of fl avonoids with protein[J]. Food Chemistry Toxicol, 2011, 39: 787-791.
[27] 汪晨净, 高明堂, 时小燕, 等. 原花青素对大鼠心肌缺血再灌注损伤的保护作用[J]. 中国临床药理学与治疗学, 2003, 8(2): 173-175.
[28] FRAGA C G, LITTERIO M C, PRINCE P D, et al. Cocoa fl avanols: effects on vascular nitric oxide and blood pressure[J]. Journal of Clinical Biochemistry and Nutrition, 2011, 48: 63-67. DOI:10.3164/jcbn.
[29] HOLT R R, HESIS C, KEM M, et al. The potential of flavanol and procyanidin intake to influence age-related vascular disease[J]. Journal of Nutrition in Gerontology & Geriatrics, 2012, 31(3): 290-323. DOI:10. 1080/21551197.2012.702541.
[30] 吴秀香, 郭荣年, 郭瑞珍, 等. 葡萄籽原花青素对肾血管性高血压大鼠血压的影响[J]. 中国病理生理杂志, 2011, 27(3): 593-595. DOI:10.3969/j.issn.1000-4718.2011.03.034.
Distribution of Procyanidin B2Metabolites in Mice
XIAO Ying, YIN Zhiting, HU Zhongzhi, LIU Taiyi, ZHOU Yiming, ZHOU Xiaoli
(Department of Food Science and Engineering, School of Perfume and Aroma Technology, Shanghai Institute of Technology, Shanghai 201418, China)
Abstract:In the present study, the metabolite prof i les of procyanidin B2in the plasma, liver, heart, spleen, lung, kidney, brain and small intestine of mice were qualitatively evaluated by high performance liquid chromatography with diode array detector coupled with electrospray ionization ion trap time-of-f l ight multistage mass spectrometry (HPLC-DAD-ESI-ITTOF-MSn). The results showed that the major conjugated metabolites included methylation metabolites (8), sulfonation metabolites (7), hydration metabolites (5) and hydroxylation metabolites (1), glucuronidation metabolite (1). Procyanidin B2was metabolized into 6, 8, 8, 6, 3, 6, 2 and 2 forms in plasma, liver, small intestine, kidney, lung, heart, brain and spleen, respectively; three forms of identif i ed metabolites were found with cleavage of interf l avanic bond. The conjugated metabolites of procyanidin B2were diverse and distributed widely in various tissues of mice. Methylation metabolites, sulfonation metabolites and hydration metabolites were dominant, and the liver was the main organ for the conjugated metabolites of procyanidin B2according to product formation (Mr>577.13). The cleavage of interf l avanic bond reaction was an important w ay that procyanidin B2is absorbed.
Key words:procyanidin B2; HPLC-DAD-ESI-IT-TOF-MSn; metabolites; tissue distribution
DOI:10.7506/spkx1002-6630-201709027
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)09-0168-05
引文格式:
肖瀛, 尹志婷, 胡中志, 等. 原花青素B2代谢产物在小鼠体内组织的分布[J]. 食品科学, 2017, 38(9): 168-172. DOI:10.7506/spkx1002-6630-201709027. http://www.spkx.net.cn
XIAO Ying, YIN Zhiting, HU Zhongzhi, et al. Distribution of procyanidin B2metabolites in mice[J]. Food Science, 2017, 38(9): 168-172. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201709027. http://www.spkx.net.cn
收稿日期:2016-05-09
基金项目:国家自然科学基金青年科学基金项目(31401504)
作者简介:肖瀛(1981—),男,副教授,博士,研究方向为分子与应用营养学、食品生物化学。E-mail:y-xiaomn@163.com