邵佩兰1,徐 明2,郭晓丹1,郑安然1,周华佩1,李宛陶1
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学生命科学学院,宁夏 银川 750021)
摘 要:探讨红枣色素对H2O2诱导人血管内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤的保护作用。体外培养HUVECs,随机分为6 组:空白对照组、H2O2损伤组、红枣色素低、中、高剂量组(50、150、250 mg/L红枣色素)和阳性对照组(50 μmol/L VE),采用显微镜观察细胞形态,四甲基偶氮盐法检测细胞增殖活力,试剂盒法测定乳酸脱氢酶(lactate dehydrogense,LDH)活性,流式细胞仪检测细胞凋亡率和线粒体膜电位水平,透射电子显微镜观察细胞超微结构。结果表明,红枣色素可保护H2O2对HUVECs的损伤作用,能明显改善受损细胞形态、超微结构,显著降低细胞增殖抑制率、LDH活性、细胞凋亡率,明显提高线粒体膜电位水平(P<0.05),且存在明显的剂量依赖关系。由此推断,红枣色素对氧化应激诱导血管内皮细胞损伤具有一定的保护作用,其机制可能与其抗氧化、抑制细胞凋亡和维持线粒体膜电位有关。
关键词:红枣色素;血管内皮细胞;过氧化氢;凋亡;线粒体膜电位
随着人们生活习惯及饮食文化的改变,心脑血管疾病的发病率逐年上升且趋于年轻化。血管内皮细胞是组织和血液间的屏障,具有维持血管张力、参与血液循环、调节血压等作用,而血管内皮细胞损伤是引起高血压和动脉粥样硬化等心脑血管疾病发病的关键因素[1-2]。血管内皮细胞损伤多与氧化应激有关,当其长时间处于氧化应激状态时就会诱导细胞内活性氧(reactive oxygen,ROS)生成,进而导致血管内皮细胞损伤和功能障碍[3-5],因此如何保护氧化损伤血管内皮细胞的功能对防治心脑血管疾病具有重要意义。红枣色素是从加工枣汁的废弃枣渣中提取的一种含有黄酮类化合物的水溶性红色素[6-7],色泽鲜艳、安全无毒,且具有一定止泻、抗菌、抗癌、抗病毒等功能[8]。鲁晓翔[9]研究发现黄酮类化合物具有很强的抗氧化作用,赵文恩等[10]用铁离子还原能力(ferric reducing antioxidant power,FRAP)法测定大枣枣皮红色素的总抗氧化能力, 李勇[11]研究表明大枣枣皮红色素对超氧阴离子自由基和亚硝酸根离子具有较好的清除作用,本课题组前期研究[12-14]发现红枣色素体外清除超氧阴离子自由基、羟自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基及NO-2能力实验结果表明,红枣色素具有较强的抗氧化作用,但红枣色素对血管内皮细胞的作用尚不清楚。本研究采用红枣色素干预H2O2诱导损伤的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)模型,探讨红枣色素对氧化应激损伤细胞的保护作用及可能作用机制。
1.1 材料与试剂
红枣色素由本课题组以枣皮为原料,采用碱法提取,经LX-60大孔树脂分离、纯化,其色价为23.01。HUVECs 南京凯基生物技术有限公司。
1640培养基、新生胎牛血清 美国Gibco公司;胰蛋白酶、Tans Detect Annexin V-FITC/PI细胞凋亡检测试剂盒 南京凯基生物技术有限公司;四甲基偶氮盐(methyl thiazolyl tetrazolium,MTT)、二甲基亚矾(dimethyl sulfoxide,DMSO) 美国Sigma公司;乳酸脱氢酶(lactate dehydrogense,LDH)试剂盒 南京建成生物技术研究所;JC-1线粒体膜电位检测试剂盒 上海碧云天生物技术有限公司;其余试剂均为分析纯。
1.2 仪器与设备
680全自动酶标仪 美国Bio-Rad公司;AE31EFINV倒置显微镜 日本Motic公司;CO2细胞培养箱日本Sanyo公司;C6型流式细胞仪 美国Beckman公司;H7650B透射电子显微镜 日本日立公司。
1.3 方法
1.3.1 细胞培养及分组
以含10%胎牛血清的1640培养液于37 ℃、5% CO2条件下培养HUVECs,待细胞至80%融合时,加入0.25%胰蛋白酶消化,吹打,制成细胞悬液,接种于96 孔板。实验设空白对照组、H2O2损伤组(1.0 mmol/L H2O2)、红枣色素低、中、高剂量组(50、150、250 mg/L红枣色素+1.0 mmol/L H2O2),阳性对照组(50 μmol/L VE+1.0 mmol/L H2O2),每组均设6 个复孔[15]。
1.3.2 细胞形态学观察
细胞以1×105个/mL接种于96 孔板,每孔100 μL,培养24 h后,按1.3.1节实验分组干预处理,继续孵育24 h,于倒置显微镜下观察细胞形态变化及生长状况。
1.3.3 MTT法检测细胞增殖
细胞按实验分组处理后,每孔加入5 mg/mL的MTT 15 μL,继续培养4 h,1 000 r/min离心5 min弃上清液,加入DMSO 150 μL,振荡10 min,放入酶标仪在570 nm波长处测定OD值,并按式(1)计算细胞增殖抑制率[16]。
1.3.4 LDH活性测定
细胞按实验分组处理,收集细胞培养液,按照LDH试剂盒说明书操作步骤测定LDH活性。
1.3.5 流式细胞仪检测细胞凋亡
用0.25%胰蛋白酶消化各处理组细胞,预冷的磷酸盐缓冲液洗涤2 次、1 000 r/min离心5 min,用50 μL磷酸盐缓冲液将细胞制成单细胞悬液,移入l mL冷70%乙醇中固定,PI染色,用流式细胞仪检测分析各组细胞凋亡率[17-18]。
1.3.6 线粒体膜电位测定
采 用JC-1法[19]检测。按实验分组处理细胞,收集细胞培养液,加入阳离子脂质荧光染料JC-1,37 ℃孵育30 min,流式细胞仪检测细胞的荧光强度。线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,产生红色荧光;线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,产生绿色荧光。用红绿荧光强度的比值,反映血管内皮细胞线粒体膜电位的水平。
1.3.7 细胞超微结构观察
按实验分组处理细胞,离心收集细胞,磷酸盐缓冲液漂洗2 次,2.5%戊二醛固定1 h,用二甲砷酸钠缓冲溶液漂洗将戊二醛洗净,加入1%锇酸固定2 h,用体积分数30%、50%、70%、80%、90%、100%乙醇洗脱,环氧树脂包埋,超薄切片,醋酸铀和柠檬酸铅双重染色,透射电子显微镜观察。
1.4 统计学处理
采用SPSS 18.0软件对数据进行统计分析,实验结果以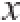 ±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2.1 红枣色素对H2O2损伤HUVECs形态的影响

图1 红枣色素对HH2O2损伤血管内皮细胞形态的影响(×110000)
Fig.1 Effect of Chinese red jujube pigment on morphology of HUVECs damaged by H2O2(× 100)
由图1可知,倒置显微镜下观察空白对照组细胞数目多,生长状态良好,贴壁较牢,细胞间连接紧密,细胞为多角形或梭形,大小均匀,边界清楚,呈铺路石状镶嵌排列,胞浆丰富,胞核圆形或椭圆形,位于细胞中央。H2O2损伤组细胞数目明显减少,细胞形态出现明显变化,细胞皱缩变圆,胞体变小,细胞膜不光滑,出现明显的毛边或有缺损,胞核变小,其核不圆或不在中央,细胞质皱缩,胞内结构模糊,细胞彼此连接减少,出现明显脱落现象。与H2O2损伤组比较,红枣色素低剂量组细胞数目略增多,细胞形态有所改善,细胞边界较清楚,部分细胞呈梭形或多角形、胞核圆形或椭圆形,位于细胞中央,细胞排列较有序,细胞间连接有所增加,但细胞脱落仍较明显。红枣色素中、高剂量组细胞数目明显增多,细胞形态明显好转,细胞排列有序,大部分细胞呈梭形或多角形,细胞间连接较为紧密,形态逐渐趋于正常,表明红枣色素能明显改善H2O2诱导损伤的HUVECs形态。
2.2 红枣色素对H2O2损伤HUVECs增殖的影响
表1 红枣色素对HH2O2损伤血管内皮细胞增殖的影响(n==66)
Table1 Effect of Chinese red jujube pigment on the proliferation of HUVECs damaged byy HH2O2((n == 66))
注:##.与空白对照组比较差异极显著(P<0.01);*.与H2O2损伤组比较差异显著(P<0.05);**.与H2O2损伤组比较差异极显著(P<0.01)。下同。
H2O2是一种常用的细胞氧化应激诱导剂,可直接作用于细胞膜脂质,造成脂质过氧化反应,致使细胞膜损伤[20]。MTT是一种检测细胞存活和增殖的方法,通过细胞活力(OD值)的变化直接反映活细胞的数量和活性[21-22],从而反映细胞受损情况。由表1可知,与空白对照组比较,H2O2诱导后HUVECs增殖活性下降,增殖抑制率明显增加(P<0.01);与H2O2损伤组比较,红枣色素能不同程度提高其增殖活性,当色素质量浓度为150 mg/L时,HUVECs增殖抑制率极显著下降(P<0.01),且随质量浓度增加,抑制作用增强,说明红枣色素能抑制细胞增殖活性下降,这一结果与李勇[11]采用细胞计数法研究大枣枣皮红色素对K562白血病细胞增殖的抑制作用结果相一致,提示红枣色素对H2O2致HUVECs损伤有保护作用。
2.3 红枣色素对H2O2损伤HUVECs LDH活性的影响
表2 红枣色素对HH2O2损伤血管内皮细胞LDH活力的影响(n==66)
Table2 Effect of Chinese red jujube pigment on LDH activity of HUVECs damaged byy HH2O2((n == 66))
LDH是胞浆酶,存在于细胞内,细胞损伤时细胞膜通透性增加,LDH就会漏到细胞外,其漏出量可反映细胞膜结构的完整性和氧化损伤程度[23-24]。结果显示(表2),H2O2损伤处理后,HUVECs的LDH漏出量较空白对照组极显著增加(P<0.01),其LDH活力达(130.28±0.43)U/L。与H2O2损伤组比较,红枣色素中、高剂量组培养液中LDH活力极显著降低(P<0.01),且呈质量浓度依赖性,表明红枣色素能够拮抗H2O2对HUVECs的氧化损伤,具有抑制氧化损伤的能力。
2.4 红枣色素对H2O2损伤HUVECs凋亡的影响
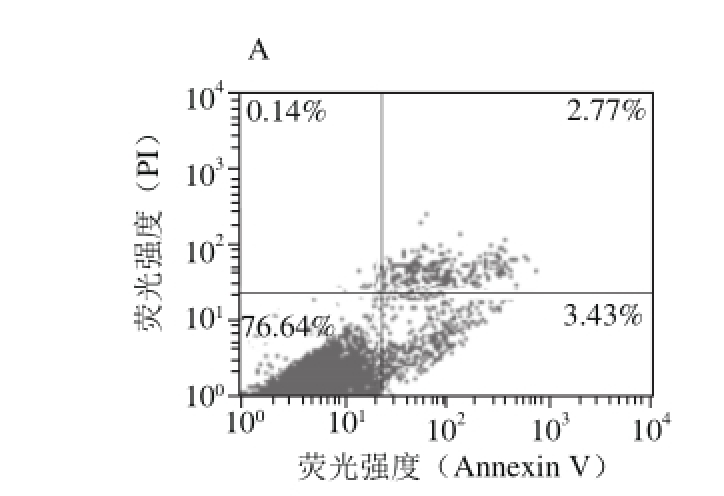

图2 红枣色素作用后流式细胞仪检测的HUVECs凋亡
Fig.2 Apoptosis of HUVECs detected by FCM after treatment with Chinese red jujube pigment
表3 红枣色素对HH2O2损伤血管内皮细胞凋亡率的影响(n=6)
T
Taabbllee 33 EEffffeecctt ooff CChhiinneessee rreedd jjuujjuubbee ppiiggmmeenntt oonn aappooppttoossiiss rraattee ooff HUVECs damaged byy HH2O2((n == 66))
流式细胞仪检测细胞凋亡是目前最可靠且常用的实验方法[25]。细胞凋亡早期的细胞结构变化比较轻微,通过干预仍能逆转细胞的功能。检测结果(图2、表3)发现H2O2诱导的细胞凋亡率显著高于空白对照组(P<0.05),经红枣色素各剂量组预处理,细胞凋亡率较H2O2损伤组显著下降(P<0.05,P<0.01),且随色素剂量的增加,凋亡率降低越明显,其中250 mg/L剂量使凋亡率从7.98%降低到3.84%。根据选定的细胞群,也发现红枣色素对H2O2诱导的氧化损伤具有明显的保护作用,能显著降低细胞凋亡率,且呈一定的剂量-效应关系,提示红枣色素对H2O2诱导的HUVECs凋亡具有抑制作用。结果也证实氧化应激可诱导细胞凋亡,且二者关系十分密切[26]。
2.5 红枣色素对H2O2损伤HUVECs线粒体膜电位水平的影响线粒体膜电位(ΔΨm)的正常维持是线粒体进行氧化磷酸化产生ATP的先决条件。实验证实,ROS生成过多会造成线粒体膜的脂质过氧化损伤,降低线粒体膜电位[27-28],而线粒体膜电位下降是线粒体调控的凋亡过程中最早期的特异性改变[19,29]。由表4可知,与空白对照组比较,H2O2损伤组细胞线粒体膜电位水平极显著降低(P<0.01);与H2O2损伤组比较,红枣色素各剂量组细胞线粒体膜电位水平明显高于H2O2损伤组(P<0.05,
表4 红枣色素对HH2O2损伤血管内皮细胞线粒体膜电位水平
的影响(n=6)
Table4 Effect of Chinese red jujube pigment on mitochondrial membrane potential in HUVECs damaged by H2O2 ( (n = 6)
P<0.01),且存在剂量依赖性。结果说明H2O2可明显损伤线粒体膜,导致线粒体膜电位降低,用红枣色素预处理HUVECs,可拮抗H2O2对线粒体膜的脂质过氧化反应,有利于维持线粒体膜电位水平。
2.6 红枣色素对H2O2损伤血管内皮细胞超微结构的影响

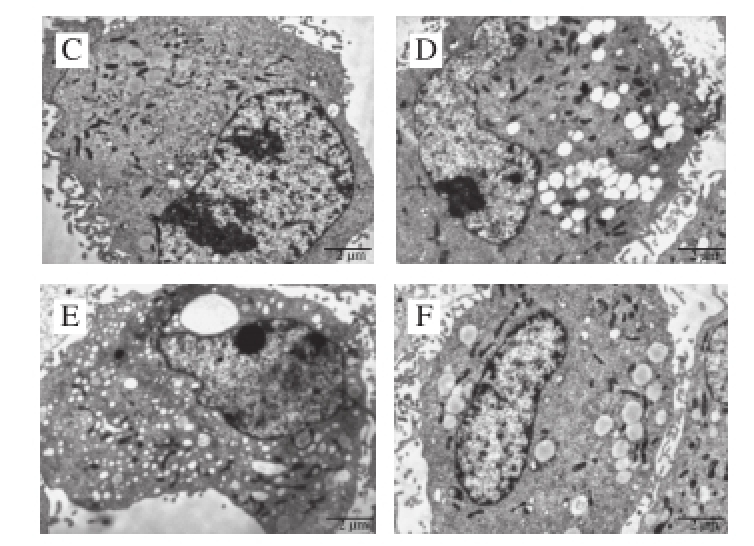
图3 红枣色素对HH2O2损伤血管内皮细胞超微结构的影响(×1 550000)
Fig.3 Effect of Chinese red jujube pigment on ultrastructure of HUVECs damaged by H2O2(× 1 500)
透射电子显微镜结果(图3)显示空白对照组细胞形状呈规则梭形,表面光滑,细胞膜边界清楚、完整,表面微绒毛丰富,分布均匀;细胞内可见圆形或卵圆形细胞核,形态规则,核膜清晰,胞核及核仁较大,核仁清晰,核染色质分布均匀,常染色质丰富,异染色质少;细胞质内细胞器丰富,线粒体呈椭圆形或长圆短棒状、数量多且密,粗面内质网充填于胞浆中、平行折叠成扁平管状;细胞间隙小,连接紧密。H2O2损伤组细胞结构呈现明显的损伤状态,细胞收缩变小,少量细胞皱缩为椭圆形或球形,或有突起,细胞膜表面有破损,微绒毛分布不规则,缩短、减少或消失;细胞核浓缩变形多呈不规则状,核膜结构不明显,有凹陷,且部分核膜破裂,核仁变小或消失,核染色质固缩,异染色质增多,常染色质减少;细胞质内线粒体、高尔基复合体等细胞器明显减少,线粒体分布不均匀、外形不规则,高尔基复合体少见,粗面内质网数量少,折叠不明显,囊泡少且短,空泡多;细胞间隙增大,细胞间连接明显减少。红枣色素低剂量组细胞收缩,细胞膜完整性受到破坏,表面微绒毛不丰富,分布不均匀;细胞核浓缩变形,核膜结构较明显,有凹陷,核仁小,染色质固缩;细胞质内线粒体、粗面内质网等细胞器较少;细胞间隙较大,但细胞间连接仍紧密。红枣色素中、高剂量组和阳性对照组细胞形态结构较规则,表面较平滑,细胞膜较为完整、光滑,伸展良好,微绒毛较多;细胞核及核仁结构从不规则变得越来越规则,染色质均匀;细胞质内线粒体、粗面内质网等细胞器较空白对照组少;细胞间隙较空白对照组增大,但细胞间连接充分,可见红枣红色素能明显改善H2O2诱导血管内皮细胞损伤的受损情况。
氧化应激被认为是导致内皮细胞损伤的主要病理因素,它可使细胞膜上不饱和脂肪酸发生脂质过氧化、蛋白质和核酸变性,产生大量脂质过氧化产物,破坏细胞膜通透性和完整性,导致内皮细胞不可逆损伤而影响细胞的正常代谢和生理功能。H2O2是机体产生的活性氧,可在细胞外诱导细胞凋亡,且极易通过细胞膜进入细胞,在氧化应激状态下能分解成具有高活性羟自由基,引发细胞膜中不饱和脂肪酸发生过氧化,使细胞膜结构破坏、通透性增加,导致细胞结构损伤。本实验发现,H2O2诱导后血管内皮细胞形态、超微结构受损,细胞活力显著下降,LDH漏出明显增多,细胞凋亡率明显增加,线粒体膜电位水平明显降低,表明H2O2能显著抑制血管内皮细胞的抗氧化能力,增加细胞膜和线粒体膜通透性,引发细胞发生氧化应激,进而导致细胞凋亡增加、细胞活力降低、形态结构受损,进一步说明H2O2可通过氧化应激诱导血管内皮细胞损伤。
红枣色素是一种含有黄酮类化合物的水溶性红色素,而黄酮类化合物是植物代谢过程中产生的一类重要有机化合物,具有清除自由基、抗脂质氧化、抗炎等作用[9]。文献报道,具有抗氧化活性的植物能够抑制血管内皮细胞的损伤[30]。实验结果显示,红枣色素干预处理能逆转细胞增殖活性下降,减少LDH漏出,降低细胞凋亡率,提高线粒体膜电位水平,改善受损细胞形态、结构,表明红枣色素能改善H2O2诱导损伤细胞的形态、结构和生长增殖状态,阻断自由基对内皮细胞的损伤,减少细胞膜结构破坏,抑制细胞凋亡,拮抗H2O2对线粒体膜的氧化损伤,对H2O2诱导的血管内皮细胞损伤具有保护作用。
综上所述,红枣色素减轻氧化应激对血管内皮细胞损伤的保护作用机制可能与其清除氧自由基、抑制细胞增殖活性下降、抑制细胞凋亡、维持内皮细胞增殖和凋亡的平衡、阻断线粒体过氧化损伤有关,但其具体机制还需进一步研究。
参考文献:
[1] RIBEIRO F, ALVES A J, TEIXEIRA M, et al. Endothelial function and atherosclerosis: circulatory markers with clinical usefulness[J]. Revista Portuguesa de Cardiologia, 2009, 28(10): 1121-1151.
[2] PAPEZIKOVA M, PEKAROVA H, KOLAIOVA A, et al. Uric acid modulates vascular endothelial function through the down regulation of nitric oxide production[J]. Free Radical Reseach, 2013, 47(2): 82-88. DOI:10.3109/10715762.2012.747677.
[3] HULSMANS M, DOOREN E V, HOLVOET P. Mitochondrial reactive oxygen species and risk of atherosclerosis[J]. Current Atherosclerosis Reports, 2012, 14(3): 264-276. DOI:10.1007/s11883-012-0237-0.
[4] FEDERICO A, CARDAIOLI E, POZZO P D, et al. Mitochondria, oxidative stress and neurodegeneration[J]. Journal of the Neurological Sciences, 2012, 322(1/2): 254-262. DOI:10.1016/j.jns.2012.05.030.
[5] LI H G, HORKE S, FORSTERMANN U. Oxidative stress in vascular disease and its pharmacological prevention[J]. Trends in Pharmacological Sciences, 2013, 34(6): 313-319. DOI:10.1016/ j.tips.2013.03.007.
[6] 马奇虎. 枣皮红色素的提取、纯化及稳定性研究[D]. 银川: 宁夏大学, 2014: 35-36.
[7] ZHANG Qiong, SHEN Guangning, WANG Shuzhen, et al. Identification of pigments from jujube fruit skin[J]. 农业科学与技术, 2010, 11(4): 110-112; 183. DOI:10.16175/ j.cnki.1009-4229.2010.04.033.
[8] 向延菊, 王大伟. 利用微波技术提取红枣色素工艺研究[J]. 保鲜与加工, 2010, 10(1): 45-47. DOI:10.3969/j.issn.1009-6221.2010.01.014.
[9] 鲁晓翔. 黄酮类化合物抗氧化作用机制研究进展[J]. 食品研究与开发, 2012, 33(3): 220-224. DOI:10.3969/j.issn.1005-6521.2012.03.064.
[10] 赵文恩, 李茜倩. FRAP法测定大枣枣皮红色素的总抗氧化能力[J]. 郑州大学学报(工学版), 2011, 32(3): 28-30. DOI:10.3969/ j.issn.1671-6833.2011.03.007.
[11] 李勇. 大枣枣皮红色素的分离、生物活性及稳定性的研究[D]. 郑州: 郑州大学, 2013: 39-43.
[12] 郑安然, 邵佩兰, 郭晓丹, 等. 枣皮红色素结构初步鉴定及抗氧化活性研究[J]. 食品科技, 2016, 41(11): 230-235. DOI:10.13684/j.cnki. spkj.2016.11.050.
[13] 邵佩兰, 徐明, 郭晓丹, 等. 红枣色素中活性成分含量与抗氧化活性的相关性[J]. 食品工业科技, 2016, 37(17): 171-174. DOI:10.13386/ j.issn1002-0306.2016.17.025.
[14] 郑安然, 邵佩兰, 郭晓丹, 等. 提取方法对红枣色素抗氧化活性的影响[J]. 北方园艺, 2016(23): 129-133. DOI:10.11937/bfyy.201623029.
[15] 王宇霆, 周海燕, 吕小翠. 白藜芦醇对过氧化氢氧化应激损伤人脐静脉血管内皮细胞的保护作用[J]. 中华医学杂志, 2013, 93(15): 1174-1177. DOI:10.3760/cma.j.issn.0376-2491.2013.15.015.
[16] LI Zilin, LIU Jincheng, HU Jing, et al. Protective effects of hyperoside against human umbilical vein endothelial cell damage induced by hydrogen peroxide[J]. Journal of Ethnopharmacology, 2012, 139(2): 388-394. DOI:10.1016/j.jep.2011.11.020.
[17] SHEN Yafen, WU Xin, CAO Gang, et al. Effect of 5-HMF on protection of hydrogen peroxide-induced injury in human umbilical vein endothelial cells[J]. Journal of Chinese Pharmaceutical Sciences, 2015, 24(3): 164-168. DOI:10.5246/jcps.2015.03.020.
[18] WANG L, HAO Q, WANG Y D, et al. Protective effects of dehydroepiandrosterone on atherosclerosis in ovariectomized rabbits via alleviating inflammatory injury in endothelial cells[J]. Atherosclerosis, 2011, 214(1): 47-57. DOI:10.1016/ j.atherosclerosis.2010.07.043.
[19] 唐香, 程训民, 江时森, 等. 替米沙坦对糖尿病大鼠心肌线粒体膜电位及心肌细胞凋亡的作用[J]. 解放军医学杂志, 2010, 35(7): 792-779.
[20] RAMOS J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells[J]. International Journal of Biochemistry & Cell Biology, 2008, 40(12): 2707-2719. DOI:10.1016/ j.biocel.2008.04.009.
[21] 徐春华. MTT法检测大豆异黄酮对癌细胞的生长抑制作用[J]. 中央民族大学学报(自然科学版), 2012, 21(1): 58-62. DOI:10.3969/ j.issn.1005-8036.2012.01.014.
[22] 宋欢欢. ICA对H2O2诱导的血管内皮细胞内质网应激损伤的拮抗作用及机制[D]. 西安: 第四军医大学, 2014: 23-26.
[23] 杨阳, 段维勋, 金振晓, 等. 姜黄素对血管内皮细胞过氧化氢损伤的保护作用及其机制研究[J]. 中国体外循环杂志, 2012, 9(4): 239-242. DOI:10.3969/j.issn.1672-1403.2011.04.015.
[24] 洪浩, 傅淑平, 偶晨, 等. 梓醇对高糖所致血管内皮细胞损伤的保护作用[J]. 世界科学技术(中医药现代化), 2015, 17(4): 846-849. DOI:10.11842/wst.2015.04.016.
[25] 贾国荣, 俞小瑞, 李红波, 等. 应用流式细胞术检测17β-雌二醇对H2O2诱导的视网膜神经细胞凋亡的保护作用[J]. 西安交通大学学报(医学版), 2008, 29(1): 47-50.
[26] QIANG Hui, WANG Kunzheng, ZHANG Chen, et al. Panax notoginseng saponins protect rabbit bone marrow stromal cells against hydrogen peroxide-induced apoptosis[J]. Journal of Chinese Integrative Medicine, 2010, 8(2): 131-137. DOI:10.3736/jcim20100207.
[27] BYUN C H, KOH J M, KIM D K, et al. Alpha-lipoic acid inhibits TNF-alpha-induced apoptosis in human bone marrow stromal cells[J]. Journal of Bone and Mineral Research: the Official Journal of the American Society for Bone and Mineral Research, 2005, 20(7): 1125-1135.
[28] 李妍, 赵东海, 张巍, 等. 柴胡皂苷d对人神经母细胞瘤SH-SY5Y细胞线粒体膜电位及细胞凋亡的影响[J]. 上海中医药杂志, 2016, 50(6): 90-93. DOI:10.16305/j.1007-1334.2016.06.028.
[29] LEE Y, GUSTAFSSON A B. Role of apoptosis in cardiovascular disease[J]. Apoptosis, 2009, 14(4): 536-548. DOI:10.1007/s10495-008-0302-x.
[30] YANG J, HAN Y, CHEN C, et al. EGCG attenuates high glucoseinduced endothelial cell inflammation by suppression of PKC and NF-κB signaling in human umbilical vein endothelial cells[J]. Life Sciences, 2013, 92(10): 589-597. DOI:10.1016/j.lfs.2013.01.025.
Protective Effect of Chinese Red Jujube Pigment on Vascular Endothelial Cell Injury Induced by Hydrogen Peroxide
SHAO Peilan1, XU Ming2, GUO Xiaodan1, ZHENG Anran1, ZHOU Huapei1, LI Wantao1
(1. College of Agriculture Science, Ningxia University, Yinchuan 750021, China; 2. College of Life Science, Ningxia University, Yinchuan 750021, China)
Abstract:This research was designed to explore the protective effect of Chinese red jujube pigment (CRJP) on human vascular endothelial cell injury induced by oxidative hydrogen in vitro. For this purpose, human vascular endothelial cells were cultured in vitro and randomly divided into 6 groups: control group, oxidative hydrogen injury group, CRJP low-, medium- and high-dose groups (50, 150, 250 mg/L), and positive control group (50 μmol/L VE). Cellular morphology, proliferation viability, LDH activity, apoptosis rate, mitochondrial membrane potential and ultrastructure of all groups were determined by inverted microscope, MTT assay, kit assay, flow cytometry and transmission electron microscope, respectively. The results showed that CRJP treatment at various doses had a protective effect on vascular endothelial cell injury induced by oxidative hydrogen. Cellular morphology and ultrastructure of the CRJP intervention groups were improved obviously along with a signif i cant decrease in proliferation inhibition rate, LDH activity and apoptosis rate and a signif i cant increase in mitochondrial membrane potential (P < 0.05) in a dose-dependent manner. These results indicate that Chinese red jujube pigment has a protective effect on human vascular endothelial cell injury induced by oxidative hydrogen in vitro and the underlying mechanism may be related to its antioxidant capacity, and its ability to inhibit apoptosis and maintain mitochondrial membrane potential.
Key words:Chinese red jujube pigment; vascular endothelial cells; oxidative hydrogen; apoptosis; mitochondrial membrane potential
DOI:10.7506/spkx1002-6630-201709028
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)09-0173-06
引文格式:
邵佩兰, 徐明, 郭晓丹, 等. 红枣色素对H2O2诱导血管内皮细胞损伤的保护作用[J]. 食品科学, 2017, 38(9): 173-178. DOI:10.7506/spkx1002-6630-201709028. http://www.spkx.net.cn
SHAO Peilan, XU Ming, GUO Xiaodan, et al. Protective effect of Chinese red jujube pigment on vascular endothelial cell injury induced by hydrogen peroxide[J]. Food Science, 2017, 38(9): 173-178. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201709028. http://www.spkx.net.cn
收稿日期:2016-04-15
基金项目:国家自然科学基金地区科学基金项目(31260375);宁夏自治区级大学生创新创业训练计划项目(20150123)
作者简介:邵佩兰(1963—),女,教授,学士,研究方向为食品化学与营养、天然产物提取及应用。E-mail:nxshpl@163.com