赵 月,李 荣,姜子涛*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘 要:采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetr azolium bromide,MTT)法评价栽培菊苣籽总黄酮对小鼠巨噬细胞RAW264.7的毒性。从总抗氧化能力、清除2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基(2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt cation radical,ABTS+·)能力、清除O2-·能力以及抑制Fe2+诱发的卵黄脂蛋白脂质过氧化能力4 个方面评价栽培菊苣籽总黄酮的抗氧化活性,并与常见的抗氧化剂VC和叔丁基对苯二酚(tertbutylhydroquinone,TBHQ)作比较。之后采用高效液相色谱(high-performance liquid chromatography,HPLC)法对栽培菊苣籽总黄酮中清除·OH的活性成分进行了识别。MTT实验结果显示,菊苣籽总黄酮质量浓度为1 mg/mL时,对RAW264.7细胞具有一定的毒性,而当其质量浓度适当减小后,则基本无毒性。抗氧化实验结果表明:栽培菊苣籽总黄酮的总抗氧化活性和清除ABTS+·的能力弱于VC和 TBHQ,但在低质量浓度时,其总抗氧化活性与TBHQ非常接近;在清除O2-·方面,活性由强到弱为VC>菊苣籽总黄酮>TBHQ;在抑制卵黄脂蛋白脂质过氧化实验中,栽培菊苣籽总黄酮强于VC,但弱于TBHQ。HPLC法结果显示,绿原酸比洋蓟素具有更高的清除·OH的活性,且二者对·OH的清除率分别为66.42%和46.00%。
关键词:栽培菊苣籽总黄酮;MTT分析;清除·OH活性;识别
菊科菊苣属草本植物栽培菊苣(Cichorium endivia L.),别名苦苣、苦菊等,是一种具有轻微苦味的绿叶蔬菜[1]。目前已有研究报道该蔬菜茎叶中提取物具有保肝[2]和抗氧化[3-4]等作用,这与其中含有的酚酸、黄酮类化合物等成分有关[5-7]。陈超杰等[8]研究发现苦菊乙酸乙酯提取物具有清除自由基的活性及还原能力,而且可抗自由基引起的兔血红细胞损伤。陈超杰等[9]还发现苦菊提取物可抑制H2O2致人肝癌(liver hepatocellular carcinoma,HepG2)细胞损伤,其抗氧化机制可能与激活细胞内Nrf2-ARE通路相关的抗氧化防御系统有关。这些研究表明栽培菊苣具有较好的抗氧化活性和一定的药用功效,具有潜在的药用价值,但目前仍鲜见有关栽培菊苣籽提取物细胞毒性的报道。
前人利用响应面法优化了超声-微波协同萃取栽培菊苣籽总黄酮的条件,利用高效液相色谱(highperformance liquid chromatography,HPLC)法鉴定总黄酮中的2 个主要成分,并采用离线1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)-HPLC法证明了洋蓟素比 绿原酸对DPPH自由基具有更强的清除活性[10]。本研究通过3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)法评价了菊苣籽总黄酮对巨噬细胞RAW264.7的毒性,然后,采用4 种化学方法,针对前期利用超声-微波协同萃取仪提取并经大孔树脂纯化后得到的较纯净的栽培菊苣籽总黄酮,与两种合成的食用抗氧化剂进行了体外抗氧化及清除自由基性能的比较,较为全面地评价了菊苣籽总黄酮的抗氧化效果。同时,采用HPLC结合·OH对栽培菊苣籽黄酮混合物中的抗氧化活性成分进行了识别。以期在一定程度上为栽培菊苣籽总黄酮的体外实验研究及其资源的开发利用提供有价值的参考。
1.1 材料与试剂
栽培菊苣籽购自天津蓟县,粉碎后过40 目筛备用。
2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS) 美国Sigma公 司;过硫酸钾、叔丁基对苯二酚(tert-butylhydroquinone,TBHQ)上海阿拉丁试剂公司;抗坏血酸(VC) 天津市北联精细化学品开发有限公司;小鼠巨噬细胞RAW264.7江苏齐氏生物科技有限公司;胎牛血清(fetal bovine serum,FBS) 浙江天杭生物科技有限公司;DMEM高糖培养基 美国Hyclone公司;MTT试剂 中国医学科学院血液研究所科技公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 天津市化学试剂一厂;水为除氧蒸馏水,无水乙醇、磷酸钠等其他试剂均为分析纯。
1.2 仪器与设备
HERAcell 240i CO2培养箱 美国Thermo公司;DS-5MC倒置荧光显微镜 日本Nikon公司;SpectraMax M5多功能读板机 美国Molecular Devices公司;FHC-1200A生物安全柜 美国Frontline公司;Alpha-1500紫外-可见分光光度计 上海谱元仪器有限公司;Lambda25紫外-可见分光光度计 珀金埃尔默仪器有限公司;FD-5冷冻干燥机 北京博医康实验仪器有限公司;DH4000BⅡ电热恒温培养箱 天津市泰斯特仪器有限公司;DK-S12型电热恒温水浴锅 上海森信实验仪器有限公司;AUY120万分之一电子天平 日本岛津公司。
1.3 方法
1.3.1 栽培菊苣籽总黄酮的提取及分离
按照文献[10]的方法,提取并纯化分离出栽培菊苣籽黄酮,冻干成粉末,放于干燥器中备用。
1.3.2 黄酮对RAW264.7细胞毒性的测定
1.3.2.1 溶液的配制
栽培菊苣籽黄酮溶液:准确称取0.005 0 g栽培菊苣籽黄酮粉末,用无血清培养基溶解,并配成1 mg/mL的溶液,用0.22 μm无菌针头滤器过滤以除菌,4 ℃保存。实验前用培养基稀释。
5 mg/mL MTT溶液:准确称取0.025 0 g MTT,用5 mL磷酸盐缓冲液(phosphate buffer saline,PBS)溶解,并用0.22 μm无菌针头滤器过滤除菌,4 ℃避光保存备用。
1.3.2.2 细胞毒性的测定
参考文献:[11-15]的方法稍作修改。取对数生长期的RAW264.7细胞,以每孔100 μL的接种量、约1×105个细胞的接种密度,接种于白色透明96 孔板中央,四周用100 μL PBS补充,在37 ℃、5% CO2培养箱中培养24 h,使其贴壁生长。24 h后,吸去培养基,加入100 μL不同质量浓度的栽培菊苣籽总黄酮溶液(1、10、100、500、1 000 μg/mL),每个质量浓度设6 个复孔,于37 ℃、5% CO2培养箱中培养24 h。之后,每孔加入20 μL MTT溶液(5 mg/ mL),再继续于37 ℃、5% CO2培养箱中培养4 h,之后小心吸去孔内液体,在每孔中加入1 50 μL DMSO,然后将96 孔板置于低速振荡器上振荡约10 min以溶解结晶物,在570 nm波长处测定各孔的OD值。本实验中设置空白组和对照组,其中,空白组不接种细胞,也不加黄酮溶液,均以培养基代替,其他处理相同;对照组接种细胞,黄酮溶液用培养基代替,其他步骤相同。按照公式(1)计算各质量浓度菊苣籽黄酮作用下的RAW264.7细胞存活率。
1.3.3 栽培菊苣籽总黄酮抗氧化活性的测定
1.3.3.1 抗氧化剂溶液的配制
称取少量栽培菊苣籽黄酮粉末,溶于30%乙醇溶液中,配成1 mg/mL的储备液。同时,配制相同质量浓度的VC和TBHQ储备液,4 ℃保存,备用。
1.3.3.2 栽培菊苣籽总黄酮总抗氧化能力的测定
参考文献[16-17]的磷钼络合物法并稍作改动。将栽培菊苣籽黄酮、VC、TBHQ储备液分别稀释成质量浓度为0.10、0.15、0.20、0.25、0.30 mg/mL的样品液。于一系列10 mL比色管中分别加入0.4 mL上述不同质量浓度的各样品液、4.0 mL磷钼试剂(终浓度为0.6 mol/L H2SO4、4.0 mmol/L钼酸铵、28 mmol/L磷酸钠),迅速摇匀后置于95 ℃恒温水浴90 min,于695 nm波长处测定各管的吸光度A695nm,各质量浓度平行测定3 次,取平均值。
1.3.3.3 栽培菊苣籽总黄酮对ABTS+·清除能力的测定
参考文献[18-20]的方法并稍加改进。将7.4 mmol/L的ABTS溶液与2.6 mmol/L的过硫酸钾溶液等体积混合均匀,在室温条件下避光保存16 h,即得到ABTS+·储备液,使用前用无水乙醇将其稀释至吸光度为0.70±0.02(734 nm波长处)的工作液。由储备液配制质量浓度为0.005、0.010、0.020 mg/mL的栽培菊苣籽总黄酮、VC、TBHQ样品液。于一系列10 mL比色管中加入3.0 mL ABTS+·工作液和1.0 mL不同质量浓度的各样品液,混匀后避光反应1 h,在734 nm波长处测定各管的吸光度A;以同样的方法测定3.0 mL 95%乙醇和1.0 m L不同质量浓度的样品液在734 nm波长处的吸光度A1;测定3.0 mL ABTS+·工作液和1.0 mL 95%乙醇在734 nm波长处的吸光度A0,则各样品液对ABTS+·的清除率按公式(2)计算。
1.3.3.4 栽培菊苣籽总黄酮O2-·清除能力的测定
O2-·并不是高活性自由基,但它是其他类型的高活性自由基(如·OH)的前体,且O2-·及其衍生物会造成机体DNA和细胞膜的损伤[21]。因此,研究天然提取物对O2-·的清除能力很重要。参考文献[22]报道的邻苯三酚自氧化法测定0.2 mg/mL的栽培菊苣籽总黄酮、VC、TBHQ对O2-·的清除能力。
1.3.3.5 Fe2+诱发卵黄脂蛋白过不饱和脂肪酸过氧化体系中抗氧化活性的测定
参考文献[23-24]的方法,测定栽培菊苣籽总黄酮、VC、TBHQ溶液抑制Fe2+诱发卵黄脂蛋白过不饱和脂肪酸氧化的效果,将3 种抗氧化剂溶液的储备液分别稀释成0.1、0.2、0.3 mg/mL作为实验样品液,每个质量浓度做3 次平行实验。
1.3.4 HPLC-OH法识别栽培菊苣籽总黄酮中的活性成分
1.3.4.1 溶液的配制
准确称取0.010 0 g经大孔树脂纯化后的栽培菊苣籽总黄酮冻干粉末,用甲醇溶解并配成1.0 mg/mL的样品储备液。
准确称取0.027 8 g FeSO4·7H2O,用0.1 mmol/L的H2SO4溶解于10 mL离心管中并定容,即得到10 mmol/L的FeSO4溶液。取10 μL H2O2原液加入装有少量除氧超纯水的10 mL离心管中并定容,即得到0.03%的H2O2溶液。
1.3.4.2 活性成分识别实验
实验过程中·OH的生成根据文献[25-26]中的Fenton反应原理。实验组为在10 mL比色管中加入10 mmol/L的FeSO4溶液500 μL,再加入1 mL菊苣籽提物样品液,最后加入0.03%的H2O2溶液500 μL,以启动反应,混合均匀后于37 ℃条件下恒温水浴30 min后过膜,进HPLC分析;量取1 mL样品液并以等体积的除氧超纯水代替FeSO4溶液和H2O2溶液作为对照组,进行HPLC分析。色谱条件:流动相:甲醇(A)、超纯水(B)和1%乙酸水溶液(C);流速:0.8 mL/min;进样量:10 μL;洗脱条件:0~25 min,30%~80% A,1% C始终保持10%;检测波长:325 nm;柱温:30 ℃。各主成分对·OH清除率按公式(3)计算。
式中:S0为对照组各成分峰面积,即未与·OH反应的各成分峰面积;S1为实验组各成分峰面积,即与·OH反应后剩余的各成分峰面积。
2.1 栽培菊苣籽总黄酮对RAW264.7细胞毒性实验结果

图1 不同质量浓度的栽培菊苣籽总黄酮对RAW264.7细胞存活率的影响
Fig.1 Effect of sample concentration on survival rate of RAW264.7 cells
不同质量浓度栽培菊苣籽总黄酮溶液对RAW264.7细胞的毒性,以细胞存活率为响应值,结果如图1所示,当栽培菊苣籽总黄酮质量浓度为1 000 μg/mL时,对RAW264.7细胞具有一定的毒性,抑制了细胞的生长;而当栽培菊苣籽总黄酮质量浓度适当减小(1~500 μg/mL范围内)后,栽培菊苣籽总黄酮对RAW264.7细胞基本无毒性,甚至对细胞生长具有轻微的增殖作用。
2.2 栽培菊苣籽总黄酮的总抗氧化能力

图2 栽培菊苣籽总黄酮的总抗氧化能力
Fig.2 Relationship between sample concentration and total antioxidant capacity
由图2可知,所有样品的吸光度基本均随着质量浓度的增大而增大,各样品的总抗氧化活性与质量浓度之间基本呈正相关关系,即各样品总抗氧化活性增强。这是因为磷钼络合物中Mo6+被具有抗氧化活性的物质还原成正Mo5+,此产物为绿色络合物,在695 nm波长处具有最大吸光度,吸光度越大,说明总抗氧化活性越强。本实验将栽培菊苣籽总黄酮与两种合成抗氧化剂VC、TBHQ比较发现,其总抗氧化活性比VC、TBHQ弱,其中,VC的抗氧化活性最强。当质量浓度为0.1 mg/mL时,栽培菊苣籽总黄酮的总抗氧化活性与TBHQ非常接近。在实验设计的质量浓度范围内,抗氧化剂VC和TBHQ的总抗氧化活性随着质量浓度的升高均强于菊苣籽总黄酮。此外,通过计算得到,菊苣籽总黄酮、VC、TBHQ的总抗氧化能力为一半(half maximal inhibitory concentration,IC50)时,各样品的质量浓度分别为0.211、0.145、0.183 mg/mL。由此也证明了菊苣籽总黄酮的总抗氧化活性弱于VC和TBHQ。实验结果表明,尽管栽培菊苣籽总黄酮的总抗氧化能力不如两种合成抗氧化剂,但仍具有一定的抗氧化活性。
2.3 栽培菊苣籽总黄酮的ABTS+·清除能力
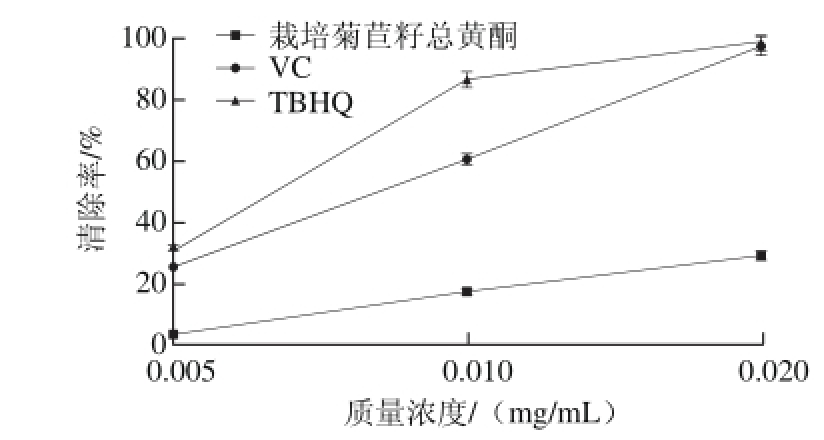
图3 不同质量浓度栽培菊苣籽总黄酮的ABTS+·清除能力
Fig.3 ABTS+· scavenging capacity of different samples at different concentrations
ABTS+·清除实验实质上是抗氧化剂(如多酚类化合物)与ABTS+·作用,使该自由基特殊的蓝绿色变浅的过程[27]。由图3可见,在实验质量浓度范围内,各样品对ABTS+·的清除率随质量浓度增大而增大,两种合成抗氧化剂VC和TBHQ对ABTS+·的清除活性远大于栽培菊苣籽总黄酮。此外,菊苣籽总黄酮、VC、TBHQ对ABTS+·的IC50分别为0.023、0.008、0.006 mg/mL。由此也可以看出,栽培菊 苣籽总黄酮对ABTS+·的清除率逊于VC和TBHQ。当质量浓度为0.02 mg/mL时,TBHQ和VC对ABTS+·的清除率几乎相同,均达到95%以上。尽管栽培菊苣籽总黄酮对ABTS+·的清除活性小于抗氧化剂VC和TBHQ,但质量浓度为0.02 mg/mL的栽培菊苣籽总黄酮对ABTS+·的清除率高于质量浓度为0.005 mg/mL的VC对该自由基的清除率。众所周知,天然的自由基清除剂具有低毒、易得[28]等优势,因此,可将4 倍及以上质量浓度的栽培菊苣籽总黄酮代替人工合成的VC和TBHQ用于食品工业中。
2.4 栽培菊苣籽总黄酮的O2-·清除能力
由图4可以看出,邻苯三酚的最大吸收光谱在325 nm波长处随时间的变化,其自氧化产物的吸光度不断增大,且在2~8 min内吸光度变化与时间呈线性关系,因此选择2~8 min范围内测定吸光度,得出的时间与吸光度之间线性方程的斜率即为邻苯三酚自氧化速率v0。
根据文献[22]的方法进行实验,得到邻苯三酚自氧化速率v0和0.2 mg/mL的样品液对邻苯三酚自氧化产物影响,经计算得到各样品对O2-·的清除率结果如图5所示。

图4 邻苯三酚的最大吸收光谱
Fig.4 UV Absorbance spectra of pyrogallol
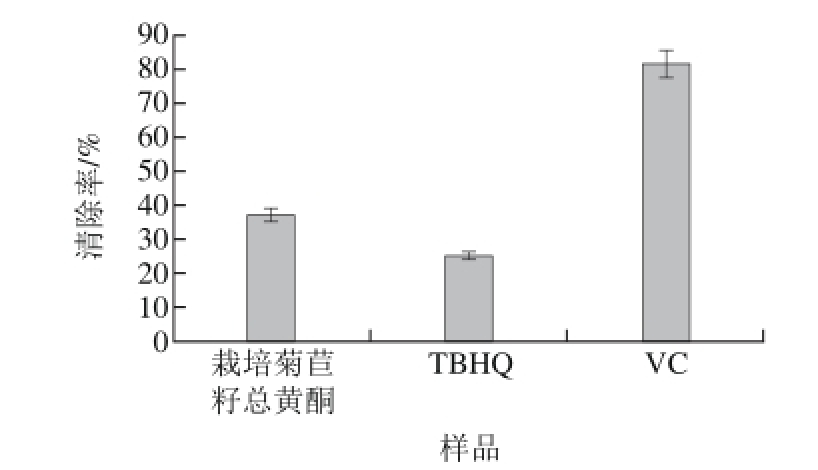
图5 0.2 mmgg/mL栽培菊苣籽总黄酮的OO-2·清除能力
Fig.5 Hydroxyl radical scavenging capacity of different samples
从图5可以看出,质量浓度均为0.2 mg/mL的各样品溶液对O2-·的清除率从大到小依次为:VC、栽培菊苣籽总黄酮、TBHQ,即栽培菊苣籽总黄酮对O2-·的清除率强于人工合成的抗氧化剂TBHQ。
2.5 Fe2+诱发的卵黄脂蛋白过氧化体系的抗氧化活性

图6 不同质量浓度栽培菊苣籽总黄酮对卵黄脂蛋白脂质过氧化的抑制作用
Fig.6 Inhibitory effects of different samples at different concentrations on lipid peroxidation in egg yolk
目前,细胞老化、代谢紊乱等病理性症状很可能由脂质过氧化所引起的[29],因此,研究抗氧化剂对脂质氧化的抑制作用具有重要意义。由图6可知,栽培菊苣籽总黄酮及两种合成抗氧化剂VC、TBHQ均对Fe2+诱发的卵黄脂蛋白脂质过氧化有不同程度的抑制作用。当各样品液均处于低质量浓度(0.1 mg/mL)时,栽培菊苣籽总黄酮的抑制率最低,但随着质量浓度的增大,其对脂质过氧化的抑制率显著增大且远远高于同质量浓度VC对脂质过氧化的抑制效果。此外,VC和TBHQ这两种合成抗氧化剂对卵黄脂蛋白的脂质过氧化抑制率随其质量浓度的变化并不明显。当栽培菊苣籽总黄酮、VC、TBHQ对脂质的IC50分别为0.20、0.25、0.12 mg/mL,由此也可以得到各抗氧化剂对卵黄脂蛋白的脂质过氧化抑制活性大小为:TBHQ>菊苣籽总黄酮>VC。本实验结果表明,栽培菊苣籽总黄酮有良好的抑制脂质氧化的能力。
2.6 菊苣籽总黄酮活性成分的识别
·OH是生物体中的重要活性氧自由基之一,它是造成衰老和组织损伤的重要原因之一[30],因此,研究天然产物对该自由基的清除作用是很有必要的。按照1.3.4.2节的方法进行实验,得到HPLC-OH法识别菊苣籽总黄酮活性成分的结果如图7和表1所示,两种成分对·OH具有较好的清除活性且各不相同,其中,绿原酸对·OH的清除效果较好。这种方法免去了对栽培菊苣籽总黄酮进行繁琐的分离、纯化并获得单一组分后再进行清除·OH活性测定这一系列步骤,而快速地筛选出其中对·OH具有较好清除作用的成分。

图7 菊苣籽总黄酮与·OH反应的HHPPLLCC图
Fig.7 HPLC chromatogram for hydroxyl radical scavenging capacity
of total fl avonoids from Cichorium endivia L. seeds
表1 菊苣籽总黄酮活性成分的·OHH清除能力
Table1 Hydroxyl radical scavenging capacity of fl avonoid constituents ffrroomm Cichorium endivviiaa L. seeds

3
通过以上实验可以看出,栽培菊苣籽总黄酮在1~500 μg/mL范围内对RAW264.7细胞基本无毒,甚至对其生长略有增殖效果,这为栽培菊苣籽总黄酮以后的应用与开发提供一个保障。然后,采用4 种化学方法并通过与两种合成抗氧化剂(VC和TBHQ)进行比较实验,较为全面地评价了栽培菊苣籽总黄酮的抗氧化及清除自由基的能力。此外,又采用一种快速且高效的HPLC-OH的方法识别出了栽培菊苣籽总黄酮中清除·OH的活性成分是绿原酸,为天然提取物中抗氧化活性成分的快速筛选提供了一个参考,这种方法目前鲜有研究报道。实验结果表明,栽培菊苣籽总黄酮在某些方面(如抑制Fe2+诱发的卵黄脂蛋白脂质过氧化方面)的抗氧化性能优于合成的抗氧化剂。因此,栽培菊苣籽总黄酮经提纯后有望作为一种天然抗氧化剂被用于食品工业,从而提升天然产物的应用价值。
参考文献:
[1] 中国在线植物志. 栽培菊苣[EB/OL][2016-03-20]. http://www. eflora.cn/sp/.
[2] 王福鑫, 林铌, 邓安珺, 等. 苦菊提取物的肝保护作用研究[J].食品与药品, 2013, 15(3): 153-155. DOI:10.3969/j.issn.1672-979x.2013.03.001.
[3] 陈超杰, 秦海林, 邓安珺, 等. 苦菊提取物的抗氧化活性研究[J].食品与药品, 2011, 13(3): 93-96. DOI:10.3969/j.issn.1672-979X.2011.02.005.
[4] KANG H W. Antioxidative activity of extracts from Cichorium endivia L.[J]. Journal of the Korean Society of Food Science and Nutrition, 2012, 41(11): 1487-1492. DOI:10.3746/jkfn.2012.41.11.1487.
[5] MASCHERPA D, CARAZZONE C, MARRUBINI G, et al. Identification of phenolic constituents in Cichorium endivia var. crispum and var. latifolium salads by high-performance liquid chromatography with diode array detection and electrospray ioniziation tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2012, 60(49): 12142-12150. DOI:10.1021/jf3034754. [6] DUPONT M S, MONDIN Z, WILLAMSON G, et al. Effect of variety, processing, and storage on the fl avonoid glycoside content and composition of lettuce and endive[J]. Journal of Agricultural and Food Chemistry, 2000, 48(9): 3957-3964. DOI:10.1021/jf0002387.
[7] El-SHAFEY N M, ABDELGAWAD H. Luteolin, a bioactive fl avone compound extracted from Cichorium endivia L. subsp. divaricatum alleviates the harmful effect of salinity on maize[J]. Acta Physiologiae Plantarum, 2012, 34(6): 2165-2177. DOI:10.1007/s11738-012-1017-8.
[8] 陈超杰, 李万芳, 秦海林, 等. 苦菊乙酸乙酯提取物的体外抗氧化活性研究[J]. 中国药房, 2011, 22(15): 1347-1350.
[9] 陈超杰, 展丽娟, 魏金锋, 等. 苦菊提取物对HepG2细胞的抗氧化作用及其机制研究[J]. 中国中药杂志, 2014, 39(14): 2716-2720. DOI:10.4268/cjcmm20141424.
[10] 赵月, 李荣, 姜子涛. 栽培菊苣籽总黄酮的提取、成分鉴定及抗氧化活性成分的识别[J]. 食品科学, 2016, 37(16): 36-42. DOI:10.7506/ spkx1002-6630-201616006.
[11] ZHAO M H, JIANG Z T, LIU T, et al. Flavonoids in Juglans regia L. leaves and evaluation of in vitro antioxidant activity via intracellular and chemical methods[J]. Scientif i c World Journal, 2014, 2014: 1-6. DOI:10.1155/2014/303878.
[12] ZHANG T T, WANG M, YANG L, et al. Flavonoid glycosides from Rubus chingii Hu fruits display anti-inflammatory activity through suppressing MAPKs activation in macrophages[J]. Journal of Functional Foods, 2015, 18: 235-243. DOI:10.1016/j.jff.2015.07.006.
[13] LI T T, ZHANG H, WU C E. Screening of antioxidant and antitumor activities of major ingredients from defatted Camellia oleifera seeds[J]. Food Science and Biotechnology, 2014, 23(3): 873-880. DOI:10.1007/ s10068-014-0117-1.
[14] DUAN X, LI M, MA H J, et al. Physicochemical proper ties and antioxidant potential of phosvitin-resveratrol complexes in emulsion system[J]. Food Chemistry, 2016, 206: 102-109. DOI:10.1016/ j.foodchem.2016.03.055.
[15] 杨云舒, 姜子涛, 李荣. 广枣黄酮清除自由基能力及抗氧化性能的细胞模型法评价[J]. 食品科学, 2016, 37(9): 92-97. DOI:10.7506/ spkx1002-6630-201609018.
[16] 党娅, 刘水英. 紫甘蓝花青苷提取工艺及抗氧化性研究[J]. 北方园艺, 2015(1): 128-136. DOI:10.11937/bfyy.201501035.
[17] SAEED N, KHAN M R, SHABBIR M. Antioxidant activity, total phenolic and total fl avonoid contents of whole plant extracts Torilis leptophylla L.[J]. BMC Complementary and Alternative Medicine, 2012, 12(2): 221. DOI:10.1186/1472-6882-12-221.
[18] XIN X Y, FAN R, GONG Y, et al. On-line HPLC-ABTS+· evaluation and HPLC-MSnidentif i cation of bioactive compounds in hot pepper peel residues[J]. European Food Research and Technology, 2014, 238: 837-844. DOI:10.1007/s00217-014-2153-8.
[19] HONG S, LIU S B. Targeted acylation for all the hydroxyls of (+)-catechin and evaluation of their individual contribution to radical scavenging activity[J]. Food Chemistry, 2016, 197: 415-421. DOI:10.1016/j.foodchem.2015.10.134.
[20] LOCATELLI D A, NAZARENO M A, FUSARI C M, et al. Cooked garlic and antioxidant activity: correlation with organosulfur compound composition[J]. Food Chemistry, 2017, 220: 219-224. DOI:10.1016/j.foodchem.2016.10.001.
[21] WANG L Y, DING L, WANG Y, et al. Isolation and characterisation of in vitro and cellular free radical scavenging peptides from corn peptide fractions[J]. Molecules, 2015, 20(2): 3221-3237. DOI:10.3390/ molecules20023221.
[22] 周媛, 李荣, 姜子涛. 食用委陵菜黄酮的抗氧化性及清除自由基能力研究[J]. 食品工业科技, 2012, 33(17): 102-105. DOI:10.13386/ j.issn1002-0306.2012.17.070.
[23] 张禄捷, 李荣, 姜子涛. 茼蒿叶中总黄酮的提取纯化及抗氧化活性分析[J]. 食品科学, 2015, 36(24): 40-45. DOI:10.7506/spkx1002-6630-201524007.
[24] WANG F, YANG J X. A comparative study of caffeic acid and a novel caffeic acid conjugate SMND-309 on antioxidant properties in vitro[J]. LWT-Food Science and Technology, 2012, 46(1): 239-244. DOI:10.1016/j.lwt.2011.09.025.
[25] MARKOVIĆ J M D, PEJIN B, MILENKOVIĆ D, et al. Antiradical activity of delphinidin, pelargonidin and malvin towards hydroxyl and nitric oxide radicals: the energy requirements calculations as a prediction of the possible antiradical mechanisms[J]. Food Chemistry, 2017, 218: 440-446. DOI:10.1016/j.foodchem.2016.09.106.
[26] MAZAREI F, JOOYANDEH H, NOSHAD M, et al. Polysaccharide of caper (Capparis spinosa L.) leaf: extraction optimization, antioxidant potential and antimicrobial activity[J]. International Journal of Biological Macromolecules, 2017, 95: 224-231. DOI:10.1016/ j.ijbiomac.2016.11.049.
[27] TLILI N, MEJRI H, ANOUER F, et al. Phenolic profile and antioxidant activity of Capparis spinosa seeds harvested from different wild habitats[J]. Industrial Crops and Products, 2015, 76: 930-935. DOI:10.1016/j.indcrop.2015.07.040.
[28] XU J K, LI M F, SUN R C. Identifying the impact of ultrasoundassisted extraction on polysaccharides and natural antioxidants from Eucommia ulmoides Oliver[J]. Process Biochemistry, 2014, 50(3): 473-481. DOI:10.1016/j.procbio.2014.12.021.
[29] YANG J X, GUO J, YUAN J F. In vitro antioxidant properties of rutin[J]. LWT-Food Science and Technology, 2008, 41(6): 1060-1066. DOI:10.1016/j.lwt.2007.06.010.
[30] ZHANG J J, MENG G Y, ZHAI G Y, et al. Extraction, characteristisation and antioxidant activity of polysaccharides of spent mushroom compost of Ganoderma lucidum[J]. International Journal of Biological Macromolecules, 2016, 82: 432-439. DOI:10.1016/ j.ijbiomac.2015.10.016.
Cytotoxicity Evaluation of Total Flavonoids and Recognition of Hydroxyl Radical Scavenging Components from Cichorium endivia L. Seeds
ZHAO Yue, LI Rong, JIANG Zitao*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:The cytotoxicity of total fl avonoids from Cichorium endivia L. seeds towards RAW264.7 cells was evaluated by 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide (MTT) assay and the antioxidant activities were investigated based o n total antioxidant activity, 2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt cation radical (ABTS+·) scavenging capacity, superoxide anion radical scavenging capacity and inhibition on Fe2+-induced lipid peroxidation in egg yolk. These activities were compared with those of the common antioxidants vitamin C (VC) and tert-butylhydroquinone (TBHQ). Furthermore, the total fl avonoids extracted from C. endivia seeds were screened for those scavenging hydroxyl radical by a high-performance liquid chromatography (HPLC) method. MTT assay showed that the total fl avonoids were toxic towards RAW264.7 cells at a concentration of 1 mg/mL, but they were hardly toxic at a certain lower temperature. Antioxidant assays revealed that the total antioxidant activity and ABTS+· scavenging activity of these compounds were lower than those of VC and TBHQ. However, at low concentration, the total antioxidant activity was similar to that of TBHQ. The superoxide anion scavenging capacity of these samples was in the decreasing order of VC > total fl avonoids from C. endivia seeds > TBHQ. The lipid peroxidation inhibitory activity of the total fl avonoids was higher than that of VC, but lower than that of TBHQ. The HPLC analysis indicated that hydroxyl radical scavenging capacity of chlorogenic acid was higher than that of cynarin, which showed a scavenging percentage of 66.42% and 46.00%, respectively.
Key words:total fl avonoids from Cichorium endivia L. seeds; MTT assay; hydroxyl radical scavenging capacity; recognition
DOI:10.7506/spkx1002-6630-201709029
中图分类号:中图分类号:TS202.3 文献标志码:A 文章编号:1002-6630(2017)09-0179-06
收稿日期:2016-04-21
基金项目:天津市自然科学基金项目(12JCZDJC34100;13JCYBJC18700; 16JCYBJC43300)
作者简介:赵月(1989—),女,硕士研究生,研究方向为食品添加剂。E-mail:1187649318@qq.com
*通信作者:姜子涛(1956—),男,教授,博士,研究方向为食品添加剂。E-mail:ztjiang@tjcu.edu.cn
引文格式:
赵月, 李荣, 姜子涛. 栽培菊苣籽总黄酮的细胞毒性及清除羟自由基活性成分的识别[J]. 食品科学, 2017, 38(9): 179-184. DOI:10.7506/spkx1002-6630-201709029. http://www.spkx.net.cn
ZHAO Yue, LI Rong, JIANG Zitao. Cytotoxicity evaluation of total flavonoids and recognition of hydroxyl radical scavenging components from Cichorium endiv ia L. seeds[J]. Food Science, 2017, 38(9): 179-184. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201709029. http://www.spkx.net.cn