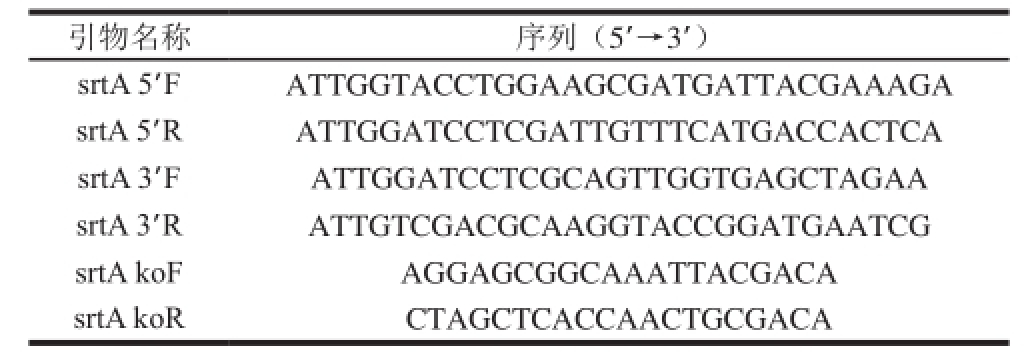
表1 引物序列信息
Table1 Primer sequences
?
李 森,热依汉古丽·麦麦提力
(上海理工大学医疗器械与食品学院,上海 200093)
摘 要:单核细胞增生性李斯特菌是常见的食源性致病菌,其细胞壁上存在的表面蛋白与其致病性和细菌菌膜的形成密切相关,而srtA基因是介导表面蛋白膜表面定位的关键因子,通过识别特定的蛋白序列将表面蛋白共价结合在细胞壁上,也是单增李斯特菌的重要毒力基因。为深入研究srtA的功能及其对细菌毒力的调控,本研究通过同源重组技术敲除了单增李斯特菌中的srtA基因,并对基因敲除菌株的生物学特性进行了初步研究。通过生长曲线的测定,发现srtA基因敲除株的生长活性低于野生型菌株。进一步利用该菌株对星形胶质细胞系U251的侵袭实验发现,srtA基因敲除菌株的侵袭效率低于野生菌株,提示srtA基因在调控单增李斯特菌的侵袭能力方面发挥重要作用。本研究可为单增李斯特菌毒力基因调控和细菌菌膜的研究提供理论依据。
关键词:单增李斯特菌;srtA基因;同源重组;生长曲线;侵袭
单核细胞增生性李斯特菌(Listeria monocytogenes)简称单增李斯特菌,是一种常见的人畜共患菌,由于其在环境中广泛存在,也是食品行业中的常见污染菌 [1]。单增李斯特菌易生成菌膜造成该菌难被清除。同时该菌具有较强的致病性,可以穿透人体的三大屏障——肠道屏障、血脑屏障和胎盘屏障,造成人体感染,严重可导致败血症、脑膜炎、流产、死胎等,对人体健康的危害极大 [2-3]。根据临床统计,由该菌感染造成的死亡率高达30%~50%,因此被世界卫生组织定义为四大食源性致病菌之一 [4-5]。对该菌致病机理的研究将有助于预防和治疗该菌引起的食源性疾病。目前已有许多研究表明细菌自身表达的一些表面蛋白在菌膜形成、细菌毒力的调控和对宿主细胞的侵袭方面发挥重要作用。例如表面蛋白InlA和InlB是参与细菌黏附和侵袭宿主细胞的重要因子 [6-7],而介导这些表面蛋白膜定位的是sortase家族的蛋白。
Sortase A(SrtA)是分选酶sortase家族的成员之一,最早由Mazmanian等 [8]于1999年在金黄色葡萄球菌中发现。sortase是一组介导表面蛋白革兰氏阳性细菌细胞壁共价结合的蛋白酶。根据识别序列的不同,sortase分为SrtA、SrtB、Srt C和SrtD 4 种 [9]。SrtA识别含有LPXTG序列的表面蛋白,通过将蛋白C-末端的LPXTG进行水解后,利用转肽作用将表面蛋白锚定在细胞壁的表面 [10]。研究发现,SrtA参与内化素InlA蛋白的膜定位过程 [11]。InlA是参与细菌侵袭过程的重要因子,在单增李斯特菌侵袭内皮细胞、肝细胞等过程中起到关键性作用 [12]。由此可以推测,srtA基因可能对细菌的侵袭起到一定的调控作用。为了更好的研究srtA基因的功能,本研究利用同源重组的方法构建了srtA基因敲除菌株,并对敲除株的生物学特性进行了初步研究。
1.1 材料与试剂
1.1.1 菌株、质粒和细胞
单增李斯特菌株EGDe为上海理工大学系统生物医学实验室保存,大肠杆菌感受态细胞购自天根生化科技(北京)有限公司。pKSV7质粒由上海交通大学史贤明教授惠赠。pMD-19T载体购自大连宝生物公司。U251细胞系购自上海细胞库。
脑心浸出液(brain heat infusion,BHI)肉汤 北京陆桥技术股份有限公司;杜氏改良Eagle培养基(Dulbecco’s modif i ed Eagle’s medium,DMEM) 美国Gibco公司;胎牛血清 上海博升生物科技有限公司;rTaq DNA聚合酶和聚合酶链式反应(polymerase chain reaction,PCR)试剂、限制性内切酶(BamHⅠ、KpnⅠ和SalⅠ)、DNA Marker、T4连接酶 大连宝生物公司;质粒抽提试剂盒 天根生化科技(北京)有限公司;氨苄青霉素、氯霉素及其他常规试剂 国药集团化学试剂有限公司。
1.1.2 引物
本实验中用到的引物均参照GenBank中公布的序列(ID:986837)设计,具体引物序列如表1所示。
表1 引物序列信息
Table1 Primer sequences

?
1.2 仪器与设备
离心机 德国Eppendorf公司;电穿孔仪 美国Bio-Rad公司;细胞培养箱 美国Thermo Fisher公司。
1.3 方法
1.3.1 目的基因片段的制备
将EGDe接种于BHI培养基中,于37 ℃摇床振荡培养过夜后收集菌体抽提细菌基因组。分别利用srtA 5’和srtA 3’引物扩增srtA的上下游同源臂。将PCR片段回收后利用BamHⅠ对片段进行单酶切。将单酶切产物分别回收后用T4 DNA连接酶连接,并进一步连接pMD-19T载体转入大肠杆菌感受态进行菌落PCR鉴定。将阳性克隆送华大基因公司测序。
1.3.2 穿梭载体pKSV7-Δ srtA的构建
将1.3.1节中测序正确的阳性菌株中的质粒进行抽提作为PCR模板,利用srtA 5’F和srtA 3’R引物进行扩增。将DNA片段回收后进行KpnⅠ和SalⅠ的双酶切,同时将穿梭载体pKSV7进行相同的双酶切反应。分别回收酶切产物后,利用T4连接酶将srtA片段连入pKSV7载体并转化到大肠杆菌中进行菌落PCR的鉴定及质粒的酶切鉴定,将阳性克隆送华大基因公司测序。
1.3.3 目的基因片段与野生型菌株基因组的同源重组
将1.3.2节中测序正确的质粒抽提后通过电穿孔的方法转入单增李斯特菌感受态细胞,并涂布氯霉素抗性(10 μg/mL)BHI板进行克隆的筛选。将含有穿梭载体的单克隆接种于BHI液体培养基,在温度(41 ℃)和氯霉素抗性(10 μg/mL)的双重压力下进行同源重组。每12 h传代一次,共传8 代后将末代培养产物进行氯霉素抗性(10 μg/mL)板划线培养。挑取单克隆接种于新鲜BHI培养基于30 ℃培养以丢失抗性质粒,每12 h传代一次,6 代后将末次培养物进行划线培养。
1.3.4 srtA敲除菌株的鉴定
挑取1.3.3中平板上的单菌落进行双引物PCR鉴定,将srtA 5’F和srtA 3’R单一扩增片段为1 400 bp,同时srtA koF和srtA koR无扩增片段的菌落视为阳性克隆。将鉴定出的阳性克隆进一步利用无抗性板和氯霉素抗性(10 μg/mL)板划线培养,最终得到无抗性板上生长、抗性板上不生长且PCR鉴定正确的为srtA敲除菌株。
1.3.5 细菌生长曲线的测定
将野生型和ΔsrtA菌株平板划线培养,分别挑取单克隆接种于BHI培养基,于37 ℃培养箱培养12~14 h后,取部分菌液用新鲜培养基按100 倍稀释,至OD 600 nm为0.14左右。置于37 ℃摇床振荡培养,每2 h测定OD 600 nm,记录细菌生长情况。
1.3.6 细胞侵袭实验
将U251细胞按2×10 5个/孔接种到12 孔培养板中,过夜培养,并于侵袭实验开始前1 h换不含血清的DMEM培养。将EGDe和ΔsrtA菌株于BHI培养基中37 ℃培养过夜,测定OD 600 nm,并利用新鲜BHI培养基将细菌的OD 600 nm调至0.3。将细菌按感染复数值100∶1的比例加入到培养的细胞中,置于CO 2培养箱37 ℃培养1.5 h。小心移除细胞培养液后加入D-Hanks稀释的庆大霉素(500 μg/mL)培养1 h,杀死细胞外的细菌。D-Hanks洗涤细胞3 次后加入1% TritonX-100裂解细胞。收集细胞裂解液稀释10 000倍后涂BHI平板培养。统计平板上生长的克隆数,计算细菌菌体浓度(以lg(CFU/mL)表示),比较不同细菌的侵袭效率。
1.4 数据统计分析
文中折线图和柱形图利用GraphPad软件绘制。srtA敲除菌株和野生型菌株的生长曲线数据分析采用双因素方差分析(two-way analysis of variance,two-way ANOVA),srtA敲除菌株和野生型菌株的侵袭效率数据统计分析采用two-way ANOVA。
2.1 目的基因片段的克隆
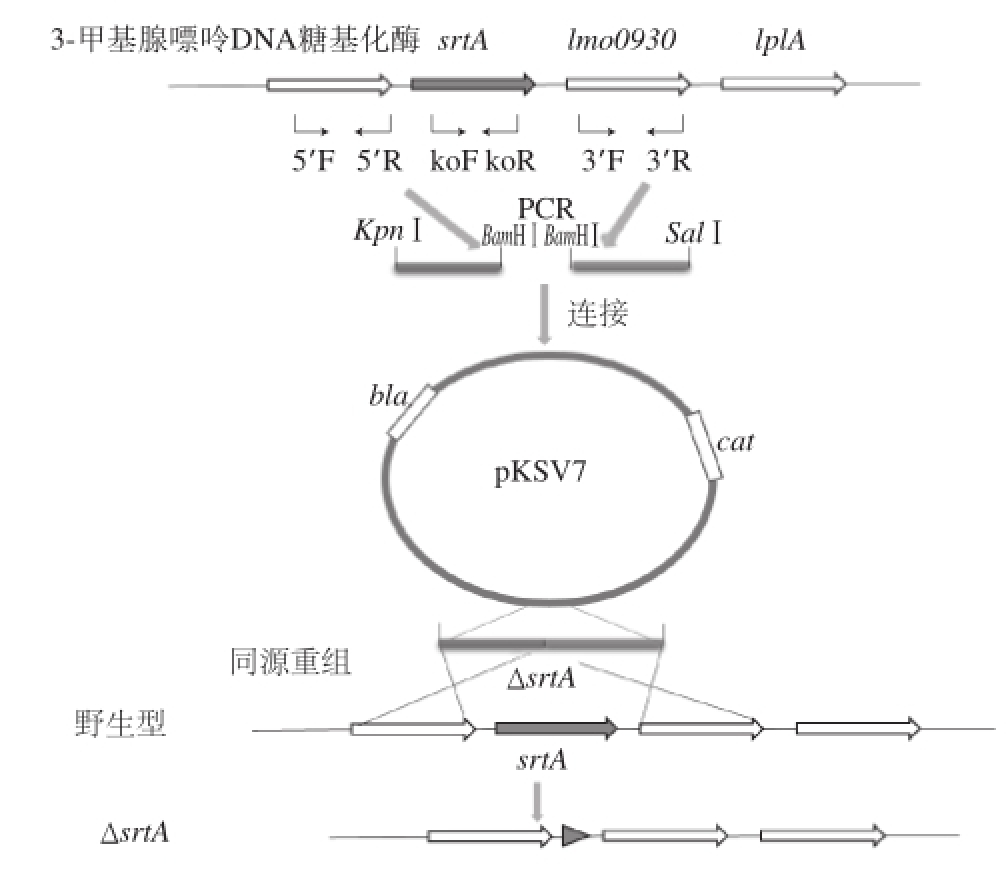
图1 srtA基因敲除菌株构建策略
Fig.1 Construction strategy of srtA knockout strains
根据GenBank上公布的序列,设计srtA的敲除策略(图1),设计引物分别扩增上游同源臂srtA 5’和下游同源臂srtA 3’的PCR产物分别为844 bp和600 bp(图2A),BamHⅠ单酶切并连接到pMD-19T载体后转化入大肠杆菌涂平板培养,挑取平板上长出的4 个克隆,经菌落PCR鉴定,在1 400 bp处扩增出阳性片段(图2B),符合预期。
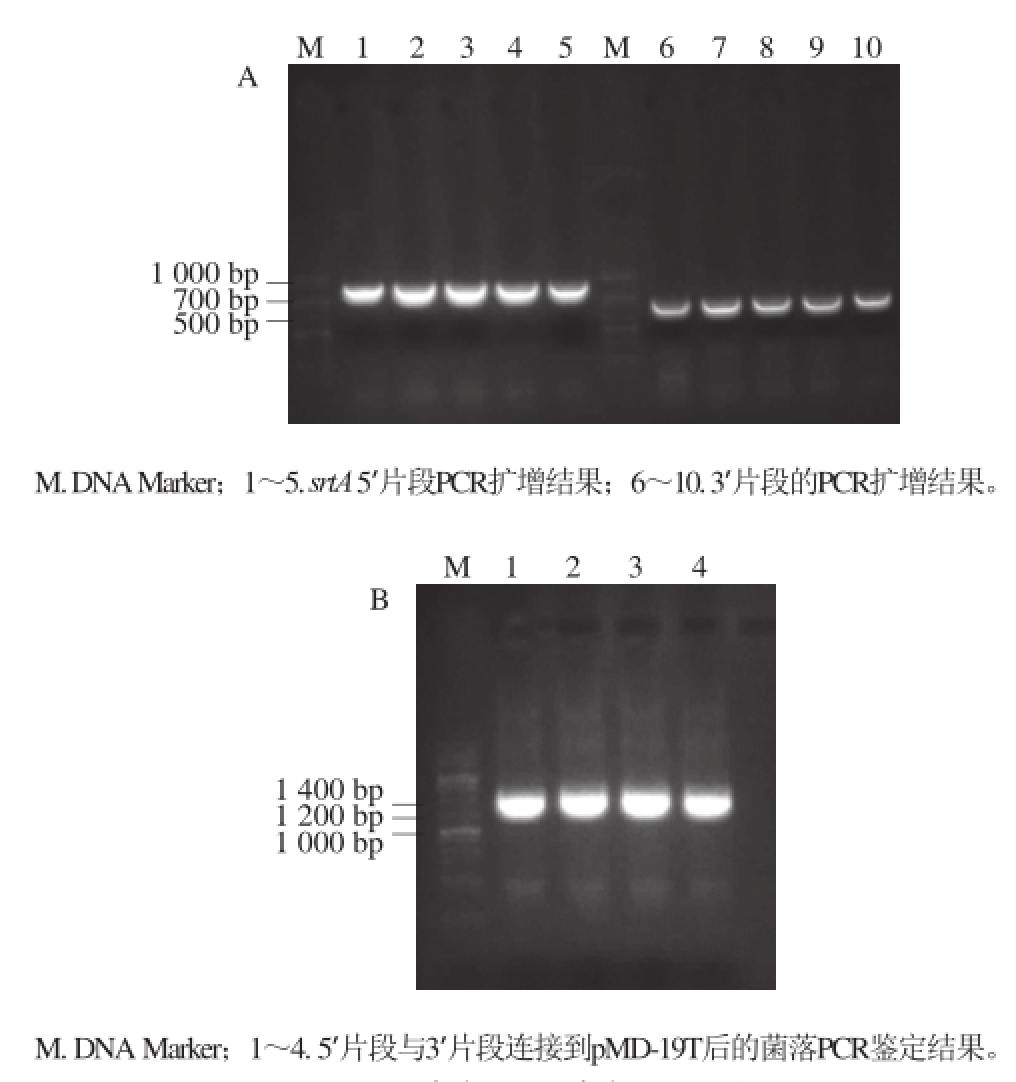
图2 srtA上(A)、下(B)游片段的克隆
Fig.2 Cloning of srtA up-stream and down-stream sequences
2.2 敲除载体的构建
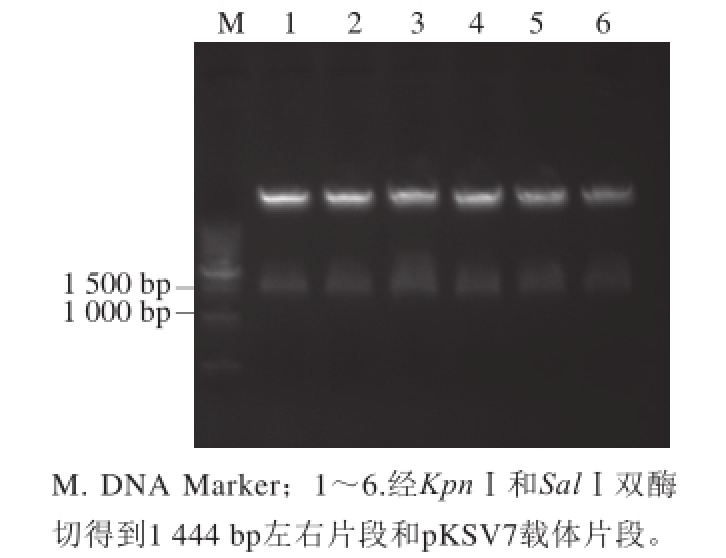
图3 pKSV7-ΔsrtA载体的酶切鉴定
Fig.3 Verif i cation of pKSV7-Δ srtA by double enzyme digestion
将pMD-19T-Δ srtA载体送公司测序后将测序正确的克隆作为模板,利用5’F和3’R引物进行PCR,将得到的阳性片段进行双酶切后与穿梭载体pKSV7进行连接得到pKSV7-ΔsrtA。利用PCR及双酶切对平板上的克隆进行鉴定。经过双酶切鉴定可以发现,挑取的6 个克隆均为阳性克隆,即酶切可以得到约1 400 bp左右的片段(图3)。
2.3 重组同源菌的筛选

图4 srtA基因敲除菌株的菌落PCR鉴定结果
Fig.4 Identif i cation of srtA knockout strains by colony PCR
将得到的pKSV7-ΔsrtA载体通过电穿孔的方式转入单增李斯特菌后,利用氯霉素抗性和温度进行筛选,将经过多次传代后得到的克隆进行PCR双引物鉴定。根据构建的策略,如果用5’F和3’R引物进行扩增,野生型菌株得到2 200 bp左右的片段,而敲除菌株得到约1 400 bp大小的片段,杂合子菌株的同时具有1 400 bp和2 200 bp两种片段,同时利用srtA ko引物进行扩增,野生型和杂合子菌株得到400 bp片段,敲除菌株则应无片段扩增。挑取的16 个克隆当中只有9号和12号克隆符合上述条件,为疑似阳性克隆(图4),利用氯霉素抗性对这两个克隆进行进一步鉴定,得到抗性板上无菌落生长的为阳性克隆,经鉴定9号和12号克隆均为阳性克隆。
2.4 敲除菌株生长曲线
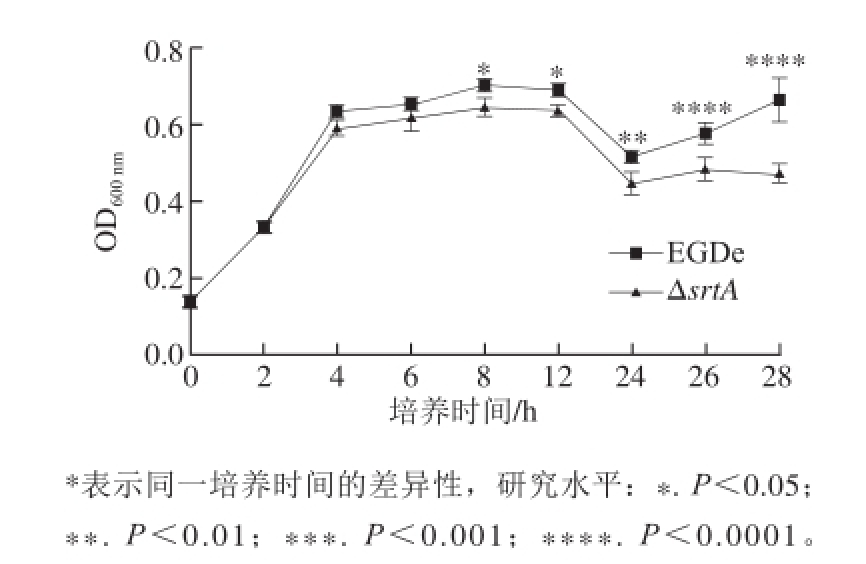
图 5srtA敲除菌株与野生型菌株的生长曲线
Fig.5 Growth curves of srtA knockout strain and wild-type strain
将野生型EGDe菌株和ΔsrtA菌株培养后,分别检测两者的生长曲线,结果显示从培养4 h开始,敲除菌株的生长速率低于野生型菌株,过夜培养后OD 600 nm的差别更加明显。两种菌株均在12 h左右OD 600 nm达到最高,然后进入衰亡期,增殖减慢,菌体大量死亡,OD 600 nm逐渐下降。当培养液中大部分菌体死亡后,细菌增殖能力开始提高,此时OD 600 nm又开始回升。因此培养24 h OD 600 nm降至最低点后又有所升高(图5),此时srtA敲除菌株的OD 600 nm还是低于野生型菌株。本结果显示srtA的敲除对细菌本身的生长活力造成一定影响。
2.5 srtA敲除对单增李斯特菌侵袭的影响
作为分选酶家族成员,SrtA被证实与单增李斯特菌的内化素的膜定位相关,而内化素是细菌侵袭的关键因子。为了验证srtA敲除对细菌毒力的影响,本研究利用人胶质细胞瘤细胞系U251进行了细菌的侵袭实验。利用庆大霉素将未侵袭的细菌杀死后,通过计算细胞内侵袭细菌的菌体浓度检测细菌的侵袭效率。如图6所示,EGDe和ΔsrtA的lg(CFU/mL)分别为5.4和4.7左右,即敲除菌株的菌体浓度明显低于野生型菌株(图6),说明ΔsrtA的侵袭效率低于EGDe,因此证明srtA的敲除影响了细菌的侵袭能力。
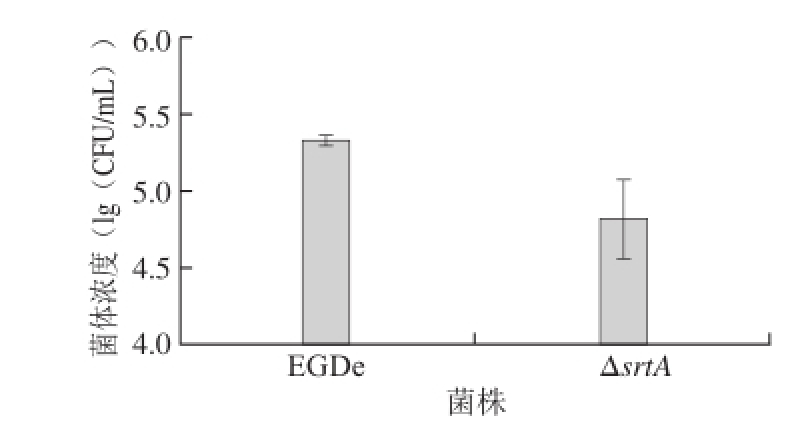
图6 srtA敲除菌株与野生型菌株EGDe的侵袭效率
Fig.6 Invasion eff i ciencies of srtA knockout strain and wild-type strain
基因敲除是研究基因功能的重要生物学手段,而细菌自身结构简单易于操作、染色体复杂程度较低等特点也为基因敲除菌株的构建提供了便利,因此被国内外学者广泛用于基因功能的研究、减毒疫苗的研发等领域。本研究利用同源重组成功构建了srtA基因的基因敲除菌株并对其生物学特性做了初步分析。生长曲线的测定发现srtA基因的缺失使得细菌自身的生长增殖能力降低,说明srtA基因对细菌自身的生长能力有一定的调控作用。SrtA特异识别含有LPXTG序列的膜表面蛋白并将这类蛋白通过蛋白修饰定位到细胞壁上,srtA的缺失影响了这类蛋白的定位,导致细菌细胞壁成分的改变,从而会对细胞的生长增殖造成一定影响。但两种菌种之间OD 600 nm的差异并不是非常大,也提示srtA基因并不是细菌生长增殖活动最关键的调控因素或者有其他sortase家族的成员部分代偿了srtA的功能。
单增李斯特菌是一种典型的胞内寄生菌,通过黏附、内化进入宿主细胞,并且在宿主细胞内存活、增殖,进而在细胞与细胞之间传播扩散,造成感染。黏附是细菌侵袭宿主细胞的第一步,也是细菌定植致病的关键环节 [13]。细菌表面的内化素是介导细菌黏附和内化的重要毒力因子,而内化素蛋白的膜表面定位则离不开分选酶的作用。经研究证实内化素InlA、InlJ的膜定位过程均由SrtA所介导 [14],与细菌侵袭哺乳动物细胞相关的另一个膜表面蛋白Vip的膜定位也受到SrtA调控。另外,细菌菌毛是细菌黏附宿主细胞的重要结构基础。有研究证实一些革兰氏阳性菌菌毛的形成需要SrtA的参与 [15-16],含有LPXTG序列的菌毛亚基蛋白前体分子由SrtA定位到菌毛上。由此可见,SrtA在调控细菌致病性方面起着重要的调控作用。Chen Fuguang等 [17]在金黄色葡萄球菌中敲除srtA基因后发现,细菌对宿主细胞的黏附率降低,并且宿主细胞内炎症因子的表达水平下降。本研究利用星形胶质细胞瘤细胞作为宿主细胞进行的侵袭实验,发现ΔsrtA菌株侵袭U251细胞的侵袭效率明显低于野生型菌株,证实srtA在调控单增李斯特菌侵袭神经细胞中起到重要的调控作用。
细菌菌膜是细菌对抗逆境的一种自我保护机制,一旦形成极难去除,极易造成食品生产线的污染,并且菌膜也是细菌耐药性产生的重要因素,易造成病灶部位反复感染并发展为慢性炎症 [18]。菌膜是由一些细菌表面蛋白、胞外多糖等构成的生物膜结构,因此SrtA在调控细菌菌膜形成中也发挥重要作用。许多研究表明SrtA可以调控链球菌、枯草芽孢杆菌、金黄色葡萄球菌等革兰氏阳性菌的菌膜形成 [19-21]。基于SrtA在调控细菌膜表面蛋白定位、细菌致病性、菌膜形成等过程中所起的重要作用,近年来SrtA被作为抑制细菌感染的重要靶标,许多学者期望通过研发针对SrtA的抑制剂药物达到抑制和消除细菌感染的目的 [22]。作为胞内寄生菌,单增李斯特菌能够良好的诱发细胞免疫,是潜在的优良疫苗载体 [23]。本研究成功构建了srtA敲除突变菌株,并发现其毒力降低,能够为重组活疫苗载体的研发提供一定理论与技术支持。
参考文献:
[1] DREVETS D A, BRONZE M S. Listeria monocytogenes: epidemiology, human disease, and mechanisms of brain invasion[J]. FEMS Immunology and Medical Microbiology, 2008, 53(2): 151-165. DOI:10.1111/j.1574-695X.2008.00404.x.
[2] DISSON O, LECUIT M. Targeting of the central nervous system by Listeria monocytogenes[J]. Virulence, 2012, 3(2): 213-221. DOI:10.4161/viru.19586.
[3] HERNANDEZ-MILIAN A, PAYERAS-CIFRE A. What is new in listeriosis?[J]. BioMed Research International, 2014, 2014: 358051. DOI:10.1155/2014/358051.
[4] Centers for Disease Control and Prevention. Vital signs: Listeria illnesses, deaths, and outbreaks-United States, 2009-2011[J]. Annals of Emergency Medicine, 2013, 62(5): 536-537.
[5] DURAND M L, CALDERWOOD S B, WEBER D J, et al. Acute bacterial meningitis in adults. a review of 493 episodes[J]. The New England Journal of Medicine, 1993, 328(1): 21-28. DOI:10.1056/ NEJM199301073280104.
[6] COSSART P. Molecular and cellular basis of the infection by Listeria monocytogenes: an overview[J]. International Journal of Medical Microbiology, 2002, 291(6/7): 401-409. DOI:10.1078/1438-4221-00146.
[7] GRÜNDLER T, QUEDNAU N, STUMP C, et al. The surface proteins InlA and InlB are interdependently required for polar basolateral invasion by Listeria monocytogenes in a human model of the bloodcerebrospinal fluid barrier[J]. Microbes and Infection, 2013, 15(4): 291-301. DOI:10.1016/j.micinf.2012.12.005.
[8] MAZMANIAN S K, LIU G, TON-THAT H, et al. Staphylococcus aureus sortase, an enzyme that anchors surface proteins to the cell wall[J]. Science, 1999, 285: 760-763. DOI:10.1126/science.285.5428.760.
[9] 赵朋朋, 肖丽英, 李继遥. 蛋白酶sortase的研究进展[J]. 国外医学(口腔医学分册), 2006, 33(1): 18-25. DOI:10.3969/j.issn.1673-5749.2006.01.006.
[10] SPIRIG T, WEINER E M, CLUBB R T. Sortase enzymes in grampositive bacteria[J]. Molecular Microbiology, 2011, 82(5): 1044-1059. DOI:10.1111/j.1365-2958.2011.07887.x.
[11] GARANDEAU C, RÉGLIER-POUPET H, DUBAIL I, et al. The sortase SrtA of Listeria monocytogenes is involved in processing of internalin and in virulence[J]. Infection and Immunity, 2002, 70(3): 1382-1390. DOI:10.1128/IAI.70.3.1382-1390.2002.
[12] LINGNAU A, DOMANN E, HUDEL M, et al. Expression of the Listeria monocytogenes EGD inlA and inlB genes, whose products mediate bacterial entry into tissue culture cell lines, by PrfA-dependent and -independent mechanisms[J]. Infection and Immunity, 1995, 63(10): 3896-3903.
[13] CARVALHO F, SOUSA S, CABANES D. How Listeria monocytogenes organizes its surface for virulence[J]. Frontiers in Cellular and Infection Microbiology, 2014, 4: 48. DOI:10.3389/ fcimb.2014.00048.
[14] SABET C, LECUIT M, CABANES D, et al. LPXTG protein InlJ, a newly identified internalin involved in Listeria monocytogenes virulence[J]. Infection and Immunity, 2005, 73(10): 6912-6922. DOI:10.1128/IAI.73.10.6912-6922.2005.
[15] NECCHI F, NARDI-DEI V, BIAGINI M, et al. Sortase A substrate specif i city in GBS pilus 2a cell wall anchoring[J]. PLoS ONE, 2011, 6(10): e25300. DOI:10.1371/journal.pone.0025300.
[16] KRISHNAN V. Pilins in gram-positive bacteria: a structural perspective[J]. IUBMB Life, 2015, 67(7): 533-543. DOI:10.1002/iub.1400.
[17] CHEN Fuguang, LIU Bingrun, WANG Dacheng, et al. Role of sortase A in the pathogenesis of Staphylococcus aureus-induced mastitis in mice[J]. FEMS Microbiology Letters, 2014, 351(1): 95-103. DOI:10.1111/1574-6968.12354.
[18] HOIBY N, BJARNSHOLT T, GIVSKOV M, et al. Antibiotic resistance of bacterial biofilms[J]. International Journal of Antimicrobial Agents, 2010, 35(4): 322-332. DOI:10.1016/j.ijantimicag.2009.12.011.
[19] NOBBS A H, VAJNA R M, JOHNSON J R, et al. Consequences of a sortase A mutation in Streptococcus gordonii[J]. Microbiology, 2007, 153: 4088-4097. DOI:10.1099/mic.0.2007/007252-0.
[20] SELVARAJ C, SIVAKAMAVALLI J, VASEEHARAN B, et al. Examine the characterization of biofilm formation and inhibition by targeting SrtA mechanism in Bacillus subtilis: a combined experimental and theoretical study[J]. Journal of Molecular Modeling, 2014, 20: 2364. DOI:10.1007/s00894-014-2364-8.
[21] XIONG N, HU C, ZHANG Y, et al. Interaction of sortase A and lipase 2 in the inhibition of Staphylococcus aureus biofilm formation[J]. Archives of Microbiology, 2009, 191(12): 879-884. DOI:10.1007/ s00203-009-0520-9.
[22] CASCIOFERRO S, RAFFA D, MAGGIO B, et al. Sortase A inhibitors: recent advances and future perspectives[J]. Journal of Medicinal Chemistry, 2015, 58(23): 9108-9123. DOI:10.1021/acs.jmedchem.5b00779.
[23] 周云, 潘蕾, 郝春秋, 等. 单增李斯特菌作为疫苗载体的研究进展[J].中国免疫学杂志, 2011, 27(12): 1132-1134. DOI:10.3969/j.issn.1000-484X.2011.12.19.
Construction and Biological Properties of srtA Gene Knockout Mutant Strains of Listeria monocytogenes
LI Sen, Zejhanguri·MAMATIRI
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:Listeria monocytogenes is a common foodborne pathogen. Cell wall-anchored surface proteins are closely related to the pathogenicity and biofilm formation of the bacterium. The srtA gene is a key factor that mediates the membrane anchoring of surface proteins, and as an important virulence gene of L. monocytogenes it can covalently bind surface proteins to the cell wall by recognizing specif i c peptide sequences. For a better understanding of the function of srtA and its role in bacterial virulence regulation, we knocked out the srtA gene in L. monocytogenes by homologous recombination in this study, and evaluated the biological properties of the mutant strain. Based on its growth curve examination, we found that the growth rate of the mutant strain was slower than that of the wild-type one. Furthermore, the invasion eff i ciency of the mutant strain in glioma U251 cells was lower than that of the wild-type one. These results indicate that srtA may play an important role in regulating the invasiveness of L. monocytogenes, which will provide a theoretical basis for further understanding of the regulatory mechanisms of virulence genes in L. monocytogenes and biof i lm formation.
Key words:Listeria monocytogenes; srtA gene; homologous recombination; growth curve; invasion
DOI:10.7506/spkx1002-6630-201704019
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2017)04-0113-05
引文格式:
李森, 热依汉古丽·麦麦提力. 单增李斯特菌srtA基因敲除菌株的构建及其生物学特性[J]. 食品科学, 2017, 38(4): 113-117. DOI:10.7506/spkx1002-6630-201704019. http://www.spkx.net.cn
LI Sen, Zejhanguri·MAMATIRI. Construction and biological properties of srtA gene knockout mutant strains of Listeria monocytogenes[J]. Food Science, 2017, 38(4): 113-117. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704019. http://www.spkx.net.cn
收稿日期:2016-04-07
基金项目:上海理工大学博士启动基金资助项目(1000308001);上海市高校青年教师资助计划项目(10-15-308-802)
作者简介:李森(1982—),女,讲师,博士,研究方向为食品安全与营养。E-mail:lisen_1027@126.com