严嘉玮 1,路洪艳 1,李 莉 1,*,罗自生 1,李栋栋 1,宋 钧 2,班兆军 3
(1.浙江大学生物系统工程与食品科学学院,浙江 杭州 310058;2.加拿大农业部,新斯科舍 B4J 1J5,加拿大;3.浙江科技学院生物与化学工程学院/轻工学院,浙江 杭州 310023)
摘 要:研究‘米拉’(‘Mira’)和‘哈尼’(‘Honeoye’)2 个草莓品种的白色未熟期、粉色转熟期和红色成熟期3 个阶段成熟过程中与风味、生理功能活性相关的特征品质指标变化。结果表明随着草莓成熟果实中总可溶性固形物含量、芳香性挥发成分、花色苷成分积累量有显著性上升,而总酸、总酚、总黄酮含量和抗氧化能力均有所下降。相关性和主成分分析结果表明,草莓成熟过程中总酚、总黄酮、总可溶性固形物和总酸含量均与总抗氧化-亚铁还原能力(ferric reducing-antioxidant power,FRAP)以及氧自由基吸收能力(oxygen radical absorption capacity,ORAC)的变化之间存在高相关性(r为0.859 1~0.994 7),而总花色苷含量与FRAP和ORAC之间的相关性仅为0.315 0和0.385 3。同时得出草莓果实的成熟度与芳香性挥发成分和花色苷组分积累量呈正相关性。
关键词:草莓;成熟;挥发性物质;花色苷;特征品质
草莓(Fragaria×ananassa Duch.)是一种蔷薇科草莓属多年生草本、常绿莓果植物,含有丰富的维生素、矿物质、纤维素和多酚类化合物 [1-2],因其丰富可口的风味特性和其独特的营养生理学功能而广泛受到世界各地人们的欢迎 [3],因此草莓也享有“水果皇后”、“神奇之果”,是世界七大水果之一 [4-5]。目前的研究已证明草莓的抗氧化能力是苹果、梨、番茄和柑橘等常食用的园艺产品的2~11 倍 [6-7],而食用草莓能提升血液、红细胞和单核细胞的抗氧化能力 [8],能有效降低心血管慢性疾病 [9]和癌症的死亡风险 [10]。
与草莓风味相关的特征品质主要是草莓的总可溶性固形物(total soluble solid,TSS)、总酸以及草莓中挥发性香味物质 [11];草莓的营养生理学功能主要与花色苷、总黄酮和总酚类等生理活性指标的含量密切相关 [12]。而伴随着草莓成熟过程中的上述生理活性物质含量不断发生变化,其特征品质也不断发生变化 [13-14]。
本实验选取‘米拉’(‘Mira’)和‘哈尼’(‘Honeoye’)2 种草莓的白色未熟期、粉色转熟期和红色成熟期3 个阶段的果实,分别测定其TSS、可滴定酸(titratable acid,TA)和芳香性挥发成分含量,果实中总黄酮含量(total flavonoid content,TFC)、总酚含量(total phenolic content,TPC)和花色苷含量以及总抗氧化活性,旨在监测2 种草莓成熟过程中与风味、生理功能活性相关的特征品质变化。
1.1 材料与试剂
‘米拉’和‘哈尼’草莓采自浙江省杭州市草莓种植园(东经120.13°、北纬30.27°);乙腈为色谱纯,其余试剂均为国产分析纯。
1.2 仪器与设备
50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane(DVB/ CAR/PDMS)萃取头 美国Supelco公司;折光仪美国ATAGO公司;848 Titrino Plus自动滴定仪(配801搅拌器) 瑞士万通公司;4000气相色谱-质谱(gas chromatography-mass spectroscopy,GC-MS)联用仪(配CombiPAL自动进样) 美国Varian公司;1100系列高效液相色谱(high performance liquid chromatography,HPLC)仪(配光电二极管阵列检测器) 美国安捷伦公司;紫外-可见全光谱酶标仪 美国伯腾仪器有限公司。
1.3 方法
1.3.1 TSS和TA含量的测定
样品预处理:将捣碎后的草莓果实用纱布过滤,得到果汁待测。
TSS含量测定:用折光仪直接测定果汁,结果以°Brix表示;TA含量测定:取果汁4 g用20 mL蒸馏水稀释后用自动电位滴定仪测定,用0.5 mol/L NaOH溶液滴定至pH 8.5 [15]为终点,结果以g/100 g柠檬酸表示。
1.3.2 芳香物质的测定
采用固相微萃取-GC法进行测定。
考虑到提取条件对测定结果有一定影响,因而分别对草莓冻干粉与提取液(饱和食盐水)体积分数、提取时间和提取温度等参数进行优化。采用‘哈尼’草莓全熟果实为试材,分别用质量浓度1、10、50 g/100 mL的提取液,提取时间为5、15、30、60 min,以及提取温度为30 ℃和60 ℃参数条件下对草莓果实的芳香物质成分进行分析,得出最佳提取参数 [16]。
以得出的最佳提取参数进行实验,取一定量的不同草莓果实样品冻干粉 [15]与等量饱和食盐水混合,置于20 mL的样品瓶内,用磁力搅拌器搅拌1 min使充分混合。同时向样品瓶中加入100 μL 5.24 μg/mL 2-辛酮溶液作为内标物校正柱温、流动相等条件造成的保留时间漂移,以聚四氟乙烯/硅隔垫加盖封好;于5 min内将萃取温度上升到最佳温度,并用50/30 μm DVB/CAR/PDMS萃取头顶空萃取一定时间后,于1177注射器解吸5 min后,转入GC进样。
GC条件:VF-Xms色谱柱(30 m×0.32 mm,1.00 μm);分流比1∶5;进样速率2.5 mL/min;进样口温度250 ℃;升温程序:起始温度35 ℃保持5 min,以10 ℃/min升温至240 ℃,保持4.5 min。
MS条件:电子电离源;质量扫描范围为35~400 u;发射电流25 μA;扫描时间0.60 s(4 μscans);目标计数20 000 个;传输线温度170 ℃;离子阱温度100 ℃;歧管温度50 ℃;离子源温度180 ℃。
之后将样品GC-MS分析所得的质谱图与各标样质谱图进行比对分析,采用NIST进行检索确定挥发性香气成分,部分芳香物质含量用标准化峰面积表示,各挥发性成分总含量以μg/g(湿基)计。
1.3.3 花色苷的提取和测定
用高效组织匀浆机充分混合7.5 g不同草莓果实样品的冻干粉与15 mL色苷提取液甲醇-丙酮-水-甲酸(40∶40∶20∶0.1,V/V)溶液2 min [4],用9 cm玻璃纤维过滤膜过滤,并用提取液定容至25 mL。样品提取混合物进行冷冻干燥至恒质量,复溶至5%乙腈溶液(用三氟乙酸(trifluoroacetic acid,TFA)调节pH值至1.35),充分溶解并于20 000 r/min离心15 min后,取过完滤膜的上清液即为HPLC供试样品 [17-18]。
HPLC条件:Zorbax SB-C 18色谱柱(2.1 mm× 50 mm,1.8 μm);进样量20 μL;流动相:A为水(TFA调pH 1.35),流动相B为乙腈(TFA调pH 1.35);起始条件:95%流动相A和5%流动相B;梯度洗脱条件:0~12.5 min,5%~10% B,12.5~43.75 min,10%~20% B,43.75~45 min,20%~100% B,45~50 min,100% B,50~55 min,100%~5% B;流速0.4 mL/min;检测波长280 nm和520 nm。
测定后获得HPLC谱图中各色谱峰的保留时间和峰面积数值。根据各花色苷标准品的回归方程,计算各供试样品中主要花色苷组分的含量。其中花色苷主要成分为天竺葵素-3-葡糖苷(pelargonidin-3-glucoside,P3G)、天竺葵素-3-芸香糖苷(pelargonidin-3-rutinoside,P3R)和天竺葵素-3-丙二酰葡糖苷(pelargonidin-3-glucosidemalonate,P3GM)均以每100 g鲜质量中P3G当量(P3G equivalent,P3GE)的毫克量计,即mg P3GE/100 g;矢车菊素-3-葡糖苷(cyanidin-3-glucoside,C3G)和矢车菊素-3-丙二酰葡糖苷(cyanidin-3-glucoside-malonate,C3GM)均以经草莓样品干质量中C3G与草莓含水量比例计算得到每100 g鲜质量中C3G当量(C3G equivalent,C3GE)的毫克量计,即mg C3GE/100 g。而总花青素含量(total anthocyanin content,TAC)分别以C3GE和P3GE表示。
1.3.4 TPC的测定
以10 mL甲醇-水-乙酸(80∶19∶1,V/V)提取液溶解0.5 g冻干至恒质量的草莓果实样品,置于15 mL样品瓶中,混匀后超声提取5 min,在振荡提取1 h后,于3 000 r/min离心10 min;取上清液经0.45 μm滤膜过滤,得到的提取液置于-20 ℃贮存,备用。
TPC使用改进的斐林试剂法测定 [5]。取0.2 mL提取液加入1 mL斐林试剂混匀后与室温条件下反应30 min,之后加入0.8 mL 7.5%碳酸钠溶液混合;取其混合物200 μL加入96 孔反应板。利用紫外-可见全光谱酶标仪测定在波长765 nm处吸光度,以80%甲醇作为空白对照,以质量浓度为20~100 μg/mL没食子酸按上述方法做标准曲线,得出回归方程,将样品吸光度代入方程计算TPC,TPC表示为每克干质量中没食子酸当量(gallic acid equivalent,GAE)的毫克量计,即mg GAE/g [19]。
1.3.5 TFC的测定
TFC采用比色法测定。以4 mL蒸馏水稀释1 mL提取液,之后立刻加入0.3 mL质量浓度为5 g/100 mL NaNO 2溶液,混匀静置5 min后加入0.6 mL 10 g/100 mL AlCl 3溶液,混匀静置6 min后加入2 mL 1 mol/L NaOH溶液;之后加入2.4 mL蒸馏水稀释并充分混合。取其混合物200 μL加入96 孔反应板,利用紫外-可见全光谱酶标仪于波长510 nm处测定吸光度,以蒸馏水作为空白对照,以不同质量浓度的儿茶素按上述方法做标准曲线,得出回归方程,将样品吸光度代入计算TFC。结果以每克干质量中儿茶素当量(catechin equivalent,CE)的毫克量计,即mg CE/g [19]。
1.3.6 总抗氧化能力的测定
总抗氧化-亚铁还原能力(ferric reducing-antioxidant power,FRAP)测定利用酸性条件下水溶性抗氧化物(亲水性抗氧化剂)可以还原Fe 3+-三吡啶基三嗪(tripyridyltriazine,TPTZ)产生蓝色的Fe 2+-TPTZ。取10 μL标样或实验样品提取液与300 μL Fe 3+-TPTZ工作液混合后加入到96 孔反应板中,于37 ℃温度条件下反应1 h后,利用紫外-可见全光谱酶标仪测定样品混合液于波长593 nm处吸光度。总抗氧化能力以FRAP值表示,以500 mmol/L L-抗坏血酸作为基准,以每克干质量中抗坏血酸当量(ascorbic acid equivalent,AAE)的毫克量计,即mg AAE/g [20]。
1.3.7 氧自由基吸收能力(oxygen radical absorption capacity,ORAC)的测定
ORAC测定是利用荧光素在有自由基作用条件下被氧化,荧光强度逐渐减弱;当有抗氧化剂存在时,荧光强度检索被抑制,且抗氧化剂对荧光素荧光强度的保护能力与其浓度成正比原理来进行测定,其中荧光素作为氧化底物,偶氮二异丁脒盐酸盐(2,2’-azobis-2-methylpropionamidine-dihydrochloride,AAPH)为自由基产生剂,以水溶性VE(Trolox)作为标准,用来定量样品的抗氧化能力 [21-22]。
测定试剂均使用74 mmol/L磷酸缓冲液(pH 7.4)配制。取25 μL样品提取液用80%甲醇溶液稀释50 倍,加入到96 孔反应板中并加入150 μL 8.68×10 -5mmol/L荧光素工作液与之混合,混合物在37 ℃温度条件下反应30 min。反应以加入25 μL 153 mmol/L AAPH的时刻为开始,最大强度振荡10 s。每隔1 min记录荧光值,所设激发波长和发射波长分别为485 nm和528 nm。同时实验以水作空白对照,以浓度为3.125~100 μmol/L的Trolox做线性标准曲线。最终结果以样品和空白对照之间的荧光衰退曲线下面积(area under the fl uorescence decay curve,AUC)大小的差异来计算,表示为每克干质量中Trolox当量(trolox equivalent,TE)的微摩尔数,即μmol TE/g。按下式计算AUC:
式中:f 4代表第4个测定点时的相对荧光强度;f i代表第i个测定点时的相对荧光强度;CT为相邻2 个测定点之间的间隔。
1.4 数据统计
采用GenStat(15 thedition)软件对实验进行设计,每个指标的每个测量点来自于3 个生物性重复和3 个技术重复的平均值,结合GenStat和Microsoft ®Excel软件进行数据统计和分析。测定指标均重复3 次。采用Sigmaplot 12.0软件作图,图中数据均为平均值,误差以平均值的标准误差表示。采用SPSS 11.5软件对所有数据在P值为0.05水平上进行Duncan多重比较差异显著性分析,并对芳香物质、TAC、TPC、TFC、TSS和TA含量以及抗氧化能力等进行主成分分析(principal component analysis,PCA),相关性分析采用Pearson相关分析。
2.1 草莓成熟过程中TSS和TA含量的变化
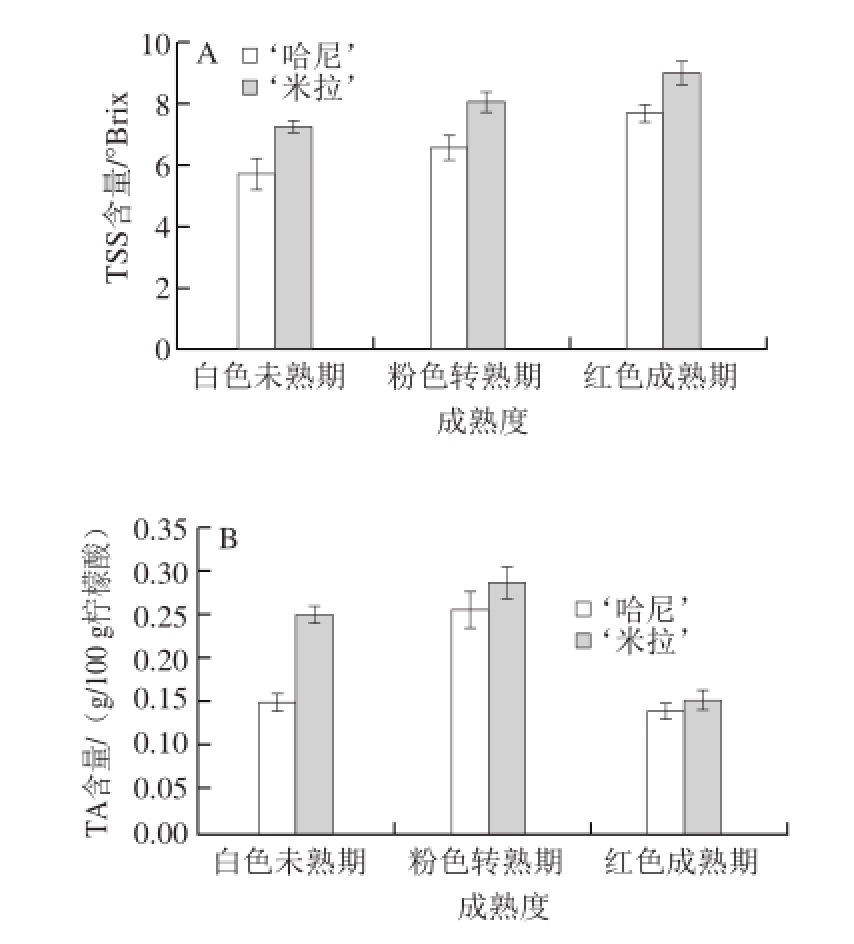
图1 草莓成熟过程中TSS(A)和TA(B)含量的变化
Fig.1 Changes in TSS (A) and TA (B) contents in strawberry fruits during ripening
如图1所示,草莓果实在不同成熟阶段,TSS和TA含量都有显著性的变化。TSS含量在‘米拉’和‘哈尼’2 种草莓中都随着果实由白色未熟期到红色成熟期而逐步上升。而TA含量在2 种草莓的粉色转熟期达到最高,到红色成熟期时有明显下降,甚至低于白色未熟期。此结果与目前在其他草莓品种中测定结果相一致 [23-24]。从总体实验结果来看,‘米拉’的TSS和TA含量较‘哈尼’高。
2.2 草莓芳香挥发性组分分析
如图2所示,当提取液质量浓度50 g/100 mL、提取时间60 min、提取温度60 ℃时,大多数所测定的特征芳香组分提取率最高。因而选择草莓果实样品香气成分的最佳提取参数为:提取液质量浓度50 g/100 mL、提取时间60 min、提取温度60 ℃。
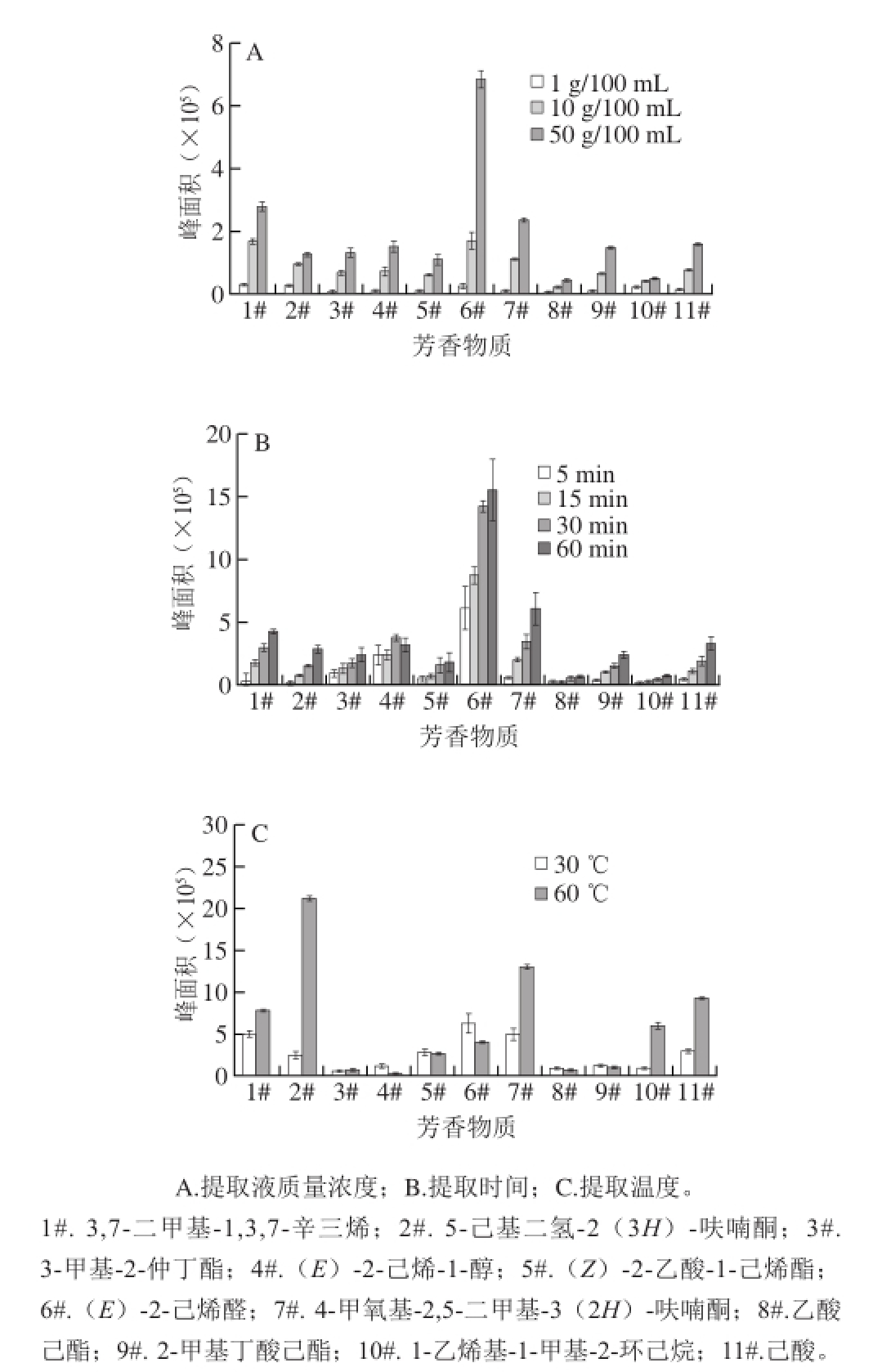
图2 不同提取参数条件下‘哈尼’草莓红色果实的部分芳香物质
Fig.2 Volatile contents extracted under different conditions from the red part of ‘Honeoye’ strawberry fruits

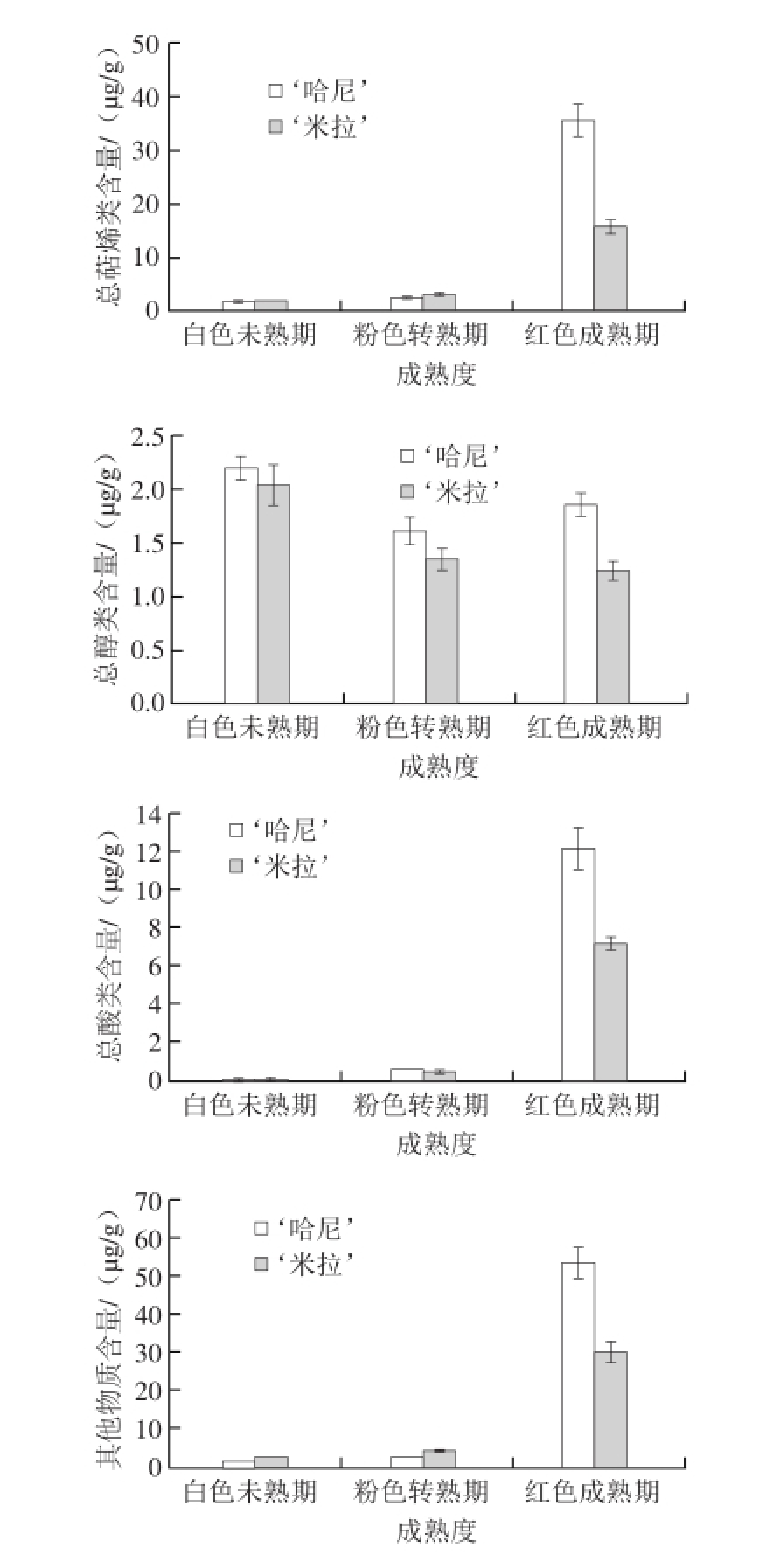
图3 草莓成熟过程中各挥发性成分含量的变化
Fig.3 Changes in the contents of total volatile compounds in strawberry fruits during ripening
选取上述最佳参数进行实验,如图3所示。2 种草莓果实在成熟过程中各种芳香挥发性组分都有显著性的变化,且总挥发性组分含量都随着果实由白色未熟期到红色成熟期逐步上升,其中当草莓由粉色转熟期到红色成熟期的过程中,总挥发性组分含量有一个显著性上升,在‘米拉’草莓的红色成熟期总挥发性组分含量达到转熟期含量的2 倍,在‘哈尼’中红色成熟期总挥发性组分含量甚至达到转熟期含量的3 倍。在芳香挥发性物质组分中,酯类物质占绝大多数 [25],红色成熟期总酯类含量上升至白色未熟期的8 倍;总萜烯类物质、总酸类物质和其他类物质总含量在白色未熟期和粉色转熟期时都较低,而在红色成熟期含量达到最高,可见草莓成熟过程中萜烯类、酸类等挥发性组分主要由粉色转熟期到红色成熟期之间产生;与之不同的是总醇类物质,其在‘哈尼’在粉色转熟期时最低,在红色成熟期时有所上升但仍低于白色未熟期,在‘米拉’中是含量是逐步递减的。
2.3 草莓成熟过程中的花色苷组分分析

图4 草莓成熟过程中花色苷组分含量的变化
Fig.4 Changes in anthocyanin contents in strawberry frui during ripening ts
如图4所示,随着草莓的成熟,果实含有花色苷的种类和含量均有显著性上升。2 种草莓在白色未熟期各种类的花色苷含量都很低,而到粉色转熟期各类花色苷含量有一定上升,而到红色成熟期各类花色苷含量均有极大幅度的上升,上升比例超过草莓由白转粉过程中花色苷的比例。可见草莓果实中花色苷的大量产生处于粉色转熟期到红色成熟期过程中,此实验结果与草莓表观颜色变化过程相一致 [4,19]。同时可以看到在红色成熟期‘哈尼’的P3G、C3G含量显著高于‘米拉’,而P3R含量与‘米拉’相当,没有显著性差异,P3GM和C3GM的含量低于‘米拉’。
2.4 草莓成熟的生物活性成分和抗氧化能力
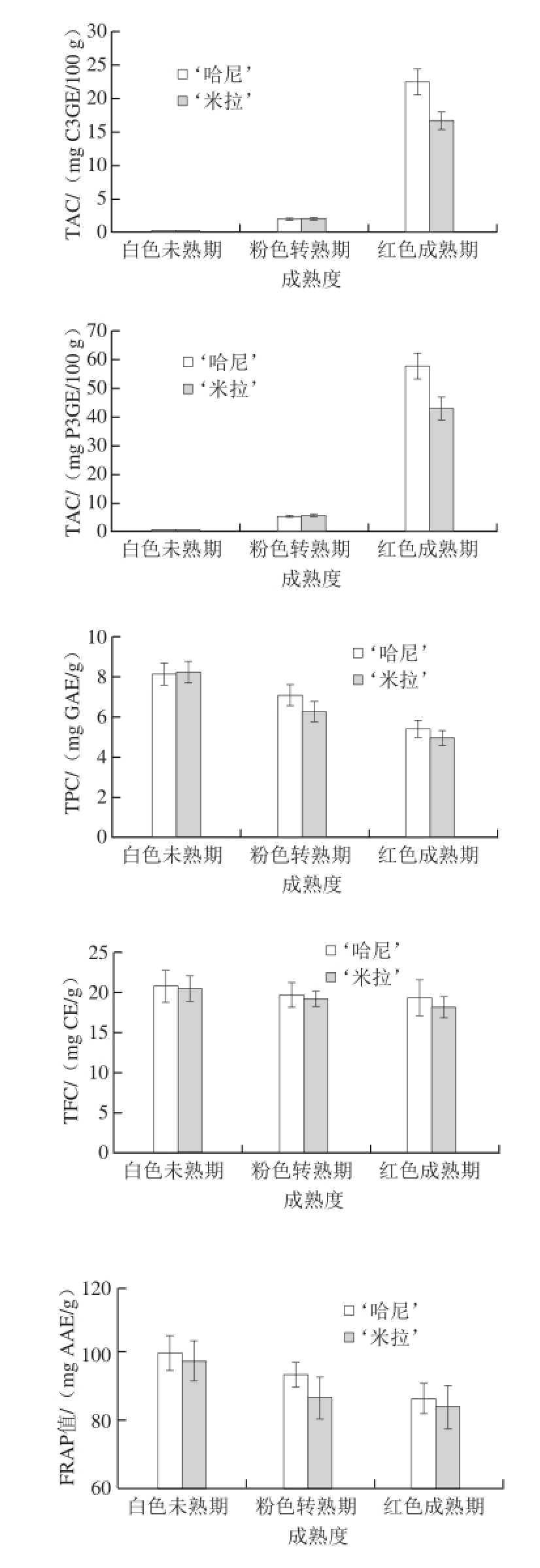
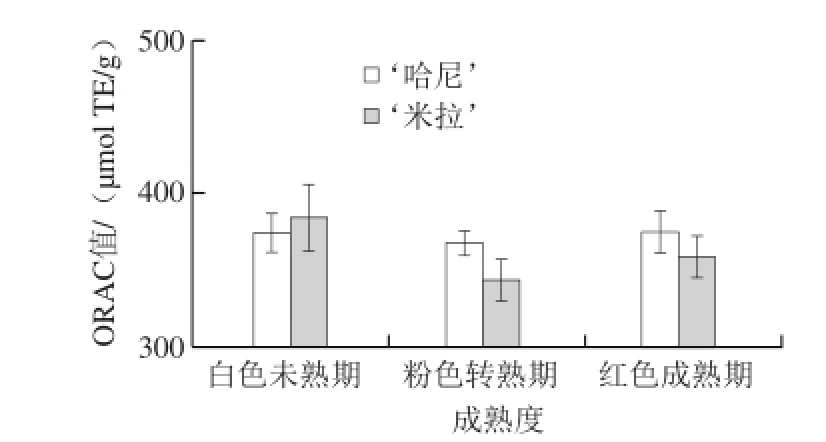
图5 草莓成熟过程中生物活性成分与抗氧化能力的变化
Fig.5 Changes in the contents of biologically active components and antioxidant capacity during strawberry ripening
如图5所示,TAC在果实的不同成熟阶段都具有显著性差异,从白色未熟期到红色成熟期草莓TAC含量显著上升,此结果与2.3节结果中花色苷组分的变化结果相一致,‘哈尼’TAC显著高于‘米拉’。
此外,2 种草莓中的TFC在果实成熟的过程中均显著性下降,这与文献[26-29]报道的其他品种草莓情况相类似,而TPC略有下降但没有显著性差别,可能的原因是草莓中酚类物质组成较复杂,包含花青素、原花青素、类黄酮和儿茶素等 [28-29];而在草莓成熟过程的花色苷类明显上升、黄酮类显著下降,导致总酚类物质变化并不明显。而在红色成熟期‘哈尼’中TFC和TPC均略高于‘米拉’。
抗氧化能力方面,以FRAP指标来看,随着草莓成熟其提取物的抗氧化能力有显著的下降,与目前对草莓成熟期中抗氧化性研究结果相一致 [26-27,30],同时‘哈尼’的抗氧化性能显著高于‘米拉’。以ORAC指标来看,2 种草莓都是在粉色转熟期的抗氧化效应最低,在‘米拉’中红色成熟期抗氧化效应较之转熟期有显著上升但仍低于白色未熟期,而在‘哈尼’中抗氧化效应没有显著性变化。以在红色成熟期的FRAP和ORAC指标综合来看,‘哈尼’的抗氧化性能高于‘米拉’,成熟期的草莓抗氧化能力低于未熟期,可能原因是具有高抗氧化能力的咖啡酸等物质含量的降低。FRAP和ORAC抗氧化性能在草莓成熟过程中的变化趋势并不一致,可能是FRAP和ORAC所测定抗氧化原理不同,在草莓成熟过程中其内在组分的变化导致其对自由基和铁离子的还原性能变化趋势有所差异。
2.5 相关性分析和PCA
表1 草莓成熟过程中特征品质参数之间的相关性分析
Table1 Correlation analysis among characteristic quality parameters in strawberry fruits during ripening

注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
?
从表1可以看出,在草莓成熟过程中上述的特征品质参数之间均呈正相关性,其中TAC以及TA与其他特征品质参数无显著相关性;TPC与TFC、TSS以及抗氧化能力指标有极显著正相关性;TFC与TSS有显著正相关性,与抗氧化能力指标有极显著正相关性;抗氧化指标FRAP与ORAC之间呈极显著正相关性,同时都与TSS有极显著正相关性。
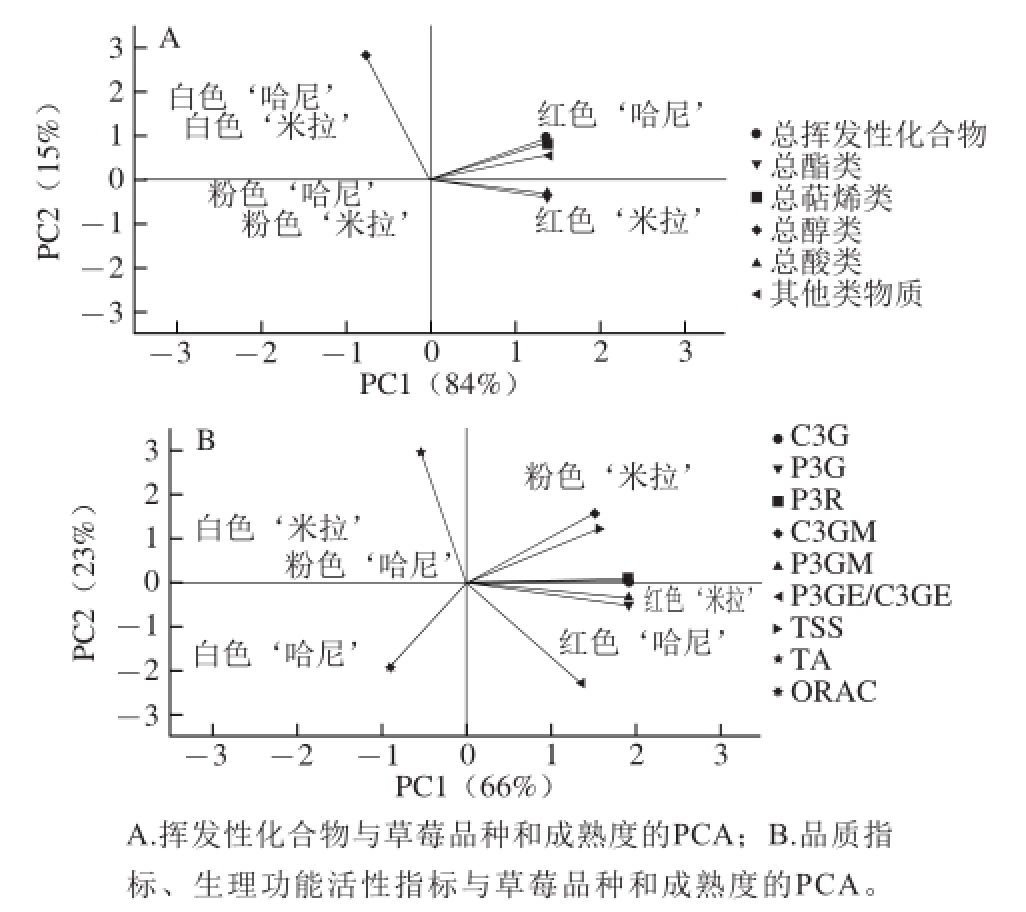
图6 草莓成熟过程中香气成分以及其他特征品质参数之间的PCA
Fig.6 Principal component analysis for correlations of volatile compounds and other characteristic quality parameters in strawberry fruits during ripening
如图6所示,‘哈尼’和‘米拉’的白色未熟期与总醇类呈正相关,粉色转熟期与总挥发性化合物、萜烯类和其他类挥发性物质的积累量呈负相关,红色成熟期与总挥发性化合物、总萜烯类、总酸类、总酯类等积累量呈正相关。如图6B所示,‘哈尼’和‘米拉’草莓的白色未熟期仅与TA具有正相关性,红色成熟期与C3G、P3G、P3R、C3GM、P3GM 之类花色苷和TSS积累量呈正相关,而粉色转熟期与各项成分的积累量的相关性不明显,各项成分相关性与上述表1相关性分析结果一致,PCA结果进一步验证了草莓果实的成熟度与芳香性挥发成分和花色苷组分积累量的正相关性,并证明了芳香物质和花色苷成分合成与果实成熟之间的正相关性。
随着‘哈尼’和‘米拉’草莓由白色未熟期至红色成熟期的成熟过程,其果实中的TSS、TA、芳香性挥发成分、花色苷组分、TPC、TFC以及抗氧化能力都有显著性的变化,其中TSS、芳香性挥发成分、花色苷成分积累量有显著性上升,可见在红色全熟期时可能是一些感官风味特征性品质最佳的阶段,而TA、TPC、TFC和抗氧化能力都有所下降。而从相关性和PCA中得出在成熟过程中2 种草莓果实的TPC、TFC、TSS、TA含量均与FRAP和ORAC的变化之间存在显著的高相关性(r为0.859 1~0.994 7),而TAC与FRAP和ORAC之间的相关性仅为0.315 0和0.385 3,同时得出草莓果实的成熟度与芳香性挥发成分和花色苷组分积累量呈正相关性,证明芳香物质和花色苷成分合成与果实成熟之间呈正相关性。以此可见2 种草莓在成熟过程中各项特征品质都有显著变化,可在一定程度上反映草莓成熟过程中新陈代谢的变化,可进一步应用到草莓的代谢研究中。
参考文献:
[1] 阮金兰, 陈静波, 赵晓亚, 等. 草莓的化学成分研究[J]. 中国中药杂志, 2001, 26(9): 610-612. DOI:10.3321/j.issn:1001-5302.2001.09.013.
[2] 程然, 生吉萍. 草莓多酚类植物化学物研究进展[J]. 食品安全质量检测学报, 2015, 7(2): 575-584.
[3] 张豫超, 苗立祥, 杨肖芳, 等. 草莓不同成熟度果实品质变化研究[C]//中国园艺学会草莓研究进展(Ⅵ). 北京: 中国园艺学会草莓分会, 2015: 123-128.
[4] CRECENTE-CAMPO J, NUNES-DAMACENO M, ROMERORODRÍGUEZ M A, et al. Color, anthocyanin pigment, ascorbic acid and total phenolic compound determination in organic versus conventional strawberries (Fragaria × ananassa, Duch. cv Selva)[J]. Journal of Food Composition and Analysis, 2012, 28(1): 23-30. DOI:10.1016/j.jfca.2012.07.004.
[5] CHANDLER C K, STAPLETON S C. Transplant source affects fruiting performance and pests of ‘Sweet Charlie’ strawberry in Florida[J]. Horttechnology, 2001, 11(1): 61-64.
[6] GUTHRIE F, PREECE W H, FOSTE R, et al. The potential impact of strawberry on human health[J]. Natural Product Research, 2013, 27(4/5): 448-455. DOI:10.1080/14786419.2012.706294.
[7] GIAMPIERI F, TULIPANI S, ALVAREZ-SUAREZ J M, et al. The strawberry: composition, nutritional quality, and impact on human health[J]. Nutrition, 2012, 28(1): 9-19. DOI:10.1016/j.nut.2011.08.009.
[8] TULIPANI S, ARMENI T, GIAMPIERI F, et al. Strawberry intake increases blood fluid, erythrocyte and mononuclear cell defenses against oxidative challenge[J]. Food Chemistry, 2014, 156(2): 87-93. DOI:10.1016/j.foodchem.2014.01.098.
[9] GIAMPIERI F, ALVAREZSUAREZ J M, BATTINO M. Strawberry and human health: effects beyond antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2014, 62(18): 3867-3876. DOI:10.1021/jf405455n.
[10] 王志巧. 草莓酚类成分的抗肿瘤及抗氧化作用研究[D]. 长春: 吉林大学, 2015.
[11] 罗娅, 王小蓉, 张勇, 等. 不同提取条件对草莓果实抗氧化物质和抗氧化活性的影响[J]. 食品科学, 2011, 32(14): 108-112.
[12] MAZUR S P, NES A, WOLD A B, et al. Effects of ripeness and cultivar on chemical composition of strawberry (Fragaria × ananassa, Duch.) fruits and their suitability for jam production as a stable product at different storage temperatures[J]. Food Chemistry, 2014, 146(3): 412-422. DOI:10.1016/j.foodchem.2013.09.086.
[13] DIAMANTI J, CAPOCASA F, DENOYES B, et al. Standardized method for evaluation of strawberry (Fragaria × ananassa, Duch.) germplasm collections as a genetic resource for fruit nutritional compounds[J]. Journal of Food Composition and Analysis, 2012, 28(2): 170-178. DOI:10.1016/j.jfca.2012.07.007.
[14] LI L, SONG J, KALT W, et al. Quantitative proteomic investigation employing stable isotope labeling by peptide dimethylation on proteins of strawberry fruit at different ripening stages[J]. Journal of Proteomics, 2013, 94(20): 219-239. DOI:10.1016/j.jprot.2013.09.004.
[15] LI L, LUO Z, HUANG X, et al. Label-free quantitative proteomics to investigate strawberry fruit proteome changes under controlled atmosphere and low temperature storage[J]. Journal of Proteomics 2015, 120: 44-57. DOI:10.1016/j.jprot.2015.02.016.
[16] NIU Y, HARDY G, AGARWAL M, et al. Characterization of volatiles Tribolium castaneum (H.) in fl our using solid phase microextractiongas chromatography mass spectrometry (SPME-GCMS)[J]. Food Science and Human Wellness, 2015, 5(1): 24-29. DOI:10.1016/ j.fshw.2015.11.002.
[17] 罗赟, 陈宗玲, 宋卫堂, 等. 草莓果实花色苷成分组成鉴定及分析[J]. 中国农业大学学报, 2014, 19(5): 86-94. DOI:10.11841/ j.issn.1007-4333.2014.05.12.
[18] 荣宁宁, 苗立祥, 杨肖芳, 等. 反相高效液相色谱法测定草莓天竺葵素-3-O-葡萄糖苷的含量[J]. 浙江农业学报, 2014(3): 626-631. DOI:10.3969/j.issn.1004-1524.2014.03.16.
[19] VOĆA S, ZLABUR J S, DOBRIČEVIĆ N, et al. Variation in the bioactive compound content at three ripening stages of strawberry fruit[J]. Molecules, 2014, 19(7): 10370-10385. DOI:10.3390/ molecules190710370.
[20] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76. DOI:10.1006/ abio.1996.0292.
[21] CAO G, PRIOR R L, CUTLER R G, et al. Effect of dietary restriction on serum antioxidant capacity in rats[J]. Archives of Gerontology and Geriatrics, 1997, 25(3): 245-253. DOI:10.1016/S0167-4943(97)00014-9.
[22] ATALA E, ASPÉE A, SPEISKY H, et al. Antioxidant capacity of phenolic compounds in acidic medium: a pyrogallol red-based ORAC (oxygen radical absorbance capacity) assay[J]. Journal of Food Composition and Analysis, 2013, 32(2): 116-125. DOI:10.1016/ j.jfca.2013.09.007.
[23] 顾采琴, 朱冬雪. 草莓成熟过程中生理生化特性的变化[J]. 山地农业生物学报, 1998(6): 345-348.
[24] SEVERO J, TIECHER A, CHAVES F C, et al. Gene transcript accumulation associated with physiological and chemical changes during developmental stages of strawberry cv. Camarosa[J]. Food Chemistry, 2011, 126(3): 995-1000. DOI:10.1016/j.foodchem.2010. 11.107.
[25] DU X, PLOTTO A, BALDWIN E, et al. Evaluation of volatiles from two subtropical strawberry cultivars using GC-olfactometry, GC-MS odor activity values, and sensory analysis[J]. Journal of Agricultural and Food Chemistry, 2011, 59(23): 12569-12577. DOI:10.1021/ jf2030924.
[26] PROTEGGENTE A R, PANNALA A S, PAGANGA G, et al. The antioxidant activity of regularly consumed fruit and vegetables ref l ects their phenolic and vitamin C composition[J]. Free Radical Research, 2009, 36(2): 217-233. DOI:10.1080/10715760290006484.
[27] LUO Y, TANG H R, WANG X R, et al. Antioxidant properties and involved antioxidant compounds of strawberry fruit at different maturity stages[J]. Journal of Food Agriculture and Environment, 2011, 9(1): 166-170.
[28] BUENDÍA B, GIL M I, TUDELA J A, et al. HPLC-MS analysis of proanthocyanidin oligomers and other phenolics in 15 strawberry cultivars[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 3916-3926. DOI:10.1017/S0025315400044556.
[29] AABY K, MAZUR S, NES A, et al. Phenolic compounds in strawberry (Fragaria × ananassa, Duch.) fruits: composition in 27 cultivars and changes during ripening[J]. Food Chemistry, 2012, 132(1): 86-97. DOI:10.1016/j.foodchem.2011.10.037.
[30] PINELI L D L D O, MORETTI C L, SANTOS M S D, et al. Antioxidants and other chemical and physical characteristics of two strawberry cultivars at different ripeness stages[J]. Journal of Food Composition and Analysis, 2011, 24(1): 11-16. DOI:10.1016/ j.jfca.2010.05.004.
Variations in Quality Characteristics of Two Strawberry Cultivars during Fruit Ripening
YAN Jiawei
1, LU Hongyan
1, LI Li
1,*, LUO Zisheng
1, LI Dongdong
1, SONG Jun
2, BAN Zhaojun
3
(1. College of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310058, China; 2. Agriculture and Agri-Food Canada, Nova Scotia B4J 1J5, Canada; 3. School of Biological and Chemical Engineering/ School of Light Industry, Zhejiang University of Science and Technology, Hangzhou 310023, China)
Abstract:In the present study, the variations in fruit quality characteristics related to the fl avor and physiological quality in two strawberry cultivars, ‘Mira’ and ‘Honeoye’, were investigated during three ripening stages. Results showed that total soluble solids (TSS), volatile aromatic components and anthocyanins accumulation signif i cantly increased, while total acid (TA), total phenolics and total fl avonoid contents as well as antioxidant capacity declined during strawberry ripening. The correlations between the quality traits were analyzed by principal component analysis. It was indicated that there were high correlations (r = 0.859 1–0.994 7) between the changes in total phenolics, fl avonoids, total soluble solid or titratable acid and antioxidant capacity (FRAP) as well as oxygen radical absorbance capacity (ORAC) during strawberry ripening, while the correlation coeff i cients between total anthocyanin and ferric reducing antioxidant power (FRAP) as well as ORAC were only 0.315 0 and 0.385 3, respectively. Furthermore, a positive correlation between the maturity of strawberry fruits and the accumulation of aromatic volatile components and anthocyanins was also observed.
Key words:strawberry; ripening; volatile compounds; anthocyanins; quality characteristics
DOI:10.7506/spkx1002-6630-201704021
中图分类号:TS255.1
文献标志码:A
文章编号:1002-6630(2017)04-0125-08
引文格式:
严嘉玮, 路洪艳, 李莉, 等. 2 种草莓成熟过程中果实特征品质指标的变化[J]. 食品科学, 2017, 38(4): 125-132.
DOI:10.7506/spkx1002-6630-201704021. http://www.spkx.net.cn
YAN Jiawei, LU Hongyan, LI Li, et al. Variations in quality characteristics of two strawberry cultivars during fruit ripening[J]. Food Science, 2017, 38(4): 125-132. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201704021. http://www.spkx.net.cn
收稿日期:2016-06-29
基金项目:国家自然科学基金青年科学基金项目(31401547);国家自然科学基金面上项目(31571895);浙江省自然基金一般项目(LY17C200008;LY17C200014);公益性行业(农业)科研专项(201303073);山东省自然科学基金青年基金项目(ZR2014CQ019)
作者简介:严嘉玮(1993—),女,硕士研究生,研究方向为果蔬采后生物学。E-mail:yjw_032@163.com
*通信作者:李莉(1984—),女,讲师,博士,研究方向为果蔬采后生物学。E-mail:lili1984@zju.edu.cn