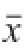 ±s表示,用软件SPSS 19.0进行数据分析。
±s表示,用软件SPSS 19.0进行数据分析。
林晓龙 1,佳木泰 2,郭海燕 1,王全喜 2,芒 来 2,贺银凤 1,吴 敬 1,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2.内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018)
摘 要:为获得应用潜力较高的抗菌菌株,对内蒙古地区传统乳制品中分离的8 株乳酸杆菌进行抗菌菌株筛选,获得了一株具有广谱抗菌活性的菌株(编号为Q-1-4)。经常规生理生化及分子生物学实验,鉴定该菌为副干酪乳杆菌(Lactobacillus paracasei)。通过实验排除有机酸和过氧化氢干扰后,L. paracasei Q-1-4发酵离心后的无细胞发酵上清液(cell-free fermentation supernatant,CFS)对鼠伤寒沙门氏菌Salmonella typhimurium CMCC50115仍具有抑制作用,且经蛋白酶处理后抗菌活性下降,说明L. paracasei Q-1-4所产抗菌物质中含有蛋白类物质。其在pH 2.0~5.5范围内对鼠伤寒沙门氏菌有抑制作用,且在此pH值范围内该抗菌物质对热稳定,对紫外线不敏感;与十二烷基硫酸钠、乙二胺四乙酸共同作用效果好于单一作用,而其他的表面活性剂、有机溶剂、金属离子对其无明显影响;该抗菌物质具有一定的贮藏稳定性且抑菌谱较广。
关键词:副干酪乳杆菌;抗菌物质;特性
近年来从干酪乳杆菌中划分出一个新种即副干酪乳杆菌(Lactobacillus paracasei),但对其在分类学中的地位一直存有争议。L. paracasei具有耐酸和耐胆盐能力,某些菌株还有抗过敏作用,能够调节人体肠道菌群平衡、增强免疫功能、预防疾病等。另外,许多研究表明,在发酵干酪成熟的过程中,L. paracasei可以控制并促进几种重要的芳香物质和风味物质形成 [1-4], 改善乳制品质量。
目前对L. paracasie的研究多数集中在利用其益生特性开发新的乳制品方面,对其产生的细菌素的研究相对较少。Sa等 [5]从生驴奶中分离筛选得到了1 株L. paracasei,并通过实验证明了这株菌的细菌素粗提物对伤寒沙门氏菌Salmonella typhi有很强的抑制作用,其最小抑菌浓度为128 μL/mL;Hassan等 [6]发现副干酪乳杆菌坚韧亚种L. paracasei ssp. tolerans L17不但可以作为酸面包发酵剂,而且还可以有效地抑制层生镰刀菌Fusarium proliferatum M5689,禾谷镰刀菌Fusarium graminearum R4053和白曲霉Aspergillium candidus C25等产毒素真菌。Lozo等 [7]通过大量的实验,从塞尔维亚高原地区自然发酵的半硬质干酪中分离得到的一株L. paracasei subsp. paracasei BGSJ2-8,能够产生第2类细菌素BacSJ,是一种具有热稳定性的未经修饰的的小分子肽。这些资料表明L. paracasei具有产生具有抑菌作用的蛋白类细菌素。L. paracasei所产细菌素具有很多优良特性,具有天然食品防腐剂的潜力,如某些菌株产生的细菌素在pH 3~12均有抑菌活性,对热有极好的耐受性,在可在4 ℃条件下可贮藏6 个月或-20 ℃条件下贮藏长达12 个月 [8]。
本研究通过抑菌实验对分离自内蒙古传统乳制品中的乳酸杆菌进行筛选,得到受试菌株L. paracasei Q-1-4,对其进行生理生化和分子生物学鉴定,并确定所产抗菌物质的性质,为开发具有新型生物防腐剂功能的细菌素产生菌提供了理论依据。
1.1 菌株、培养基与试剂
供试菌株:内蒙古牧民家庭手工制作的酸马奶样品中分离得到8 株乳酸杆菌;其他11株菌由内蒙古农业大学食品科学与工程学院提供,分别为:Bacillus cerecus CGMCC1.1686、Geobacillus stearo thermophilus GMCC1.1923、Streptococcus thermophilus CICC6038、Staphylococcus aureus CMCC(B)26112、Micrococcus luteus CMCC(B)28001、Listeria monocytogenes CMCC54002、Bacillus subtilis CGMCC1(B)63501、Pseudomonas fluarescens CGMCC1.1802、Salmonella enterica subsp. enterica CGMCC1.1859、Escherichia coli ATCC25922、Salmonella typhimurium CMCC50115。
MRS液体培养基、LB液体培养基、营养琼脂培养基根据文献[9-10]方法配制,固体培养基均添加1.5%~2%的琼脂。制备培养基使用的试剂均为国产分析纯。
蛋白酶K、胃蛋白酶、胰蛋白酶、木瓜蛋白酶、过氧化氢酶、溶菌酶 美国Sigma公司;其他化学试剂均为分析纯;细菌基因组DNA提取试剂盒、普通琼脂糖凝胶DNA回收试剂盒 天根生化科技(北京)有限公司;DNA Marker 宝生物工程(大连)有限公司;单盒生化鉴定管 广东环凯微生物科技有限公司。
1.2 仪器与设备
HPS-250生化培养箱 哈尔滨市东明医疗仪器厂;PB-10 pH计 赛多利斯科学仪器有限公司;HH.S1-Ni电热恒温水浴锅 北京长安科学仪器厂;BPG-9240A精密鼓风干燥箱 上海一恒科学仪器有限公司;BCN-1360型生物超净工作台 哈尔滨市东联电子技术开发有限公司;KDC-140HR高速冷冻离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 乳酸杆菌的活化及无细胞发酵上清液的制备
将半固体穿刺保存的实验菌株接种于MRS液体培养基中,37 ℃培养24 h,按2%接种量传3代,将最后一代液体培养物在冷冻离心机中以6 000 r/min的转速离心15 min后,旋转蒸发仪浓缩10倍,0.45 μm孔径的滤菌器过滤除菌,得无细胞发酵上清液,置于4 ℃保存备用 [11]。
1.3.2 指示菌菌悬液的制备
将保存的指示菌挑单菌落接入LB液体培养基中,37 ℃培养24 h后,以2%的接种量再活化两代,第3代培养24 h后。用0.85%无菌生理盐水梯度稀释至菌悬液浓度为10 6CFU/mL,置于4 ℃保存待用。
1.3.3 抑菌活性的测定
抑菌实验采用双层琼脂平板扩散法 [12]。以Salmonella typhimurium CMCC50115为指示菌,测待检菌中是否具有抑菌活性。
1.3.4 产抗菌物质乳酸杆菌的筛选及鉴定
1.3.4.1 菌株个体形态和生理生化鉴定
将半固体保存的实验菌株接种于MRS液体培养基培养两代。在固体培养基上划线培养,挑取单菌落,革兰氏染色后在光学显微镜下观察形态并对筛选出的乳酸杆菌做生理生化实验和糖发酵实验。根据《常见细菌系统鉴定手册》 [13]和《乳酸细菌分类鉴定及实验方法》 [14]中描述的特征进行分析鉴定。
1.3.4.2 分子生物学鉴定
根据细菌基因组D N A提取试剂盒中说明书进行总D N A提取,并以此D N A为模板,加入通用引物进行P C R扩增,正向引物为2 7 f:5’-AGAGTTTGATCCTGGCTCAG-3’;反向引物为1495r:5’-CTACGGCTACCTTGTTACGA-3’。PCR扩增体系为25 μL:上下游引物各1 μL,DNA模板1 μL,Ex Taq mix 12.5 μL,ddH 2O 9.5 μL,PCR的反应条件:94 ℃预变性5 min,94 ℃变性1 min,58 ℃复性1 min,72 ℃延伸2 min,30 次循环,最后72 ℃延伸5 min。
将PCR扩增产物委托上海生工生物工程股份有限公司测序及双向拼接后,在NCBI上用BLAST模块进行同源性比对,获得数据后使用DNAStar软件中Megalign程序绘制系统发育树并进行分析。
1.3.5 Q-1-4所产抗菌物质的确定
1.3.5.1 酸及酸性末端产物作用的排除
为排除酸性末端产物的干扰,将浓缩10倍的无细胞发酵上清液(cell-free fermentation supernatant,CFS)pH值调至5.0,以相同pH值的乳酸和乙酸为对照,进行抑菌实验。
1.3.5.2 过氧化氢作用的排除
乳酸杆菌代谢产生的过氧化氢也可抑制细菌的生长 [15]。将过氧化氢酶溶解并按终质量浓度为1 mg/mL加入到排酸后的CFS中,37 ℃水浴2 h后沸水煮沸5 min使酶灭活,进行抑菌实验。
1.3.5.3 蛋白酶对抗菌物质活性的影响
取5份等量的CFS,分别将pH值调至7.6、6.5、6.2、7.0、2.0,依次为胰蛋白酶、溶菌酶、木瓜蛋白酶、蛋白酶K和胃蛋白酶的最适pH值,按终质量浓度1.0 mg/mL加入各酶液,37 ℃温浴2 h后,沸水煮沸5 min使酶失活。将pH值调至排酸pH值,以未经酶处理的CFS为对照,进行抑菌实验。
1.3.6 Q-1-4所产抗菌物质的特性测定
1.3.6.1 pH值稳定性
分别用1 mol/L的HCl溶液和1 mol/L的NaOH溶液将CFS的pH值调为2.0、3.0、4.0、4.5、5.0、5.5、6.0,以相同pH值的MRS液体培养基为对照,进行抑菌实验。
1.3.6.2 热稳定性
将调至不同pH值的CFS分别于60、80、105、121 ℃条件下处理30 min,冰浴急冷后,以未温度处理的CFS为对照,进行抑菌实验。
1.3.6.3 紫外线敏感性
取等量的CFS 加到灭菌平皿中,于40 W紫外灯下距离40 cm分别辐照不同时间,以未经紫外处理的CFS为对照 [16],进行抑菌实验。
1.3.6.4 有机溶剂对抑菌活性的影响
按1.0%(V/V)添加甲醇、乙醇、丁醇、丙酮、氯仿到CFS中。以未经有机溶剂处理的CFS、加入相同用量有机溶剂处理的MRS液体培养基为对照 [16],进行抑菌实验。
1.3.6.5 表面活性剂对抑菌活性的影响
按1.0%(V/V)添加Tween-20、Tween-80、 TritonX-100、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、尿素到CFS中。以未经表面活性剂处理的CFS、加入相同用量表面活性剂处理的MRS液体培养基为对照 [17],进行抑菌实验。
1.3.6.6 金属离子对抑菌活性的影响
将CFS与溶解在50 mmol/L磷酸钠缓冲液(pH 7.0)中的不同金属离子溶液分别按1∶1体积比混合。以未经金属离子处理但加入相同体积超纯水的CFS及加入相同金属离子浓度处理的MRS液体培养基为对照 [18],进行抑菌实验。
1.3.6.7 贮藏稳定性
将CFS分别在25、4、-20 ℃条件下贮藏0、20、40、60 d,检测不同温度条件下贮藏不同时间后对指示菌抑菌活性的变化。
1.3.6.8 抑菌谱的测定
将不同的革兰氏阳性菌、革兰氏阴性菌活化3 代,第3代的培养菌数进行梯度稀释调节至10 6CFU/mL,进行抑菌实验。
1.4 数据处理
每个实验3 个平行,数据用
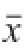 ±s表示,用软件SPSS 19.0进行数据分析。
±s表示,用软件SPSS 19.0进行数据分析。
2.1 产抗菌物质乳酸杆菌的筛选
表1 乳酸杆菌的抑菌活性
Table1 Antimicrobial activity of the screened strains

注:+++.抑菌圈直径16.0~20.0 mm;++.抑菌圈直径13.0~16.0 mm;+.抑菌圈直径8.0~13.0 mm。下同。
?
表1结果显示,8 株乳酸杆菌对S. typhimurium CMCC 50115均有抑制作用。但Q-1-4所产CFS对其的抑菌直径较大,故选定菌株Q-1-4为最终实验菌株。
2.2 菌株个体形态和生理生化鉴定
菌株分离纯化后,光学显微镜下菌体形态见图1。菌株Q-1-4生理生化鉴定结果见表2,表中这些生理生化特征与文献 [19]中描述的L. paracasei的特征相同,初步将菌株Q-1-4归入L. paracasei。L. paracasei的分类学地位一直饱受争议。2007年,在公布的乳杆菌属和种的分类中,德国微生物与细胞培养物保藏中心将L. paracasei直接划分为干酪乳杆菌菌群 [20]。由于L. paracasei与鼠李糖乳杆菌以及干酪乳杆菌中的其他亚种具有很高的相似性,需要结合分子生物学实验对其进行鉴定。
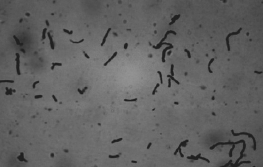
图1 菌株Q-1-4的菌体形态(10×100)
Fig.1 Mycelial morphology of strain Q-1-4
表2 菌株Q-1-4的生理生化特征
Table2 Physiological and biochemical characteristics of strain Q-1-4

注:+.阳性;—.阴性。
?
2.3 分子生物学鉴定
以菌株Q-1-4的细菌基因组DNA为模板,PCR扩增获得长度为1 500 bp的16S rDNA碱基序列。与GenBank中已知菌株的基因序列进行同源性比较,结果见表3,系统发育树见图2。
表3 菌株Q-1-4的同源性比较
Table3 Homology alignment of strain Q-1-4

注:上下部分数据分别为同源性百分比(%)和散度。1. Q-1-4;2. Lactobacillus casei ATCC393;3. Lactobacillus paracasei ATCC25302;4. Lactobacillus paracasei subsp. tolerans NBRC15906;5. Lactobacillus rhamnosus ATCC53103;6. Lactobacillus saniviri YIT12363;7. Lactobacillus zeae RIA482。
?
由表3、图2可直观地看出实验菌株和已知菌的亲缘关系,菌株Q-1-4与L. paracasei同源性均高达99.2%,在进化树中处于同一分支,由此可判定Q-1-4为L. paracasei,这同生理生化鉴定得到的结果一致,由此进一步验证了菌株Q-1-4为L. paracasei。

图2 菌株Q-1-4系统发育树
Fig.2 Phylogenetic tree based on the sequences of strain Q-1-4
2.4 L. paracasei Q-1-4产抗菌物质的确定
2.4.1 酸与过氧化氢作用的排除
表4 酸与过氧化氢作用的排除
Table4 Acids and hydrogen peroxide in CFS were not responsible for its antimicrobial activity

注:—.未显示抑菌活性;牛津杯直径为8.00 mm;同列相同字母表示差异不显著(P>0.05),同列不同字母表示差异显著(P<0.05)。下同。
样品抑菌圈直径/mm pH 5.0的CFS18.53±0.36 pH 5.0的乳酸—pH 5.0的乙酸—未处理的CFS18.57±0.25 A过氧化氢酶处理的CFS18.54±0.33 A
由表4可以看出,pH 5.0的乳酸、乙酸对S. typhimurium CMCC50115没有抑制作用,而 pH 5.0的L. paracasei Q-1-4产生的CFS对其有明显的抑制作用,说明CFS的抑菌活性不是由有机酸引起的,仍然存在其他的抗菌物质。CFS经过氧化氢酶处理后,抑菌能力比未处理的CFS略有下降,但还存在较强的抑菌作用,从而说明CFS中的过氧化氢不是主要的抗菌物质,还有另其他物质对指示菌起抑制作用。
2.4.2 蛋白酶对抗菌物质抑菌活性的影响
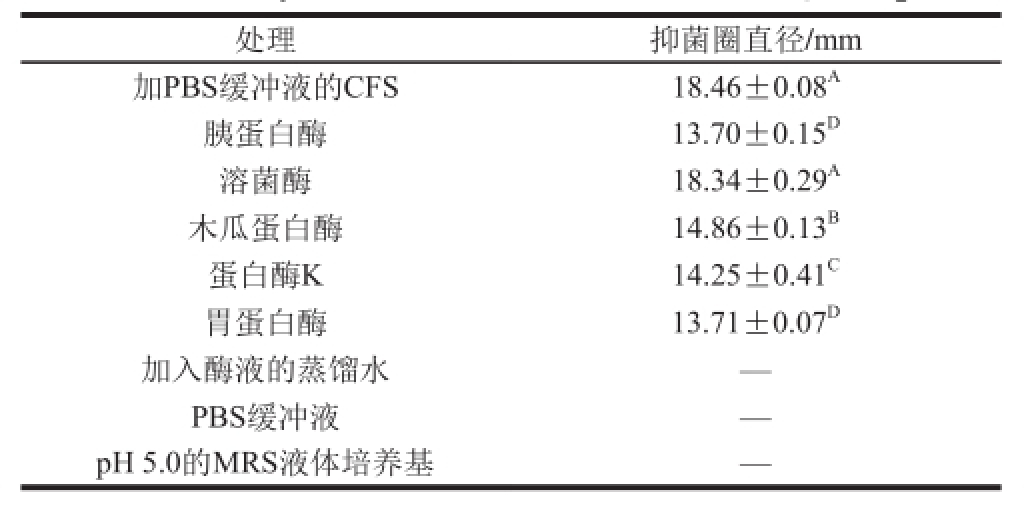
表5 抗菌物质对蛋白酶的敏感性
Table5 Sensitivity of the antimicrobial substances of strain Q-1-4 to protease
?
由表5可以看出,CFS经过胰蛋白酶、木瓜蛋白酶、蛋白酶K和胃蛋白酶处理之后对指示菌的抑菌活性分别下降了25.79%、19.50%、22.80%、25.73%,且显著差异,根据Luo Fan等 [21]的判断标准,确定CFS含有对蛋白酶敏感的蛋白类物质或肽类抗菌物质。而经过溶菌酶处理之后抑菌活性没有明显变化,仍具有抑菌活性,原因可能是L. paracasei Q-1-4所产抗菌物质不仅仅含有蛋白类物质,还有其他具有抑菌效果的代谢产物,如胞外多糖 [22]等。
2.5 L. paracasei Q-1-4所产抗菌物质的特性
2.5.1 pH值稳定性
表6 抗菌物质的pH值稳定性
Table6 pH Stability of the antimicrobial activity
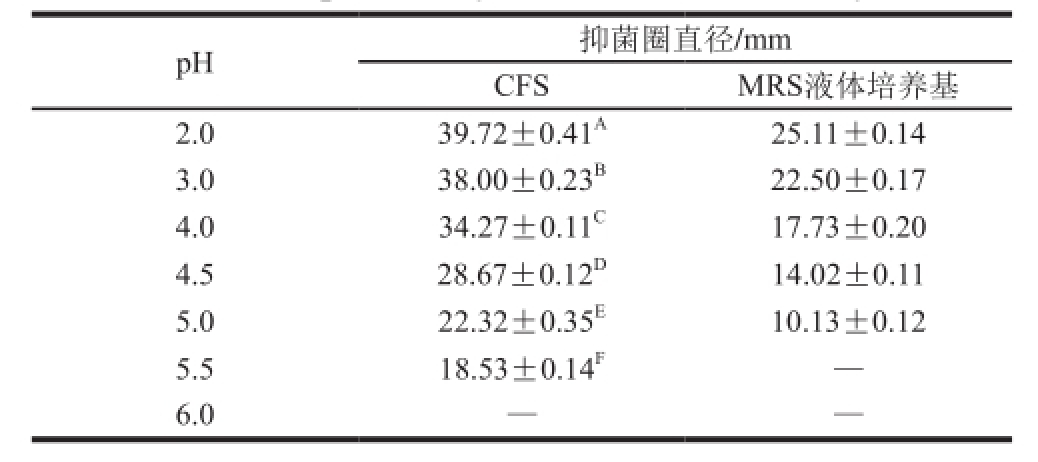
pH抑菌圈直径/mm CFSMRS液体培养基2.039.72±0.41 A25.11±0.14 3.038.00±0.23 B22.50±0.17 4.034.27±0.11 C17.73±0.20 4.528.67±0.12 D14.02±0.11 5.022.32±0.35 E10.13±0.12 5.518.53±0.14 F—6.0——
由表6可知,与空白对照比较,L. paracasei Q-1-4产生的抗菌物质在pH 2.0~5.5时对指示菌有抑制作用,但抑菌活性随pH值升高而逐渐降低,pH 3.0、4.0、4.5、5.0、5.5分别较pH 2.0时活性下降了3.2%、13.72%、27.82%、43.81%、53.35%,当pH值大于5.5时对指示菌的抑菌作用消失,这可能是由于pH值既是肽链上氨基质子化程度的决定性因素,同时也间接地影响着乳酸菌素在介质中的溶解性并影响该细菌素对指示菌的表面吸附作用,因而pH值对乳酸菌素的活性会产生影响 [23]。该抗菌物质在pH 2.0时抑菌活性较强,所以它适合应用于偏酸性食品中,不同于周佳等 [24]认为的pH值过高或过低都会影响细菌素结构,从而降低或丧失抑菌活性,本实验表明细菌素产生的最佳pH值条件具有一定的菌株特异性 [25]。
2.5.2 热稳定性
表7 抗菌物质的热稳定性
Table7 Thermal stability of the antimicrobial substance

注:同行肩标不同大写字母表示差异显著(P<0.05);同列肩标不同小写字母表示差异显著(P<0.05)。
温度/℃抑菌圈直径/mm pH 2.0pH 3.0pH 4.0pH 4.5pH 5.0pH 5.5 539.74±0.03 Aa37.95±0.09 Ba34.96±0.06 Ca28.69±0.03 Da22.31±0.09 Ea18.39±0.17 Fa6038.98±0.03 Ab37.88±0.07 Bb34.28±0.33 Cb28.25±0.14 Db21.97±0.05 Eb18.22±0.10 Fab8038.67±0.15 Ac37.82±0.04 Bb33.72±0.18 Cc28.10±0.12 Db21.64±0.05 Ec18.01±0.06 Fb10538.51±0.19 Ac37.37±0.19 Bc33.69±0.04 Cc27.92±0.04 Dc21.43±0.14 Ed17.76±0.07 Fc12137.70±0.13 Ad37.25±0.04 Bd32.99±0.03 Cd27.65±0.09 Dd21.01±0.02 Ee17.59±0.21 Fd
从表7可以看出,CFS在同一处理温度、不同pH值条件下,随着pH值的升高抑菌活性逐渐下降,且有显著差异,与2.5.1节结果相一致,这与许多细菌素相似,如Mason等 [23]研究了含有组氨酸的阳离子型抑菌肽在中性条件下的抑菌性一般,而在酸性条件下的抑菌性会增强很多。
CFS在同一pH值、不同处理温度条件下,随着处理温度的升高,抑菌活性逐渐降低。选取抑菌活性最高的pH 2.0时,60、80、105、121 ℃处理后分别较5 ℃时的活性下降了1.91%、2.69%、3.1%、5.13%,这可能是由于高pH值环境会胁迫细菌素的蛋白质结构构象发生变化,从而导致抑菌活性下降。但总体来说,该抗菌物质表现出了良好的热稳定性,Miao Jianxin等 [26]从L. paracasei subsp. tolerans FX-6菌株中分离出的新型细菌素同样耐高温。耐高温是抗菌物质的有利优点,食品经巴氏杀菌处理后,其抑菌活性不受影响。
2.5.3 紫外线敏感性
表8 抗菌物质对紫外线的敏感性
Table8 Ultraviolet sensitivity of the antimicrobial substances

CFS处理抑菌圈直径/mm未处理18.62±0.30 A紫外照射10 min18.66±0.21 A紫外照射30 min18.59±0.14 A紫外照射120 min18.57±0.17 A
由表8可知,经紫外线辐照不同时间的抗菌物质的抑菌活性与对照组无显著差异,说明L. paracasei Q-1-4所产抗菌物质对紫外线不敏感。由于有些食品不耐高温高压杀菌,便可以通过紫外杀菌的方式来达到灭菌的目的,且该抗菌物质对紫外有良好的耐受性,为其应用到食品生产和销售环节提供了有力的依据。
2.5.4 有机溶剂对抑菌活性的影响
表9 有机溶剂对抑菌活性的影响
Table9 Effect of organic solvents on the inhibitory activities

?
由表9可知,上述有机溶剂对CFS的抑菌活性没有明显影响,说明该抗菌物质对有机溶剂具有良好的耐受性。与Mi等 [27]的研究结果相一致。
2.5.5 表面活性剂对抑菌活性的影响由表10可知,经表面活性剂处理的CFS的抑菌活性没有明显影响。L. paracasei Q-1-4所产抗菌物质与EDTA
表10 表面活性剂对抑菌活性的影响
Table10 Effect of surfactants on the antimicrobial activity

?
共同作用效果好于单一作用,说明EDTA对抗菌物质有一定的协同增效作用且效果显著(P<0.05)。EDTA是一种金属离子的螯合剂,它可以与介质中的金属离子通过共价键相结合,消耗溶液中的金属离子,从而增强乳酸菌素的抑菌活性 [28]。
2.5.6 金属离子对抑菌活性的影响
表11 金属离子对抑菌活性的影响
Table11 Effect of metal ions on the antimicrobial activity

金属离子溶液抑菌圈直径/mm CFSMRS液体培养基FeSO 416.23±0.12 A—ZnSO 416.20±0.18 A—CuSO 416.13±0.34 A—MgSO 416.13±0.18 A—BaCl 216.21±0.27 A—CaCl 216.20±0.46 A—未处理的CFS/MRS16.18±0.14 A—
由表11所示,上述二价金属离子对CFS的抑菌活性并没有明显影响(P>0.05),说明对上述金属离子有一定的耐受性。
2.5.7 贮藏稳定性
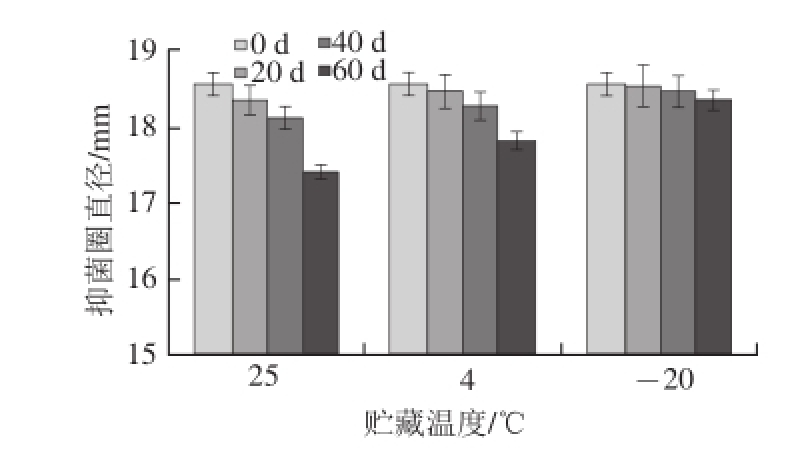
图3 抑菌活性在贮藏过程中的变化
Fig.3 Effect of storage temperature on the antimicrobial activity
由图3可以看出,CFS贮藏20 d后,其抑菌活性基本没有明显的变化。40 d后,抑菌活性略微降低一点,基本保持稳定。60 d 后,其抑菌活性均有不同程度的降低,其中-20 ℃的损失最小,具体机理还有待于进一步研究。可见L. paracasei Q-1-4所产抗菌物质在贮藏过程中对冷冻和冷藏有较好的耐受性,且冷冻比冷藏效果更好。韩雪等 [29]曾提出冷冻比冷藏对乳酸片球菌产生的细菌素活性的损害小,与本实验结果相类似。
2.5.8 抑菌谱的测定结果
由表12可以得出,L. paracasei Q-1-4所产抗菌物质对所选的指示菌均显示了较强的抑菌活性,其中对Bacillus cerecus CGMCC1.1686、Geobacillus stearo thermophilus GMCC1.1923、Micrococcus luteus CMCC(B)28001、 Listeria monocytogenes CMCC54002、Bacillus subtilis CGMCC1(B)63501、Salmonella typhimurium CMCC50115这6 株指示菌显示了很强的抑菌活性,抑菌圈直径达到16 mm以上;对其他的指示菌(Streptococcus thermophilus CICC6038、Staphylococcus aureus CMCC(B)26112、Pseudomonas fluarescens CGMCC1.1802、Salmonella enterica subsp. enterica CGMCC1.1859、Escherichia coli ATCC25922)均显示了较强的抑菌活性,抑菌圈直径为13~16 mm,其中陈飞龙等 [30]已经对L. paracasei FX-6对Staphylococcus aureus的抑菌机理做了一定的解释:前者所分泌的抗菌肽能与后者细胞内的DNA结合,阻碍其遗传信息正常表达继而使相应的大分子产物活性减弱,使生长代谢无法顺利进行。L. paracasei Q-1-4对包括食品常见的革兰氏阳性菌、革兰氏阴性菌均有良好的抑制作用,与马迎涛 [31]所研究的L. paracasei S-2相似。
表12 L. paracasei Q-1-4所产抗菌物质的抑菌谱
Table12 Antimicrobial spectrum of the antimicrobial substances from L. paracaseiQ-1-4

?
采用双层琼脂平板扩散法,从分离自内蒙古传统乳制品的8 株乳酸杆菌中筛选出有较好抑菌效果的菌株Q-1-4,通过生理生化实验和分子学鉴定认定为L. paracasei。
将L. paracasei Q-1-4所产抗菌物质经排酸、排过氧化氢后对S. typhimurium CMCC50115仍具有明显的抑制作用,且经过不同蛋白酶处理后,抑菌活性均有不同程度的下降,说明该抗菌物质中含有蛋白类物质。L. paracasei Q-1-4所产抗菌物质在pH值小于5.5范围内对S. typhimurium CMCC50115有抑制作用。在此pH值范围内抗菌物质对热有耐受性,对紫外不敏感,耐贮藏,有机溶剂、金属离子、表面活性剂对其影响不显著,但与EDTA共同作用效果好于单一作用。且L. paracasei Q-1-4所产抗菌物质抑菌谱较广。
参考文献:
[1] BURITI F C A, da ROCHA J S, ASSIS E G, et al. Probiotic potential of Minas fresh cheese prepared with the addition of Lactobacillus paracasei[J]. LWT-Food Science and Technology, 2005, 38(2): 173-180. DOI:10.1016/j.lwt.2004.05.012.
[2] LYNCH C M, MUIR D D, BANKS J M, et al. Inf l uence of adjunct cultures of Lactobacillus paracasei subsp. paracasei or Lactobacillus plantarum on Cheddar cheese ripening[J]. Journal of Dairy Science, 1999, 82(8): 1618-1628. DOI:10.3168/jds.S0022-0302(99)75390-7.
[3] SOBRINO-LÓPEZ A, MARTÍN-BELLOSO O. Use of nisin and other bacteriocins for preservation of dairy products[J]. International Dairy Journal, 2008, 18(4): 329-343. DOI:10.1016/j.idairyj.2007.11.009.
[4] BERGHE E V D, SKOURTAS G, TSAKALIDOU E, et al. Streptococcus macedonicus ACA-DC 198 produces the lantibiotic, macedocin, at temperature and pH conditions that prevail during cheese manufacture[J]. International Journal of Food Microbiology, 2006, 107(2): 138-147. DOI:10.1016/j.ijfoodmicro.2005.08.023.
[5] SA A, KRISHNAA R S, PAVITHRAB V, et al. Production and antibacterial activity of bacteriocin by Lactobacillus paracasei isolated from donkey milk[J]. International Journal of Current Sciences, 2011, 1: 109-115.
[6] HASSAN Y I, BULLERMAN L B. Antifungal activity of Lactobacillus paracasei ssp. tolerans isolated from a sourdough bread culture[J]. International Journal of Food Microbiology, 2008, 121(1): 112-115. DOI:10.1016/j.ijfoodmicro.2007.11.038.
[7] LOZO J, JOVCIC B, KOJIC M, et al. Molecular characterization of a novel bacteriocin and an unusually large aggregation factor of Lactobacillus paracasei subsp. paracasei BGSJ2-8, a natural isolate from homemade cheese[J]. Current Microbiology, 2007, 55(3): 266-271. DOI:10.1007/s00284-007-0159-1.
[8] LOZO J, VUKASINOVIC M, STRAHINIC I, et al. Characterization and antimicrobial activity of bacteriocin 217 produced by natural isolate Lactobacillus paracasei subsp. paracasei BGBUK2-16[J]. Journal of Food Protection, 2004, 67(12): 2727-2734.
[9] 沈萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999: 214-222.
[10] 陈天寿. 微生物培养基的制造与应用[M]. 北京: 中国农业出版社, 1995: 382-451.
[11] 赵娜, 萨如拉, 郭军. 瑞士乳杆菌AJT所产抗菌物质的初步研究[J]. 食品工业科技, 2013, 34(9): 67-71. DOI:10.13386/ j.issn1002-0306.2013.09.038.
[12] 吴敬, 芒来, 贺银凤. 马奶酒中抗单增李斯特氏菌细菌素产生菌的筛选及鉴定[J]. 中国酿造, 2011, 30(4): 119-121. DOI:10.14088/j.cnki. issn0439-8114.2011.08.008.
[13] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 244-258.
[14] 凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 85-86; 100.
[15] 白凤翎, 励建荣. 抗真菌性乳酸菌生物保护剂的研究进展[J]. 现代食品科技, 2014(5): 311-319. DOI:10.13982/ j.mfst.1673-9078.2014.05.048.
[16] 张国强, 师俊玲, 杨自文. 1 株乳酸菌所产类细菌素Lactobacillin SD-22的初步研究[J]. 食品与发酵工业, 2008, 34(5): 51-54. DOI:10.13995/j.cnki.11-1802/ts.2008.05.002.
[17] TURGIS M, VU K D, LACROIX M. Partial characterization of bacteriocins produced by two new Enterococcus faecium isolated from human intestine[J]. Probiotics & Antimicrobial Proteins, 2013, 5(2): 110-120. DOI:10.1007/s12602-013-9129-z.
[18] JABEEN N, GUL H, SUBHAN S A, et al. Biophysicochemical charecterization of bacteriocin(s) from indigenously isolated Agrobacterium Radiobacter NA6[J]. Pakistan Journal of Botany, 2009, 41(6): 3227-3237.
[19] 巨晓英, 寇晓虹. 副干酪乳杆菌的功能及其在食品工业中的应用研究进展[J]. 中国乳品工业, 2009(8): 48-50.
[20] 郭兴华, 曹郁生, 东秀珠. 益生乳酸细菌分子生物学及生物技术[M].北京: 科学出版社, 2008: 409-411.
[21] LUO F, FENG S, SUN Q, et al. Screening for bacteriocin-producing lactic acid bacteria from kurut, a traditional naturally-fermented yak milk from Qinghai-Tibet plateau[J]. Food Control, 2011, 22(1): 50-53. DOI:10.1016/j.foodcont.2010.05.006.
[22] KAMAL E E A, MOHAMED A S H, MOHSEN A E K A, et al. Antimicrobial, anticoagulation, fi brinolytic and prebiotic activities of exopolysaccharide produced by Marine klebsiella sp.[J]. The Egyptian Journal of Experimental Biology (Botany), 2016, 12(2): 267-274. DOI:10.5455/egyjebb.20161115114843.
[23] MASON A J, GASNIER C, KICHLER A, et al. Enhanced membrane disruption and antibiotic action against pathogenic bacteria by designed histidine-rich peptides at acidic pH[J]. Antimicrobial Agents and Chemotherapy, 2006, 50(10): 3305-3311. DOI:10.1128/ AAC.00490-06.
[24] 周佳, 刘书亮, 胡欣洁, 等. 产宽谱pH细菌素乳酸菌的筛选鉴定、毒力检测及细菌素特性研究[J]. 食品科学, 2012, 33(11): 194-199.
[25] 陈琳, 孟祥晨. 响应面法优化植物乳杆菌代谢产细菌素的发酵条件[J].食品科学, 2011, 32(3): 176-180.
[26] MIAO J Y, GUO H X, OU Y W, et al. Purif i cation and characterization of bacteriocin F1, a novel bacteriocin produced by Lactobacillus paracasei subsp. tolerans, FX-6 from Tibetan kefir, a traditional fermented milk from Tibet, China[J]. Food Control, 2014, 42(Suppl 1): 48-53. DOI:10.1016/j.foodcont.2014.01.041.
[27] MI Y Y, KIM Y J, HWANG H J. Properties and safety aspects of Enterococcus faecium, strains isolated from Chungkukjang, a fermented soy product[J]. LWT-Food Science and Technology, 2008, 41(5): 925-933. DOI:10.1016/j.lwt.2007.05.024.
[28] 方芳. 产细菌素乳酸菌的筛选, 细菌素的纯化及其特性研究[D].呼和浩特: 内蒙古农业大学, 2008.
[29] 韩雪, 周志江. 乳酸片球菌细菌素的活性及特性的研究[J]. 食品研究与开发, 2006, 27(4): 19-21.
[30] 陈飞龙, 苗建银, 廖玮灵, 等. 副干酪乳杆菌坚韧亚种FX-6发酵提取物对鲜虾的保鲜评价[J]. 食品工业科技, 2016, 37(4): 76.
[31] 马迎涛. 微生态制剂副干酪乳杆菌素分离及理化特性研究[D].杨凌: 西北农林科技大学, 2016.
Screening and Identif i cation of Lactobacillus paracasei Q-1-4 and Analysis of Antimicrobial Substances Produced by It
LIN Xiaolong
1, JIA Mutai
2, GUO Haiyan
1, WANG Quanxi
2, MANG Lai
2, HE Yinfeng
1, WU Jing
1,*
(1. College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China; 2. College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China)
Abstract:To isolate Lactobacillus with great application potential from traditional homemade dairy products in Inner Mongolia, eight strains of Lactobacillus were screened for their antimicrobial activity. Strain Q-1-4 was found to have a broad spectrum of antimicrobial activity and was identif i ed as Lactobacillus paracasei by physiological and biochemical characterization and 16S rDNA sequencing analysis. The antimicrobial activity of the cell-free culture supernatant (CFS) of L. paracasei Q-1-4 against Salmonella typhimurium CMCC50115 still existed after eliminating the interference factors such as lactic acid, acetic acid, and hydrogen peroxides. However, the CFS of L. paracasei Q-1-4 was inactivated after treatment with proteolytic enzymes. Inhibitory activity of the CFS against S. typhimurium CMCC50115 was observed in the pH range from 2.0 to 5.5. The antimicrobial substance had good thermal stability in this pH range and was not sensitive to ultraviolet. SDS and EDTA could enhance the antimicrobial activity, but surfactants, organic solvents and metal ions had no effect on the antimicrobial activity. In addition, the antibacterial activity had good storage stability with a broad inhibitory spectrum.
Key words:Lactobacillus paracasei; antimicrobial activity; characteristics
DOI:10.7506/spkx1002-6630-201704003
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)04-0013-07
引文格式:
林晓龙, 佳木泰, 郭海燕, 等. 副干酪乳杆菌Q-1-4的筛选鉴定及抗菌物质特性分析[J]. 食品科学, 2017, 38(4): 13-19.
DOI:10.7506/spkx1002-6630-201704003. http://www.spkx.net.cn
LIN Xiaolong, JIA Mutai, GUO Haiyan, et al. Screening and identif i cation of Lactobacillus paracasei Q-1-4 and analysis of antimicrobial substances produced by it[J]. Food Science, 2017, 38(4): 13-19. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704003. http://www.spkx.net.cn
收稿日期:2016-06-30
基金项目:国家自然科学基金地区科学基金项目(31260391);内蒙古自治区自然科学基金项目(2014MS0392);内蒙古农业大学博士科研启动基金项目(BJ2013D-19;BJ2014D-20)
作者简介:林晓龙(1989—),男,硕士研究生,研究方向为食品微生物与分子生物学。E-mail:nevsaynev3@163.com
*通信作者:吴敬(1969—),女,副教授,博士,研究方向为食品生物技术及功能食品。E-mail:wujing2003825@163.com