潘 瑶,郑时莲,邹兴平,熊字伟,邓泽元,李红艳 *
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:利用高效液相色谱-质谱联用技术分析3 种水果(葡萄、芒果、草莓)乙醇提取物的主要组成成分。建立2种体外抗氧化模型:1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS),比较3 种不同水果提取物在不同抗氧化模型中相互作用的能力。同时,利用等辐射分析法,分析以不同比例混合后,各物质之间抗氧化相互作用的差异。结果表明:葡萄提取物的总酚以及总黄酮含量最高,其次是草莓和芒果。草莓提取物中主要含有鞣花酸、花葵素-3-葡糖苷、花葵素-3-乙酰葡糖苷和花葵素-3-芸香苷等。芒果提取物主要含有鞣花酸、芒果苷和桑橙素等。葡萄提取物中主要含有反-白藜芦醇、花色苷等。同一组合,在不同抗氧化模型中表现出的活性不同,葡萄提取物体外抗氧化性较强,其次是芒果和草莓。同一模型中,抗氧化协同率最高的组合比例为草莓-芒果1∶9(DPPH模型)和草莓-芒果1∶1(ABTS模型)。
关键词:抗氧化相互作用;等辐射分析法;协同作用;水果混合物
各种内源性因素和外源性因素会在机体中产生过量的自由基,对机体造成伤害。水果中部分天然植物化学物可以防护、清除和修护过量的自由基 [1]。这些天然的植物化学物包括类胡萝卜素、酚类化合物、植酸等 [2]。葡萄中的抗氧化物质主要包括黄醇酮和花色苷 [3],儿茶素单体和低聚体原花青素等黄酮类化合物,此外还包括白藜芦醇和其糖苷类化合物。儿茶素可明显抑制胶原引起的过氧化氢产生,原花青素也可以直接和羟自由基、过氧化氢反应 [4]。芒果中含有丰富的抗氧化物质如多酚类化合物,没食子酸、间双没食子酸、没食子鞣质、槲皮素、异槲皮甙、芒果苷等 [5]。草莓果肉提取物中含有丰富的VC、VE和黄酮等抗氧化物质 [6]。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法和2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸 )二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)法广泛用于定量测定生物试样和食品的抗氧化能力。通过测量试样溶液的吸光度变化进行快速的定量分析 [7-8],操作简单,常作为实验室抗氧化剂的抗氧化评价方法 [9]。
相关研究表明 [10-11]:将不同水果或深色农产品提取物按不同比例混合后,往往会表现出协同效应,即混合后的不同果蔬提取物的抗氧化活性比相应的单个果蔬提取物抗氧化活性理论之和更强。等辐射分析法是一种简单、精确分析药物之间相互作用的方法 [11],在食品抗氧化相互作用的分析中较为少见。本实验运用等辐射分析法,研究3 种水果乙醇提取物之间的抗氧化相互作用。参照Jiang Haiwei等 [11]的研究,建立2 种体外抗氧化模型,研究3 种水果乙醇提取物的抗氧化作用,探讨2 种抗氧化评价模型之间的差异;并运用等辐射分析法,评价3 种水果乙醇提取物以不同比例混合后,它们之间的抗氧化相互作用。研究结果可以帮助合理搭配食用水果,通过天然植物化学物之间的增效作用,提高抗氧化能力。
1.1 材料与试剂
丰香草莓、台农芒果、夏黑葡萄 上海益生农业技术有限公司;ABTS试剂盒 碧云天生物技术研究所;铁氰化钾(分析纯) 广州化学试剂厂;三氟乙酸(分析纯) 广东西陇化工厂;无水乙醇、盐酸均为国产分析纯。
1.2 仪器与设备
EXL800酶标仪 美国Biotek Instruments有限公司;QL-861涡流混合器 太仓科教器材厂;HH-S11电热恒温水浴锅 广州户瑞明仪器有限公司;AR1140电子分析天平 奥豪斯仪器有限公司;DGG-9140A电热鼓风干燥箱 上海森信实验仪器有限公司;FW80高速万能粉碎机 天津市泰斯特仪器有限公司;RE-85Z旋转蒸发仪 巩义市英峪予华仪器厂;FD-1冷冻干燥机北京德天佑科技发展有限公司;-80 ℃超低温保存箱青岛海尔特种电器有限公司;1200N高效液相色谱(high performance liquid chromatography,HPLC)仪、7200三重串联四极杆飞行时间质谱(mass spectrometry,MS)仪美国Agilent公司。
1.3 方法
1.3.1 样品的制备
将新鲜水果洗净晾干,选取草莓果实、芒果果肉、带皮葡萄,各削成厚约2 mm的薄片,于烘箱内45 ℃烘干48 h,粉碎过40 目筛,充分混匀,冰箱内冷藏保存。45 ℃水浴浸提,液料比50∶1(mL/g),提取液为无水乙醇-蒸馏水-盐酸(4∶1∶0.05,V/V)溶液。
浓缩工艺:旋转蒸发仪,温度45 ℃,待有机溶剂挥发后,冻干提取液,所得粉末避光保存。
1.3.2 HPLC-MS法对3 种水果提取物定性分析
HPLC条件:OD C 18色谱柱(4.6 mm×250 mm,5 µm);流动相A为水-甲酸(97∶3,V/V)溶液,流动相B为乙腈溶液。梯度洗脱条件为:0~3 min,10%~15% B;3~5 min,15%~20% B;5~8 min,20%~25% B;8~10 min,25%~30% B;10~20 min,30%~40% B;20~30 min,40%~70% B;35~40 min,70%~100% B;40~41 min,保持100% B;运行3 min回到10% B。流速为300 µL/min,柱温30 ℃,进样量5 µL,检测波长为280、520 nm。
MS条件:电喷雾离子源;离子源温度350 ℃;毛细管电压为32.5 kV;锥孔电压-58 V;光电倍增器电压-1 030 V;电喷雾离子源电压5 kV;正离子扫描;质量扫描范围m/z 为100~1 000。
1.3.3 总酚和总黄酮含量的测定
总酚含量的测定:采用福林酚 [12]法。在96 孔板中加入25 µL没食子酸(gallic acid,GAE)标品或水果提取物,125 µL福林酚试剂,于室温条件下反应10 min后,加入125 µL饱和碳酸钠溶液,室温条件下静置30 min,使用酶标仪于波长765 nm处测定吸光度。总酚含量以GAE毫克数等量每克干质量样品原料(mg GAE/g)表示。所有样品均测定3 次。
总黄酮含量的测定:采用Chun等 [13]改良的比色法。将提取物配制成200 mg/mL的待测溶液备用。取2 mL待测溶液与0.2 mL 5 g/100 mL的亚硝酸钠溶液混合。6 min后加入0.2 mL 10 g/100 mL AlCl 3·6H 2O溶液,混合摇匀。5 min后加入2 mL 1 mol/L氢氧化钠溶液,待反应液充分混匀,15 min后于波长510 nm处测定吸光度。根据芦丁标准曲线计算总黄酮含量。总黄酮含量以芦丁(rutin,RT)当量毫克数等量每克干质量样品原料(mg RT/g)表示。所有样品均测定3 次。
1.3.4 体外化学抗氧化模型的建立
1.3.4.1 试剂配制
取草莓、芒果、葡萄提取物的干物质粉末,用蒸馏水溶解配制成所需的质量浓度梯度(50、100、150、200、250 mg/mL),冷藏待用。
1.3.4.2 DPPH自由基清除法
2 mL 1×10 -4mol/L DPPH溶液与等体积不同质量浓度的受试物混合,充分摇匀。室温暗光条件下反应30 min,于波长517 mn处测定其吸光度,平行测定3 次。DPPH自由基清除率按公式(1)计算:
式中:A 0为不加样品,加入DPPH时的吸光度;A i为加入样品和DPPH的吸光度;A j为加入样品,不加DPPH的吸光度。
1.3.4.3 ABTS +·清除法
将5 mL 7.4 mmol/L ABTS储备液与88 µL 2.6 mmoL/L K 2S 2O 8溶液混匀,静置12~16 h,配制成ABTS工作液。常温条件下于波长734 nm处测定吸光度为0.7±0.02。0.2 mL ABTS工作液与10 µL不同质量浓度受试物混合,常温避光静置6 min,于波长734 nm处测吸光度,平行测定3 次。ABTS +·清除率按公式(2)计算:
式中:A 0为不加样品,加入ABTS的吸光度;A i为加入样品和ABTS的吸光度。
1.4 数据处理
1.4.1 体外化学抗氧化模型
所有的数据均以
 ±s表示,测得同一模型条件下,不同质量浓度的受试物的清除率,制作清除率曲线。在DPPH和ABTS模型中,半效应浓度(median effect concentration,EC
50)值表示清除1 mg DPPH自由基或ABTS
+·时,其清除率达到50%时水果提取物的每毫克干质量。数据分析用Excel 2013和SPSS 16.0软件,进行线性回归分析和其他统计分析,不同比例的EC
50
mix采用oneway ANOVA分析,以P<0.05表示统计学显著差异相同比例的理论值与实际值采用独立样本t检验,釆用Origin 8.5软件作图。
±s表示,测得同一模型条件下,不同质量浓度的受试物的清除率,制作清除率曲线。在DPPH和ABTS模型中,半效应浓度(median effect concentration,EC
50)值表示清除1 mg DPPH自由基或ABTS
+·时,其清除率达到50%时水果提取物的每毫克干质量。数据分析用Excel 2013和SPSS 16.0软件,进行线性回归分析和其他统计分析,不同比例的EC
50
mix采用oneway ANOVA分析,以P<0.05表示统计学显著差异相同比例的理论值与实际值采用独立样本t检验,釆用Origin 8.5软件作图。
1.4.2 等辐射分析法
选择合适的指标:运用Probit回归分析做各样品的剂量-效应曲线,求得EC 50值,并根据Luszczki等 [14]的方法,由相加等效公式(3)分别计算理论值EC 50 add。

式中:E C 5 0 A为抗氧化剂A单独作用时的EC 50值/(mg/mg)。R为2 种抗氧化剂的协同组合中单独作用时的效价比;P 1为抗氧化剂A在A、B两种抗氧化剂混合后,复配组中所占的比例;P 2为抗氧化剂B在A、B两种抗氧化剂混合后,复配组中所占的比例。
各组分实际产生的抗氧化能力的实验值EC 50 mix,由不同质量浓度梯度拟合的清除率曲线求得。采用独立样本t检验来检验理论值与实验值之间的显著性。按公式(4)计算协同率:

绘制等辐射分析图,直线代表着抗氧化物A和B之间既无协同作用也无拮抗作用,下凹表示抗氧化协同效应,上凸表示抗氧化拮抗作用。
2.1 3 种水果提取物的成分鉴定
2.1.1 草莓提取物的成分鉴定

图1 草莓提取物于波长280 nm处的HPLC图
Fig.1 HPLC chromatogram at 280 nm of ethanol extract from strawberry
表1 草莓提取物的HPLC-MS分析
Table1 HPLC-MS analysis of ethanol extract from strawberry

?
由图1、表1可知,草莓提取物于波长280 nm处有吸收的主要成分有花葵素-3-葡糖苷、花葵素-3-芸香苷、鞣花酸、花葵素-3-乙酰葡糖苷等。
2.1.2 芒果提取物的成分鉴定
由图2、表2可知,芒果提取物于波长280 nm处有吸收的主要成分有芒果苷、鞣花酸、桑橙素等。
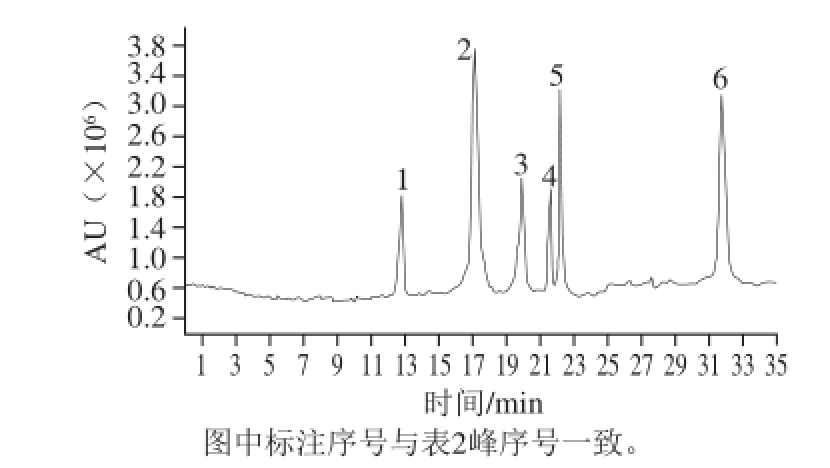
图2 芒果提取物于波长280 nm处的HPLC图
Fig.2 HPLC chromatogram at 280 nm of ethanol extract from mango
表2 芒果提取物的HPLC-MS分析
Table2 HPLC-MS analysis of ethanol extract from mango

?
2.1.3 葡萄提取物的成分鉴定

图3 葡萄提取物于波长280 nm处的HPLC图
Fig.3 HPLC chromatogram at 280 nm of ethanol extract from grape
表3 葡萄提取物的HPLC-MS分析
Table3 HPLC-MS analysis of ethanol extract from grape

峰序号保留时间/min最大吸收波长/nm MS[M+H] m/z成分鉴定17.19280315原儿茶酸己糖酯28.01280227反-白藜芦醇38.90280447槲皮素-3-O-鼠李糖苷410.82280329香草酸己糖酯512.38280134鞣花酸616.84280、520611(303)花青素香豆酰化葡糖苷719.40280、530655二甲花葵素-3,5-二葡糖苷819.80280、520611(409、287)花青素-3,5-二葡糖苷921.50280、520817二甲花青素-3-反式咖啡酰化葡糖苷1021.80280、5207873’-甲花青素-3-香豆酰化葡糖苷-5-葡糖苷1122.41280、520801二甲花青素-3-反式香豆酰化葡糖苷-5-葡糖苷1225.53280609槲皮素-3-芸香糖苷1327.08280、520639二甲花青素反式香豆酰化葡糖苷
由图3、表3可知,葡萄提取物于波长280 nm处有吸收的主要成分有反-白藜芦醇、原儿茶酸己糖酯、槲皮素-3-O-鼠李糖苷、香草酸己糖酯、二甲花葵素-3,5-二葡糖苷和花青素-3,5-二葡糖苷等。
2.2 水果提取物的抗氧化活性
表4 3 种水果提取物中主要抗氧化组分与抗氧化活性
Table4 The main antioxidant components and antioxidant activities of three fruits extracts
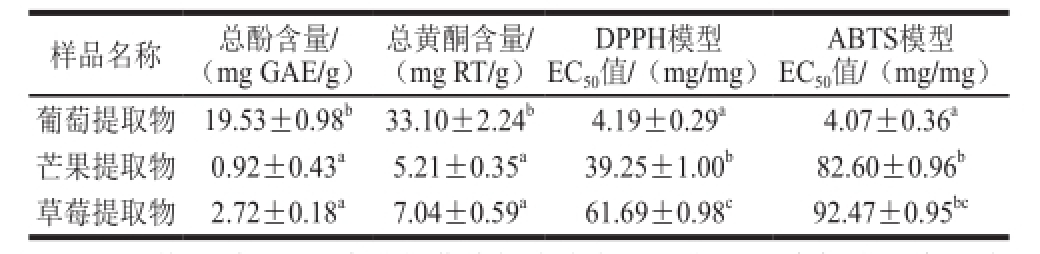
注:EC 50值通过Probit法进行曲线拟合求得。同行不同肩标小写字母表示不同抗氧化物质种类间的成分含量及抗氧化活性在P<0.05水平上存在显著性差异。
?
由表4可知,葡萄提取物的总酚含量为(19.53±0.98)mg GAE/g,总黄酮含量为(33.1±2.24)mg RT/g远高于芒果和草莓。同时,葡萄提取物在2 种抗氧化模型中的EC 50值最小,DPPH模型为(4.19±0.29)mg/mg,ABTS模型为(4.07±0.36)mg/mg。结果表明葡萄体外抗氧化能力最强,其次是芒果和草莓。可见,酚类化合物是这3 种水果乙醇提取物抗氧化活性的主要抗氧化组分。
2.3 不同水果提取物在体外模型中的协同作用分析
表5 DPPH模型中不同水果提取物组合的理论值和实验值
Table5 Theoretical and experimental EC
50values for combination of the three samples in different proportions for scavenging DPPH radical

?
由表5和图4可知,在DPPH模型中,大部分比例均表现出较强的协同作用。如葡萄-芒果比例为1∶9时表现为较高的协同作用(协同率29.28%),葡萄-草莓比例为1∶9时,表现出较高的协同作用(协同率30.62%)。其中芒果-草莓比例为9∶1时拥有最高的协同率(48.00%)。同时,也有部分表现为拮抗作用,如葡萄-草莓比例为7∶3(协同率-15.29%)、9∶1时(协同率-16.91%)表现为抗氧化拮抗作用。其中葡萄-草莓比例为9∶1的抗氧化拮抗作用最强(协同率-16.91%)。
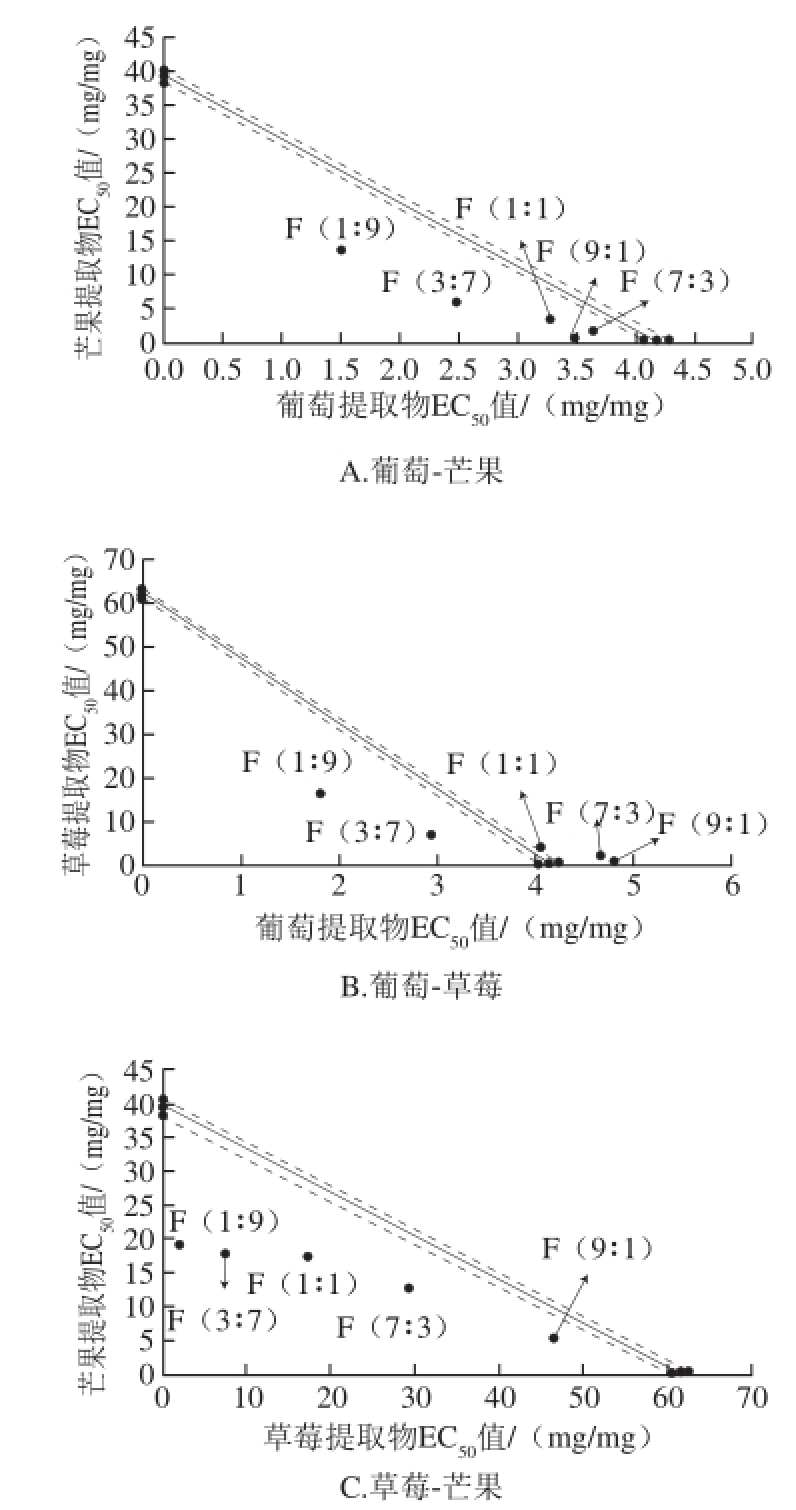
图4 等辐射分析法评价3 种水果提取物间的DPPH法抗氧化相互关系
Fig.4 Isobolographic description of the antioxidant interactions among the three samples for scavenging DPPH radical
表6 ABTS模型中不同水果提取物组合的理论值和实验值
Table6 Theoretical and experimental EC
50values for combinations in different proportions of the three extracts for scavenging ABTS radical

?

图5 等辐射分析法评价3 种水果提取物间的ABTS法抗氧化相互关系
Fig.5 Isobolographic description of the antioxidant interactions among the three samples for scavenging ABTS radical
由表6和图5可知,在ABTS模型中,大部分比例均表现出较强的协同作用。例如:葡萄-芒果比例为1∶9时表现为较高的协同作用(协同率31.60%)。当芒果的比例减少时,又表现为抗氧化拮抗作用,如葡萄-芒果比例为9∶1时,协同率为-27.93%。葡萄-草莓比例为3∶7时,表现出较高的协同作用(协同率27.64%)。芒果-草莓比例为1∶1时拥有最高的协同率(47.40%),葡萄-草莓比例为7∶3时表现出较高的抗氧化拮抗作用(协同率-39.40%)。
3.1 等辐射分析法的优势
目前评价相互作用关系的方法主要有直接比较法、加和法和响应面法。但对于不成线性关系的相互作用,直接比较法和加和法不适用评价,且响应面法需要进行多组试验优化,不适用于贵重或量少化合物及标品的评价。这些评价方法的缺陷直接限制了相互作用机制的研究,甚至会造成对结果的错误评判。等辐射分析的优点在于用图形表示,直观方便,不受抗氧化物剂量与线性关系的影响。研究 [14]表明,该方法适用于不同药物之间相互作用的评价,但在食品抗氧化中的应用相对较少。
3.2 不同提取物抗氧化差异
由表4可知,3 种水果提取物在体外的抗氧化活性最强的是葡萄提取物,其次是芒果和草莓。葡萄提取物的总酚、总黄酮含量远高于芒果和草莓提取物。结合HPLC-MS分析结果可知,葡萄提取物中花色苷的种类和丰富程度远高于芒果和草莓提取物。葡萄提取物中还含有大量的白藜芦醇等小分子植物化学物。这可能是葡萄提取物在体外表现出强抗氧化性的原因。
葡萄-芒果比例为7∶3和9∶1的组合在DPPH模型中协同率分别为8.60%和15.65%,均表现出抗氧化协同作用。而在ABTS模型中协同率分别为-23.37%、-27.93%,均表现为抗氧化拮抗作用。
这可能是由于2 种不同的抗氧化模型其原理不同导致的。DPPH法是根据DPPH自由基有单电子,其醇溶液呈紫色的特性。当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系。ABTS +·相当稳定,具有供氢能力的抗氧化剂与其反应,使之变成没有颜色的ABTS。抗氧化剂清除ABTS +·的能力可以用当量抗氧化能力(trolox equivalent antioxidant capacity,TEAC)值表示。抗氧化剂清除ABTS +·的能力与时间有关 [15],时间越长,TEAC值越大,而有些抗氧化剂在给定时间内没有与ABTS +·完全反应,TEAC值被低估。同时,某些物质的TEAC值反映的包括该物质以及该物质与ABTS +·反应产物的共同清除能力 [15]。
3.3 不同比例提取物组合抗氧化协同作用差异
通过表5、6发现,相同提取物不同比例混合其抗氧化协同作用也不同,比如在DPPH模型中,芒果与草莓提取物组合5 种比例配方中,当芒果-草莓比例为9∶1 时协同率最大(48.00%)。在ABTS模型中,当芒果-草莓比例为1∶1 时协同率最大(47.40%)。
不同比例混合的抗氧化因子的抗氧化活性不同,可能与各混合物中的植物化学物的含量不同有关,例如阿魏酸、根皮素和VE以不同比例混合,其抗氧化相互作用也不同 [16]。葡萄-草莓比例为7∶3时,在两模型中均表现出抗氧化拮抗作用,协同率分别为-15.29%和-39.40%,其原因可能是组合中某种物质含量过多,从而导致其从协同作用向拮抗作用转变 [17]。有报道发现,水果中的白藜芦醇、儿茶素和槲皮素之间存在抗氧化拮抗作用 [18]。因此在水果提取物相互作用中也存在抗氧化拮抗作用,且其拮抗作用可以使混合后的提取物抗氧化活性降低。
3.4 不同提取物抗氧化协同作用的可能原因
草莓、芒果、葡萄提取物联合使用其抗氧化活性具有一定的协同作用,且协同作用的强弱受混合比例的影响。其抗氧化协同作用机理可能有以下几种原因:第一,多种抗氧化活性成分通过相互修复再生形成氧化还原循环系统。大多数理论认为 [19],复合抗氧化功效因子之间可以通过相互修复再生作用,形成氧化还原循环系统,进而使抗氧化效果明显强于单一抗氧化剂。由表5、6可知,草莓与芒果提取物在2 种抗氧化模型中均表现为抗氧化协同作用,在DPPH模型中,芒果-草莓比例为9∶1 时协同率为48.00%,在ABTS模型中,芒果-草莓比例为1∶1 时协同率为47.40%。根据HPLC-MS分析的结果可知,草莓提取物主要成分是花葵素类花色苷。花葵素,又称天竺葵素,是花青素的一种 [20]。芒果中的主要成分是芒果苷、槲皮素、桑橙素。芒果苷,又名莞知母宁或芒果素,是一种四羟基吡酮的碳酮苷,属双苯吡酮类黄酮类化合物 [21]。Rossetto等 [22]研究表明儿茶素可促进矢车菊素-3-O-葡萄糖苷等花青素的氢再生,从而提高混合物的抗氧化能力。由于芒果苷分子内具有多个酚羟基,结构与儿茶素相似,而酚羟基恰好是清除自由基和活性氧的重要基团。其对自由基的作用机制可归结为2 个方面:一方面直接作用于清除自由基 [23],另一方面,这可能是由于芒果中的芒果苷与草莓中的花色苷发生了抗氧化相互修复作用,芒果苷可能产生游离基可以与花色苷交换电子从而使其含量维持正常水平不断发挥抗氧化作用,使得抗氧化功效因子在与自由基反应的过程中能够不断再生,从而产生协同作用。第二,多种抗氧化活性成分混合时生成新的酚类化合物。2 种以上的抗氧化功效因子复合使用时,各种抗氧化剂也可能使体系中产生的游离基相互作用生成新的酚类化合物继续发挥抗氧化作用,使其抗氧化性能得以增强 [24-25]。葡萄提取物中主要成分为白藜芦醇、花翠素以及花青素的葡萄糖苷。白藜芦醇是存在于植物中的天然抗氧化剂,主要通过清除或抑制自由基生成,抑制脂质过氧化、调节抗氧化相关酶活性等机制发挥抗氧化作用 [25]。白藜芦醇通过与自由基反应来降低自由基活性,阻止自由基的进一步链式反应,从而达到清除自由基的效果 [25]。而芒果中的芒果苷可能产生游离基与葡萄提取物中的物质相互作用生成新的酚类,继续发挥抗氧化作用。
除此以上原因之外,也有报道 [26-27]认为多种抗氧化功效因子之间存在基于氧化还原电位差的偶联氧化,可以降低直接反应的2 种抗氧化功效因子之间的电位落差,使反应更容易进行。
3.5 不同提取物抗氧化拮抗作用的可能原因
草莓、芒果、葡萄提取物联合使用其抗氧化活性具有一定的拮抗作用,且拮抗作用的强弱受混合比例的影响。其抗氧化拮抗作用机理可能有以下几种原因:第一,槲皮素与白藜芦醇间存在抗氧化拮抗作用。由表5、6可知,芒果与葡萄在ABTS模型中,一定比例条件下也表现出抗氧化拮抗作用(葡萄-芒果比例为7∶3时,协同率为-23.37%,葡萄-芒果比例为9∶1时协同率为-27.93%)。有研究 [19]表明,槲皮素和白藜芦醇之间存在抗氧化拮抗作用。而芒果中含有一定量的槲皮素。芒果中的槲皮素可能与葡萄中的白藜芦醇产生抗氧化拮抗作用。第二,2 种黄酮类抗氧化物质混合后生成新的产物,使抗氧化活性受到抑制。Abou等 [28]研究表明,若2 种黄酮均有3’,4’-二羟基结构,则混合物经反应后,由于2 种黄酮均生成邻二苯醌结构,混合物抗氧化活性受到较强抑制。因此,草莓和葡萄的混合物可能由于抗氧化活性受到较强的抑制从而表现出抗氧化拮抗作用。第三,多种抗氧化活性成分间发生氢键缔合,降低了供电子的能力。由HPLC-MS结果分析可知芒果中含有槲皮素,而葡萄提取物中含有花青素。同时,研究 [29]表明,槲皮素与花青素混合物之间发生氢键的缔合,减少了羟基数目,降低供电子的能力,从而削弱了与DPPH的反应能力。同时,有研究 [30]表明含有较多B环羟基的黄酮类化合物,其混合物反应后由于缺少能够中断自由基链式反应的氢电子,DPPH自由基以及羟自由基清除能力更易受到抑制。从而表现出抗氧化拮抗作用。
研究采用等辐射分析法可以快速有效地评价以不同比例混合后,不同物质之间的抗氧化相互作用,相同植物化学物以不同比例混合后,可能表现出协同或拮抗作用。由于抗氧化模型原理不同,相同的植物化学物组合在不同的体外抗氧化模型中存在差异。不同水果提取物的抗氧化效果不同。其中葡萄提取物的抗氧化活性最强,其次是芒果与草莓提取物。3 种不同水果提取物联合使用后,大多数比例表现出抗氧化协同作用,且协同作用的强弱受比例的影响,其中协同效应最强的组合为芒果-草莓比例9∶1(DPPH模型)和芒果-草莓比例1∶1(ABTS模型)。部分组合如葡萄-草莓比例为9∶1(DPPH模型)、葡萄-草莓比例为7∶3时(ABTS模型)表现出较强的抗氧化拮抗作用。本实验使用的葡萄为带皮葡萄,文献[31-32]表明,葡萄果皮与果肉之间抗氧化组分存在差异。这也是今后值得进一步完善的工作,另外对于各提取物中主要成分的定量分析、各抗氧化活性组分产生协同作用或拮抗作用的具体原因也是今后实验探究的主要方向。
参考文献:
[1] 吕双双, 李书国. 植物源天然食品抗氧化剂及其应用的研究[J]. 粮油食品科技, 2013, 21(5): 60-65. DOI:10.16210/j.cnki.1007-7561.2013.05.020.
[2] 熊皓平, 杨伟丽, 张友胜, 等. 天然植物抗氧化剂的研究进展[J].天然产物研究与开发, 2011, 13(5): 75-79. DOI:10.16333/j.1001-6880.2001.05.022.
[3] XI X J, ZHA Q, JIANG A L, et al. Impact of cluster thinning on transcriptional regulation of anthocyanin biosynthesis-related genes in‘Summer Black’ grapes[J]. Plant Physiology and Biochemistry, 2016, 104: 80-187. DOI:10.1016/j.plaphy.2016.03.015.
[4] PUSPITA S, CHRISTOFORA H W, DONDIN S, et al. Colour properties, stability, and free radical scavenging activity of jambolan (Syzygium cumini) fruit anthocyanins in a beverage model system: natural and copigmented anthocyanins[J]. Food Chemistry, 2012, 132: 1908-1914. DOI:10.1016/j.foodchem.2011.12.025.
[5] 郭长江, 高蔚娜, 谢宗恺, 等. 中国蔬菜、水果抗氧化作用与有效成分的研究进展[J]. 生命科学, 2015, 27(8): 1000-1004. DOI:10.13376/ j.cbls/2015139.
[6] 刘文旭, 黄午阳, 曾晓雄, 等. 草莓、黑莓、蓝莓中多酚类物质及其抗氧化活性研究[J]. 食品科学, 2011, 32(23): 130-133.
[7] MÜLLER L, FRÖHLICH K, BÖHM V. Comparative antioxidant activities of carotenoids measured by ferric reducing antioxidant power (FRAP), ABTS bleaching assay (αTEAC), DPPH assay and peroxyl radical scavenging assay[J]. Food Chemistry, 2011, 129(1): 139-148. DOI:10.1016/j.foodchem.2011.04.045.
[8] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26: 1231-1237.
[9] 林恋竹, 赵谋明. 反应时间对DPPH·法、ABTS +·法评价抗氧化性结果的影响[J]. 食品科学, 2010, 31(5): 63-67.
[10] HOLE A S, GRIMMER S, JENSEN M R, et al. Synergistic and suppressive effects of dietary phenolic acids and other phytochemicals from cereal extracts on nuclear factor kappa B activity[J]. Food Chemistry, 2012, 133(3): 969-977. DOI:10.1016/j.foodchem.2012.02.017.
[11] JIANG H W, LI H Y, YU C W, et al. The evaluation of antioxidant interactions among 4 common vegetables using isosbolographic analysis[J]. Journal of Food Science, 2015, 80(6): C1-C8. DOI:10.1111/1750-3841.12896.
[12] WANG S, MECKLING K A, MARCONE M F, et al. Synergistic, additive, and antagonistic effects of food mixtures on total antioxidant capacities[J]. Journal of Agricultural and Food Chemistry, 2011, 59(3): 960-968. DOI:10.1021/jf1040977.
[13] CHUN O K, KIM D O, LEE C Y. Superoxide radical scavenging activity of the major polyphenols in flesh plums[J]. Journal of Agricultural and Food Chemistry, 2003, 51(27): 8067-8072. DOI:10.1021/jf034740d.
[14] LUSZCZKI J J, ANTKIEWICZ M L, CZUCZWAR S J. Isobolographic analysis of interactions between 1-methyl-1,2,3,4-tetrahydroisoquinoline and four conventional antiepileptic drugs in the mouse maximal electroshock-induced seizure model[J]. European Journal of Pharmacology, 2009, 602(2): 298-305. DOI:10.1016/ j.ejphar.2008.11.049.
[15] LABRINEA E P, GEORGUOU G A. Stop-f l ow method for assessment of pH and time effect on the ABTS total antioxidant capacity assay[J]. Anlytica Chimica Acta, 2004, 526(1): 63-68. DOI:10.1016/ j.aca.2004.09.040.
[16] 孙玥, 余燕影, 曹树稳. 阿魏酸、根皮素和水溶性VE的抗氧化协同效应及其配方优化[J]. 食品科学, 2012, 33(3): 33-38.
[17] IP C, THOMPSON H J, ZHU Z, et al. In vitro and in vivo studies of methylseleninic acid: evidence that a monomethylated selenium metabolite is critical for cancer chemoprevention[J]. Cancer Research, 2000, 60(11): 2882-2886.
[18] WANG S, MECKLING K A, MARCONE M F, et al. In vitro antioxidant synergism and antagonism between food extracts can lead to similar activities in H 2O 2-induced cell death, caspase-3 and MMP-2 activities in H 9C 2cells[J]. Journal of the Science of Food and Agriculture, 2012, 92(15): 2983-2993. DOI:10.1002/jsfa.5711.
[19] PINELO M, MANZOCCO L, NUNEZ M J, et al. Interaction among phenols in food fortification: negative synergism on antioxidant capacity[J]. Journal of Agricultural and Food Chemistry, 2004, 52(5): 1177-1180. DOI:10.1021/jf0350515.
[20] MEYERS K J, WATKINS C B, PRITTS M P, et al. Antioxidant and antiproliferative activities of strawberries[J]. Journal of Agricultural and Food Chemistry, 2003, 51(1): 6887-6892. DOI:10.1021/jf034506n.
[21] TOSHIHIDE K, HADJIME N, MEGUMI A, et al. Characterization of novel antimicrobial compounds from mango (Mangifera indica L.) kernel seeds[J]. Food Chemistry, 2000, 71(1): 61-66.
[22] ROSSETTO M, VANZANI P, MATTIV F, et al. Synergistic antioxidant effect of catechin and malvidin-3-glucoside on free radical-initiated peroxidation of linoleic acid in micelles[J]. Archives of Biochemistry and Biophysics, 2002, 408(2): 239-245.
[23] CAI Y J, MA L P, HOU L F, et al. Antioxidant effects of green tea polyphenols on free radical initiated peroxidation of rat liver microsomes[J]. Chemistry and Physics of Lipids, 2002, 120(1): 109-117.
[24] SAUCIER C T, WATERHOUSE A L. Synergetic activity of catechin and other antioxidants[J]. Journal of Agricultural and Food Chemistry, 1999, 47(11): 4491-4494.
[25] 程雅芳, 李全文, 续颖, 等. 花生茎中白藜芦醇的提取及体外抗氧化性的研究[J]. 食品工业科技, 2011, 32(7): 144-146. DOI:10.13386/ j.issn1002-0306.2011.07.011.
[26] SARGIS R M, SUBBAIAH P V. Protection of membrane cholesterol by sphingomyelin against free radical-mediated oxidation[J]. Free Radical Biology and Medicine, 2006, 40(12): 2092-2102.
[27] LIU Z L. Microenvironmental effects and synergistic effects of bioantioxidants[J]. Chinese Journal of Organic Chemistry, 2001, 21(11): 884-889. DOI:10.3321/j.issn:0253-2786.2001.11.014.
[28] ABOU S M, CHEDEA V S, ECONOMOU A, et al. Antioxidant/ pro-oxidant properties of model phenolic compounds: part Ⅰ. Studies on equimolar mixtures by chemiluminescence and cyclic voltametry[J]. Food Chemistry, 2011, 125(2): 622-629. DOI:10.1016/ j.foodchem.2010.08.076.
[29] 汤晓, 方伟, 沈秀丽, 等. 多黄酮混合物抗氧化活性的协同与拮抗作用[J]. 食品科学, 2014, 35(5): 111-115. DOI:10.7506/spkx1002-6630-201405022.
[30] 汤晓, 焦泽武, 龚淑珍, 等. 黄酮混合物体外抗氧化活性的相互作用[J]. 食品科技, 2013, 38(2): 198-206. DOI:10.13684/j.cnki. spkj.2013.02.002.
[31] 范文来, 徐岩, 李记明, 等. 应用HS-SPME技术分析葡萄果皮与果肉挥发性香气物质[J]. 食品与发酵工业, 2011, 37(12): 113-118. DOI:10.13995/j.cnki.11-1802/ts.2011.12.012.
[32] 杨成涛. 云南主产区主栽葡萄果皮组成成分及抗氧化活性研究[D].昆明: 昆明理工大学, 2015: 20-51.
Analysis of Antioxidant Compounds in Ethanol Extracts of Grape, Mango and Strawberry and Their Interactions
PAN Yao, ZHENG Shilian, ZOU Xingping, XIONG Ziwei, DENG Zeyuan, LI Hongyan
*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Abstract:This study aimed to analyze the main chemical constituents of ethanol extracts of grape, mango and strawberry by high performance liquid chromatography-mass spectrometry (HPLC-MS) and compare the antioxidant interactions among the three extracts using 1,1-diphenyl-2-picrylhydrazyl (DPPH) and 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate (ABTS) radical scavenging assays. The isobolographic analysis method was used to analyze the differences in the antioxidant activity of mixtures in various proportions of the extracts. Results demonstrated that the grape extract had the highest contents of total phenols and total fl avonoids among three fruit extracts. Gallogen, pelargonidin-3-glucoside, pelargonidin-3-acetylglucoside and pelargonidin-3-rutinoside were the main compounds of the strawberry extract. Gallogen, mangiferin and maclurin were the main compounds of the mango extract. Trans-resveratrol and anthocyanin were the main compounds of the grape extract. The same combination showed different antioxidant activities in different antioxidant models. The strawberry extract had the highest antioxidant capacity followed by the mango extract and the grape extract. In the same antioxidant model, the highest synergistic antioxidant effect of the strawberry extract was achieved when combined with the mango extract at a ratio of 1:9 and 1:1 (V/V) for scavenging of DPPH and ABTS radicals, respectively.
Key words:antioxidant interactions; isobolographic analysis; synergistic effect; fruit combination
DOI:10.7506/spkx1002-6630-201704022
中图分类号:R151.3
文献标志码:A
文章编号:1002-6630(2017)04-0133-08
引文格式:
潘瑶, 郑时莲, 邹兴平, 等. 葡萄、芒果、草莓乙醇提取物抗氧化活性组分分析及其抗氧化相互作用[J]. 食品科学, 2017, 38(4): 133-140. DOI:10.7506/spkx1002-6630-201704022. http://www.spkx.net.cn
PAN Yao, ZHENG Shilian, ZOU Xingping, et al. Analysis of antioxidant compounds in ethanol extracts of grape, mango and strawberry and their interactions[J]. Food Science, 2017, 38(4): 133-140. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704022. http://www.spkx.net.cn
收稿日期:2016-06-21
基金项目:国家自然科学基金青年科学基金项目(31301433);中国博士后科学基金项目(2014T70618)
作者简介:潘瑶(1993—),女,硕士研究生,研究方向为营养与食品卫生学。E-mail:1130panyao@sina.com
*通信作者:李红艳(1986—),女,副教授,博士,研究方向为食品营养与化学。E-mail:lihongyan@ncu.edu.cn