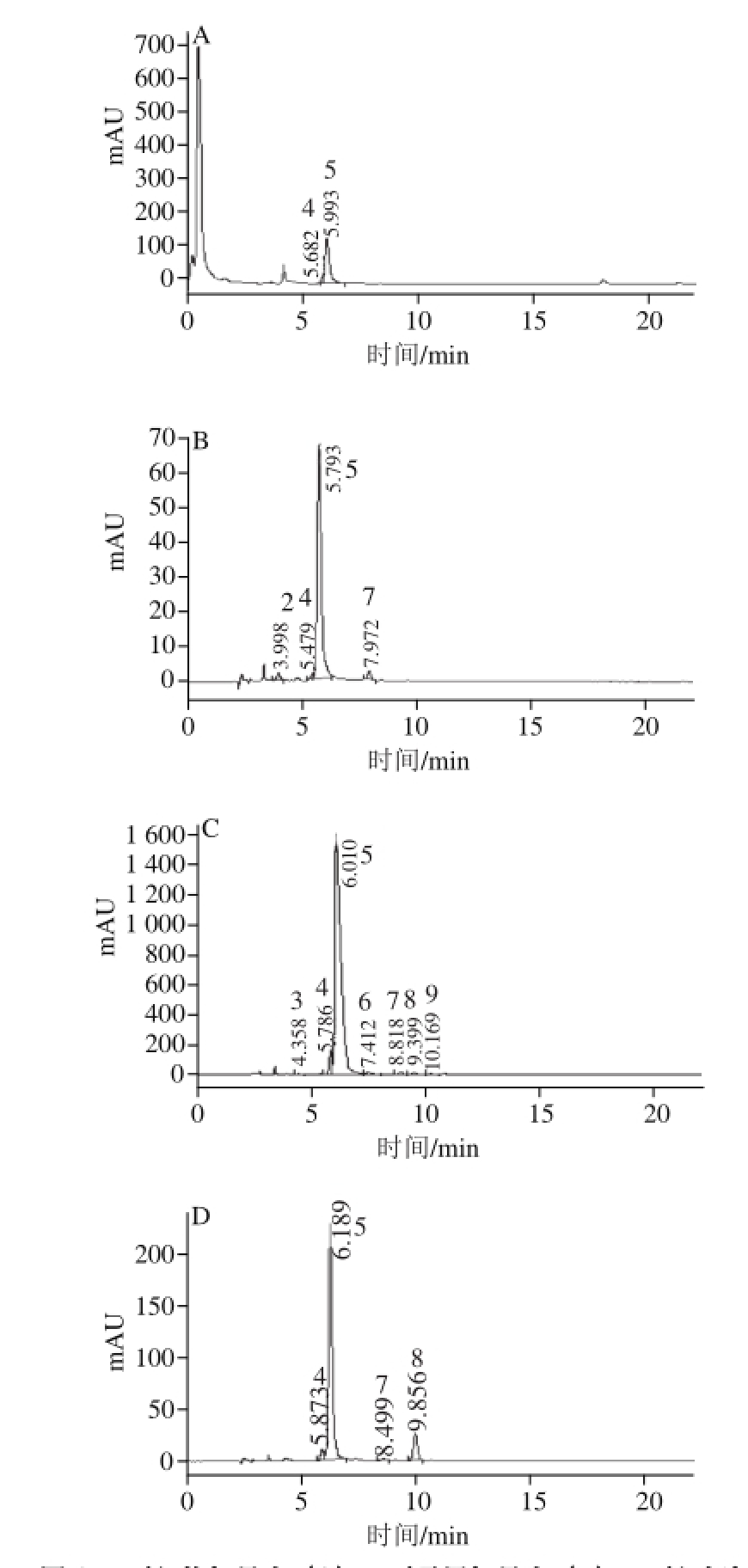
图1 ‘红艳’果皮(A)、‘雷尼’果皮(B)、‘红灯’果皮(C)和‘红灯’果肉(D)花色苷提取物HPLC图
Fig.1 HPLC chromatograms of anthocyanin extracts from skins of‘Hongyan’ (A), ‘Rainier’ (B), ‘Hongdeng’ (C) cherries and pulp of ‘Hongdeng’ cherries (D)
孙 丹 1,陈为凯 2,何 非 2,王 军 2,谷会岩 1,*
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.中国农业大学食品科学与营养工程学院,葡萄与葡萄酒研究中心,北京 100083)
摘 要:应用高效液相色谱-质谱联用技术测定甜樱桃‘雷尼’、‘红艳’、‘红灯’3 个品种的花色苷与非花色苷酚的组成与含量。花色苷的检测条件为:色谱柱Kromasil 100-5C 18柱(250 mm×4.6 mm,6.5 μm),流动相为水-甲酸-乙腈溶液,梯度洗脱,进样量30 μL,流速1.00 mL/min,柱温50 ℃,检测波长525 nm;非花色苷酚的检测条件为:色谱柱Zorbax SB-C 18(50 mm×3.0 mm,1.8 μm),流动相为1%乙酸-1%乙酸-乙腈溶液,梯度洗脱,进样量2 μL,流速1.00 mL/min,柱温25 ℃,检测波长280 nm。结果表明,3 个品种共检测到9 种花色苷,主要为花青素-3-芸香糖苷和花青素-3-葡萄糖苷,其在‘红艳’果皮、‘雷尼’果皮、‘红灯’果皮、‘红灯’果肉中的含量分别为5.21、2.51、75.70、7.40 mg/g和0.09、0.07、3.57、0.34 mg/g。非花色苷酚类化合物检测出了芦丁与山柰酚-3-芸香糖苷这2 种化合物,其在‘红艳’果皮、‘雷尼’果皮、‘红灯’果皮中的含量分别为0.30、0.63、0.74 mg/g和1.17、2.91、2.37 mg/g。
关键词:高效液相色谱-质谱联用;甜樱桃;花色苷;非花色苷酚
樱桃属蔷薇科(Rosaceae)樱桃属植物 [1]。成熟的樱桃果皮薄,颜色诱人,带有深红色或紫色的光泽,也有一些樱桃品种果皮为黄色。因樱桃诱人的颜色、特有的香气、独特的味道和保健功能,而备受人们喜爱 [2-7]。不同颜色的品种其口感不同,红色品种通常较酸、花色苷和总酚含量高:黄色品种通常较甜,花色苷和总酚含量低 [8]。
酚类物质是樱桃浆果中一类重要的次生代谢产物,可以分为花色苷和非花色苷酚两大类 [9]。花色苷是樱桃的呈色物质 [10]。目前,国内外对樱桃中花色苷的研究主要集中在提取分离、结构鉴定、稳定性和生理功能等方面。Valentina等 [11]发现,酸樱桃中的花色苷主要为花青素-3-葡萄糖苷、花青素-3-葡萄糖基芸香糖苷、花青素-3-槐糖苷和花青素-3-芸香糖苷。而甜樱桃的花色苷研究报道较少,尤其是针对甜樱桃果皮与果肉分离后用高效液相色谱-串联质谱(high-performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)技术检测其酚类物质含量的相关研究报道。樱桃果实所含的植物多酚类物质是樱桃果实风味的物质基础 [12]。利用如紫外分光光度法 [13]、酒石酸亚铁比色 [14]、福林酚法 [15]等测定植物多酚的方法报道也很多,相对而言HPLC-MS/MS [16-20]技术其准确性更强。据此,本实验以甜樱桃‘雷尼’、‘红艳’、‘红灯’3 个品种果实为试材,应用HPLC-MS/MS技术分别测定其‘雷尼’果皮、‘红艳’果皮、‘红灯’果皮以及‘红灯’果肉的花色苷与非花色苷酚类物质,为进一步研究樱桃多酚类物质的构成和含量提供理论依据。
1.1 材料与试剂
‘红艳’、‘雷尼’、‘红灯’3 个甜樱桃品种的果实采自北京市怀柔区庙城镇碧野天湖生态农业有限公司樱桃园(东经116°61´),树龄为5 a生,砧木为‘吉塞拉3’(Gisela 3),栽植密度为(3×5) m。果园田间管理按照GB/T 19630—2005《有机产品》进行。樱桃果实样品采于2015年,在果实成熟时每品种随机采集300 个果实,放置于塑料盒中,并立即运到实验室用液氮冷冻,置于-80 ℃保存待测。
甲酸、甲醇、乙酸乙酯(均为分析纯) 北京化工厂;槲皮素、二甲花翠素-3-葡萄糖苷 美国Sigma公司;甲醇、乙酸、乙腈(均为色谱级) 美国Fisher公司;超纯水采用Milli-Q(Milipore, Bedford, MA)系统制备。
1.2 仪器与设备
902-ULTS超低温冰箱 美国赛默飞公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;SHZ-88A水浴振荡器 大仓市仪器有限公司;TDL-5-A低温离心机 上海飞鸽仪器有限公司;SG3200HBT超声波清洗机 上海冠特超声仪器有限公司;FD-1A-50冻干燥机 北京必瑞克生物科技有限公司;1100系列LC/ MSD Trap-VL液相色谱-离子阱质谱联用仪(配有G1379A真空溶剂脱气机、G1311A四元高压梯度泵、G1313A自动进样器、G1316A柱温箱、G1315A二极管阵列检测器)、1200系列LC/MSD Trap-VL高效液相色谱-三重四极杆质谱联用仪(配有G1322A真空脱气机、G1312B二元高压梯度泵、G1367C自动进样器、G1316B柱温箱、G1314C可变波长检测器) 美国安捷伦科技有限公司。
1.3 方法
1.3.1 樱桃花色苷提取检测
将樱桃于液氮条件下剥离果皮、果肉后,液氮保护条件下破碎成粉末状,真空冷冻干燥24 h。准确称取0.500 g(±0.005 g)樱桃果皮或果肉干粉,加体积分数2%甲酸-甲醇溶液10 mL;功率100 W、频率59 Hz条件下超声10 min;25 ℃、130 r/min条件下摇床浸提30 min,然后8 000 r/min离心10 min,转移上清液于100 mL圆底烧瓶中。重复提取5 次,合并上清液,25 ℃旋转蒸发至干,用花色苷定溶剂(流动相A-B体积比9∶1)定容至10 mL,提取过程全程控温25 ℃以条件下,提取液放置于-40 ℃冰箱保存备用。每个样品进行3 组独立的技术重复。所测物质含量以干质量计。
采用Agilent 1100系列的LC/MSD Trap-VL液相色谱-离子阱质谱联用仪进行樱桃果皮与果肉花色苷的分析。
HPLC条件:色谱柱为Kromasil 100-5C 18柱(250 mm×4.6 mm,6.5 μm);进样量30 μL;样品测定前经0.22 μm微孔滤膜过滤;流动相A:水-甲酸-乙腈(92∶2∶6,V/V)溶液;流动相B:水-甲酸-乙腈(44∶2∶54,V/V)溶液;洗脱程序:0~18 min,10%~25% B;18~20 min,25% B;20~30 min,25%~4 0% B;30~35 m i n,40%~70% B;35~40 min,70%~100% B;流速1.00 mL/min;柱温50℃;检测波长525 nm。
MS条件:电喷雾离子源;正离子模式;质量扫描范围m/z 100~1 000;雾化器压力35 psi;干燥气流速10 L/min;干燥气温度350 ℃ [21]。
样品的定性依据中国农业大学葡萄酒研究中心建立的谱库并结合文献报道进行判定,通过比对谱库中HPLC-UV-MS/MS图谱中的质谱信息、光谱信息和保留时间确定花色苷种类。定量方法采用二甲花翠素-3-葡萄糖苷为标准物,建立0.5~500 mg/L之间花色苷定量回归方程:Y=6.356 46X-5.746 04,R=0.999 5,相关系数在0.998以上,表明在标样质量浓度0.5~500 mg/L范围内,色谱图峰面积和二甲花翠素-3-葡萄糖苷含量有良好的线性关系,满足定量条件。
1.3.2 樱桃非花色苷酚提取检测
分别准确称取5.000 g(±0.005 g)樱桃果皮、果肉冻干粉于锥形瓶中,加入5 mL蒸馏水和45 mL乙酸乙酯,在室温条件下,130 r/min水浴摇床萃取30 min,转移上清液于250 mL圆底烧瓶中,重复提取5 次,合并上清液,30 ℃旋转蒸发至干,用甲醇溶解定容至5 mL,置于-40 ℃冰箱保存备用。每个样品进行3 组独立的技术重复。样品测定前经0.22 μm尼龙膜过滤。所测物质含量以干质量计。
采用Agilent 1200系列HPLC-MSD trap VL高效液相色谱-离子阱质谱联用仪,配有G1314C可变波长检测器。
HPLC条件:色谱柱为Zorbax SB-C 18(50 mm× 3.0 mm,1.8 μm);进样量为2 μL;流动相A:1%乙酸溶液;流动相B:1%乙酸-乙腈溶液;洗脱程序:0~10 min,5% B;10~18 min,8% B;18~40 min,40% B;40~50 min,15% B;50~53 min,20% B;53~58 min,30% B;58~62 min,50% B;62~66 min,100% B;流速1.00 mL/min;柱温25 ℃;检测波长280 nm。
MS条件:电喷雾离子源;负离子模式;质量扫描范围m/z 0~1 000;雾化气压力30 psi;干燥气流速10 L/min;干燥气温度325 ℃;离子阱离子电荷控制量为30 000 units;最大累计时间为300 ms;碰撞诱导解离的MS/MS诱导碰撞电压为1.0 V [22-23]。
定量方法:配制10 个质量浓度水平的槲皮素标准溶液,每个水平重复3 次,以各组分的平均峰面积(Y)对质量浓度(mg/L)(X)建立回归方程。黄酮醇类采用槲皮素为标准品,回归方程:Y=(X-9.942 8)/ 3.230 7,R=0.999 4,该种标准非花色苷酚类化合物在相应的线性范围内相关系数均在0.998以上,表明在一定的标样质量浓度范围内具有良好的线性关系,满足定量条件。
2.1 樱桃花色苷成分检测结果

图1 ‘红艳’果皮(A)、‘雷尼’果皮(B)、‘红灯’果皮(C)和‘红灯’果肉(D)花色苷提取物HPLC图
Fig.1 HPLC chromatograms of anthocyanin extracts from skins of‘Hongyan’ (A), ‘Rainier’ (B), ‘Hongdeng’ (C) cherries and pulp of ‘Hongdeng’ cherries (D)
如图1所示,根据保留时间依次可推测出,‘红艳’果皮花色苷的出峰时间为5.68、5.99 min,‘雷尼’果皮花色苷的出峰时间为4.00、5.48、6.79、7.97 min,‘红灯’果皮花色苷的出峰时间为4.36、5.79、6.01、7.41、8.82、9.40、10.17 min,‘红灯’果肉花色苷的出峰时间为5.87、6.19、8.50、9.56 min。所有检测结果中只有峰4、5是这4 种材料的共有化合物,且为这3 个甜樱桃品种的主要花色苷。
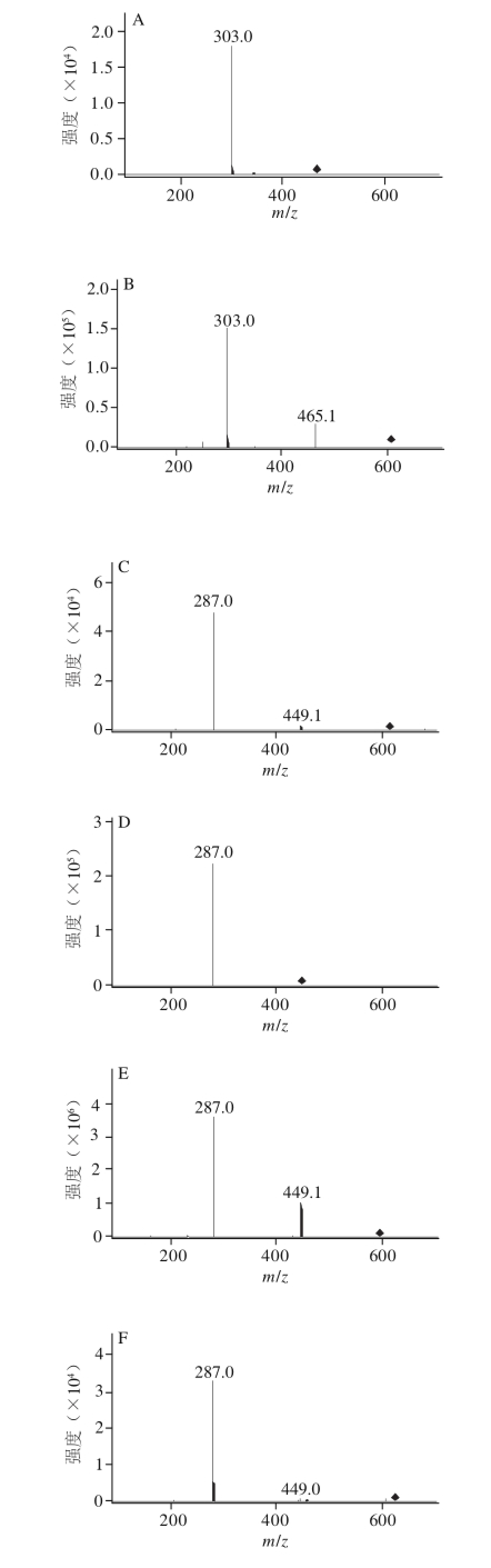
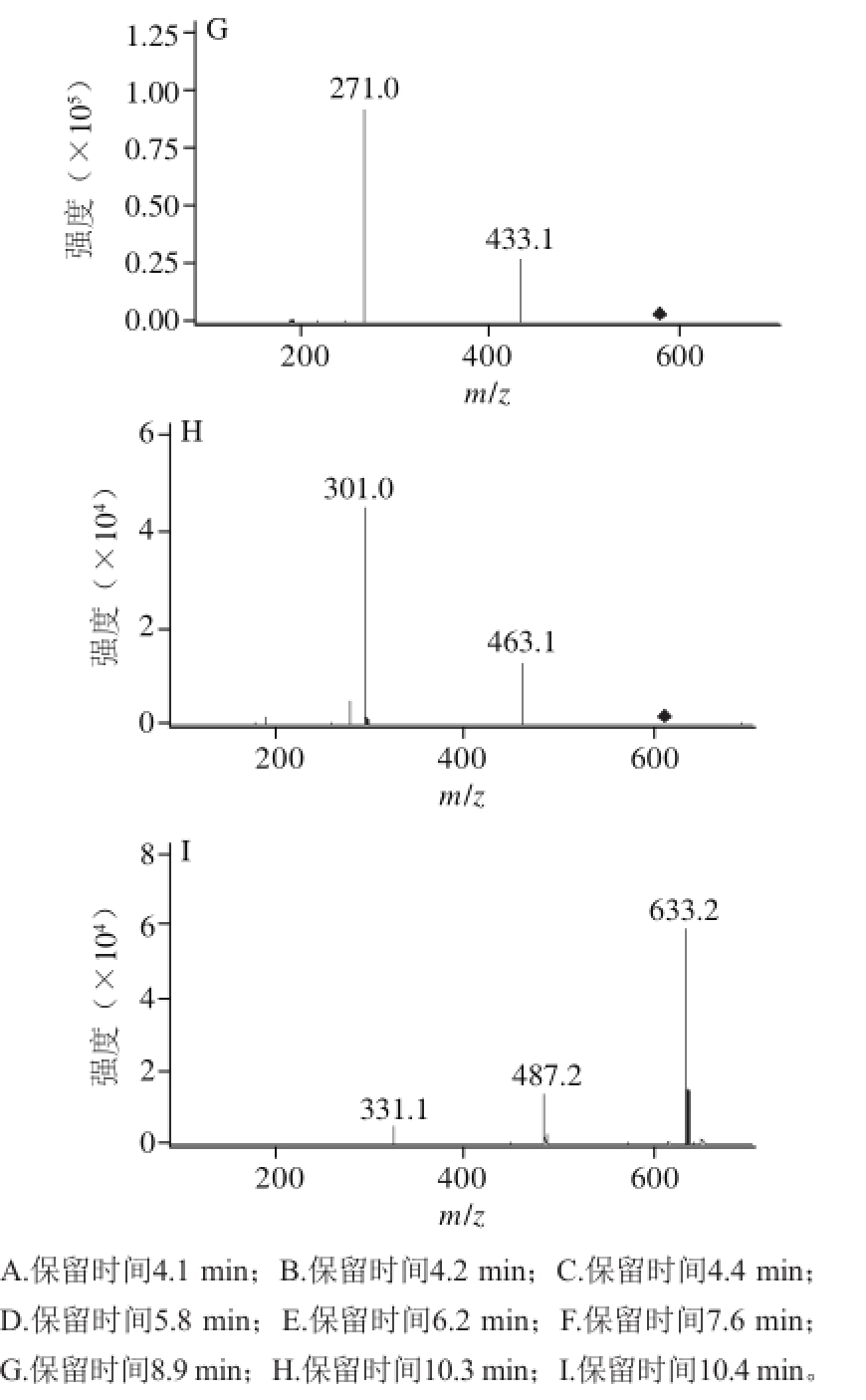
图2 樱桃不同保留时间的花色苷组分MS图
Fig.2 Mass spectra of anthocyanin components with different retention times
植物中花色素主要有6 种,即花青素、花翠素、花葵素、甲基花青素、甲基花翠素及二甲花翠素 [24]。如图2所示,由峰4、5二级质谱信号m/z 287,可判定它们的苷元为花青素。根据母离子m/z 449,子离子m/z 287,其中162是葡萄糖失去1分子水的相对分子质量,保留时间为5.8 min,由此可推断峰4化合物为花青素-3-葡萄糖苷;保留时间为6.2 min的质谱图母离子M +的m/z 595,其子离子m/z 287,595-287=308是破碎的糖苷的m/z,初步推测此化合物为花青素-3-芸香糖苷 [25],结合标样花青素-3-芸香糖苷的谱图,两者的HPLC保留时间和MS中检测到的碎片离子m/z均相同,因此断定峰5的化合物为花青素-3-芸香糖苷。
如表1所示,樱桃果实中共检测出9 种花色苷化合物。其中花青素-3-芸香糖苷、花青素-3-葡萄糖苷在这3 个品种的果皮和‘红灯’果肉中都存在,且含量都相对较高。花青素-3-芸香糖苷在所有检测到的花色苷中含量最高,在‘红艳’果皮、‘雷尼’果皮、‘红灯’果皮、‘红灯’果肉中的含量依次为5.21、2.51、75.70、7.40 mg/g。‘红艳’果皮中检测到可定量的花色苷化合物有花青素-3-葡萄糖苷和花青素-3-芸香糖苷。‘雷尼’果皮中检测到可定量的花色苷化合物除花青素-3-葡萄糖苷和花青素-3-芸香糖苷外,还检测到花葵素-3-芸香糖苷。‘红灯’果皮中检测到花色苷普遍比‘红艳’果皮、‘雷尼’果皮含量高,种类多,共有6 种:花青素-3-槐糖苷、花青素-3-葡萄糖苷、花青素-3-芸香糖苷、花青素衍生物、花葵素-3-芸香糖苷、甲基花青素-3-芸香糖苷。‘红灯’果肉中检测到4 种花色苷化合物,分别为花青素-3-葡萄糖苷、花青素-3-芸香糖苷、花葵素-3-芸香糖苷、甲基花青素-3-芸香糖苷。同一品种中,‘红灯’皮花色苷的种类、含量除了甲基花青素-3-芸香糖苷外,都比‘红灯’果肉的多。
表1 樱桃果实花色素的HPLC-MS/MS成分分析
Table1 HPLC-MS/MS data and tentative identif i cation of anthocyanin composition of cherries
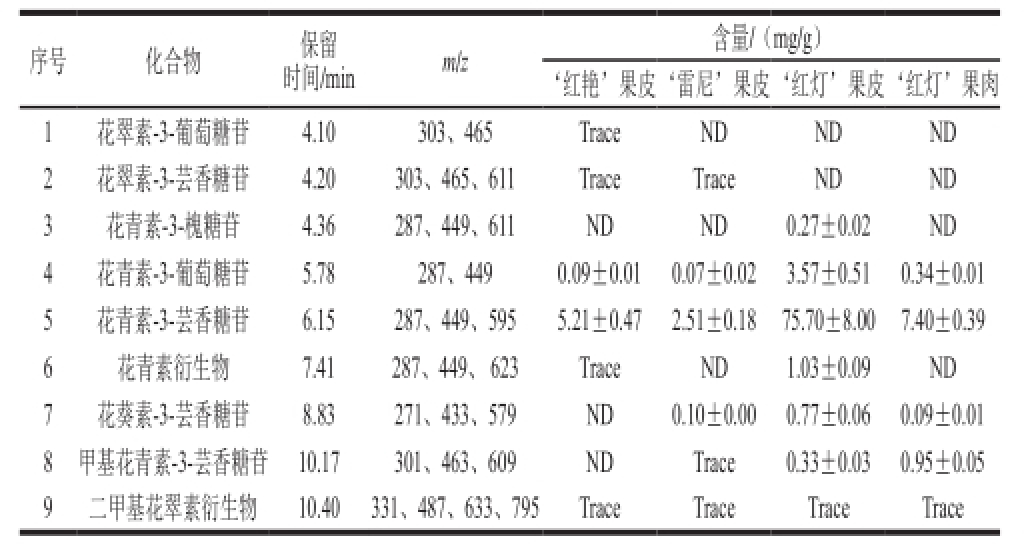
注:Trace.微量;ND.未检测到。
?
2.2 樱桃非花色苷酚化合物检测结果
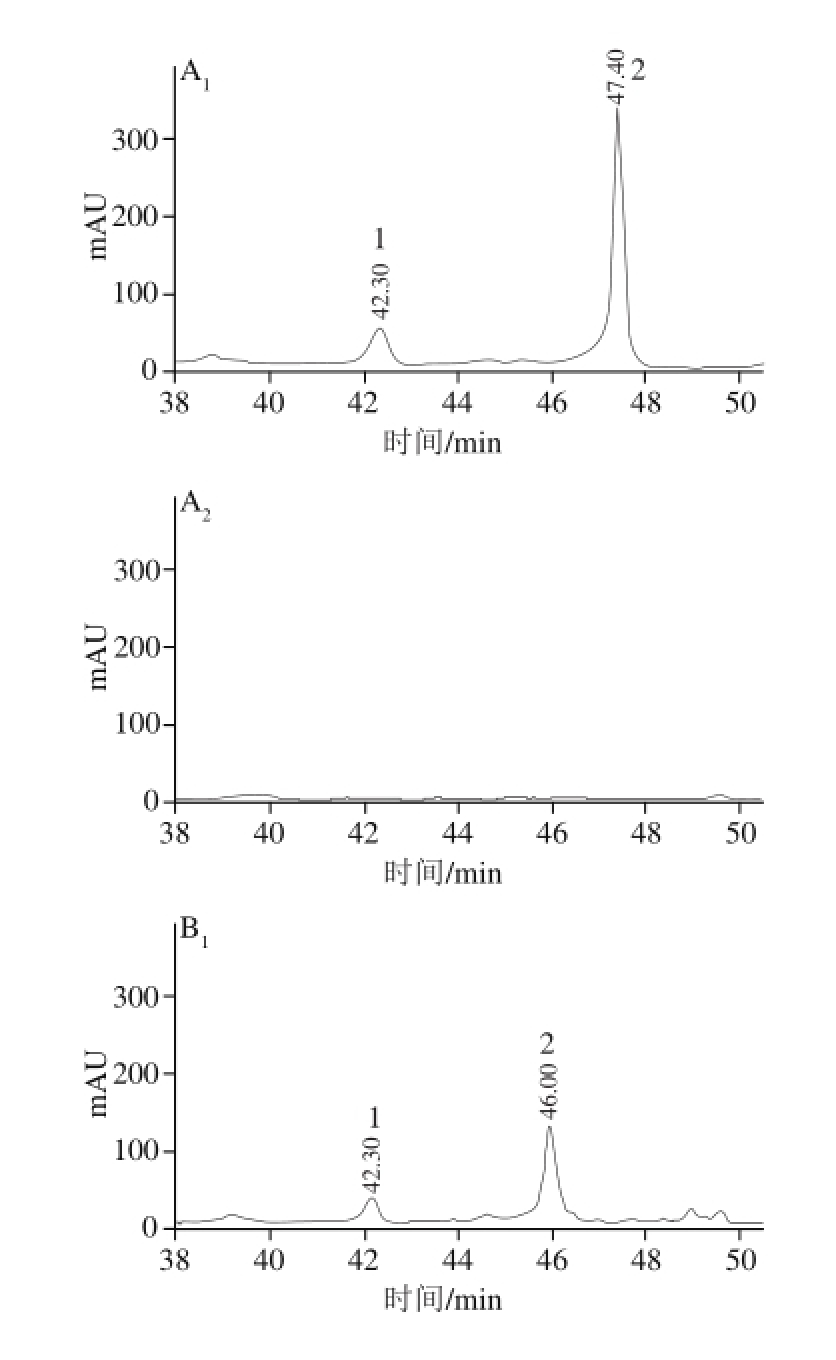

图3 ‘雷尼’(A)、‘红艳’(B)和‘红灯’(C)非花色苷提取物HPLC图
Fig.3 HPLC chromatograms of nonanthocyanin phenolics extracts from ’ (C)‘Rainier’ (A),‘Hongyan’ (B),‘Hongdeng
如图3所示,保留时间42.30、47.40 min为‘红艳’果皮、‘红灯’果皮、‘雷尼’果皮主要的非花色苷酚化合物,‘雷尼’果肉、‘红艳’果肉、‘红灯’果肉没有检测到非花色苷酚化合物。根据保留时间及离子碎片可推测出图中峰1、2分别为芦丁和山柰酚-3-芸香糖苷。
表2 樱桃果皮中非花色苷酚的HPLC-MS/MS成分分析
Table2 HPLC-MS/MS data and tentative identif i cation of nonanthocyanin phenolic composition of cherries

序号化合物保留时间/minm/z ‘红灯’果肉1芦丁42.30609、301 0.30±0.02ND0.63±0.13ND0.74±0.06ND 2山柰酚-3-芸香糖苷47.40593、285 1.17±0.02ND2.91±0.45ND2.37±0.02ND含量/(mg/g)‘红艳’果皮‘红艳’果肉‘雷尼’果皮‘雷尼’果肉‘红灯’果皮
如表2所示,这3 个品种仅有芦丁与山柰酚-3-芸香糖苷这2 种化合物被检测出来,且芦丁与山柰酚-3-芸香糖苷仅在樱桃果皮中检出。芦丁含量最高的是‘红灯’果皮,为0.74 mg/g,‘红艳’果皮、‘雷尼’果皮、‘红灯’果皮的山柰酚-3-芸香糖苷分别为1.17、2.91 mg/g和2.37 mg/g,‘雷尼’果皮中含量最高。
在供试的甜樱桃果皮和果肉中,共检测到9 种花色苷化合物,分别为花翠素-3-葡萄糖苷、花翠素-3-芸香糖苷、花青素-3-槐糖苷、花青素-3-葡萄糖苷、花青素-3-芸香糖苷、花葵素-3-芸香糖苷、甲基花青素-3-芸香糖苷、花青素衍生物、二甲基花翠素衍生物,其中花青素-3-芸香糖苷是这3 个樱桃品种的主要花色苷,其在‘红艳’果皮、‘雷尼’果皮、‘红灯’果皮、‘红灯’果肉中的含量分别为5.21、2.51、75.70、7.40 mg/g,在‘红灯’果皮中的含量最高。对红肉品种而言,其果皮和果肉中的花色苷组成和含量不同,‘红灯’果肉中检测到4 种花色苷,含量最多的亦为花青素-3-芸香糖苷,其含量仅为果皮中的十分之一。
在供试的3 种甜樱桃果皮中,共检测到2 种非花色苷酚类化合物,分别为芦丁和山柰酚-3-芸香糖苷,而在果肉中未检测到非花色苷酚类化合物,山柰酚-3-芸香糖苷是供试的3 个甜樱桃品种果皮中的主要非花色苷酚类化合物,其含量约为芦丁含量的3~4 倍。
参考文献:
[1] 肖军霞, 黄国清, 迟玉森. 樱桃花色苷的提取及抗氧化活性研究[J]. 中国食品学报, 2011, 11(5): 70-75. DOI:10.3969/ j.issn.1009-7848.2011.05.012.
[2] CRISOSTO C H, CRISOSTO G M, METHENEY P. Consumer acceptance of ‘Brooks’ and ‘Bing’ cherries is mainly dependent on fruit SSC and visual skin colour[J]. Postharvest Biology and Technology, 2003, 28(1): 159-167. DOI:10.1016/s0925-5214(02)00173-4.
[3] HEINONEN I M, MEYER A S, FRANKEL E N. Antioxidant activity of berry phenolics on human low-density lipoprotein and liposome oxidation[J]. Journal of Agricultural and Food Chemistry, 1998, 46(10): 4107-4112. DOI:10.1021/jf980181c.
[4] SERRADILLA M J, MARTIN A, RUI Z M, et al. Physicochemical and sensorial characterisation of four sweet cherry cultivars grown in Jerte Valley[J]. Food Chemistry, 2012, 133(4): 1551-1559. DOI:10.1016/j.foodchem.2012.02.048.
[5] 闫国华, 张开春, 周宇, 等. 樱桃保健功能研究进展[J]. 食品工业科技, 2008, 29(2): 313-316. DOI:10.13386/j.issn1002-0306.2008.02.081.
[6] 崔新颖, 李香艳, 孔祥雨, 等. 酸樱桃果实有效成分及药理作用的研究[J]. 北华大学学报, 2007, 8(2): 145-149. DOI:10.3969/ j.issn.1009-4822.2007.02.012.
[7] 熊蔚蔚, 丁雪馨, 付瑶, 等. 樱桃成分及其药理作用的研究[J]. 北华大学学报, 2010, 11(5): 408-411. DOI:10.3969/j.issn.1009-4822.2010.05.006.
[8] 高佳, 王宝刚, 冯晓元, 等. 甜樱桃和酸樱桃品种果实性状的综合评价[J]. 北方园艺, 2011(17): 17-21.
[9] 赵权, 王军, 段长青. 山葡萄果实发育过程中花色苷和非花色苷酚成分及其含量的变化[J]. 植物生理学通讯, 2010, 46(1): 80-86.
[10] 王燕. 樱桃李(Prunus cerasifera Ehrh.)果实主要花色苷组分及相关特性分析[D]. 泰安: 山东农业大学, 2012.
[11] VALENTINA S, SPOMENKA K, DAJANA G, et al. Determination of anthocyanins in four Croatian cultivars of sour cherries (Prunus cerasus)[J]. European Food Research and Technology, 2005, 220(5/6): 575-578. DOI:10.1007/s00217-004-1103-2.
[12] 王贤萍, 段泽敏, 戴桂林, 等. 甜樱桃主要栽培品种多酚含量的测定与品质分析[J]. 中国农学通报, 2011, 27(13): 173-176.
[13] 卜彦花, 周娜娜, 王春悦, 等. 福林酚试剂法和紫外分光光度法测定冬枣多酚含量的比较研究[J]. 中国农学通报, 2012, 28(1): 212-217. DOI:10.3969/j.issn.1000-6850.2012.01.041.
[14] 刘蓓蓓, 陈胜璜, 邹菊英, 等. 酒石酸亚铁比色法测定黄鹂芽中茶多酚的含量[J]. 中南药学, 2011, 9(10): 740-741. DOI:10.3969/ j.issn.1672-2981.2011.10.006.
[15] 张萍, 王毅红, 张春生, 等. 樱桃多酚含量的福林法测定研究[J]. 食品研究与开发, 2016, 37(2): 146-149. DOI:10.3969/ j.issn.1005-6521.2016.02.036.
[16] 赵秀林, 王富荣, 徐凌云, 等. HPLC法测定桃不同品种果实中花色苷组成和含量[J]. 食品科学, 2013, 34(8): 208-211. DOI:10.7506/ spkx1002-6630-201308044.
[17] 李广, 李琪, 金丽琼, 等. HPLC法测定甘肃地产不同品种酿酒葡萄中的花色苷[J]. 中国酿造, 2014, 33(3): 132-136. DOI:10.3939/ j.issn.0254-5071.2014.03.032.
[18] 夏效东, 凌文华, 郑琳, 等. HPLC法测定黑米皮提取物中花色苷成分及含量[J]. 食品科学, 2006, 27(2): 206-208. DOI:10.3321/ j.issn:1002-6630.2006.02.045.
[19] 陈亮, 李公斌, 辛秀兰, 等. HPLC法测定3 种杂交翠菊花色苷的含量[J]. 食品研究与开发, 2012, 33(8): 129-131. DOI:10.3969/ j.issn.1005-6521.2012.08.039.
[20] 王卫东, 李超, 许时婴, 等. 高效液相色谱-串联质谱法分离鉴定黑莓花色苷[J]. 食品科学, 2009, 30(14): 230-234. DOI:10.3321/ j.issn:1002-6630.2009.14.049.
[21] HE J J, LIU Y X, PAN Q H, et al. Different anthocyanin prof i les of the skin and the pulp of Yan 73 (Muscat Hamburg × Alicante Bouschet) grape berries[J]. Molecules, 2010, 15(3): 1141-1153. DOI:10.3390/ molecules15031141.
[22] JIN Z M, BI H Q, LIANG N N, et al. An extraction method for obtaining the maximum non-anthocyanin phenolics from grape berry skins[J]. Analytical Letters, 2010, 43(5): 776-785. DOI:10.1080/00032710903486351.
[23] 肖慧琳. 滇川高原地区酿酒葡萄果实酚类物质的积累规律[D]. 北京: 中国农业大学, 2012.
[24] 赵善仓, 刘宾, 赵领军, 等. 蓝、紫粒小麦籽粒花色苷组成分析[J]. 中国农业科学, 2010, 43(19): 4072-4080. DOI:10.3864/ j.issn.0578-1752.2010.10.020.
[25] LONGO L, SCARDINO A, VASAPOLLO G. Identification and quantification of anthocyanin in the berries of Pistacia lentiscus L., Phillyrea latifolia L. and Rubia peregrina L.[J]. Innovative Food Science and Emerging Technologies, 2007, 8(3): 360-364. DOI:10.1016/j.ifset.2007.03.010.
Analysis of Anthocyanins and Nonanthocyanin Phenolics in Sweet Cherry by HPLC-MS/MS
SUN Dan
1, CHEN Weikai
2, HE Fei
2, WANG Jun
2, GU Huiyan
1,*
(1. School of Forestry, Northeast Forestry University, Harbin 150040, China; 2. Center for Viticulture and Enology, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Abstract:The compositions and contents of anthocyanins and nonanthocyanin phenolics in three cultivars of sweet cherry (‘Rainier’, ‘Hongyan’ and ‘Hongdeng’) were analyzed by using high-performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). The separation of anthocyanins was achieved on a Kromasil 100-5C 18column (250 mm × 4.6 mm, 6.5 μm) using a mobile phase consisting of water/formic acid/acetonitrile at a fl ow rate of 1.00 mL/min by gradient elution. The injection volume was 30 μL and the column temperature was set at 50 ℃. The detection wavelength was 525 nm. Meanwhile, the separation of nonanthocyanin phenolics was accomplished a Zorbax SB-C 18column(50 mm × 3.0 mm, 1.8 μm)using a mobile phase consisting of 1% acetic acid aqueous solution and 1% acetic acid acetonitrile solution at a fl ow rate of 1.00 mL/min by gradient elution. The injection volume was 2 μL and the column temperature was set at 25 ℃. The detection wavelength was 280 nm. The results showed that a total of 9 anthocyanin compounds were detected in these cultivars of sweet cherry, mainly cyanidin-3-rutinoside and cyanidin-3-glucoside, their contents in the skin of ‘Hongyan’, ‘Rainier’,‘Hongyan’ cherries and the pulp of ‘Hongdeng’ cherries were 5.21, 2.51, 75.70 and 7.40 mg/g, and 0.09, 0.07, 3.57 and 0.34 mg/g, respectively. In addition, two nonanthocyanin phenolic compounds were also detected, namely quercetin-3-rutinoside and kaempferol-3-rutinoside. The contents of quercetin-3-rutinoside and kaempferol-3-rutinoside in the skin of ‘Hongyan’, ‘Rainier’and ‘Hongdeng’ cherries were 0.30, 0.63 and 0.74 mg/g, and 1.17, 2.91 and 2.37 mg/g, respectively.
Key words:high-performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); sweet cherry; anthocyanin compounds; nonanthocyanin phenolic compounds
DOI:10.7506/spkx1002-6630-201704029
中图分类号:S662.5
文献标志码:A
文章编号:1002-6630(2017)04-0181-06
收稿日期:2016-07-24
基金项目:中央高校基本科研业务费专项(DL09EA03-3);黑龙江省科技攻关项目(GZ11B303)
作者简介:孙丹(1990—),女,硕士,研究方向为葡萄与葡萄酒。E-mail:qi1cai2jia3ri4@126.com
*通信作者:谷会岩(1970—),男,副教授,博士,研究方向为植物资源开发利用、生物多样性保育和干扰生态学。
E-mail:ghuiyan@nefu.edu.cn
引文格式:
孙丹, 陈为凯, 何非, 等. HPLC-MS/MS法测定甜樱桃花色苷与非花色苷酚的组成与含量[J]. 食品科学, 2017, 38(4): 181-186. DOI:10.7506/spkx1002-6630-201704029. http://www.spkx.net.cn
SUN Dan, CHEN Weikai, HE Fei, et al. Analysis of anthocyanins and nonanthocyanin phenolics in sweet cherry by HPLC-MS/MS[J]. Food Science, 2017, 38(4): 181-186. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704029. http://www.spkx.net.cn