
图1 混合标准品的HPLC谱图
Fig.1 HPLC chromatograms of mixed standard substances
段凯莉 1,高明景 2,刘永泉 1,张婷婷 1,陈 丽 1,赵三忠 2,罗丽萍 1,*
(1.南昌大学生命科学学院,江西 南昌 330031;2.北京忠澜艾健康研究院,北京 100070)
摘 要:为研究艾叶化学成分与其产地之间关系,分别以产自河南南阳和新疆的艾叶为实验材料,对比研究其酚类化合物和挥发油的组成。以体积分数60%乙醇溶液为溶剂超声提取酚类化合物,高效液相色谱法结合标样检测其组成;同时蒸馏萃取结合气相色谱-质谱联用检测挥发油的化学成分。结果表明,河南南阳和新疆艾叶挥发油得率分别为2.644%、0.805%;河南南阳、新疆艾叶分别检测出标准品中的19 种和14 种酚类化合物,总含量达13.43 mg/g和9.75 mg/g;挥发油中分别鉴定出29 种和12 种化合物,占挥发油总量的80.24%和71.22%。河南南阳艾叶比新疆艾叶含有更加丰富的酚类化合物和挥发油。
关键词:艾叶;酚类化合物;相似度分析;高效液相色谱;挥发油;气相色谱-质谱法
艾草(Artemisia argyi)为菊科蒿属多年生草本植物。艾叶在我国具有悠久的药食同源应用历史以及很高的药用价值,我国古代曾有“家有三年艾,郎中不用来”的谚语,在历代本草著作以及医书古籍均有描述和记载。现代研究表明,艾叶含有香豆素、糖苷、黄酮、甾醇、萜类化合物、挥发油等,具有治溃疡 [1]、活血 [2]、抗氧化 [3]、抗诱变、抗炎 [4]、抗癌、抗菌、免疫调节 [5]等生物活性。
酚类化合物是一种广泛存在于植物中的次级代谢产物。艾叶的酚类化合物具有抗菌、抗炎、抗癌、抗氧化 [6]及抗乙肝病毒 [7]的活性,是艾叶的主要活性成分之一。但是不同品种与不同产地艾叶的酚类化合物存在差异,如银叶蒿的酚类化合物主要为黄酮和羟基肉桂酸的衍生物 [8];野艾蒿含有39 种酚类化合物,包括黄酮、香豆素、酚酸等 [6];北艾叶仅含有15 种酚类化合物 [9];Carvalhoa等 [10]对6 个品种的艾叶酚类化合物研究发现艾叶富含酚类化合物,但不同品种间有较大差异;Tan Xiaojie等 [11]研究发现不同产地及收获季节的茵陈蒿酚类物质有很大差异。
艾叶挥发油具有特殊香气,味辛、微苦、性凉,为艾叶的主要活性成分,一直被视为评价其药材质量的标准。研究表明,艾叶挥发油不仅具有防晒、抗氧化 [12]、抗菌 [13]的活性;还具有神经调节的作用,可以治疗癫痫、抑郁、失眠、焦虑等精神疾病 [14]。由于生长环境的不同,不同产地间艾叶挥发油质量不同。有研究对土耳其 [15]、伊朗卡尚地区 [16]及伊朗西北部 [17]的艾叶挥发油进行测定,得率分别为0.4%、0.25%、1.4%,土耳其艾叶主要成分为侧柏酮、石竹烯、桉树脑,伊朗卡尚地区艾叶主要成分为反式石竹烯、桉树脑、鼠尾草烯,伊朗西北部艾叶主要成分为蒎烯、薄荷脑、桉叶油醇;Jin Ran等 [18]研究发现5 个不同产地的艾叶所含挥发油成分及含量明显不同。
然而,以上研究均为独立报道,艾叶的品种、采收季节、提取方式、测定仪器不同,使这些数据缺乏可比性。且地理来源对艾叶主要化学成分影响的研究均为艾叶酚类化合物或挥发油单一方面的比较,鲜见艾叶酚类化合物与挥发油两方面的综合分析。本实验以河南南阳和新疆艾叶为材料,采用同一方法分别提取其酚类化合物和挥发油,计算得率,然后采用高效液相色谱(high performance liquid chromatography,HPLC)法结合标样测定其酚类化合物,气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用测定挥发油的化学组成,通过对结果的比较分析,明确河南南阳和新疆艾叶主要化学组成的差异。研究结果可为艾叶的开发利用,以及优质艾叶的科学种植规划提供理论依据。
1.1 材料与试剂
艾叶分别采自新疆和河南南阳,由北京忠澜艾健康研究院提供。
阿魏酸、肉桂酸、柚皮素、槲皮素、山柰酚(纯度≥98%) 中药固体制剂制造技术国家工程研究中心;没食子酸、儿茶素、咖啡酸、芦丁(纯度≥98%) 中国食品药品检定研究院;染料木素、p-香豆酸、杨梅酮、对硝基苯甲酸(纯度≥98%) 美国Sigma公司;白藜芦醇、黄豆苷元、橙皮素、鹰嘴豆芽素A(纯度≥98%) 美国阿拉丁公司;橙皮苷、原儿茶酸(纯度≥98%) 北京百灵威科技有限公司;实验用水均为超纯水;甲醇和乙腈为色谱纯,甲酸为优级纯,其余试剂均为国产分析纯。
1.2 仪器与设备
1200型HPLC仪(包括在线脱气装置、四元泵、柱温箱、光电二极管阵列检测器、手动进样装置、配有G2170BA LC化学工作站)、6890/5973 GC-MS联用仪美国Agilent公司;JS-02安捷顺多功能粉碎机 浙江武义捷顺工具有限公司;KQ3200DE超声波清洗器 昆山市超声仪器有限公司;同时蒸馏萃取(simultaneous distillation extraction,SDE)装置 安徽天长优信电器设备有限公司;DK-S18水浴锅 上海森信实验仪器有限公司;ME203E/02电子天平 梅特勒-托利多仪器(上海)有限公司;TDL-5-A离心机 上海安亭科学仪器厂;IKARV10旋转蒸发仪 艾卡仪器设备有限公司;Hitech-Master综合型超纯水机 上海和泰仪器有限公司。
1.3 方法
1.3.1 艾叶酚类化合物的提取
将河南南阳和新疆艾叶粉碎,过40 目筛。分别准确称取1.000 g样品于离心管中,加入40 mL体积分数60%乙醇溶液混匀,室温浸泡24 h,40 ℃、150 W超声提取40 min。提取液3 500 r/min离心10 min,取上清液旋转蒸发,回收乙醇溶液,体积分数70%甲醇溶液定容至10 mL,提取液于-20 ℃保存备用。
1.3.2 标准品的制备
分别称取19 种干燥至恒质量的标准品5.0 mg,用甲醇溶解,配制成1 mg/mL标准品储备液,-20 ℃避光保存,用体积分数70%甲醇溶液稀释其他质量浓度标准品溶液,保存备用。
1.3.3 标准曲线的绘制
准确吸取适量上述标准品储备液,用体积分数70%甲醇溶液稀释成各质量浓度的6 组混合标准溶液。参照Guo Xiali等 [19]的方法,黄豆苷元、柚皮素、槲皮素、没食子酸、山柰酚、芦丁、杨梅酮的混合标准溶液在波长256 nm处检测;橙皮素、p-香豆酸、咖啡酸、鹰嘴豆芽素A、肉桂酸、白藜芦醇、染料木素、原儿茶酸、阿魏酸、对硝基苯甲酸、橙皮苷、儿茶素的混合标准溶液在波长280 nm处检测。p-香豆酸、鹰嘴豆芽素A、肉桂酸、黄豆苷元的质量浓度为1.8~60 μg/mL,柚皮素、染料木素的质量浓度为1~60 μg/mL,没食子酸、原儿茶酸、阿魏酸、芦丁、白藜芦醇、槲皮素的质量浓度为3~100 μg/mL,对硝基苯甲酸、橙皮苷、儿茶素、杨梅酮、咖啡酸、山柰酚、橙皮素的质量浓度为6~200 μg/mL。用体积分数70%甲醇溶液将上述标准品稀释成6 个质量浓度,按从低到高质量浓度依次进行HPLC分析,平行测定3 次。
1.3.4 HPLC检测艾叶酚类化合物组成
色谱柱:Agilent ZORBAX Eclipse XDB C 18色谱柱(4.6 mm×150 mm,5 μm);流动相:乙腈(A)和0.2%甲酸溶液(B);流速1.0 mL/min;柱温35℃;检测波长为256 nm和280 nm;进样量20 µL;采用梯度洗脱:0~5 min,5%~14% A,95%~86% B;5~20 min,14%~16% A,86%~84% B;20~25 min,1 6%~2 8% A,84%~72% B;25~40 m i n,2 8%~3 3% A,72%~67% B;40~50 m i n,3 3%~5 5% A,67%~45% B;50~55 m i n,5 5%~6 5% A,45%~35% B;55~60 m i n,65%~25% A,35%~75% B。
1.3.5 HPLC指纹图谱的相似度分析
利用国家药典委员会指纹图谱相似度评价系统(2004A版)对河南南阳和新疆2 种艾叶醇提物在波长256 nm和280 nm处检测的HPLC指纹图谱进行相似度分析,设定参照谱图,将谱图自动匹配生成对照图谱进行相似度评价。
1.3.6 GC-MS测定艾叶挥发油的化学成分
1.3.6.1 艾叶挥发油的提取
采用SDE法提取艾叶挥发油。称取15 g艾叶粉末与400 mL蒸馏水混合浸泡10 h,将混合物转移至SDE装置的物料瓶中,下方用电炉加热。仪器另一侧容量瓶中加入40 mL无水乙醚,50 ℃恒温水浴加热,打开冷凝装置,待样品沸腾时开始计时,SDE萃取8 h。蒸馏完毕后收集乙醚相,加入无水硫酸钠除去水分,旋转蒸发获得挥发油 [20]。1.3.6.2 挥发油化学组成的GC-MS分析
取适量挥发油用正己烷稀释进行GC-MS检测。色谱条件:色谱柱为Agilent 122-3832 DB-35ms(30 m×0.25 mm,0.25 μm);载气为高纯氦气;流速1.0 mL/min;分流比50∶1;进样量1 μL;进样口温度280℃;升温程序:初始温度50 ℃,保持2 min,以6 ℃/min的速率升温至180 ℃,保持1 min,再以10 ℃/min的速率升温至280 ℃,保持5 min,共运行39.67 min。
电子电离源;电子能量70 eV;离子源温度230 ℃;传输线温度280 ℃;四极杆温度150 ℃;质量扫描范围40~600 u。
利用NIST 02.L质谱库对各色谱峰进行检索,根据质谱数据和保留时间确认挥发性物质中各化学成分。用峰面积归一法进行定量分析,得出挥发性油中各化学成分的相对含量。
2.1 酚类化合物标准品的HPLC谱图及其相似度分析

图1 混合标准品的HPLC谱图
Fig.1 HPLC chromatograms of mixed standard substances
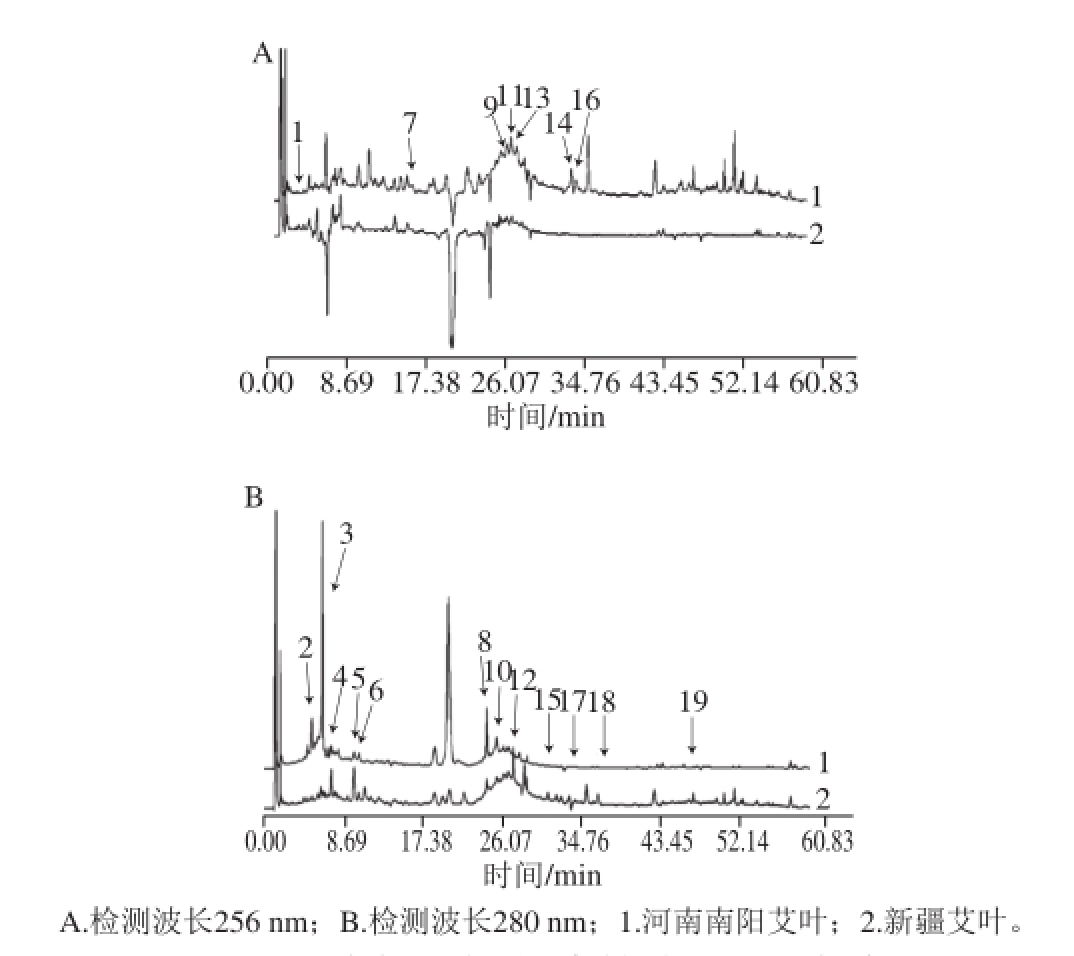
图2 河南南阳和新疆艾叶醇提液HPLC图谱比较
Fig.2 HPLC chromatograms of alcoholic extracts of A. argyi leaves from Nanyang and Xinjiang
在220、256、280、320 nm和360 nm 5 个波长条件下同时检测混合标准品,发现在256 nm和280 nm检测波长条件下出峰数及分离效果较好。在综合考虑基线、峰形、信号响应强弱以及负峰等情况后,最终确定将标准品分为2 组,分别在波长256 nm和280 nm处检测。分组后混合标准品的分离效果较好,如图1所示。
如图2所示,可直观判断2 种艾叶醇提物中酚类化合物种类和相对含量存在较大差异。在波长256 nm和280 nm处检测与对照谱图的相似度,河南南阳艾叶为0.794和0.846,新疆艾叶为0.903和0.887。
2.2 方法学验证
2.2.1 线性关系及检出限
以1.3.3节所配制标准溶液的平均峰面积y对标准品质量x(µg)进行线性回归。以R SN为3确定各物质的检出限,得出各标准品HPLC检测的回归方程、线性范围和相关系数,如表1所示。
表1 混合标准品保留时间、线性范围、校正曲线、相关系数(R
2)及检出限
Table1 Retention times, linear ranges, calibration curves, correlation coeff i cients (R
2) and limits of detection of mixed standard substances
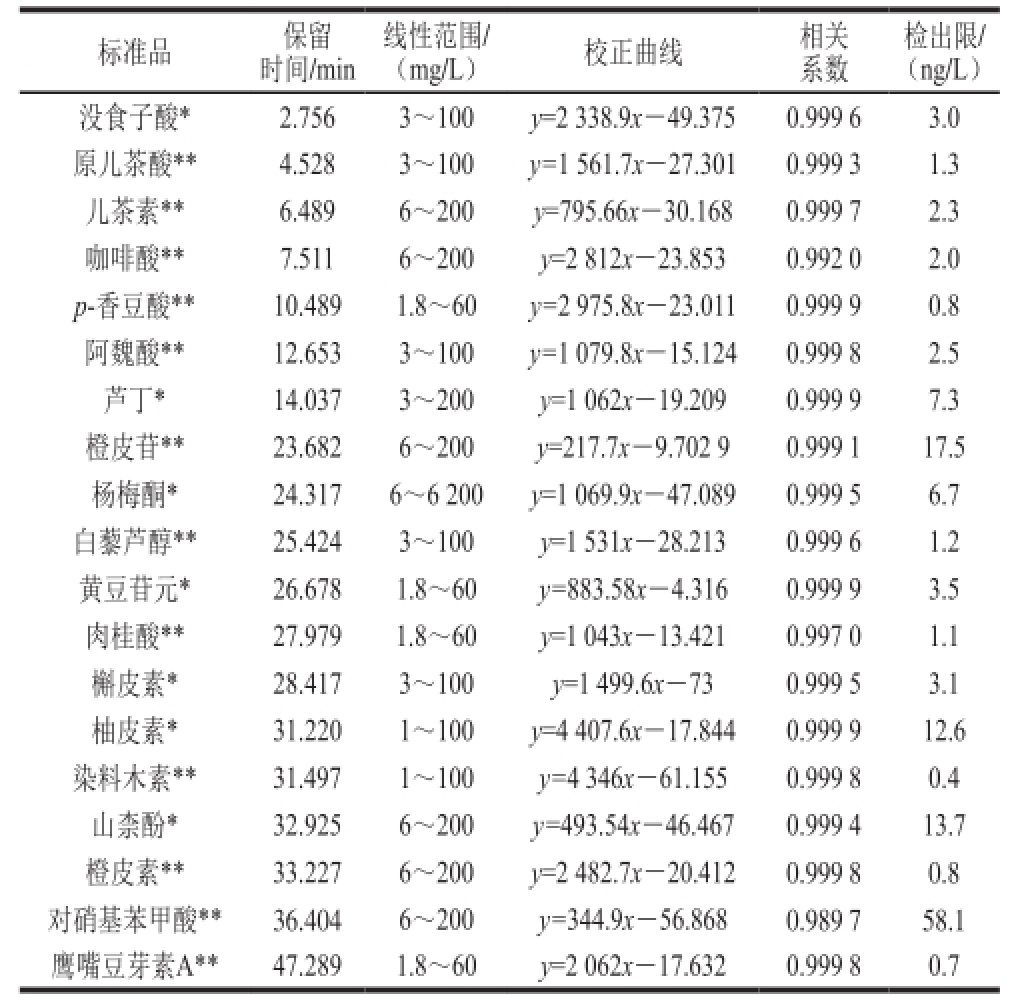
注:*.检测波长为256 nm;**.检测波长为280 nm。
?
2.2.2 精密度、稳定性、重复性和回收率实验结果
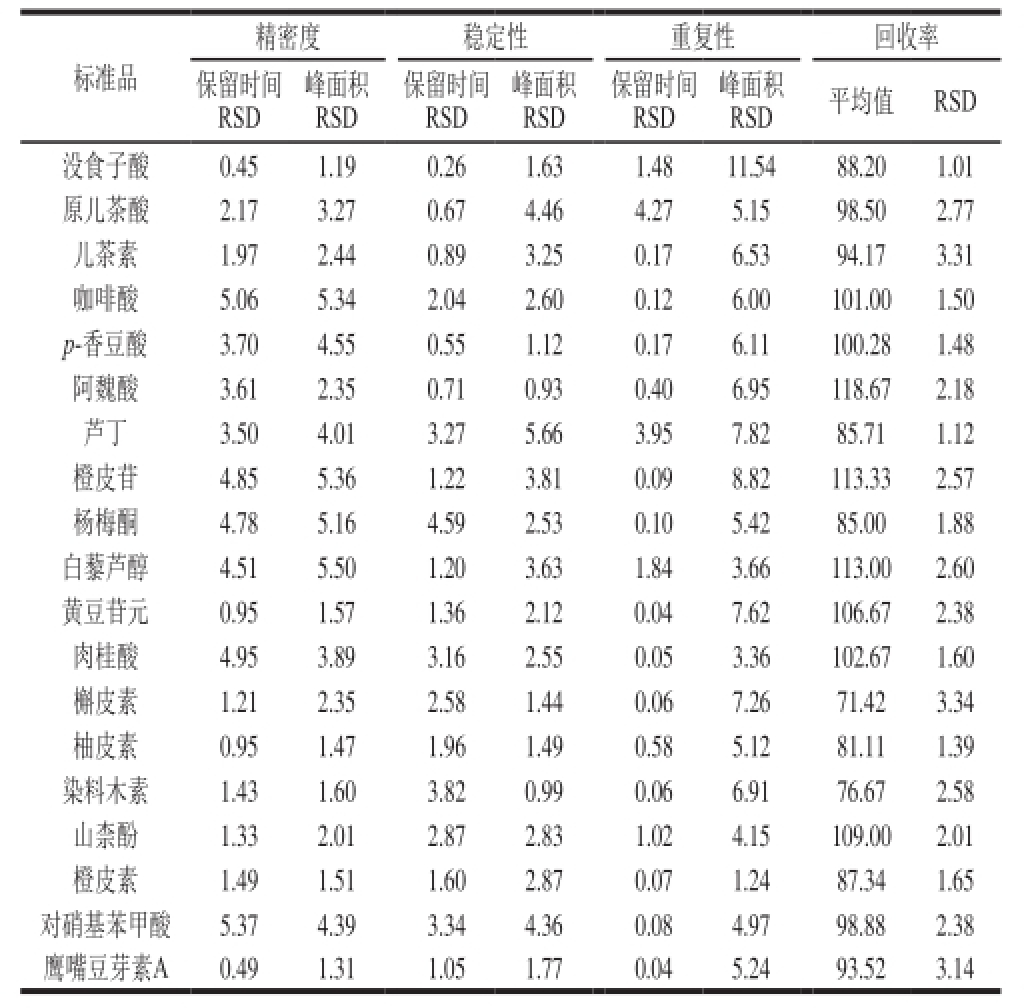
分别将2 组混合标准品溶液按1.3.4节方法进行HPLC分析,每6 h测定一次,共测6 次,考查保留时间及峰面积的重复性。如表2所示,各色谱峰峰面积的相对标准偏差(relative standard deviation,RSD)在1.19%~5.50%之间,保留时间的RSD在0.45%~5.37%之间,结果表明仪器精密度良好。
将配制好的混合标准品溶液,置于4 ℃冰箱中保存,每隔2 h测定一次,后每隔1 d测定一次,连测4 d,考查混合样品中各标准品的稳定性。如表2所示,各色谱峰峰面积的RSD在0.93%~5.66%之间,保留时间的RSD在 0.26%~4.59%之间,说明2 组混合标准品在测定时间内性质稳定。
称取6 份南阳艾叶,按1.3.1节方法制得供试品溶液,按1.3.4节色谱条件,分别进样20 μL,进行重复性实验。如表2所示,保留时间的RSD在0.04%~4.27%之间,各色谱峰峰面积的RSD在1.24%~11.54%之间,说明该方法具有很好的重复性。
准确称取1 g艾叶样品,分别加入高、中、低3 个质量浓度的已知量混合标准品溶液,充分混匀,按1.3.1节的方法提取,在1.3.4节色谱条件下分别以20 μL进样,每个水平测定3 次。如表2所示,19 种酚类化合物的平均回收率在71.42%~118.67%之间,RSD在1.01%~3.31%之间,说明本方法准确度高。
表2 混合标准品的精密度、稳定性及样品的重复性、加标回收率
Table2 Precision, stability, repeatability and recovery of spiked samples %
?
2.3 2 种艾叶的酚类化合物HPLC检测结果
由表3可知,19 种标准品在河南南阳艾叶中均可检出;从新疆艾叶可检出14 种,其中柚皮素、山柰酚、染料木素、橙皮素和对硝基苯甲酸未检出。有研究运用质谱、紫外、核磁等方法检测出艾叶、北艾中含有儿茶素、槲皮素、杨梅酮、山柰酚、p-香豆素、咖啡酸、阿魏酸、肉桂酸、没食子酸、苯甲酸、柚皮素、原儿茶酸、香豆素、芦丁等酚类物质,与本实验所检测出的物质相同 [6-10,21-23]。2 种艾叶中含量最高的成分均为橙皮苷;黄豆苷元、白藜芦醇及槲皮素含量相当;河南南阳艾叶中芦丁、肉桂酸含量高于新疆艾叶,新疆艾叶中儿茶素和杨梅酮含量高于河南南阳艾叶。两地艾叶醇提物酚类化合物的种类和含量有较大差异。
表3 HPLC分析河南南阳和新疆艾叶中各标准品含量
Table3 HPLC analysis of the concentrations of phenolic compounds in A. argyi from Nanyang and Xinjiang

注:—.未检出。下表同。
化合物含量/(mg/g)河南南阳新疆黄酮橙皮苷4.312.54儿茶素0.272.10芦丁0.630.15染料木素0.08—橙皮素0.11—鹰嘴豆芽素A0.060.02杨梅酮1.051.42黄豆苷元1.431.40槲皮素0.850.79柚皮素0.05—山柰酚1.32—酚酸原儿茶酸0.270.20没食子酸0.150.10咖啡酸0.170.09 p-香豆酸0.220.10阿魏酸0.320.08对硝基苯甲酸0.61—肉桂酸1.000.25其他白藜芦醇0.530.51合计13.439.75
2.4 艾叶挥发油的化学组成
表4 GC-MS分析南阳和新疆艾叶挥发油的化学成分
Table4 GC-MS analysis of the essential oil compositions of A. argyi leaves from Nanyang and Xinjiang

?
续表4

?
经检测河南南阳艾叶挥发油得率为2.644%,明显高于新疆艾叶的0.805%。河南南阳艾叶挥发油呈浅黄绿色,新疆艾叶挥发油呈黄绿色,均具有艾叶特有的浓郁芳香气味。
如表4所示,2 种艾叶挥发油共鉴定出37 种化合物,其中氧化石竹烯、1,8-桉叶油素、崖柏酮、六氢法尼基丙酮4 种化合物为2 种艾叶挥发油的共有成分。河南南阳艾叶挥发油鉴定出29 种化合物,占挥发油总量的80.24%,主要成分为氧化石竹烯、1,8-桉叶油素、冰片、(-)-4-松油醇等。新疆艾叶挥发油鉴定出12 种化合物,占挥发油总量的71.22%,主要成分为氧化石竹烯、1,8-桉叶油素、α-毕橙茄醇、棕榈酸等。河南南阳艾叶挥发油萜醇相对含量最高,为37.80%;新疆艾叶挥发油中萜醇相对含量为19.67%,两地挥发油存在差异。
艾叶主要活性成分为黄酮类、酚酸、香豆素 [11],艾叶黄酮和酚酸具有抗氧化、抗炎的生物活性 [24],黄酮类的芦丁 [25]对肾病具有治疗作用,橙皮苷 [26]、山柰酚 [27]具有抗炎抗癌作用。河南南阳艾叶醇提物酚类化合物中有以上药用价值的活性物质含量较高且成分多样,因此,河南南阳艾叶可能比新疆艾叶有更高的药用价值。
河南南阳和新疆艾叶挥发油与其他产地艾叶挥发油化学成分也存在较大差别,如贵州遵义艾叶挥发油中含量最高的成分是表蓝桉醇(8.79%) [28],湖北蕲春、江西樟树和河北安国艾叶挥发油中含量最高的成分是1,8-桉叶油素(25.625%、22.924%、26.095%) [29],云南艾叶挥发油中含量最高的成分是龙脑(52.42%) [30]。
河南南阳和新疆艾叶挥发油的主要成分均为萜类化合物,其中氧化石竹烯具有抗利什曼虫的活性 [31],1,8-桉叶油素可用于神经痛和皮肤病的治疗 [29],河南南阳艾叶挥发油中氧化石竹烯和1,8-桉叶油素都高于新疆艾叶挥发油。冰片是传统中药的重要成分,有抗氧化、抑菌、抗炎 [32]、治疗心脑血管疾病等作用,它与阿霉素合成的靶向药物可以穿过血脑屏障,有效治疗神经胶质瘤 [33]。河南南阳艾叶挥发油中冰片相对含量为10.95%,新疆艾叶挥发油中未检出。
若以开发艾叶酚类化合物和挥发油为目的的功能性药物及保健品时应注意艾叶产地的选择。在开发利用前对艾叶进行成分分析,根据有效成分区别应用,可以为优质艾叶生产基础选择提供理论依据。
河南南阳和新疆艾叶中酚类化合物组成存在差异,从河南南阳和新疆艾叶醇提物中分别检测出19 种和14 种酚类化合物,含量为13.43 mg/g和9.75 mg/g。河南南阳艾叶醇提物中酚类化合物主要为橙皮苷、杨梅酮、黄豆苷元、山柰酚、肉桂酸,新疆艾叶醇提物中酚类化合物主要为橙皮苷、杨梅酮、儿茶素、黄豆苷元、槲皮素。河南南阳和新疆艾叶挥发油成分也有较大差异,其中河南南阳艾叶挥发油相对含量较高,化合物种类丰富,主要为萜醇、萜烯及萜类氧化物,且萜烯、萜醇等具有生物活性的萜类化合物相对含量更高;而新疆艾叶主要为萜醇和芳香族化合物。河南南阳艾叶的酚类化合物及挥发油的种类及相对含量均高于新疆艾叶,活性成分较新疆艾叶丰富。
参考文献:
[1] YOON K D, CHIN Y W, YANG M H, et al. Separation of anti-ulcer flavonoids from Artemisia extracts by high-speed countercurrent chromatography[J]. Food Chemistry, 2011, 129(2): 679-683. DOI:10.1016/j.foodchem.2011.05.005.
[2] AAMS J D, GARCIA C, GARY G. Mugwort (Artemisia vulgaris, Artemisia douglasiana, Artemisia argyi) in the treatment of menopause, premenstrual syndrome, dysmenorrhea and attention def i cit hyperactivity disorder[J]. Chinese Medicine, 2012, 3(3): 116-123. DOI:10.4236/cm.2012.33019.
[3] LÜ J L, DUAN J A, SHEN B, et al. Caffeic acid esters from Artemisia argyi and their antioxidant activities[J]. Chemistry of Natural Compounds, 2013, 49(1): 8-11. DOI:10.1007/s10600-013-0492-5.
[4] ABU-DARWISH M S, CABRAL C, GONCALVES M J, et al. Artemisia herba-alba essential oil from Buseirah (South Jordan): chemical characterization and assessment of safe antifungal and antiinflammatory doses[J]. Journal of Ethnopharmacology, 2015, 174: 153-160. DOI:10.1016/j.jep.2015.08.005.
[5] BAO X L, YUAN H, WANG C, et al. Antitumor and immunomodulatory activities of a polysaccharide from Artemisia argyi[J]. Carbohydrate Polymers, 2013, 98(1): 1236-1243. DOI:10.1016/j.carbpol.2013.07.018.
[6] MEGDICHE-KSOURI W, TRABELSI N, MKADMINI K, et al. Artemisia campestris phenolic compounds have antioxidant and antimicrobial activity[J]. Industrial Crops and Products, 2015, 63: 104-113. DOI:10.1016/j.indcrop.2014.10.029.
[7] ZHAO Y, GENG C A, MA Y B, et al. UFLC/MS-IT-TOF guided isolation of anti-HBV active chlorogenic acid analogues from Artemisia capillaris as a traditional Chinese herb for the treatment of hepatitis[J]. Journal of Ethnopharmacology, 2014, 156: 147-154. DOI:10.1016/j.jep.2014.08.043.
[8] GOUVEIA S, CASTILHO P C. Antioxidant potential of Artemisia argentea L’Hér alcoholic extract and its relation with the phenolic composition[J]. Food Research International, 2011, 44(6): 1620-1631. DOI:10.1016/j.foodres.2011.04.040.
[9] MELGUIZO-MELGUIZO D, DIAZ-DE-CERIO E, QUIRANTESPINÉ R, et al. The potential of Artemisia vulgaris leaves as a source of antioxidant phenolic compounds[J]. Journal of Functional Foods, 2014, 10: 192-200. DOI:10.1016/j.jff.2014.05.019.
[10] CARVALHOA I S, CAVACOA T, BRODELIUS M. Phenolic composition and antioxidant capacity of six Artemisia species[J]. Industrial Crops and Products, 2011, 33(2): 382-388. DOI:10.3390/ molecules15053135.
[11] TAN X J, LI Q, CHEN X H, et al. Simultaneous determination of 13 bioactive compounds in herba Artemisiae Scopariae (Yin Chen) from different harvest seasons by HPLC-DAD[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47(4): 847-853. DOI:10.1016/ j.jpba.2008.04.010.
[12] HUANG H C, WANG H F, YIH K H, et al. Dual bioactivities of essential oil extracted from the leaves of Artemisia argyi as an antimelanogenic versus antioxidant agent and chemical composition analysis by GC/MS[J]. International Journal of Molecular Sciences, 2012, 13(11): 14679-14697. DOI:10.3390/ijms131114679.
[13] WANG W, ZHANG X K, WU N, et al. Antimicrobial activities of essential oil from Artemisiae argyi leaves[J]. Journal of Forestry Research, 2006, 17(4): 332-334. DOI:10.1007/s11676-006-0077-2.
[14] PREEDY V R. Essential oils in food preservation, flavor and safety[M]. Academic Press, 2015: 573-579.
[15] EREL Ş B, REZNICEK G, ŞENOL S G, et al. Antimicrobial and antioxidant properties of Artemisia L. species from West Anatolia[J]. Turkish Journal of Biology, 2012, 36(1): 75-84. DOI:10.3906/biy-0912-27.
[16] BAMONIRI A, MIRJALILI B B F, MAZOOCHI A, et al. Chemical composition of Artemisia vulgaris L. from Kashan area isolated by nano scale injection[J]. Iranian Journal of Organic Chemistry, 2010, 2(4): 533-536.
[17] ALIZADEH M, AGHAEI M, SHARIFIAN I, et al. Chemical composition of essential oil of Artemisia vulgaris from West Azerbaijan, Iran[J]. Electronic Journal of Environmental Agricultural and Food Chemistry, 2012, 11(5): 493-496.
[18] JIN R, ZHAO B X. Volatile constituents of folium Artemisiae argyi of different sources[J]. Journal of Acupuncture and Tuina Science, 2010, 8(4): 214-217. DOI:10.1007/s11726-010-0406-z.
[19] GUO X L, CHEN B, LUO L P, et al. Chemical compositions and antioxidant activities of water extracts of Chinese propolis[J]. Journal of Agricultural and Food Chemistry, 2011, 59(23): 12610-12616. DOI:10.1021/jf202818p.
[20] ZHU Y, LÜ H P, DAI W D, et al. Separation of aroma components in Xihu Longjing tea using simultaneous distillation extraction with comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry[J]. Separation and Purif i cation Technology, 2016, 164: 146-154. DOI:10.1016/j.seppur.2016.03.028.
[21] NIRANJAN A, BARTHWAL J, LEHRI A, et al. Development and validation of an HPLC-UV-MS-MS method for identification and quantification of polyphenols in Artemisia pallens L[J]. Acta Chromatographica, 2009, 21(1): 105-116. DOI:10.1556/ AChrom.21.2009.1.9.
[22] 魏海胜, 吕丰, 张令令. 蕲艾化学成分研究[J]. 亚太传统医药, 2013, 9(2): 4-6. DOI:10.3969/j.issn.1673-2197.2013.02.003.
[23] HAN J, YE M, QIAO X, et al. Characterization of phenolic compounds in the Chinese herbal drug Artemisia annua by liquid chromatography coupled to electrospray ionization mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47(3): 516-525. DOI:10.1016/j.jpba.2008.02.013.
[24] FERREIRA J F S, LUTHRIA D L, SASAKI T, et al. Flavonoids from Artemisia annua L. as antioxidants and their potential synergism with artemisinin against malaria and cancer[J]. Molecules, 2010, 15(5): 3135-3170. DOI:10.3390/molecules15053135.
[25] HAO H H, SHAO Z M, TANG D Q, et al. Preventive effects of rutin on the development of experimental diabetic nephropathy in rats[J]. Life Sciences, 2012, 91(19): 959-967. DOI:10.1016/j.lfs.2012.09.003.
[26] DEVI K P, RAJAVEL T, NABAVI S F, et al. Hesperidin: a promising anticancer agent from nature[J]. Industrial Crops and Products, 2015, 76: 582-589. DOI:10.1016/j.indcrop.2015.07.051.
[27] LIAO W Z, CHEN L Y, MA X, et al. Protective effects of kaempferol against reactive oxygen species-induced hemolysis and its antiproliferative activity on human cancer cells[J]. European Journal of Medicinal Chemistry, 2016, 114: 24-32. DOI:10.1016/ j.ejmech.2016.02.045.
[28] 兰美兵, 余永莉, 李啸红. 贵州产艾叶挥发油的化学成分分析[J].药物分析杂志, 2009, 29(8): 1305-1308. DOI:10.16155/j.0254-1793.200.08.010.
[29] 江丹, 易筠, 杨梅, 等. 不同品种艾叶挥发油的化学成分分析[J].中国医药生物技术, 2009, 4(5): 339-344. DOI:10.3969/cmba. j.issn.1673-713X.2009.05.004.
[30] 杜萍, 张先俊, 孙晓东. 滇产艾纳香叶挥发油化学成分的GC-MS分析[J]. 林产化学与工业, 2009, 29(2): 115-118. DOI:10.3321/ j.issn:0253-2417.2009.02.023.
[31] PASTOR J, GARCÍA M, STEINBAUER S, et al. Combinations of ascaridole, carvacrol, and caryophyllene oxide against Leishmania[J]. Acta Tropica, 2015, 145: 31-38. DOI:10.1016/ j.actatropica.2015.02.002.
[32] ZHANG Q, WU D, WU J, et al. Improved blood-brain barrier distribution: effect of borneol on the brain pharmacokinetics of kaempferol in rats by in vivo microdialysis sampling[J]. Journal of Ethnopharmacology, 2015, 162: 270-277. DOI:10.1016/ j.jep.2015.01.003.
[33] XU X L, LI J J, HAN S P, et al. A novel doxorubicin loaded folic acid conjugated PAMAM modified with borneol, a nature dualfunctional product of reducing PAMAM toxicity and boosting BBB penetration[J]. European Journal of Pharmaceutical Sciences, 2016, 88: 178-190. DOI:10.1016/j.ej ps.2016.02.015.
Phenolic Compounds and Essential Oil Compositions of Artemisia argyi Leaves from Two Growing Areas
DUAN Kaili
1, GAO Mingjing
2, LIU Yongquan
1, ZHANG Tingting
1, CHEN Li
1, ZHAO Sanzhong
2, LUO Liping
1,*
(1. School of Life Sciences, Nanchang University, Nanchang 330031, China; 2. Beijing Zhonglan Moxa Health Research Institute, Beijing 100070, China)
Abstract:To fi nd the relationship between the chemical composition and geographic origin of Artemisia argyi leaves, leaf samples from Nanyang, Henan province and Xinjiang were comparatively analyzed for phenolic compounds and essential oil composition. The phenolic compounds were ultrasonically extracted with 60% ethanol, and then detected by high performance liquid chromatography (HPLC) using standard substances. The essential oils were extracted by simultaneous distillation extraction method and analyzed by gas chromatography-mass spectrometry (GC-MS). The results showed that the yields of essential oil from A. argyi leaves from Nanyang and Xinjiang were 2.644% and 0.805%, respectively. A total of 19 and 14 phenolic compounds were identif i ed from A. argyi leaves grown in the two areas, with total contents of 13.43 and 9.75 mg/g, respectively. A total of 29 and 12 compounds were identif i ed from the two essential oils different geographic origins, which accounted for 80.24% and 71.22% of the total amount, respectively. A. argyi leaves from Nanyang contained more abundant phenolic compounds and essential oils than those from Xinjiang.
Key words:Artemisia argyi; phenolic compounds; similarity analysis; high performance liquid chromatography (HPLC); essential oil; gas chromatography-mass spectrometry (GC-MS)
DOI:10.7506/spkx1002-6630-201704033
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)04-0204-07
引文格式:
段凯莉, 高明景, 刘永泉, 等. 2 种艾叶酚类化合物与挥发油成分比较[J]. 食品科学, 2017, 38(4): 204-210. DOI:10.7506/ spkx1002-6630-201704033. http://www.spkx.net.cn
DUAN Kaili, GAO Mingjing, LIU Yongquan, et al. Phenolic compounds and essential oil compositions of Artemisia argyi leaves from two growing areas[J]. Food Science, 2017, 38(4): 204-210. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201704033. http://www.spkx.net.cn
收稿日期:2016-07-04
基金项目:江西省科技厅项目(20123BCB22004);国家自然科学基金面上项目(31370384);长江学者和创新团队发展计划项目(IRT13054);南昌大学研究生创新专项资金项目(cx2016204)
作者简介:段凯莉(1992—),女,硕士研究生,研究方向为植物化学。E-mail:18292337518@163.com
*通信作者:罗丽萍(1972—),女,教授,博士,研究方向为植物代谢产物。E-mail:lluo2@126.com