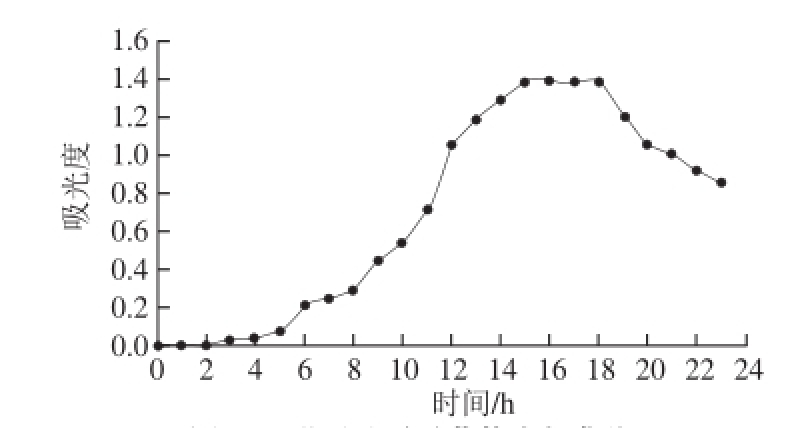
图1 黏质沙雷氏菌的生长曲线
Fig.1 Growth curve of Serratia marcescens
陈新颜 1,操丽丽 1,杨培周 1,*,王康林 2,章 华 1,操新民 1,郑 志 1,姜绍通 1
(1.合肥工业大学食品科学与工程学院,安徽省农产品加工精深省级实验室,安徽 合肥 230009;2.平光制药股份有限公司,安徽 合肥 231131)
摘 要:为筛选得到一株产灵菌红素的黏质沙雷氏菌为发酵菌种,采用响应面法优化培养基组分和发酵条件,提高黏质沙雷氏菌生产灵菌红素的效率,结果表明,黏质沙雷氏菌最优培养基组分及发酵条件为玉米粉用量10 g/L、菜籽饼粕用量21.7 g/L、硫酸锌质量浓度0.05 g/L、发酵液初始pH 5.8、接种量5.5%、装液量80 mL/250 mL三角瓶、温度27 ℃、摇床转速200 r/min,培养24 h后,发酵液中灵菌红素产量达到11.56 g/L。本研究为高温菜籽饼粕原料发酵生产灵菌红素提供理论依据。
关键词:黏质沙雷氏菌;灵菌红素;菜籽饼粕;响应面优化;发酵
油菜籽作为油脂原料,是人类生活和生产的主要食用油来源之一 [1]。菜籽饼粕是菜籽油加工的副产品 [2],组分复杂,其中粗蛋白含量占35%~42%;含有的碳水化合物多为不易消化的戊糖,戊聚糖和粗纤维分别占8%和10%~12%;磷、钙、锰、硒含量高,磷含量中的60%~70%为植酸磷;烟酸和胆碱的含量高;此外,菜籽饼粕含有较多的异硫氰酸酯、恶唑烷硫酮、硫氰酸酯、腈、单宁、芥子碱、植酸等抗营养因子不但影响日粮的适口性 [3],还易引起动物的甲状腺肿大 [4],高价值合理利用是解决目前我国菜籽饼粕利用的一个出路 [5]。
属于天然红色素的灵菌红素是由黏质沙雷氏菌(Serratia marcescens)表达的次生代谢产物 [6]。灵菌红素具有抗肿瘤、抑制癌细胞增殖 [7]和免疫抑制 [8]等活性,在一定剂量范围内表现良好的抗肿瘤及免疫抑制活性,且引起细胞凋亡的作用机制完全不同于当前的临床药物,具有潜在的巨大的应用价值和市场前景 [9]。研究开始在灵菌红素发酵生产条件优化方面展开了探索 [10-14],已经报道的发酵原料都属于化工产品,如乙醇 [15]、甘油-丙酮 [16]等。以农产品加工副产物特别是利用价值低的副产物菜籽饼粕还鲜有报道。课题组从臭鳜鱼肠道内分离出一株产红色素的黏质沙雷氏菌,通过结构分析鉴定证明该红色素为灵菌红素,并对该菌的发酵产灵菌红素的条件进行初步研究 [17],抑癌实验表明该灵菌红素具有强烈抑制人肺癌细胞A549和人乳腺癌细胞MCF-7增殖的功能 [18],具有良好的应用前景。本研究将菜籽饼粕作为营养组分添加到发酵培养基中,通过分析不同组分配方对黏质沙雷氏菌发酵生产灵菌红素的影响,提高灵菌红素的产量,同时实现菜籽饼粕高值化利用,为高效低成本生产高附加值的灵菌红素提供支持。
1.1 材料与培养基
菜籽饼粕购于安徽肥西油菜籽油加工厂,是高温压榨菜籽油的副产物;种子培养基:10 g/L蛋白胨、10 g/L甘油、2 g/L NaCl;发酵培养基:20 g/L菜籽饼粕、10 g/L碳源、2 g/L无机盐离子。
1.2 仪器与设备
AL104电子天平 梅特勒-托利多仪器公司;TU-1901双光束紫外-可见分光光度计 北京普析通用仪器公司;HZQ-F160振荡培养箱 哈尔滨市东联电子技术公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器公司;高压蒸汽灭菌锅 日本Sanyo Electric公司;SPX-150B型生化培养箱 上海博讯公司;PHS-25数显酸度计 上海天达仪器公司。
1.3 方法
1.3.1 黏质沙雷氏菌生长曲线的绘制
采用比浊法测定菌体含量,取适量发酵液进行10 倍稀释,以未接种的培养基做等量对照,在波长600 nm处,测定细胞悬浮液的吸光度,在3 个250 mL的三角瓶中分别装50 mL种子培养基,分别加入活化12 h种子液1 mL,30 ℃、200 r/min培养24 h,每隔1 h测定在波长600 nm处的吸光度,绘制黏质沙雷氏菌的生长曲线。
1.3.2 灵菌红素标准曲线及灵菌红素的检测
配制不同质量浓度的灵菌红素酸性(pH 3)甲醇溶液(1、2、3、4、5、6 g/100 mL),在535 nm波长处测定吸光度;根据不同质量浓度的灵菌红素溶液在535 nm处的吸光度,绘制灵菌红素标准曲线,R 2为0.999 7,吸光度和灵菌红素质量浓度之间的线性关系明显。取20 mL发酵液离心去除上清液,通过搅拌将沉淀悬浮于甲醇体系中。细胞超声波辅助浸提(超声波超声时间10 s、工作间隙3 s、工作次数7 次、工作最大功率200 W),室温条件下浸提10 min,收集融入色素的甲醇溶液,反复提取直到甲醇溶液不变色。将收集的甲醇溶液进一步离心,得上清液,调节pH值至3,在535 nm波长处测定吸光度,计算灵菌红素产量。
1.3.3 工艺优化设计
1.3.3.1 单因素试验
以灵菌红素产量为指标,分别考察发酵时间(6、12、18、24、30、36 h)、碳源(蔗糖、玉米粉、红薯粉、甘油、淀粉、麦芽粉和小麦粉)、菜籽饼粕-玉米粉质量比(1∶1、1.5∶1、2∶1、2.5∶1、3∶1、3.5∶1)、无机盐种类(磷酸氢二钾、硫酸锰、氯化钙、硫酸锌、二氯化碳、氯化钠、磷酸二氢钠、七水硫酸镁)、硫酸锌用量(0、0.05、0.10、0.15、0.25、0.35、0.45 g/L)、发酵温度(22、24、26、28、30、32 ℃)、摇床转速(100、150、200、250、300 r/min)、接种量(1%、3%、5%、7%、9%、11%)、装液量(50、60、70、80、90、100 mL)、初始pH值(5.83、6、7、8、9、10)和菜籽饼粕用量(0、5、10、15、20、25、30 g/L)对灵菌红素产量的影响。单因素试验是在基本培养条件的基础上,对各因素进行考察时先固定其他参数,然后对目标因素进行考察,基本培养的设置条件分别为:发酵时间30 h、10 g/L甘油(碳源)、2 g/L NaCl(无机盐离子)、0.1 g/L硫酸锌、30 ℃、200 r/min摇床转速、5%接种量、80 mL装液量/250 mL、初始pH 7、20 g/L菜籽饼粕(氮源)。
1.3.3.2 Plackett-Burman(PB)试验
在单因素试验基础上选取菜籽饼粕用量、玉米粉用量、摇床转速、接种量、无机盐用量、温度为PB试验因素,设计六因素PB试验方案。
1.3.3.3 响应面分析
以PB试验因素的影响程度为基础,筛选出3 个影响灵菌红素产量的主要因素,研究主要因素的最佳水平以及主要因素之间是否存在交互性,通过响应面分析确定最佳的发酵条件。
1.3.4 灵菌红素的分离纯化
在最优发酵条件下提取并纯化灵菌红素,将溶有灵菌红素的酸性甲醇溶液在70 ℃条件下真空浓缩,取2 倍体积的氯仿对浓缩物进行萃取浓缩。将得到的粗品进行硅胶柱层析,洗脱剂为乙酸乙酯;收集硅胶柱中红色部分,对收集到的洗脱液进行浓缩,在真空冷冻干燥机中干燥得成品。
2.1 黏质沙雷氏菌的生长曲线
黏质沙雷氏菌在0~5 h处于适应期,6~15 h处于对数期,16~18 h进入稳定期,19 h后进入衰亡期。选择培养12 h的种子液进行接种,这种菌种中后期活性大,适应性强,延滞期短。

图1 黏质沙雷氏菌的生长曲线
Fig.1 Growth curve of Serratia marcescens
2.2 单因素试验结果
以玉米粉为碳源,配制相同的发酵培养基,获得的最佳发酵时间为24 h(图2a);玉米粉和红薯粉两种碳源获得灵菌红素产量最大,由于玉米粉的价格便宜,性价比高,碳源选为玉米粉(图2b);当菜籽饼粕-玉米粉质量比2∶1时灵菌红素的产量最高(图2c);添加Zn 2+的发酵培养基中灵菌红素的产量比未添加的空白高,其余的离子对产量影响均呈负相关,添加的最优无机盐为硫酸锌(图2d);高质量浓度的Zn 2+对灵菌红素可能有轻微的抑制效果(图2e);发酵最适温度为26 ℃(图2f);当摇床转速达到200 r/min时,灵菌红素产量最大,最优转速为200 r/min(图2g);添加5%接种量的发酵培养基灵菌红素产量最大,最优接种量为5%(图2h);装液量达到80 mL时,灵菌红素产量达到最大,最优装液量80 mL(图2i);最优pH值为6(图2j);最优菜籽饼粕的质量浓度为20 g/L(图2k)。
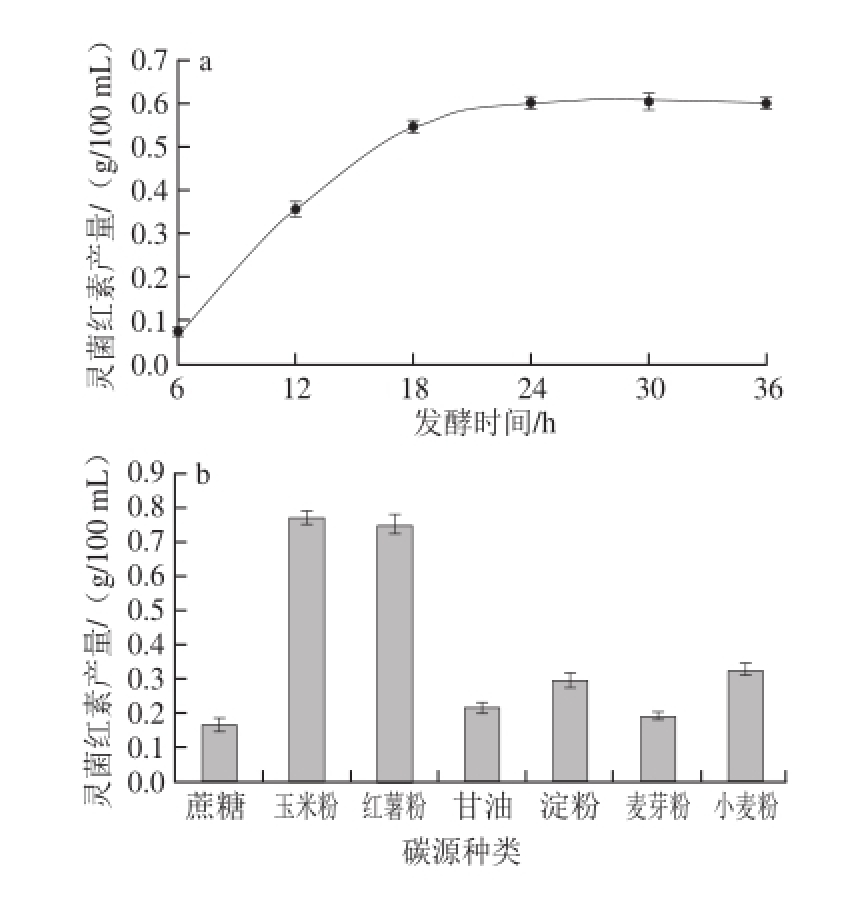
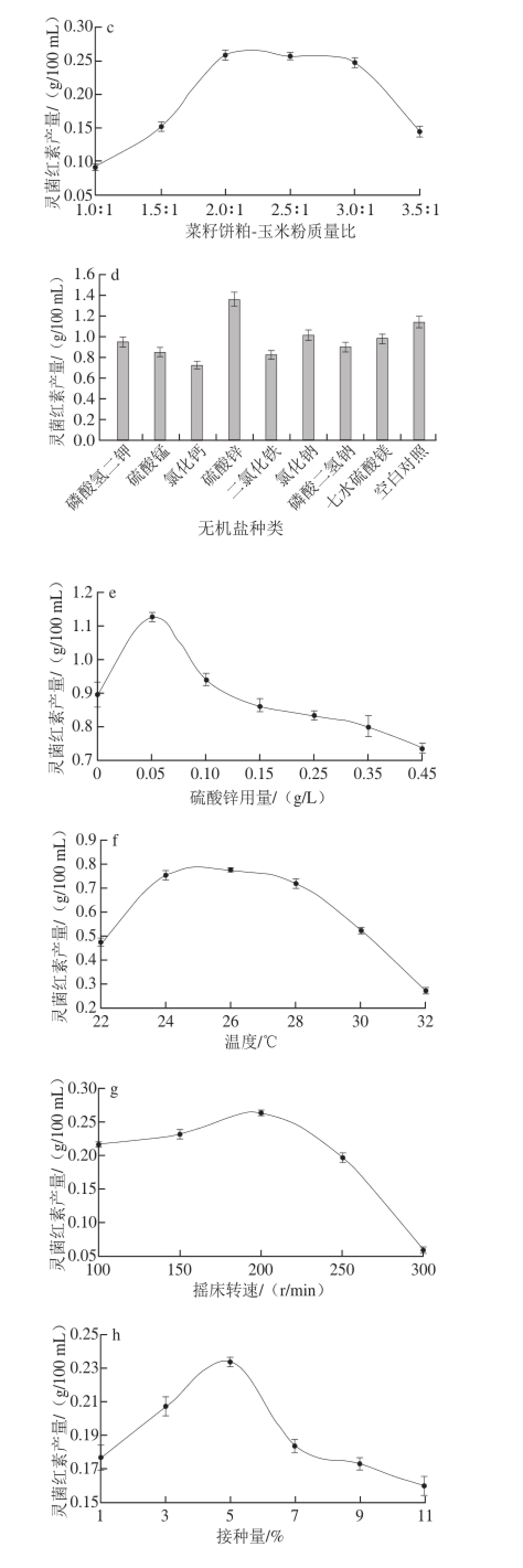
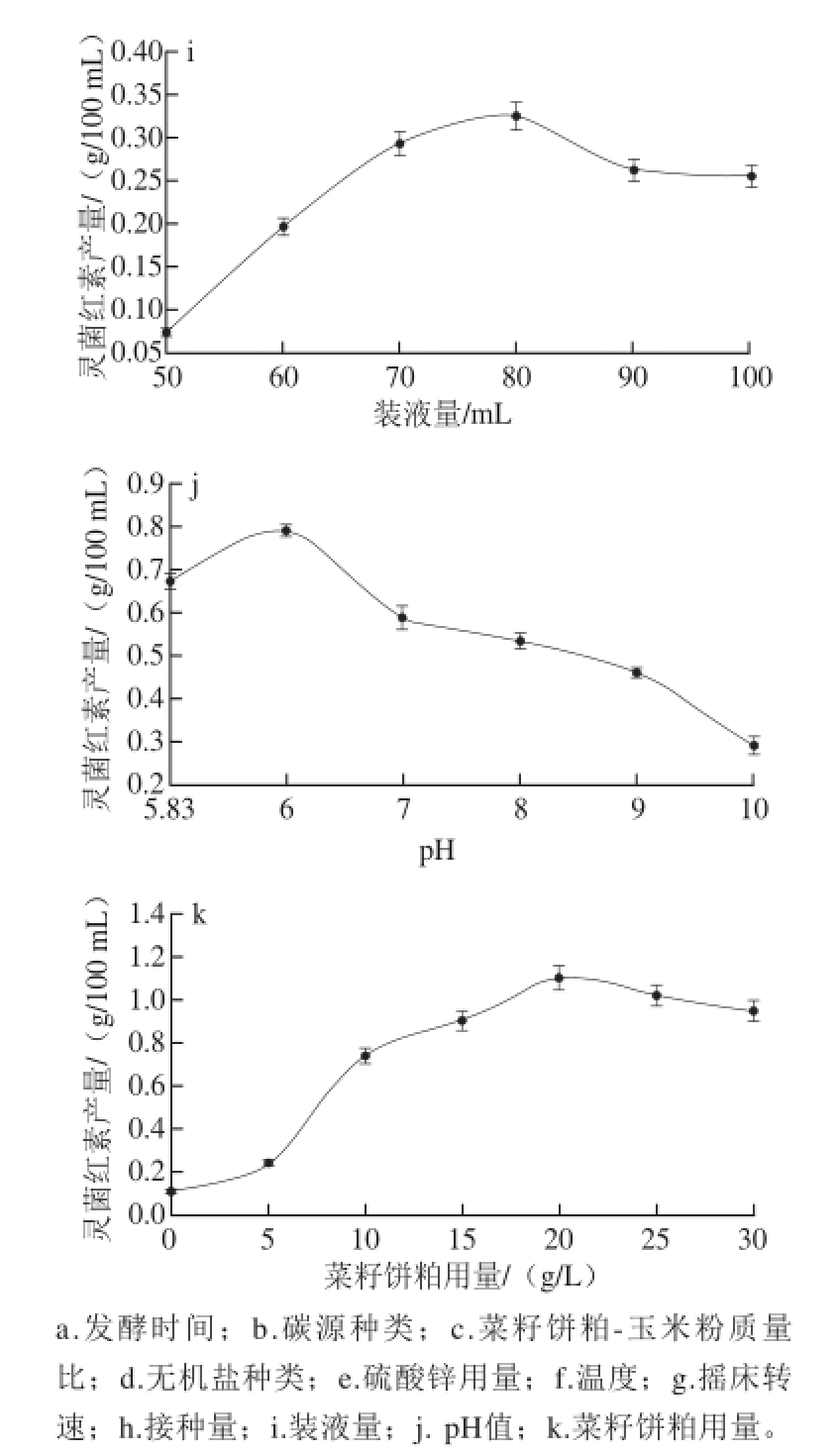
图2 单因素试验结果
Fig.2 Results of one-factor-at-a-time experiments
2.3 影响灵菌红素发酵产量的PB试验结果
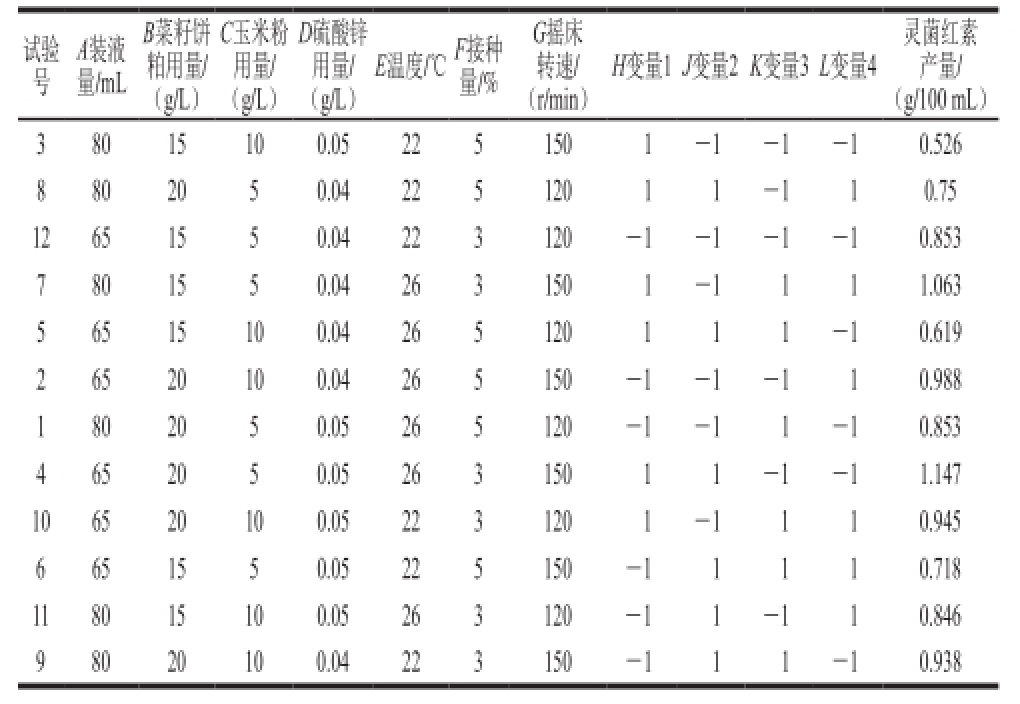
表1 PB试验设计与结果
Table1 Plackett-Burman (PB) design with experimental values of prodigiosin production
?
以单因素试验为基础,取单因素试验结果中上升区间的两个水平设计PB试验。装液量:65~80 mL;菜籽饼粕用量:15~20 g/L;玉米粉用量:5~10 g/L;硫酸锌用量:0.04~0.05 g/L;温度:22~26℃;接种量:3%~5%;摇床转速:120~150 r/min,通过软件处理,得到PB试验设计(表1)。
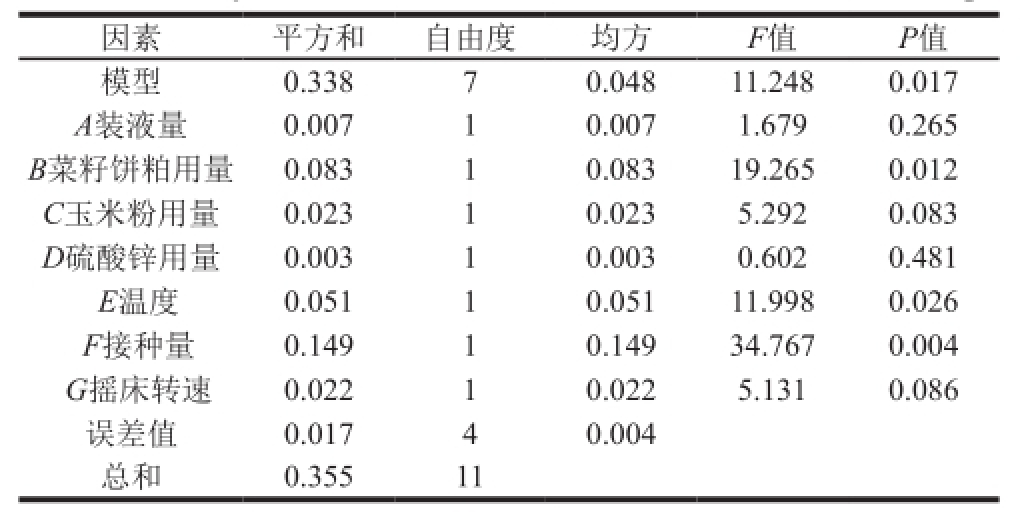
试验处理方差结果见表2,该PB试验设计模型P值为0.017,该模型显著,由单因素显著性可知,B菜籽饼粕用量、E温度和F接种量的P值均小于0.05,因此,选用这3 个因素设计响应面。
表2 PB试验方差分析结果
Table2 Analysis of variance of the model established based on PB design
?
2.4 响应面试验结果
以PB试验结果为基础,取PB试验结果中影响显著的因素设计响应面试验(表3)。
表3 响应面试验设计表与结果
Table3 Experimental design and results for response surface methodology

?


图3 各因素交互作用的响应面
Fig.3 Response surface plots showing the effects of various factors on prodigiosin production
图3 a中,等高线所围成的是圆面,温度与接种量之间的交互影响不显著,温度相对于接种量所对应的响应面更加陡,温度对灵菌红素产量的影响更大。沿温度方向向峰值移动的等高线密度明显大于沿接种量方向向峰值移动的等高线密度,表明温度对灵菌红素影响比接种量大。
图3b中,接种量与菜籽饼粕用量的等高线所围成的图形为椭圆形,表明接种量和菜籽饼粕用量对灵菌红素产量影响交互作用显著;沿菜籽饼粕用量方向向峰值移动的等高线密度大于沿接种量方向向峰值移动的等高线密度,表明菜籽饼粕用量对灵菌红素影响比接种量大。
图3c中,温度与菜籽饼粕用量的等高线所围成图形为近似圆形,表明温度和菜籽饼粕用量对灵菌红素产量影响交互作用不是很显著,沿温度方向向峰值移动的等高线密度大于沿菜籽饼粕用量方向向峰值移动的等高线密度,表明温度对灵菌红素产量影响比菜籽饼粕用量大。
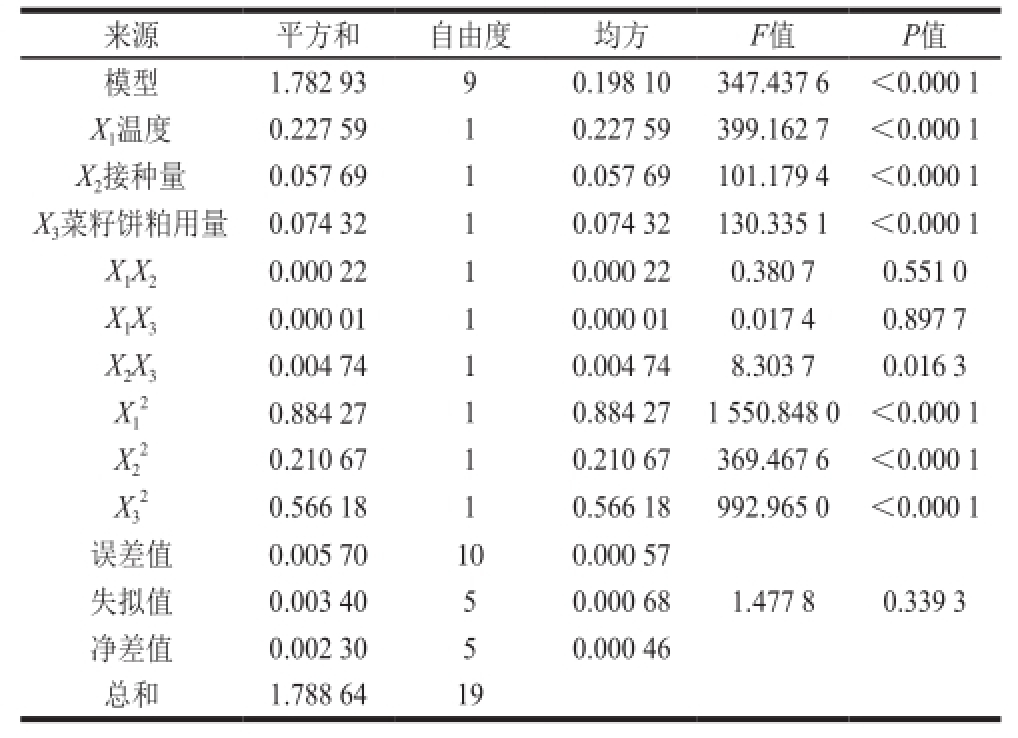
表4 响应面方差分析
Table4 Analysis of variance of the response surface model
?
如表4所示,温度、接种量和菜籽饼粕用量对灵菌红素的产量均有极大影响,菜籽饼粕用量与接种量的交互作用对灵菌红素的产量有一定的影响,这与上述图形分析中的结果一致。
以菜籽饼粕为发酵培养基的组分发酵生产灵菌红素,影响最显著的3 个单因素为温度、接种量和菜籽饼粕用量,其主次顺序为:温度>菜籽饼粕用量>接种量,最优发酵条件:温度27 ℃、菜籽饼粕用量21.7 g/L、接种量5.5%、玉米粉用量10 g/L、摇床转速200 r/min、pH 6、硫酸锌用量0.05 g/L、装液量80 mL/250 mL,在此条件下达到的灵菌红素最优产量为11.56 g/L,分离纯化后的成品如图4所示。

图4 灵菌红素浓缩后(A)冷冻干燥后(B)成品
Fig.4 Concentrated fermented broth containing prodigiosin (A) and freeze-dried product (B)
黏质沙雷氏菌发酵产灵菌红素过程中存在多种衍生物,包括如十一烷基灵菌红素等 [19],对灵菌红素合成的相关基因簇也有相关报道 [20-21]。在灵菌红素合成的发酵条件方面,发酵液中存在的葡萄糖严重抑制灵菌红素的合成 [22],而豆油、棕榈油、葵花子油等脂肪类碳源 [23]以及富含脂肪的花生籽粉、芝麻粉能诱导灵菌红素合成 [24],甘氨酸 [25]、脯氨酸、组氨酸及天冬氨酸能够作为灵菌红素合成的中间体,参与灵菌红素的代谢与合成,此外,部分无机碳也能够诱导灵菌红素的合成,如乙醇和甘油等。国内部分学者主要侧重于灵菌红素鉴定及菌种选育 [26-28]。在本研究中,由于黏质沙雷氏菌在油脂为底物的发酵中呈粉红色,而在菜籽饼粕发酵中呈血红色,尽管菜籽饼粕中存在少量残留的脂肪酸能够诱导灵菌红素的表达,可以确定残留的油脂并不是本研究中灵菌红素高产的主因。菜籽饼粕含有较多的如芥子碱、植酸等抗营养因子,对普通微生物生长抑制强烈,大部分细菌、霉菌和酵母都难以在含有菜籽饼粕的培养基中生长。本研究通过以含有抗营养因子的菜籽饼粕为发酵底物,通过优化发酵条件,获得最优的发酵条件,为利用菜籽加工废弃物菜籽饼粕生产高价值的医药产物灵菌红素提供依据。
参考文献:
[1] 胡健华, 刘培林. 国内外油菜籽脱皮(壳)冷榨生产技术比较[J]. 武汉轻工大学学报, 2015, 34(2): 36-39. DOI:10.3969/ j.issn.2095-7386.2015.02.008.
[2] 金虎, 李坤朋, 黄凤洪, 等. 菜籽饼粕生物转化与高值化利用技术研究进展[J]. 中国油料作物学报, 2014, 36(4): 545-550. DOI:10.7505/ j.issn.1007-9084.2014.04.019.
[3] NIDHINA N, MUTHUKUMAR S P. Antinutritional factors and functionality of protein-rich fractions of industrial guar meal as affected by heat processing[J]. Food Chemistry, 2015, 173: 920-926. DOI:10.1016/j.foodchem.2014.10.071.
[4] BUREL C, BOUJARD T, ESCAFFRE A M, et al. Dietary lowglucosinolate rapeseed meal affects thyroid status and nutrient utilization in rainbow trout (Oncorhynchus mykiss)[J]. British Journal of Nutrition, 2000, 83(6): 653-664. DOI:10.1017/S0007114500000830.
[5] WANG R H, SHAARANI S D M, GODOY L C, et al. Bioconversion of rapeseed meal for the production of a generic microbial feedstock[J]. Enzyme and Microbial Technology, 2010, 47(3): 77-83. DOI:10.1016/ j.enzmictec.2010.05.005.
[6] AZAMJON B S, KAKUSHI H, KEIICHI E. Bioactive pigments from marine bacteria: applications and physiological roles[J]. Evidence-Based Complementary and Alternative Medicine, 2011, 2011(3): 331-366. DOI:10.1155/2011/670349.
[7] PANDEY R, CHANDER R, SAINIS K B. Prodigiosins as anti cancer agents: living upto their name[J]. Current Pharmaceutical Design, 2009, 15(7): 732-741. DOI:10.2174/138161209787582192.
[8] HAN S B, LEE C W, YOON Y D, et al. Effective prevention of lethal acute graft-versus-host disease by combined immunosuppressive therapy with prodigiosin and cyclosporine A[J]. Biochemical Pharmacology, 2005, 70(10): 1518-1526. DOI:10.1016/ j.bcp.2005.08.017.
[9] DARSHAN N, MANONMANI H K. Prodigiosin and its potential applications[J]. Journal of Food Science and Technology, 2015, 52(9): 5393-5407. DOI:10.1007/s13197-015-1740-4.
[10] TAO J L, WANG X D, SHEN Y L, et al. Strategy for the improvement of prodigiosin production by a Serratia marcescens mutant through fed-batch fermentation[J]. World Journal of Microbiology and Biotechnology, 2005, 21(6): 969-972. DOI:10.1007/s11274-004-7257-z.
[11] SUMATHI C, MOHANA P D, SWAMALATHA S, et al. Production of prodigiosin using tannery fleshing and evaluating its pharmacological effects[J]. The Scientific World Journal, 2014. DOI:10.1155/2014/290327.
[12] El BIALY H A, El NOUR S A A. Physical and chemical stress on Serratia marcescens and studies on prodigiosin pigment production[J]. Annals of Microbiology, 2015, 65(1): 59-68. DOI:10.1007/s13213-014-0837-8.
[13] JUANG R S, YEH C L. Adsorptive recovery and purification of prodigiosin from methanol/water solutions of Serratia marcescens fermentation broth[J]. Biotechnology and Bioprocess Engineering, 2014, 19(1): 159-168. DOI:10.1007/s12257-013-0547-2.
[14] JH B I, YANG J G, OUYANG M A, et al. Secondary metabolites produced by Serratia marcescens as an inhibitor against TMV[J]. Scientia Agricultura Sinica, 2014, 47(5): 912-922. DOI:10.3864/ j.issn.0578-1752.2014.05.008.
[15] SONG C, MAKOTO S, OSAMU J, et al. High production of prodigiosin by Serratia marcescens grown on ethanol[J]. Biotechnology Letters, 2000, 22: 1761-1765. DOI:10.1023/ A:1005646102723.
[16] ANDREYEVA I N, OGORODNIKOVA T I. Pigmentation of Serratia marcescens and spectral properties of prodigiosin[J]. Microbiology, 2015, 84(1): 28-33. DOI:10.1134/S0026261715010026.
[17] 张丹峰, 杨培周, 操丽丽, 等. 粘质沙雷氏菌摇瓶发酵产灵菌红素的工艺优化[J]. 食品科学, 2015, 36(13): 119-124. DOI:10.7506/spkx 1002-6630-201513023.
[18] 张丹峰. 一株粘质沙雷氏菌的筛选及其所产红色素抗癌功能初步研究[D]. 合肥: 合肥工业大学, 2015: 40-50.
[19] WILLIAMSON N R, FINERAN P C, LEEPER F J, et al. The biosynthesis and regulation of bacterial prodiginines[J]. Nature Reviews Microbiology, 2006, 4(12): 887-899. DOI:10.1038/ nrmicro1531.
[20] CERDE A M, BIBB M J, CHALLIS G L. Analysis of the prodiginine biosynthesis gene cluster of Streptomyces coelicolor A3(2): new mechanisms for chain initiation and termination in modular multienzymes[J]. Chemistry and Biology, 2001, 8: 817-829. DOI:10.1016/S1074-5521(01)00054-0.
[21] STELLA N A, FENDER J E, LAHR R M, et al. The LysR transcription factor, HexS, is required for glucose inhibition of prodigiosin production by Serratia marcescens[J]. Advances in Microbiology, 2012, 2(4): 511-517. DOI:10.4236/aim.2012.24065.
[22] ERIC M L, KALIVODA J, SHANKS R M Q, et al. Production by glucose acidification and inhibition of prodigiosin dehydrogenase activity mediates medium Serratia marcescens quinoprote in glucose[J]. Applied and Environmental Microbiology, 2012, 78(17): 6225-6235. DOI:10.1128/AEM.01778-12.
[23] WEI Y H, CHEN W C. Enhanced production of prodigiosin-like pigment from Serratia marcescens SMDR by medium improvement and oilsupplementation strategies[J]. Journal of Bioscience and Bioengineering, 2005, 99(6): 616-622. DOI:10.1007/s00232-006-0016-3.
[24] SHAHITHA S, POOMIMA K. Enhanced production of prodigiosin production in Serratia Marcescens[J]. Journal of Applied Pharmaceutical Science, 2012, 2(8): 138-140. DOI:10.7324/JAPS.2012.2823.
[25] SU W T, TSOU T Y, LIU H L. Response surface optimization of microbial prodigiosin production from Serratia marcescens[J]. Journal of the Taiwan Institute of Chemical Engineers, 2011, 42(2): 217-222. DOI:10.1016/j.jtice.2010.05.009.
[26] 朱雄伟, 徐智鹏, 张楠, 等. 粘质沙雷氏菌代谢产物灵菌红素的鉴定[J]. 化学与生物工程, 2012, 29(11): 80-82. DOI:10.3969/ j.issn.1672-5425.2012.11.022.
[27] 陶金莉, 沈亚领, 魏东芝, 等. 产灵菌红素沙雷氏菌的诱变育种[J]. 微生物学通报, 2004, 31(2): 45-49. DOI:10.3969/ j.issn.0253-2654.2004.02.011.
[28] 段学辉, 傅奇, 魏斌, 等. 一株灵菌红素产生菌的分离及其色素分析[J].农业科学与技术: 英文版, 2010, 39(增刊2): 25-27. DOI:10.3969/ j.issn.1009-4229-B.2010.11.008.
Response Surface Optimization of Prodigiosin Production of Serratia marcescens Using Rapeseed Meal
CHEN Xinyan
1, CAO Lili
1, YANG Peizhou
1,*, WANG Kanglin
2, ZHANG Hua
1, CAO Xinmin
1, ZHENG Zhi
1, JIANG Shaotong
1
(1. Anhui Key Laboratory of Intensive Processing of Agricultural Products, School of Food Science and Engineering, Hefei University of Technology, Hefei 230009, China; 2. Pingguang Pharmaceutical Limited by Share Ltd., Hefei 231131, China)
Abstract:A culture medium containing rapeseed meal was designed for prodigiosin production by Serratia marcescens. Optimizations of culture medium composition and fermentation conditions by response surface method were performed for improved production of prodigiosin. The results indicated that the optimal medium composition was composed of corn powder 10 g/L, rapeseed meal 21.7 g/L, inoculum concentration 5.5%, and zinc sulfate 0.05 g/L at an initial pH of 5.8. When the strain was cultured for 24 h in 80 mL of the medium contained in a 250 mL fl ask with shaking at 200 r/min, the fermented broth had the highest prodigiosin content of 11.56 g/L. This study could provide a basis for the microbial production of prodigiosin from high-temperature rapeseed meal.
Key words:Serratia marcescens; prodigiosin; rapeseed meal; response surface optimization; fermentation
DOI:10.7506/spkx1002-6630-201704037
中图分类号:TS209
文献标志码:A
文章编号:1002-6630(2017)04-0231-06
引文格式:
陈新颜, 操丽丽, 杨培周, 等. 响应面试验优化黏质沙雷氏菌利用菜籽饼粕产灵菌红素工艺[J]. 食品科学, 2017, 38(4): 231-236. DOI:10.7506/spkx1002-6630-201704037. http://www.spkx.net.cn
CHEN Xinyan, CAO Lili, YANG Peizhou, et al. Response surface optimization of prodigiosin production of Serratia marcescens using rapeseed meal[J]. Food Science, 2017, 38(4): 231-236. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201704037. http://www.spkx.net.cn
收稿日期:2016-04-14
基金项目:合肥工业大学大学生创新创业训练项目(201510359056);安徽省科技攻关项目(1604a0702001)
作者简介:陈新颜(1994—),男,本科生,研究方向为发酵工程。E-mail:1172149534@qq.com
*通信作者:杨培周(1976—),男,副教授,博士,研究方向为食品微生物和发酵工程。E-mail:yangpeizhou@163.com