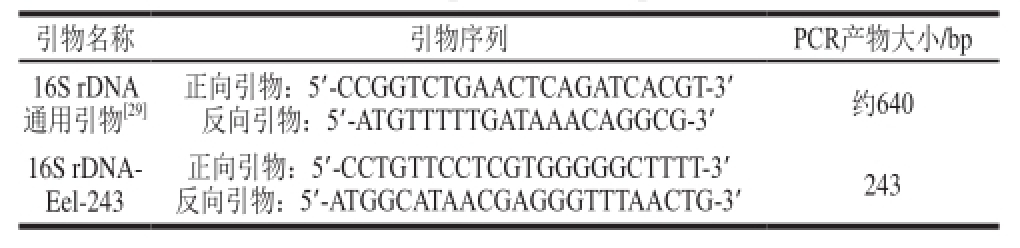
表1 鳗鱼16S rDNA的PCR引物与PCR产物
Table1 Primer sequences for PCR amplif i cation of 16S rDNA from eel and corresponding PCR products
?
陈文炳,缪婷玉,彭 娟,邵碧英,陈 彬,江树勋,张志灯
(福建出入检验检疫局检验检疫技术中心,福建 福州 350003)
摘 要:为满足鳗鱼养殖、加工、贸易企业及执法部门的需求,建立我国主要养殖鳗鱼美洲鳗(Anguilla rostrata)、欧洲鳗(Anguilla anguilla)、日本鳗(Anguilla japonica)的物种DNA条形码鉴定方法。以扩增16S rRNA基因的通用引物扩增美洲鳗、欧洲鳗、日本鳗的16S rRNA基因片段,各获得1 条16S rDNA片段,测序结果表明,前二者的长度均为638 bp、日本鳗的长度为640 bp,为了使物种鉴定方法更简便,结果更准确,从各自片段中截取具有物种特异序列的片段(243 bp),作为3 种鳗鱼的标准DNA条形码,设计两端碱基数分别为22 bp与23 bp的正向与反向引物,建立聚合酶链式反应-DNA条形码检测方法。3年来的应用结果表明:建立的美洲鳗、欧洲鳗、日本鳗3 种鳗鱼的DNA条形码鉴定方法,操作简便、准确、稳定,可应用于3 种鳗鱼的物种鉴定。
关键词:美洲鳗;欧洲鳗;日本鳗;16S rRNA基因;DNA条形码;鉴定
我国东部沿海省份,福建、浙江、山东、江苏、广东等是鳗鱼养殖与加工出口大省,主要产品有3 种鳗鱼,即美洲鳗(Anguilla rostrata)、欧洲鳗(Anguilla anguilla)、日本鳗(Anguilla japonica)。2015年烤鳗与活鳗出口量达4万 t,货值达10亿 美元,主要出口国有日本、美国、俄罗斯、德国、韩国等。由于鳗鱼加工品如烤鳗、蒲烧或制成其他形态熟食后,以及进口鳗苗体积细小,难以从形态上辨别其种类。一方面不同种类的鳗鱼产品与鳗苗价格也不同,另一方面,欧洲鳗被自然保护国际联盟组织列为极度濒危物种,《濒危野生动植物种国际贸易公约》秘书处于2009年3月13日宣布,174个《公约》的缔约国将对欧洲鳗实施新的监管措施 [1-2],之后所有的欧洲鳗国际贸易都需要获得进出口许可证。进口国则需要确保所有进口的欧洲鳗都伴随有出口许可证,我国鳗鱼产品出口日本,被要求提供检验检疫部门出具的鳗鱼物种鉴定报告,如果产品物种属于欧洲鳗,又未能提供出口许可证,将被强行销毁处理。为了维护企业与消费者利益以及正常市场秩序,避免贸易壁垒,应企业与执法部门要求,建立主要进出口鳗鱼种类的精确鉴定方法,对我国鳗鱼养殖业与加工出口外贸易具有重要的现实意义。
聚合酶链式反应(polymerase chain reaction,PCR)扩增技术在食品中鱼类物种成分的鉴别已有不少研究与应用 [3-7],但在鳗鱼中的应用主要是基于PCR的随机扩增多态性DNA遗传多样性分析与物种鉴别的初步研究 [8-12],应用于检验检疫实践,缺乏稳定性与准确性。DNA条形码是生物体内能够代表该物种的、标准的、有足够变异的、易扩增且相对较短的DNA片段。最早由加拿大生物学家Hebert研究 [13-14]发现利用线粒体细胞色素C氧化酶亚基Ⅰ(mitochondrial cytochrome c oxidase subunitⅠ,COⅠ)基因一段长度为648 bp的片段,能够在DNA水平上成功的区分物种,认为利用COⅠ基因从分子演化的角度,将提供一种快速、简便、可信的分类方法,且命名为DNA条形码技术。近年来,随着基因条形码技术的发展,除了COⅠ基因DNA序列作为标准条形码应用于物种鉴别 [13-15]外,作为重要条形码的线粒体16S rRNA、COⅡ等基因的DNA序列,也越来越多地被应用于物种鉴别和遗传多样性分析 [16-23],国内有关于鳗鱼线粒体DNA的COⅠ与COⅡ基因序列分析及其系统分类的研究 [24-26]报道。国外有研究应用COⅠ基因序列的DNA条形码与GenBank中鳗鱼DNA序列比对,而判定非法贸易的欧洲鳗物种,但该方法往往存在待测样品与GenBank中多个鳗鱼物种同源率相同,产生难以准确判断具体物种的困惑 [27-28]。目前国内外尚鲜有利用16S rRNA基因序列作为DNA条形码进行鳗鱼物种鉴定的研究报道。本研究基于16S rRNA基因的部分DNA序列分析与比对,筛选出了标准DNA条形码,建立了日本鳗、美洲鳗、欧洲鳗物种的精确鉴定方法。
1.1 材料
1.1.1 鳗鱼样品
日本鳗(Anguilla japonica)、美洲鳗(Anguilla rostrata)、欧洲鳗(Anguilla anguilla)的蒲烧鳗成品,由福建省三明市华晟食品公司提供,105号、123号、223号待测鳗鱼样品系企业委托实验室留样。
1.1.2 试剂
十六烷基三甲基溴化铵 上海博亚生物技术有限公司;2×Taq PCR Master Mix、蛋白酶K、DNA MarkerⅠ 天根生化科技(北京)有限公司;琼脂糖英国Oxoid公司。
1.1.3 仪器与设备
Ultrospec 1100 pro核酸蛋白分析仪 瑞典Amersham公司;T-Gradient梯度PCR仪 德国Biometra公司;Power Pac 1000电泳仪 美国Bio-Rad公司;GL212 PRO凝胶成像仪 美国Carestream公司。
1.2 方法
1.2.1 引物设计
16S rRNA基因PCR扩增通用引物 [20]序列与自主设计的DNA条形码引物见表1,由生工生物工程(上海)股份有限公司合成。
表1 鳗鱼16S rDNA的PCR引物与PCR产物
Table1 Primer sequences for PCR amplif i cation of 16S rDNA from eel and corresponding PCR products

?
1.2.2 DNA的提取
1.5 mL离心管中加入约50 mg样品粉末或鲜样100 mg,加200 μL TE溶液(pH 8.0),旋涡混匀;加入400 μL裂解液,旋涡混匀;加600 mL Tri-饱和酚-氯仿-异戊醇(25∶24∶1,V/V),剧烈振荡,12 000×g离心10 min;取上清液,加入等体积的氯仿-异戊醇(24∶1,V/V),剧烈振荡,12 000×g离心10 min;取上清液,加0.8 倍体积异丙醇,12 000×g离心10 min;取沉淀,加入400 μL NaCl(1 mol/L)于65 ℃温浴中溶解,再加入5 μL蛋白酶K溶液(20 mg/mL),5 μL Rnase A(10 μg/mL),剧烈振荡30 s以上,37 ℃温浴1 h,期间定期晃动。加等体积的水饱和酚-氯仿-异戊醇(25∶24∶1,V/V),振荡,12 000 r/min离心15 min,重复该步骤1~2 次,直到蛋白质去除干净为止。取上清液,加2 倍体积的无水乙醇,轻微晃动,12 000 r/min离心10 min。取沉淀,70%乙醇溶液清洗2 次,干燥,加100 μL TE(pH 8.0)溶解。每个样品设2 个重复。
1.2.3 DNA的浓度与纯度测定
样品DNA用核酸蛋白分析仪测定260 nm和280 nm处OD值,分别计算DNA纯度与质量浓度,计算公式如下:DNA纯度=OD 260 nm/OD 280 nm,比值在1.7~2.0之间较为理想;双链DNA质量浓度/(μg/mL)=50×OD 260 nm值。
1.2.4 PCR反应体系
采用的PCR检测体系见表2。每个样品反应体系设2个重复。PCR反应体系设置空白对照,用配制反应体系的实验用纯水代替DNA模板,防止交差污染导致假阳性结果产生。
表2 定性PCR检测反应体系(25μL)
Table2 Reaction system for qualitative PCR detection

注:—.试剂盒说明。
?
1.2.5 PCR反应热循环参数的设置
94 ℃预变性3 min。94 ℃变性30 s,45 ℃退火30 s,72 ℃延伸60 s,5 个循环;94 ℃变性30 s,51 ℃退火60 s,72 ℃延伸60 s,35 个循环。72 ℃延伸10 min。4 ℃条件下保存。也可根据不同的基因扩增仪对PCR反应热循环参数做适当的调整。
1.2.6 PCR扩增产物的电泳检测
用0.5×TBE电泳缓冲液制备2 g/100 mL的琼脂糖凝胶。将8~10 μL的PCR扩增产物分别与1~2 μL的6×加样缓冲液(电泳前沿指示剂)混合后,在凝胶板上的孔中点样。用分子质量大小适当的DNA Marker做分子质量标记。选择合适的电压(80~90 V),电泳时间为50~60 min。用凝胶成像仪观察、拍照、记录与分析。
1.2.7 PCR扩增产物的DNA测序与分析
PCR扩增产物委托铂尚(Biosune)生物技术(上海)有限公司进行克隆、测序,得到的结果用DNAMAN V6(中文版)进行整理以*.seq格式输出,然后进行同源性比对与亲缘关系分析,比对结果以MASED Document/ DNAMAN1格式输出。
2.1 鳗鱼的16S rDNA通用引物PCR及其产物序列分析
提取的鳗鱼DNA纯度(OD 260 nm/OD 280 nm)在1.8~1.9之间,质量浓度在500~1 000 ng/μL之间,可用于PCR分析。用表1中的16S rDNA通用引物对3 种鳗鱼DNA进行PCR扩增,获得的PCR产物电泳图如图1所示。PCR产物克隆、测序结果获得3 条16S rDNA序列,其中美洲鳗与欧洲鳗的片段长度均为638 bp,日本鳗为640 bp,在GenBank中比对,分别与数据库中的A. rostrata(KJ564217.1)、A. anguilla(KJ564270.1)、A. japonica(AB278890.1)的同源率均为99%。基于3 条序列的同源性比对部分图(图2),排除序列中存在碱基缺失部分与不具差异的区间,选取具有物种特异性的片段,从250号碱基截取至492号碱基(以未出现碱基缺失的日本鳗为准),长度为243 bp,作为DNA条形码标准片段,选取碱基序列相同片段(下划黑线部分)为新设计引物(16S rDNA-Eel-243,表2),上游引物为250~271号碱基:CCTGTTCCTCGTGGGGGCTTTT(22 bp),下游引物为470~492号碱基的反向互补序列ATGGCATAACGAGGGTTTAACTG(23 bp)。由图2可知,在选定的3 种鳗鱼的特异DNA条形码片段(250~492号碱基)主要差别在352~354号框内的3 个碱基,其中美洲鳗为GTT,欧洲鳗为GGT,日本鳗为AAC。

图1 3 种鳗鱼部分16S rRNA基因PCR扩增结果
Fig.1 PCR amplif i cation results o f partial 16S rRNA gene in 3 species of eel
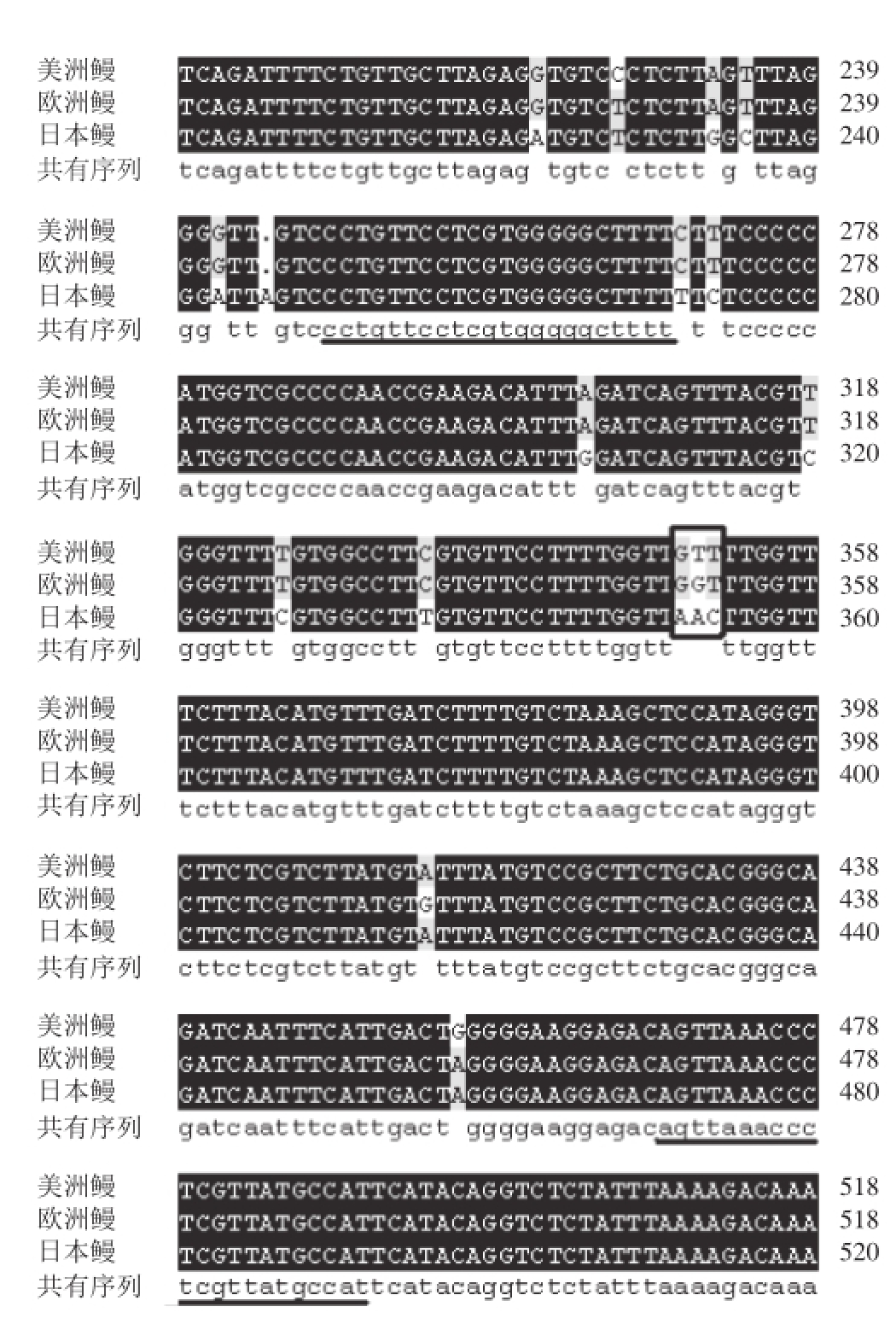
图2 3 种鳗鱼16S rRNA部分基因序列比对(部分图)
Fig.2 Multiple alignment of partial 16S rRNA gene sequences among three eel species
2.2 物种特异性标准DNA条形码序列建立及分析

图3 3 种鳗鱼16S rRNA基因部分DNA片段PCR产物碱基序列(243 bp)
Fig.3 DNA sequences (243 bp) of PCR products of partial 16S rRNA gene sequences from 3 eel species

图4 3 种鳗鱼16S rRNA基因部分片段(243 bp)的DNA条形码序列比对
Fig.4 Multiple sequence alignment of DNA barcode of partial 16S rRNA gene (243 bp) among three eel species
以2.1节中设计的16S rDNA-Eel-243引物(表1),对3 种鳗鱼样品DNA进行PCR扩增、克隆、双向测序,各获得一条长度为243 bp的DNA片段序列(图3),从正向引物第1个碱基C起第103~105号碱基序列为美洲鳗鱼GTT、欧洲鳗GGT、日本鳗AAC(图4),该片段具有3 个鳗鱼物种特异性,可作为物种鉴定的DNA条形码。种间序列同源性分析表明,美洲鳗与欧洲鳗间的同源率为99%,二者与日本鳗间为96%(图5)。3 条序列GenBank登录号为美洲鳗KX440970、欧洲鳗KX440971、日本鳗KX440972。
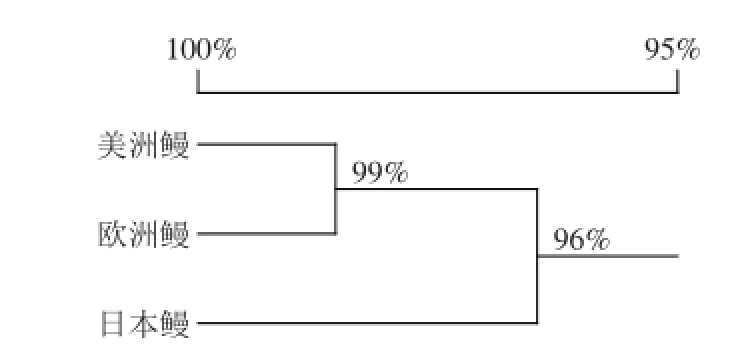
图5 3 种鳗鱼DNA条形码序列(243 bp)亲缘关系树
Fig.5 Phylogenetic tree of three eel species based on DNA barcode sequence (243 bp)
2.3 3 种鳗鱼样品物种DNA条形码鉴定方法建立与应用
2.3.1 DNA条形码鉴定方法建立
1)制样:取鳗鱼单个个体肌肉烘干研磨成粉末,或直接取鲜肉;2)DNA提取:按照1.2.2节部分操作;3)DNA质量检测:用核酸蛋白分析仪测定DNA纯度与质量浓度,DNA纯度(OD 260 nm/OD 280 nm)在1.7~2.0,或用凝胶电泳、染色、成像检测(凝胶质量浓度1 g/100 mL),步骤参照1.2.6节;4)PCR扩增反应与测序:步骤按照1.2.4节~1.2.7节。用16S rDNA-Eel-243引物(表1)扩增出243 bp的PCR产物,为了获得完整的243 bp序列,必须进行克隆、双向测序与接拼。然后将243 bp片段序列,用DNAMANV6软件输入,转化成.seq格式,与2.2节建立的3 种鳗鱼的标准DNA条形码(.seq格式)进行多序列比对,获得同源树,待测样品与哪个物种的标准条形码100%同源,就可判别为是哪个物种。
2.3.2 DNA条形码方法在鳗鱼物种鉴别中的应用
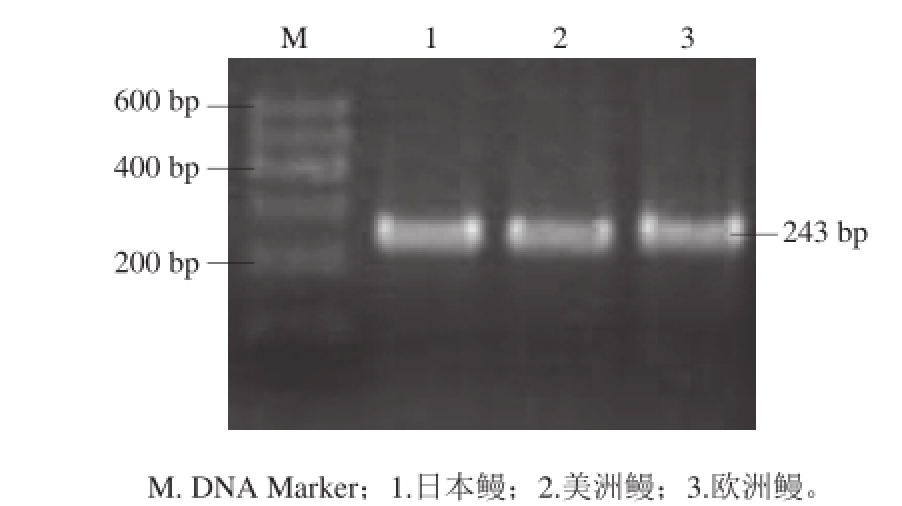
图6 3 种鳗鱼DNA条形码的PCR产物(243 bp)
Fig.6 PCR products of DNA barcode sequences (243 bp) from three eel species
选用实验室留样105号、123号、223号待测鳗鱼样品,经DNA提取、PCR扩增(图6)、克隆、双向测序与序列接拼,获得的序列(243 bp)分别与3 个物种鳗鱼的标准DNA条形码进行比对,获得序列比对图与同源树见图7~9,同源树图中可知:105号、123号、223号样品分别与日本鳗、美洲鳗、欧洲鳗的同源率为100%。因此,判别105号、123号、223号待测鳗鱼样品分别为日本鳗、美洲鳗、欧洲鳗。
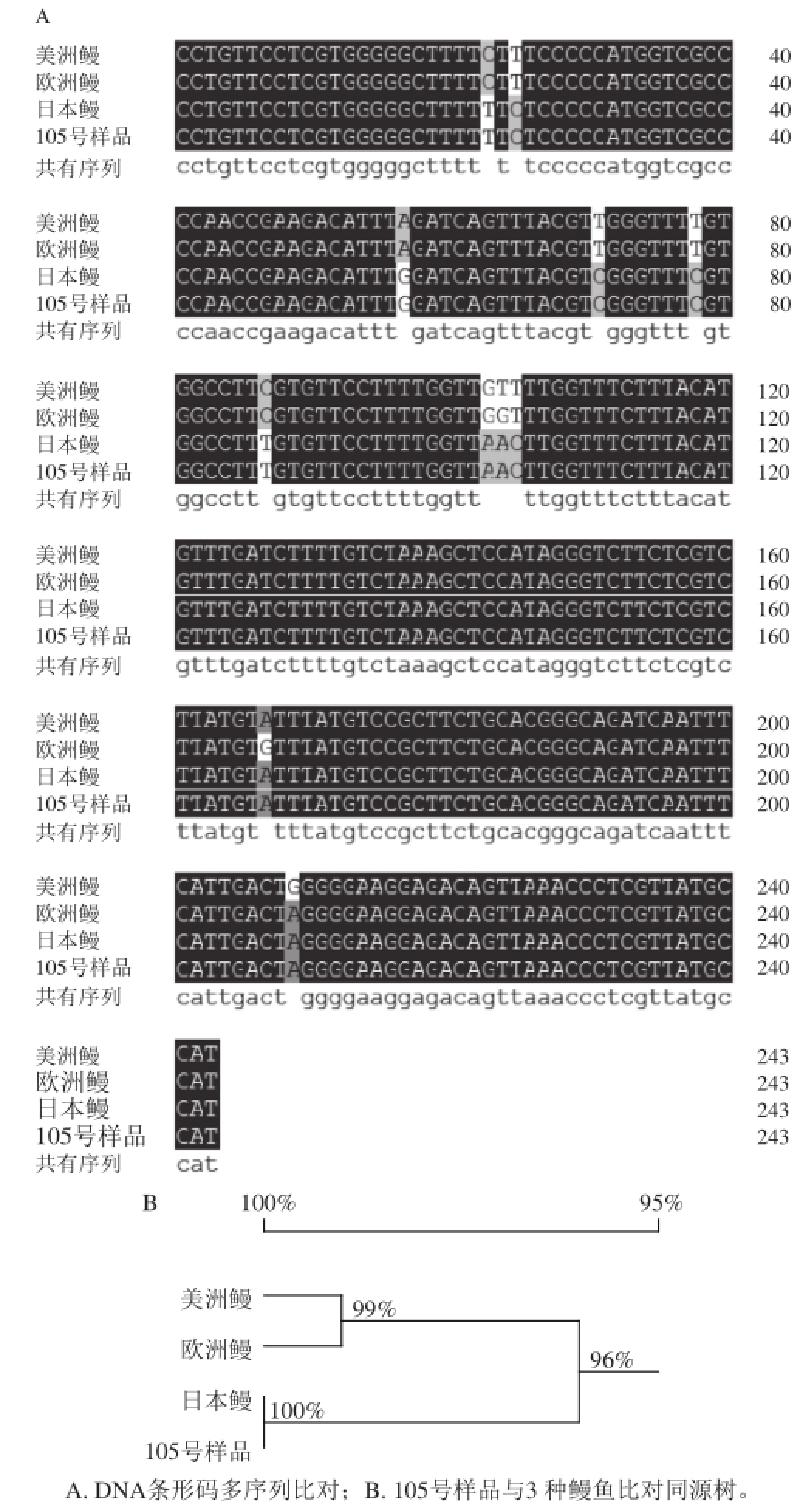
图7 105号样品DNA条形码与3 种鳗鱼标准DNA条形码序列比对及同源树
Fig.7 Multiple sequence alignment of DNA barcodes from partial 16S rRNA genes of sample 105 and three known eel species and phylogenetic tree

图8 123号样品DNA条形码与3 种鳗鱼标准DNA条形码序列比对及同源树
Fig.8 Multiple sequences alignment of DNA barcodes from partial 16S rRNA genes sample 123 and three known eel species and phylogenetic tree
本方法2013年10月作为实验室非标方法,应用于企业委托业务鳗鱼加工产品(单个体样品)与鳗苗个体的物种检测,3年多来共检测样品171 份,其中判别为美洲鳗的74 份,欧洲鳗的57 份,日本鳗的40 份,结果未出现差错。

图9 223号样品DNA条形码与3 种鳗鱼标准DNA条形码序列比对及同源树
Fig.9 Multiple sequences alignment of DNA barcodes from partial 16S rRNA genes of sample 223 and three known eel species and phylogenetic tree
Hebert最早提出DNA条形码的定义,且仅限于COⅠ基因序列,种内遗传距离一定要小于种间距离,种间遗传距离在2%以上,且是种内的10 倍以上 [11]。DNA条形码(COⅠ、COⅡ基因序列)应用于鳗鱼系统发育与分类的研究,发现种内个体间也存在遗传距离 [23-27],虽然比种间距离小,但在其他物种存在种内与种间距离重叠的现象 [23],即有时种内距离反而大于种间。Vandamme [27]、Stein [28]等应用COⅠ基因序列鉴别非法贸易的濒危物种欧洲鳗,结果因存在待测样品同时与Genbank数据库中2个以上物种序列同源率相同的问题,给结果判定造成困惑,最终只能借助其他数据库(如BOLD(The Barcode of Life Data System))收录的DNA序列加以比对,做出综合判定。可见,最理想的物种鉴定DNA条形码指标,应该是物种内部个体间遗传距离为0,而种间保持一定的距离。随着基因条形码技术的发展,除了COⅠ基因DNA序列作为标准条形码 [11-13]外,作为重要条形码的线粒体16S rRNA、COⅡ等基因的DNA序列,近年也越来越多地被应用于物种鉴别和遗传多样性分析 [14-21]。理想的标准DNA条形码片段不应局限于COⅠ基因序列,只要能有效鉴别物种的DNA片段都可以应用,多基因遗传信息的组合使用,能获得更理想的物种系统进化的分析结果 [30]。
本方法于2013年10月作为实验室非标方法,应用于企业委托业务鳗鱼加工产品烤鳗(单个体样品)与鳗苗个体的检测,至本文投稿(2016年6月),3年多来共为相关企业出具出口鳗鱼产品与进口鳗苗样品检测结果报告171 份,结果未出现差错,未有客户提出异议,为企业鳗鱼产品出口与进口鳗苗的鳗种鉴定提供了重要技术支持,该法已经在国家标准委作为行业标准制定项目立项,标准发布后将在检验检疫实践中推广应用。但该方法也存在局限性,仅限于以个体为样品的检测,进行美洲鳗、欧洲鳗、日本鳗的3 种鳗鱼种类的判别。为满足执法与市场需求,将进一步扩大鳗鱼物种研究范围,设计出更多的引物,从COⅠ、COⅡ、Cyt b等基因中筛选出更理想的DNA条形码,用于鳗鱼物种精准鉴定。
本研究应用16S rRNA基因的通用引物,通过鳗鱼16S rRNA基因部分DNA片段的PCR扩增与测序,筛选出具有3 种鳗鱼(美洲鳗、欧洲鳗、日本鳗)物种特异性DNA片段(243 bp),设计了一对新的引物用于扩增该片段,作为具有物种特异性的标准DNA条形码,建立了3 种鳗鱼的物种鉴别方法。3 种鳗鱼的物种间关系为:美洲鳗与欧洲鳗间的同源率为99%,二者与日本鳗间为96%(图5)。待测鳗鱼样品获得的条形码与本方法建立的标准条形码之间的同源率为100%,即遗传距离为0时,才能进行所属物种的判断,不存在待测样品同时与Genbank中多个物种DNA序列同源率相同的问题,是理想的标准DNA条形码。
参考文献:
[1] The IUCN red list of threatened species. Anguilla anguilla[DB/OL]. http://www.iucnredlist.org.
[2] JACOBY D M P, CASSELMAN J M, CROOK V, et al. Synergistic patterns of threat and the challenges facing global anguillid eel conservation[J]. Global Ecology and Conservation, 2015, 4: 321-333. DOI:10.1016/j.gecco.2015.07.009CrossRef.
[3] 张舒亚, 金丽琴, 蒋剑琼, 等. 食品中鱼源性成分PCR的检测方法[J].食品与发酵工业, 2010, 36(1): 142-145.
[4] 陈文炳, 赵晨, 邵碧英, 等. PCR方法检测河豚鱼的引物筛选及反应体系的优化[J]. 食品科学, 2010, 31(20): 376-381.
[5] 陈文炳, 林少华, 邵碧英, 等. 河豚鱼Cyt b基因部分DNA序列分析与应用[J]. 食品科学, 2012, 33(20): 227-232.
[6] 陈双雅, 陈文炳, 张津, 等. 应用PCR-RFLP和芯片生物分析系统鉴别河豚鱼品种[J]. 食品科学, 2012, 33(22): 200-202.
[7] 曲良苗, 陈文炳, 缪婷玉, 等. 限制性内切酶酶切确证河豚鱼成分PCR检测结果[J]. 食品科学, 2014, 35(8): 169-173. DOI:10.7506/ spkx1002-6630-201408034.
[8] 杨弘, 王希道, 吴婷婷, 等. 用RAPD技术研究3 种鳗的种质鉴定[J]. 中国水产科学, 2002, 9(3): 269-272. DOI:10.3321/ j.issn:1005-8737.2002.03.018.
[9] 胡庚东, 尤洋, 陈家长. 澳洲鳗、日本鳗和欧洲鳗的RAPD初步比较分析[J]. 浙江海洋学院学报(自然科学版), 2006, 25(3): 254-257. DOI:10.3969/j.issn.1008-830X.2006.03.004.
[10] 张新艳, 樊海平, 范斯敏, 等. 应用RAPD技术对6 种玻璃鳗的种质鉴定和遗传多样性分析[J]. 江西农业大学学报, 2010, 32(4): 683-688. DOI:10.3969/j.issn.1000-2286.2010.04.010.
[11] 刘光明, 史千玉, 曹敏杰, 等. 利用PCR和限制性酶切技术鉴别3 种鳗鱼[J]. 集美大学学报(自然科学版), 2011, 16(3): 178-181. DOI:10.3969/j.issn.1007-7405.2011.03.004.
[12] KESZKA S, PANNICZ R, KEMPTER J. Eel species identification by polymerase chain reaction followed by reaction fragment length polymorphism (PCR-RFLP)[J]. Medycyna Wet, 2009, 65(5): 315-318.
[13] HEBERT P D N, CYWINSKA A, BALI S L, et a1. Biological identifications through DNA barcodes[J]. Proceedings of Royal Society of London, 2003, 270: 313-321. DOI:10.1098/rspb.2002.2218.
[14] 彭居俐, 王绪祯, 王丁, 等. 基于线粒体CO1基因序列的DNA条形码在鲤科鲌属鱼类物种鉴定中的应用[J]. 水生生物学报, 2009, 33(2): 271-276.
[15] 李新光, 王璐, 赵峰, 等. DNA条形码技术在鱼肉及其制品鉴别中的应用[J]. 食品科学, 2013, 34(18): 337-342. DOI:10.7506/spkx1002-6630-201318069.
[16] 邵爱华, 朱江, 陈葵, 等. 暗纹东方豚线粒体COⅡ及两侧tRNA基因的克隆和序列分析[J]. 动物学杂志, 2005, 40(6): 1-8. DOI:10.3969/ j.issn.0250-3263.2005.06.001.
[17] 邵爱华, 朱江, 陈葵, 等. 暗纹东方豚线粒体COⅠ及其侧翼tRNA基因的克隆与序列分析[J]. 遗传, 2006, 28(8): 963-971. DOI:10.3321/ j.issn:0253-9772.2006.08.011.
[18] 邵爱华, 杜建, 陈葵, 等. 暗纹东方豚线粒体DNA 16S rRNA基因克隆、测序与在分子系统发育分析中的应用[J]. 江苏农业科学, 2009(2): 15-19. DOI:10.3969/j.issn.1002-1302.2009.02.005.
[19] 毕潇潇, 高天翔, 肖永双, 等. 4 种鳕鱼线粒体16S rRNA、COⅠ和Cyt b基因片段序列的比较研究[J]. 南方水产科学, 2009, 5(3): 46-52. DOI:10.3969/j.issn.1673-2227.2009.03.008.
[20] 陈文炳, 翁国柱, 陈融斌, 等. 河豚鱼16S rRNA基因部分DNA序列分析及应用探讨[J]. 食品科学, 2015, 36(21): 140-144. DOI:10.7506/ spkx1002-6630-201521027.
[21] 韦健红, 李薇, 吴文如, 等. 基于COⅠ和16S rRNA基因对广地龙的DNA分子鉴定研究[J]. 中国药房, 2012, 23(35): 3274-3278. DOI:10.6039/j.issn.1001-0408.2012.35.04.
[22] 马梅, 李薇, 龚玲, 等. 基于COⅠ和16S rRNA基因的地龙药材及其混淆品的DNA条形码鉴定[J]. 中药新药与临床药理, 2014, 25(5): 595-598. DOI:10.3969/j.issn.1003-9783.2014.05.018.
[23] 李海涛, 张保学, 高阳, 等. DNA条形码技术在海洋贝类鉴定中的实践: 以大亚湾生态监控区为例[J]. 生物多样性, 2015, 23(3): 299-305. DOI:10.17520/biods.2014261.
[24] 吴宁, 黎中宝, 林小云, 等. 6 种鳗鲡(Anguilla)线粒体DNA COⅠ序列的比较研究[J]. 海洋与湖沼, 2010, 41(6): 930-934.
[25] 田鑫江, 吴宁, 黎中宝, 等. 6 种鳗鲡(Anguilla)线粒体DNA COⅡ基因序列分析及其系统发育[J]. 海洋与湖沼, 2011, 42(2): 279-283. DOI:10.11693/hyhz201102018018.
[26] 龚小玲, 岳丽佳, 崔忠凯, 等. 鳗鲡属6 种鱼线粒体COⅠ和COⅡ基因序列分析和分类的有效性[J]. 上海海洋大学学报, 2013, 22(4): 524-530.
[27] VANDAMME S G, GRIFFITHS A M, TAYLOR S, et al. Sushi barcoding in the UK: another kettle of fi sh[J]. Peer J, 2016, 4: e1891. DOI:10.7717/peerj.1891.
[28] STEIN F M, WONG J C Y, SHENG V, et al. First genetic evidence of illegal trade in endangered European eel (Anguilla anguilla) from Europe to Asia[J]. Conservation Genetics Resources, 2016, 8(4): 533-537. DOI:10.1007/s12686-016-0576-1.
[29] INOUE J G, MIYA M, TSUKAMOTO K, et al. A mitogenomic perspective on the basal teleostean phylogeny: resolving higher-level relationships with longer DNA sequences[J]. Molecular Phylogenetic Evolution, 2001, 20(2): 275-285. DOI:10.1006/mpev.2001.0970.
[30] AOYAMA J, NISHIDA M, TSUKAMOTO K. Molecular phylogeny and evolition of the freshwater eel, genus Anguilla[J]. Molecular Phylogenetics and Evolution, 2001, 20(3): 450-459. DOI:10.1006/ mpev.2001.0959.
Identif i cation of Anguilla rostrata, Anguilla anguilla and Anguilla japonica Using DNA Barcoding Based on 16S rRNA Gene
CHEN Wenbing, MIAO Tingyu, PENG Juan, SHAO Biying, CHEN Bin, JIANG Shuxun, ZHANG Zhideng
(Inspection and Quarantine Technology Center, Fujian Entry-Exit Inspection and Quarantine Bureau, Fuzhou 350001, China)
Abstract:To meet the demands of enterprises engaged in eel farming, processing and trading and law enforcements, a DNA barcoding method for the identif i cation of three main farmed eel species, Anguilla rostrata, A. Anguilla and A. japonica, was developed. Universal 16S rRNA primers were designed and used to amplify partial 16S rRNA gene fragments of A. rostrata, A. Anguilla and A. japonica and their PCR products were sequenced to be 638, 638 and 640 bp in length, respectively. The specif i c DNA fragment (243 bp) was selected as standard DNA barcode with eel species specif i city to identify eel species conveniently, and a forward primer (22 bp) and a reversed primer (23 bp) were designed and used to establish the PCRDNA barcoding method. The results of the application of the proposed method over the past three years showed that it is convenient, accurate, stable, and useful to identify the three eel species.
Key words:A. rostrata; A. Anguilla; A. japonica; 16S rRNA gene; DNA barcode; identif i cation
DOI:10.7506/spkx1002-6630-201704046
中图分类号:S917.4;Q78
文献标志码:A
文章编号:1002-6630(2017)04-0283-07
引文格式:
陈文炳, 缪婷玉, 彭娟, 等. 基于16S rRNA基因DNA条形码鉴定美洲鳗、欧洲鳗、日本鳗[J]. 食品科学, 2017, 38(4): 283-289. DOI:10.7506/spkx1002-6630-201704046. http://www.spkx.net.cn
CHEN Wenbing, MIAO Tingyu, PENG Juan, et al. Identification of Anguilla rostrata, Anguilla anguilla and Anguilla japonica using DNA barcoding based on 16S rRNA gene[J]. Food Science, 2017, 38(4): 283-289. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704046. http://www.spkx.net.cn
收稿日期:2016-06-27
基金项目:福建省科技计划农业引导性项目(2015N0016)
作者简介:陈文炳(1962—),男,研究员,博士,研究方向为农产品、食品分子生物学检测技术。E-mail:621213wbc@163.com