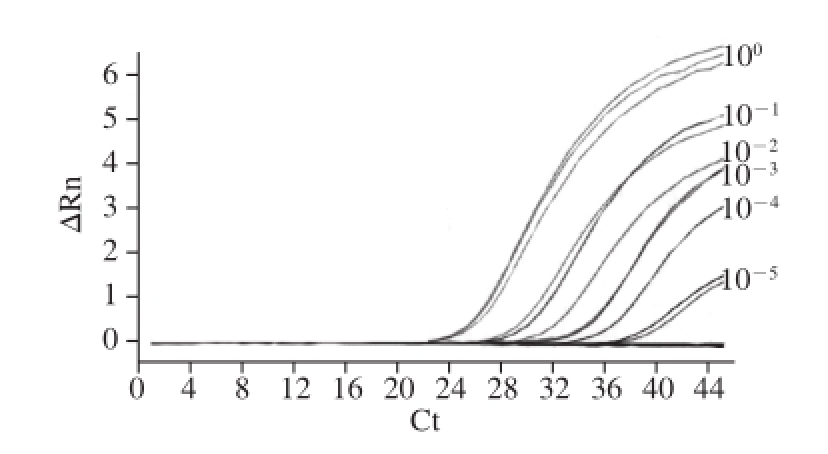
图1 NoV GⅡ型病毒浓度梯度检测结果
Fig.1 PCR amplif i cation curves of NoVGⅡconcentration gradients
徐文斐,房保海,林 超,王宫璞,王 群,郑小龙,梁成珠,岳志芹 *
(山东出入境检验检疫局检验检疫技术中心,山东 青岛 266002)
摘 要:目的:设计对比实验,以冷冻草莓为材料,研究样品中所含抑制剂对诺如病毒荧光定量逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)检测结果的影响,优化提高检测灵敏度与准确率。方法:GⅡ型诺如病毒便悬液的制备与RNA提取,已知阴性冷冻草莓样品进行前处理、病毒富集、病毒RNA提取纯化,分组(对照组、实验组),抑制剂去除,荧光定量RT-PCR检测。结果:随着病毒浓度的梯度递减,抑制剂影响作用呈明显增强趋势,导致在高于正常检测最低限度两个数量级的水平,即出现假阴性结果;抑制剂去除的实验组检测结果,随着病毒浓度梯度的递减明显优于未经处理的对照组;抑制剂去除的实验组稳定检出限为10 -6(Ct值小于40),最低检出限为10 -7(诺如病毒(norovirus,NoV)浓度梯度检测最低检出限为10 -5)。结论:抑制剂去除可明显优化冷冻草莓中NoV荧光定量RT-PCR检测,提高检测方法的灵敏度,且操作简便快捷,检测成本浮动不大,期望应用于日常检测工作中。
关键词:冷冻草莓;诺如病毒;荧光定量RT-PCR;抑制剂
诺如病毒(norovirus,NoV),是一种引起非细菌性急性胃肠炎的病毒,基因组为单股正链RNA,属杯状病毒 [1],具GⅠ~GⅤ 5 种基因组,29 种基因型 [2],1968年科学家最早在美国诺瓦克市暴发的一次急性腹泻的患者粪便中分离发现。可感染人和动物导致急性肠胃炎,其中对人类具有高感染性的NoV主要基因型为GⅠ、GⅡ型,少于等于10 2拷贝数/mL的NoV颗粒即可以致病,1972年由Kapikian首次检出 [3],传播途径以食物和水为载体的“粪→口”传播为主 [4]。2012年,德国发生了10 952人次感染NoV的大面积急性肠胃炎事件,伴随着腹泻、呕吐、高热等症状 [5],此后2013—2014年,欧盟连续两次颁布相关法令,提高对进出口冷冻草莓的官方监控水平 [6]。目前食品中NoV检测的报道多见于贝类 [7],但最新研究表明,冷冻草莓、酸性浆果类和蔬菜类食品同样是NoV感染高发的重要载体 [8-10]。NoV可从急性胃肠炎病人的粪便中分离获得,尚不能在细胞或组织中培养,也没有合适的动物模型,因此检测工作目前多通过分子生物学的荧光定量逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)实验方法 [11-13]。水果类食品基质中,草莓及其他酸性软果样品中存在着大量的RT-PCR抑制剂,包括复杂多糖、酚类物质和腐植酸等 [14],以及病毒RNA提取过程中有机、无机试剂成分的残留同样会对RT-PCR反应产生抑制作用 [15],影响荧光定量检测的灵敏度,加之该类食品基质中NoV污染水平往往很低 [16-18],一旦出现假阴性的检测结果,所造成的经济与大面积腹泻爆发,将造成不可挽回的负面影响。因此,检出限越低的方法越能更好地保障食品安全。
因此本实验为分析草莓等酸性软果类释放的大量PCR抑制剂的影响作用,实验设计以国际标准化组织(International Organization for Standardization,ISO)公布的食品中NoV检测方法为基础 [19],经过特定的PCR抑制剂去除实验,对不同梯度浓度GⅡ型NoV RNA含量的条件下,常规检测方法效果进行评估。对比分析抑制剂的影响作用及最佳检测方法,以期为建立国内相关食品中NoV检测标准提供数据。
1.1 材料
1.1.1 样品与病毒
冷冻草莓样品均来自于实验室常规检测样品,-20 ℃保存,1 周内检测。
NoV GⅡ型病毒原液:由实验室检测获得NoV粪便悬液,使用1×磷酸缓冲液(phosphate buffer saline,PBS)10 倍稀释,旋涡振荡混匀,8 000×g离心20 min,上清液分装至1.5 mL离心管,-80 ℃贮存备用 [20]。
1.1.2 试剂与仪器
果胶酶(Sigma p2401) 美国Sigma公司;Tris/Glycine/Beef extract(TGBE)缓冲液(Tris base 12.1 g、甘氨酸3.8 g、牛肉浸出粉10 g、双蒸水补充至1 L,pH值调节至9.5,高压灭菌)、PBS(5×PEG,50 g/100 mL PEG 8000,1.5 mol/L NaCl,高压灭菌)、1 mol/L盐酸、氢氧化钠溶液、氯仿、正丁醇等化学试剂(均为分析纯) 国药集团化学试剂有限公司;RNEASY Mini Kit(74104) 德国Qiagen公司;One-Step TMPCR Inhibitor Removal Kit 美国Genemed Synthesis公司;Ambion AgPath-ID TMOne-Step RT-PCR Kit(AM1005) 美国ABI公司。
7500荧光定量PCR仪 美国Applied Biosystems公司;5804R高速低温离心机(50 mL) 德国Eppendorf公司;BagPage R无菌匀质袋 法国Interscience公司;MLS-3750高压灭菌锅、WDF-U4186S超低温冰箱 松下健康医疗器械(上海)有限公司。
1.1.3 引物和探针
参照ISO/TS 15216-2:2013 [19]合成引物与探针,Norovirus GⅡ正向引物:ATG TTC AGR TGG ATG AGR TTC TCW GA;反向引物:TCG ACG CCA TCT TCA TTC ACA;探针:FAM-AGC ACG TGG GAG GGC GAT CG-BHQ。引物加无RNase超纯水配制成10 μmol/L溶液,探针加无RNase超纯水配制成5 μmol/L溶液。
1.2 方法
1.2.1 样品前处理
称取冷冻草莓样品25 g或6~8 枚果粒置于带滤网的匀质袋中,加入40 mL已混30 U果胶酶的TGBE缓冲液,调节pH值至9.5,60 r/min匀速振摇20 min。每隔10 min检测样品pH值,若pH值小于9.0,则使用NaOH调节至pH 9.5,孵育时间延长10 min。结束后将过滤样品液倒入离心管中,4 ℃、10 000×g离心30 min,取上清液至新离心管。
1.2.2 病毒富集
使用HCl溶液调节样品液pH值至7.0,加入1/4体积的PEG充分混匀后4 ℃振摇4 h或静置过夜。4 ℃、10 000×g离心30 min,弃上清液,4 ℃、10 000×g离心5 min,压实沉淀。移液枪移去废液后加500 μL PBS振荡重悬,室温静置5 min,4 ℃、10 000×g离心10 min,吸上清液至离心管,加入等体积氯仿-正丁醇(1∶1,V/V),振荡混合后静置5 min。4 ℃、10 000×g离心15 min,将上层水相小心移至新离心管中,-20 ℃保存。
1.2.3 病毒RNA提取
按照Qiagen RNEASY Mini Kit (74104)试剂盒说明书,提取NoV GⅡ病毒10 倍梯度稀释悬液RNA和样品中病毒提取液RNA,最终溶于100 μL RNase水,-80 ℃保存。
1.2.4 PCR抑制剂的去除
采用One-Step TMPCR Inhibitor Removal Kit [21],将离心柱下端去除,放入离心管中,8 000 r/min离心3 min,弃离心液;加入50 μL提取获得的RNA溶液至离心柱中心,8 000 r/min离心1 min,收集过柱病毒RNA用于荧光定量RT-PCR检测。
1.2.5 最低检出限的确定及对照组的设定
目前NoV尚未能体外培养,对其难以准确定量。本实验中将已确定为阳性样品的病毒便悬液进行梯度稀释后,分别提取病毒RNA,使用荧光定量RT-PCR方法确定稳定检测出最高稀释倍数10 -x(x>0)。Linear线性图中具有指数期起峰和相应Ct数值的检测结果,即判定为阳性检出。
实验设计2 组实验组与2 组对照组:对照组A为原倍样品RNA溶液;对照组B为10 倍稀释的样品RNA溶液;实验组A为去除抑制剂样品的RNA溶液;实验组A为10 倍稀释的去除抑制剂样品RNA溶液。具体步骤:取不同批次经检测确定为阴性的冷冻草莓样品,每组5 个重复平行,按照1.2.1~1.2.3节的方法步骤进行样品前处理与RNA提取,最终获得100 μL样品RNA溶液,取50 μL进行PCR抑制剂去除实验,分别将常规与去除抑制剂后样品RNA溶液进行10 倍稀释。
1.2.6 荧光定量RT-PCR检测
采用Ambion AgPath-ID TMOne-Step RT-PCR Kit(AM1005)试剂盒,扩增体系:包含5 μL待测样品RNA,12.5 μL 2×PCR Master Mix、增强剂1.67 μL,正向引物1 μL,反向引物1 μL,荧光探针1 μL,0.25 μL不同浓度的NoV RNA作为内参照,补充水至25 μL。以水代替模板作为空白对照。反应参数:反转录45 ℃ 10 min;酶活性热启动95 ℃ 10 min;95 ℃ 15 s,60 ℃ 40 s 反应45 个循环。实验结果采用双因素方差分析法进行差异显著性方差分析。
2.1 梯度浓度及检出限的确定
NoV GⅡ型病毒原液进行10 倍梯度稀释至10 -8,按照1.2.3节步骤提取病毒RNA,每个样品3个平行,荧光定量PCR进行检测,结果见图1。原倍至稀释1 0 -8倍的平均C t值分别为2 5.0 3 9±0.3 2 6、28.151±0.378、31.784±0.720、34.744±0.543、37.648±0.779、39.560±0.921、0、0、0,本实验方法最低检出数量级为10 -5,Ct值为39.560±0.921。

图1 NoV GⅡ型病毒浓度梯度检测结果
Fig.1 PCR amplif i cation curves of NoVGⅡconcentration gradients
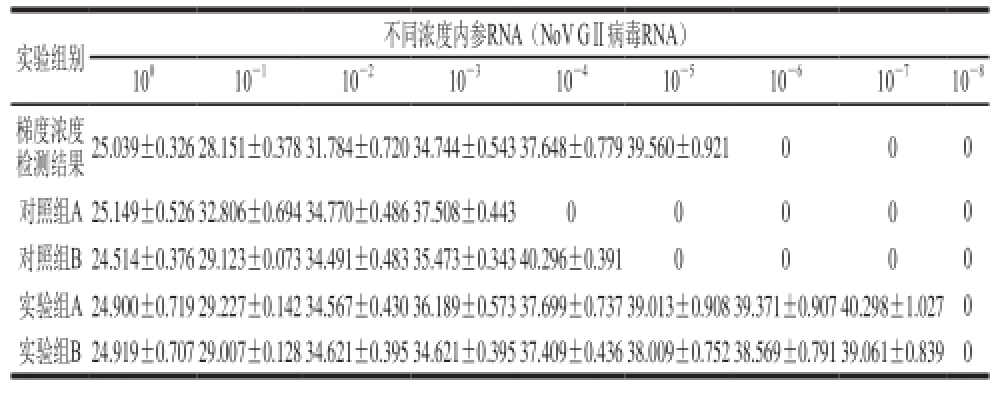
2.2 不同浓度内参RNA条件下荧光定量PCR结果
不同浓度内参RNA(NoV GⅡ病毒RNA)条件下,实验组A、B与对照组A、B实验结果数据见表4。对比内参RNA常规梯度浓度检测结果,并进行差异显著性分析。结果显示:在高浓度10 0倍NoV病毒内参RNA条件下,酸性软果类所含有的抑制剂成分对荧光定量RTPCT检测结果的影响极小(P>0.05)见图2;随着NoV内参RNA浓度的降低,10 -1~10 -3倍NoV内参RNA条件下对照组A中,PCR抑制剂影响作用极显著(P<0.01)见图3、4;10 -4倍内参RNA条件下开始出现假阴性结果,见图5。
结果显示:随着内参RNA浓度的降低,10 -3倍稀释浓度之后,抑制剂去除后的实验组A/B与对应的内参RNA梯度浓度检测结果差异不显著(P>0.05);最低检出数量级为10 -7,实验组A Ct值为40.298±1.027,实验组B Ct值为39.061±0.839,两组检测结果差异不显著(P>0.05)。
表4 不同浓度内参RNA条件下荧光定量PCR结果(Ct值)
Table4 Results of PCR detection of internal reference RNA at different concentrations
?
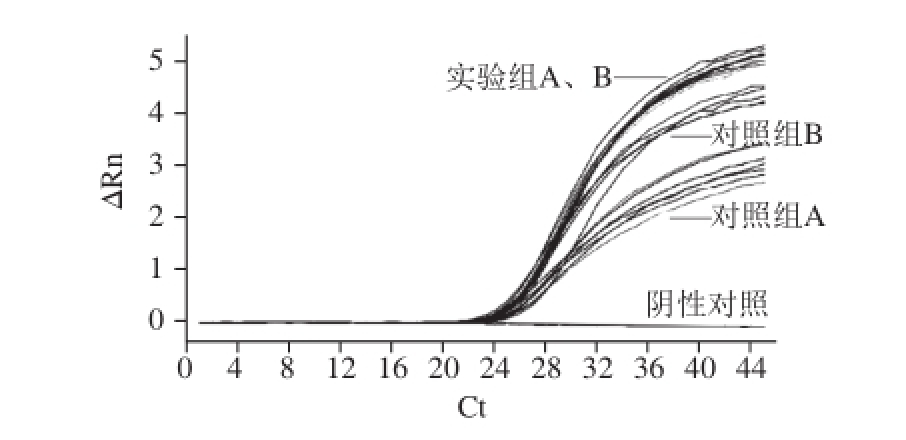
图2 10倍内参RNA条件下实验组与对照组PCR结果
Fig.2 PCR Amplif i cation curves of internal reference RNA at initial concentration of 10
0
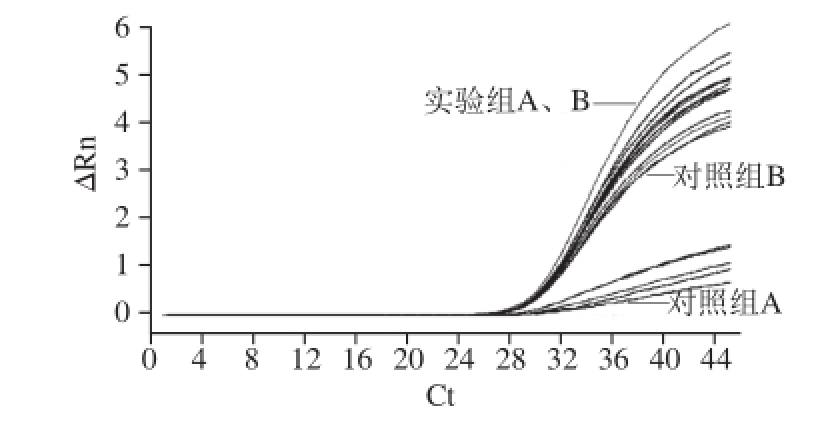
图3 稀释至10
-1倍内参RNA条件下实验组与对照组PCR结果
Fig.3 PCR Amplif i cation curves of internal reference RNA diluted to 10
-1
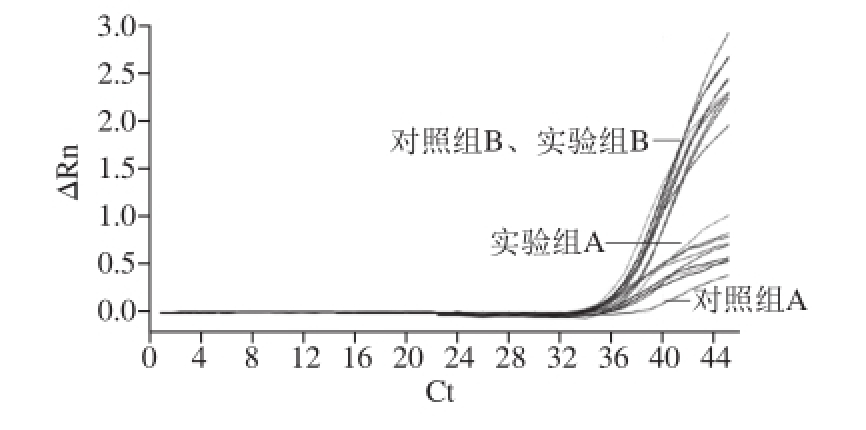
图4 稀释至10
-3倍内参RNA条件下实验组与对照组PCR结果
Fig.4 PCR Amplif i cation curves of internal reference RNA diluted to 10
-3
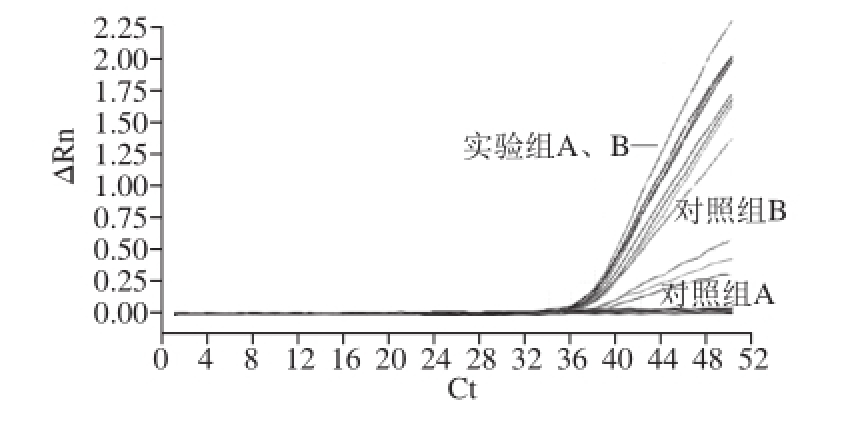
图5 稀释至10倍内参RNA条件下实验组与对照组PCR结果
Fig.5 PCR Amplifi cation curves of internal reference RNA diluted to 10
-4
截至目前NoV的培养和分离,缺乏合适的动物模型和细胞系,尚不能人工培养,但随着分子生物学技术的发展,荧光定量RT-PCR检测技术的应用 [22-24],着实提供了一种高灵敏度、低检出限、步骤简便、节省时间的检测方法 [11-13]。但冷冻草莓食品样品所含有的大量复杂多糖、酚类物质和腐植酸等PCR抑制剂成分 [14],在某些条件下可直接影响到检测结果。周阳等 [25]研究建议,在冷冻草莓的前处理阶段,选择在冷冻草莓样品未完全解冻前进行取样处理,甘氨酸缓冲液洗脱冷冻草莓样品时,振荡的时间和强度都需要严格控制,目的是为了防止果皮破裂,减少草莓中所含有的大量糖类成分、酸性成分与果胶流出 [25]。此类酚类、多糖等物质属RT-PCR强干扰物质,却可随病毒RNA的提取共同提取出 [26]。
本实验使用One-Step TMPCR Inhibitor Removal Kit试剂盒 [21],去除检测样品病毒RNA提取溶液中的抑制剂成分,方法简便快捷。为准确反映PCR抑制剂的去除对检测结果的影响作用,本实验设计将不同数量级浓度的NoV RNA作为内参病毒RNA,添加至阴性样品PCR反应体系中,进行荧光定量RT-PCR检测,直观准确地反映出冷冻草莓样品所释放出的大量抑制剂成分对检测结果的影响规律,为下一步优化冷冻软果类食品中NoV检测方法,提高检测灵敏度与准确率提供不可或缺的数据基础。
根据不同浓度NoV内参RNA条件下实验结果显示:在原倍样品提取液(对照组A)环境下,高浓度NoV RNA(Ct值为25.039)含量下,抑制剂对检测结果的影响较小;但随着病毒浓度的递减,抑制剂影响作用呈明显增强趋势;实验结果表明冷冻草莓样品中的抑制剂成分在NoV稀释至10 -4倍浓度时,检测结果即出现假阴性现象,造成标准检测方法的灵敏度低至10 -3,其对正常检测工作的阻碍影响高达两个数量级。本实验通过专用试剂盒去除正常检测样品中的抑制剂,实验结果分析表明:除了在原倍高浓度NoV RNA含量条件下,实验组A、B与对照组A、B无明显差异之外,抑制剂去除的实验组随着病毒浓度的递减,检测结果的效果明显优于未经处理的原倍样品病毒RNA提取液(对照组A)。10 倍稀释的对照组B与10 倍稀释的实验组B,检测结果分别不同程度的优于各自的原倍组,其原因李楠等 [21]在研究中推测是因为随着10 倍稀释,所含抑制剂的浓度也随之降低;抑制剂去除的实验组A与10 倍稀释的实验组B稳定检出限为10 -6(Ct值小于40);实验组最低检出限为10 -7,此时实验组A检测Ct值为40.298,在日常检测中此结果应进行进一步复验。通过实验结果分析得出,抑制剂去除可明显优化冷冻草莓等冷冻软果类食品基质中NoV的荧光定量RT-PCR检测效果,提高检测方法的灵敏度,对此类病毒污染水平较低的样品,具有重要意义。本实验所采取的抑制剂去除方法为One-Step TMPCR Inhibitor Removal Kit试剂盒,操作简便快捷,单个样品检测成本浮动不大。期望在日常检测工作中,从以往的原倍样品提取液检测与10 倍稀释提取液检测,增加去除抑制剂样品提取液检测,3 种检测体系,多重检测保障,确保检测结果的可靠性,更好的保障食品安全性。
参考文献:
[1] 郭丽, 王健伟, 洪涛. 诺如病毒分子生物学研究进展[J]. 传染病信息, 2009, 22(3): 174-178. DOI:10.3969/j.issn.1007-8134.2009.03.020.
[2] PALCHETTI I, MASCINI M. Electroanalytical biosensors and their potential for food pathogen and toxin detection[J]. Analytical and Bioanalytical Chemistry, 2008, 391(2): 455-471. DOI:10.1007/s00216-008-1876-4.
[3] HOONMO L K, NADIM A, ROBERT L A, et al. Noroviruses: the principal cause of foodborne disease worldwide[J]. Discovery Medicine, 2010, 10(50): 61-70.
[4] KOOPMANS M, DUIZER E. Foodborne viruses: an emerging problem[J]. International Journal of Food Microbiology, 2004, 90(1): 23-41. DOI:10.1016/S0168-1605(03)00169-7.
[5] BERNARD H, FABER M, WILKING H, et al. Large multistate outbreak of norovirus gastroenteritis associated with frozen strawberries, Germany, 2012[J]. Eurosurveillance, 2014, 19(8): 13-21. DOI:10.2807/1560-7917.ES2014.19.8.20719.
[6] 李小波, 师永霞, 郑夔, 等. 诺如病毒快速检测方法的建立及其在国境卫生检疫中的应用[J]. 中国卫生检验杂志, 2011, 18(11): 2303-2304; 2329. DOI:10.3969/j.issn.1004-8685.2008.11.050.
[7] 周德庆, 苏来金, 赵峰, 等. 诺如病毒在贝类中的富集特性与机制研究进展[J]. 病毒学报, 2015, 31(3): 313-317.
[8] DUBOIS E, AGIER C, TRAORE O, et al. Modified concentration method for the detection of enteric viruses on fruits and vegetables by reverse transcriptase-polymerase chain reaction or cell culture[J]. Journal of Food Protection, 2002, 65(12): 1962-1969.
[9] COTTERELLE B, DROUGARD C, ROLLAND J, et al. Outbreak of norovirus infection associated with the consumption of frozen raspberries, France, March 2005[J]. Euro Surveill, 2005, 10(4): E050421-050428.
[10] LOPMAN B A, ADAK G K, REACHER M H, et al. Two epidemiologic patterns of norovirus outbreaks: surveillance in England and wales, 1992-2000[J]. Emerging Infectious Diseases, 2003, 9(1): 71-77. DOI:10.3201/EID0901.020175.
[11] 寇晓霞, 吴清平, 薛亮, 等. 贝类中诺如病毒的研究进展[J]. 中国食品卫生杂志, 2014, 26(2): 200-204.
[12] AJJAMPUR S S, RAJENDRAN P, RAMANI S, et al. Closing the diarrhoea diagnostic gap in Indian children by the application of molecular techniques[J]. Journal of Medical Microbiology, 2008, 57(Pt 11): 1364-1368. DOI:10.1099/JMM.0.2008/003319-0.
[13] ATMAR R L, ESTES M K. Diagnosis of noncultivatable gastroenteritis viruses, the human caliciviruses[J]. Clinical Microbiology Reviews, 2001, 14(1): 15-37. DOI:10.1128/CMR.14.1.15-37.2001.
[14] 谢雅晶, 刘贤金. 食源性诺如病毒在果蔬农产品中的污染及检测研究[J]. 病毒学报, 2015, 31(6): 685-697.
[15] 周晓红, 李晖, 杨杏芬. 食品中诺如病毒RT-PCR检测技术研究进展[J].国外医学: 卫生学分册, 2009, 36(4): 234-238.
[16] 袁巧, 王晨, 李晖, 等. 贝类中诺如病毒检测方法的研究进展[J]. 华南预防医学, 2012, 38(5): 30-33.
[17] 周晓红, 李晖, 杨杏芬. 食源性及水源性诺如病毒研究进展[J]. 中国公共卫生, 2010, 26(9): 1213-1214. DOI:10.11847/ZGGGWS2010-26-09-74.
[18] 余昆英, 师舞阳, 陈子龙, 等. 水中诺如病毒富集效果及核酸提取方法的比较[J]. 南昌大学学报(医学版), 2014, 54(12): 28-30.
[19] International Organization for Standardization. Microbiology of food and animal feed-horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR-Part 1: Method for quantif i cation: ISO/TS 15216-2:2013[S]. 2013.
[20] 夏体娇, 金敏, 陈照立, 等. 荧光定量RT-PCR检测诺如病毒基因Ⅱ型方法的建立和评估[J]. 解放军预防医学杂志, 2013, 31(3): 200-203.
[21] 李楠, 王佳慧, 李凤琴, 等. 检测鲜草莓中GⅡ型诺如病毒的两种富集方法比较[J]. 中国食品卫生杂志, 2015, 27(3): 242-246.
[22] KOJIMA S, KAGEYAMA T, FUKUSHI S, et al. Genogroup-specif i c PCR primers for detection of Norwalk-like viruses[J]. Journal of Virology, Methods, 2002, 100(1/2): 107-114. DOI:10.1016/S0166-0934(01)00404-9.
[23] 纪蕾, 韩建康, 吴晓芳, 等. 多重荧光RT-PCR同时检测GⅠ型和GⅡ型诺如病毒方法的建立[J]. 中国人兽共患病学报, 2011, 27(4): 311-315.
[24] 陈传德, 周晓红, 莫艳玲, 等. 荧光定量RT-PCR定量检测诺如病毒方法的建立及其评价[J]. 中国卫生检验杂志, 2010, 20(3): 467-469; 558.
[25] 周阳, 栾军, 蒋鲁岩, 等. 实时荧光RT-PCR检测冷冻草莓中诺如病毒[J]. 食品安全质量检测学报, 2013, 4(2): 516-520.
[26] ZHENG D P, ANDO T, FANKHAUSER R L, et al. Norovirus classification and proposed strain nomenclature[J]. Virology, 2006, 346(2): 312-323. DOI:10.1016/J.VIROL.2005.11.015.
Inf l uence of PCR Inhibitor Removal on Detection of Norovirus GⅡ in Frozen Strawberry by Real-Time Fluorescent RT-PCR
XU Wenfei, FANG Baohai, LIN Chao, WANG Gongpu, WANG Qun, ZHENG Xiaolong, LIANG Chengzhu, YUE Zhiqin
*
(Technique Center of Inspection and Quarantine, Shandong Entry-Exit Inspection and Quarantine Bureau, Qingdao 266002, China)
Abstract:Objective: Comparative experiments were designed to address the inf l uence of the presence of PCR inhibitor on the results of detection of norovirus GⅡ in frozen strawberry by real-time fl uorescent RT-PCR (RT-qPCR), aiming to improve the detection sensitivity and accuracy. Methods: After pretreatment of fecal suspensions containing norovirus GⅡand known negative strawberry samples, the virus was enriched for the extraction and purif i cation of RNA and a control group and an experimental group were established. After removal of the PCR inhibitor, the samples were determined by RT-qPCR. Results: The effect of the inhibitor tended to increase obviously with decreasing concentration gradient of virus, thus giving false negative results which were two orders of magnitude higher than the lowest level detected without the presence of the inhibitor. Better detection results were obtained by removal of the inhibitor compared with the control untreated group, as the virus concentration gradient decreased. The stable detection limit (LOD) for the experimental group without PCR inhibitor was 10 -6(Ct value < 40), and the minimum LOD were 10 -7. Conclusion: The detection of norovirus in frozen strawberries by fl uorescence quantitative RT-PCR could be improved in terms of sensitivity by removal of the inhibitor. In addition, the improved method was quick, easy to operate, economic and practical.
Key words:frozen strawberry; norovirus G Ⅱ; RT-PCR; inhibitors
DOI:10.7506/spkx1002-6630-201704048
中图分类号:X954
文献标志码:A
文章编号:1002-6630(2017)04-0296-05
引文格式:
徐文斐, 房保海, 林超, 等. 抑制剂去除对冷冻草莓中诺如病毒RT-PCR检测的影响[J]. 食品科学, 2017, 38(4): 296-300.
DOI:10.7506/spkx1002-6630-201704048. http://www.spkx.net.cn
XU Wenfei, FANG Baohai, LIN Chao, et al. Inf l uence of PCR inhibitor removal on detection of norovirus GⅡ in frozen strawberry by real-time fluorescent RT-PCR[J]. Food Science, 2017, 38(4): 296-300. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704048. http://www.spkx.net.cn
收稿日期:2016-05-29
基金项目:青岛市民生科技计划项目(14-2-3-60-nsh);科技部质检公益项目(201410080-2)
作者简介:徐文斐(1987—),女,硕士研究生,研究方向为食源性病毒检测食品安全。E-mail:34660104@qq.com
*通信作者:岳志芹(1975—),女,研究员,博士,研究方向为水生动物疫病病原生物学。E-mail:yuezhiqin@126.com