
图1 克隆菌株菌落PCR验证
Fig.1 PCR verif i cation of monoclonal colonies
刘爱平,叶子熊,马 榆,张周莉,熊 清,李文丽,孙海芹,李 诚 *
(四川农业大学食品学院,四川 雅安 625014)
摘 要:以大肠杆菌表达系统制备抗单增李斯特菌(Listeria monocytogenes,Lm)的单链抗体,以胶体金作为示踪物,优化胶体金探针的制备,并经免疫渗滤法鉴定胶体金探针的活性。结果表明该胶体金探针应用于免疫渗滤法时,具有高度特异性,通过胶体金探针的直接显色,可判断阳性样品;对Lm的最低检测限约为10 7CFU/mL;完成检测过程仅需10 min左右。该方法简单、快速、准确,可用于食品中Lm的检测。
关键词:单增李斯特菌;单链抗体;胶体金;免疫渗滤
单核细胞增生李斯特氏菌(Listeria monocytogenes,Lm)简称单增李斯特菌,是一种对人畜危害较大的人兽共患病原菌 [1],肉、奶、蛋、水产品、蔬菜以及冷冻食品等均受到不同程度的污染 [2]。因此对Lm的分析检测显得极其重要。Lm的分析检测方法主要包括传统的分离鉴定法 [3]、显色培养基快速检测法 [4]、分子生物学方法 [5]及基于抗原-抗体反应的免疫学方法 [6-7]等。免疫分析技术因操作简单、反应迅速、检测灵敏等优点在食品检测领域得到广泛运用 [8]。
抗体是免疫分析技术的核心试剂,常用的免疫分析方法中多采用单克隆抗体和多克隆抗体,前者特异性强、灵敏度高,但制备复杂、价格较昂贵;后者批间差异大,且易伴随高交叉反应率 [9]。基因工程抗体是随着分子生物学技术而发展起来的第3代抗体,其具有制备简单、生产周期短、成本低等特点 [10]。基因工程抗体主要包括抗原结合片段、可变区片段、单链抗体(single chain Fv antibody fragment,scFv)、纳米抗体等。scFv是由抗体重链可变区和轻链可变区通过15~20 个氨基酸的短肽连接而成 [11]。scFv能较好地保留其对抗原的亲和活性,并具有分子质量小、易于体外表达等特点,广泛用于食品安全检测等方面 [12-13]。
本研究参考文献报道合成经密码子优化适宜大肠杆菌(Escherichia coli,E. coli)表达的Lm scFv基因 [14],构建pET-22b-scFv重组载体,在E. coli BL21(DE3)中表达纯化;以柠檬酸三钠法制备胶体金,与纯化的scFv结合制备胶体金探针;采用免疫渗滤法检测该胶体金探针的活性。本研究可为实现食品中的Lm快速筛查、现场快检提供技术基础。
1.1 试剂与仪器
菌株:Lm、E. coli DH5α和E. coli BL21(DE3)感受态细胞、pET-22b质粒由课题组保存;SanPrep柱式聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒、兔源抗组氨酸多克隆抗体 生工生物工程(上海)股份有限公司;限制性内切酶(NcoⅠ、XhoⅠ)、PCR Master mix 日本Takara公司;WesternBright ECL化学发光底物 美国Advansta公司;氯金酸 美国Sigma公司;硝酸纤维素膜 美国Pall公司;其他常规试剂均为国产分析纯。
ST 16R台式高速冷冻离心机 美国Thermo公司;JY 92-IIN超声波细胞粉碎仪 宁波新芝生物科技股份有限公司;Gel Doc XR+凝胶成像系统、Chem Doc TMXRS+成像系统 美国Bio-Rad公司;UV-2450紫外-可见分光光度计 上海美谱达仪器有限公司;WP700P21微波炉格兰仕集团。
1.2 方法
1.2.1 重组载体pET-22b-scFv的构建
参考Paoli等 [14]的研究,在生工生物工程(上海)股份有限公司合成密码子经优化(适于E. coli表达系统)的抗Lm scFv基因片段,采用含NcoⅠ和XhoⅠ酶切位点的5’和3’引物扩增scFv基因片段。分别对scFv基因片段与pET-22b质粒进行Nco Ⅰ和Xho Ⅰ双酶切,以SanPrep柱式PCR产物纯化试剂盒纯化酶切产物。酶切后的scFv基因片段与pET-22b质粒按物质的量比6∶1进行连接;将连接产物转化至E. coli DH5α感受态细胞,在LB-A(含100 μg/mL氨苄青霉素)固体培养基上37 ℃过夜培养,挑取单菌落进行菌落PCR鉴定,将疑似正确的克隆菌株测序验证。
1.2.2 抗Lm scFv的表达与纯化
将测序验证的克隆菌株在液体培养基中扩大培养,提取重组载体pET-22b-scFv,转化至E. coli BL21(DE3)感受态细胞,以菌落PCR验证阳性克隆。挑取单个阳性克隆菌落接种至LB-AG液体培养基(含0.5%葡萄糖和100 μg/mL氨苄青霉素),110 r/min,37 ℃培养,待OD 600 nm至0.6~0.8时,加入终浓度为1 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropy-β-D-thiogalactoside,IPTG),于16 ℃诱导表达12 h后将菌液离心,弃上清液。以结合(binding,BD)缓冲液(50 mmol/L NaH 2PO 4,300 mmol/L NaCl,pH 8.0)洗3 次,重悬菌体于20 mL BD缓冲液,在冰浴条件下超声破碎菌体(超声30 min,2 s 开启,2 s切断,功率105 W)。将超声后混合液在4 ℃条件下10 000 r/min离心10 min,采用His标签纯化树脂亲和纯化上清液,并以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和Western blot分析scFv表达与纯化效果。
1.2.3 胶体金制备
参考刘颖沙等 [15]报道,对制备胶体金的各种玻璃器具进行清洗,高温干燥,备用。采用柠檬酸三钠法制备胶体金,并对柠檬酸三钠的加入量进行优化。具体方案如下:取5 瓶40 mL 0.01%氯金酸分别加入1%柠檬酸三钠0.4、1.2、1.6、2.4 mL和4.8 mL,充分混匀后,置于微波炉中小火加热15 min。
通过目测得到胶体金的外观特征,同时以紫外-可见分光光度计对各条件下制备的胶体金在可见光波长范围(400~700 nm)进行扫描并记录结果。
1.2.4 胶体金探针的制备
1.2.4.1 最适标记pH值的确定
取50 μL pH值分别为6、7、8、9和10的胶体金溶液,加入至96 孔酶标板,向各孔依次加入纯化的scFv,使其终质量浓度达到25 μg/mL,振荡混合后室温放置10 min。每孔加入10 μL 10%氯化钠溶液,振荡混合后室温放置2 h,观察各孔颜色变化。取胶体金溶液保持红色不变的pH值,重复上述过程,但将scFv终质量浓度降至5、4、3、2 μg/mL和1 μg/mL,观察各孔颜色变化。取胶体金溶液仍保持红色不变的pH值为最适标记pH值。
1.2.4.2 最适scFv标记量的确定
取pH值调至最适值的胶体金溶液50 μL分别加入至96 孔酶标板,各孔依次加入不同量的纯化scFv,使其质量浓度达到0、10、15、25、30、40 μg/mL,振荡混合后室温放置10 min。每孔加入10 μL 10%氯化钠溶液,振荡混合后室温放置2 h,观察各管颜色变化。使得胶体金溶液保持红色不变的最小抗体用量即为最低稳定量,在此基础上再加20%即为最适稳定量。
1.2.4.3 胶体金探针的制备和纯化
将1.2.2节中纯化的scFv置于0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS,pH 8.0)中透析24 h,将透析后的scFv于4 ℃、10 000 r/min离心10 min,取上清液。用0.1 mol/L的HCl溶液和K 2CO 3溶液调节至最佳pH值,调整scFv添加量至最适稳定量,摇匀15 min,室温放置10 min;加入牛血清白蛋白至其终质量分数为1.5%,缓慢摇匀10 min。将标记的胶体金溶液于4 000 r/min离心20 min,收集上清液;4 ℃条件下于13 000 r/min离心50 min,弃上清液;以原体积1/10的胶体金探针稀释液(质量分数为1%的牛血清蛋白溶液)重悬沉淀,加入叠氮钠至其终质量分数为0.02%,置4 ℃保存备用 [16]。
1.2.5 胶体金探针的活性鉴定
1.2.5.1 菌悬液的制备
将受检菌种Lm、E. coli DH5α分别在含0.6%酵母膏的胰酪胨大豆肉汤培养基和LB培养基中培养,取少量培养液进行平板稀释法计数;剩余菌液离心收集,并采用PBS洗涤3 次,4 ℃保存备用。
1.2.5.2 活性鉴定
采用免疫渗滤法对上述胶体金探针活性进行检测,具体步骤参考谌志强等 [17]研究,略有改动。在硝酸纤维素膜上分别滴加不同稀释度的菌样4 μL,待渗入,加4 μL 5%脱脂牛奶封闭液(溶于0.1% PBST,含0.1%吐温-20的PBS),待渗入,加6 μL胶体金探针,待渗入,加10 μL洗涤液(0.1% PBST),观察结果。
2.1 重组载体pET-22b-scFv的构建
按照1.2.1节中方法构建重组载体pET-22b-scFv,并转化至克隆菌株E.coli DH5α,经菌落PCR验证(图1),得到大小约750 bp的片段,与理论值一致。然后将克隆菌株测序,验证重组载体构建成功。

图1 克隆菌株菌落PCR验证
Fig.1 PCR verif i cation of monoclonal colonies
2.2 抗Lm scFv的表达与纯化
液体培养基扩大培养克隆菌株,提取质粒并转化至表达菌株E.coli BL21(DE3),再次经PCR验证转化成功(图2)。按照1.2.2节方法诱导scFv表达,并采用SDS-PAGE和Western blot对scFv表达情况进行分析,结果见图3。在同等菌浓度条件下(条带1~3),含重组质粒pET-22b-scFv的E.coli BL21(DE3)经IPTG诱导后,在12% SDS-PAGE胶上出现更明显的大小约27 kD的蛋白条带(图3A),经过His标签纯化树脂亲和纯化后,获得的scFv在27 kD和54 kD左右显示出条带,且当采用兔源抗组氨酸多克隆抗体进行Western blot反应时,在27 kD和54 kD左右处也显示条带(图3B)。27 kD处条带符合scFv预估分子质量大小,54 kD处条带的出现可能是由于scFv形成了二聚体 [11]。

图2 表达菌株菌落PCR验证
Fig.2 PCR verif i cation of monoclonal colonies
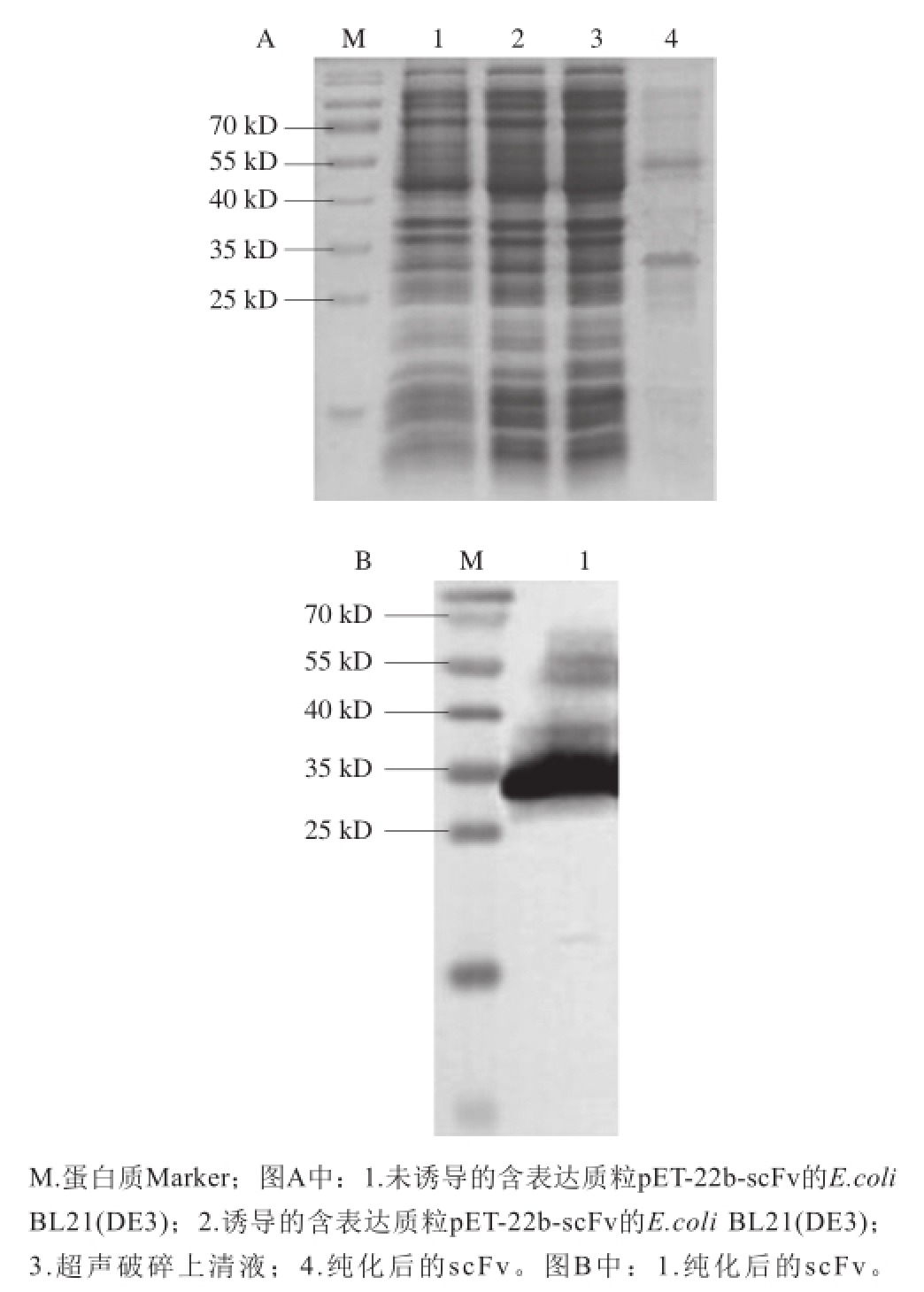
图3 scFv表达的SDS-PAGE(A)和Western blot(B)分析
Fig.3 SDS-PAGE (A) and Western blot (B) analyses of scFv expression
2.3 柠檬酸三钠还原法制备胶体金
表1 柠檬酸三钠加入量对胶体金溶液最大吸收波长、平均粒径的影响
Table1 Effect of sodium citrate concentration on the maximum absorption wavelength and average particle size of colloidal gold
?
研究者多用柠檬酸三钠、鞣酸、抗坏血酸、硼氢化钠为还原剂制备胶体金,其中柠檬酸三钠法最常用。通过改变反应体系中还原剂的量可得到不同直径的金颗粒 [18]。本研究探索了在40 mL 0.01%氯金酸溶液体系中,柠檬酸三钠加入量对胶体金颗粒大小的影响。添加0.4、1.2 mL的1%柠檬酸三钠溶液所得到的胶体金的颜色偏紫色;当添加1.6、2.4、4.8 mL的1%柠檬酸三钠溶液时,制得的胶体金颜色为酒红色,视觉效果良好、透明度高、无悬浮颗粒出现。采用紫外-可见分光光度计对不同柠檬酸三钠溶液添加量条件下制备的胶体金进行全波长扫描(400~700 nm),根据胶体金的最大吸收峰波长与平均粒径的线性关系回归方程Y = 0.427 1X+514.56(X为纳米金平均粒径;Y为最大吸收峰),可得到胶体金的粒径(表1)。结合胶体金颜色及前人研究报道中胶体金的粒径 [19],确定本实验中,40 mL质量分数为0.01%的氯金酸溶液中,质量分数1%柠檬酸钠溶液的最佳添加量为2.4 mL,加热时间为15 min。
2.4 最适标记pH值和scFv标记量的确定
胶体金探针的最适标记pH值和scFv的最佳标记量实验结果见图4,由图4A可知,pH值为6和10时,胶体金有明显褪色现象,将每孔的scFv质量浓度分别降至5、4、3、2、1 μg/mL,如图4B所示,在scFv质量浓度为1 μg/mL和2 μg/mL,pH值为7和8的微孔都有褪色现象,故选择pH 9为最佳标记pH值。


图4 最适标记pH和scFv标记量的优化
Fig.4 Optimization of pH and scFv concentration for colloidal gold probe
由图4C、D观察可知,除空白外其他孔颜色都较为稳定,但15 μg/mL相对10 μg/mL颜色更加鲜艳,故最低scFv稳定量为15 μg/mL,最佳scFv标记量为15 μg/mL的1.2 倍,即18 μg/mL。
2.5 胶体金探针的活性鉴定

图5 胶体金探针的活性鉴定
Fig.5 Determination of the activity of colloidal gold probe
采用免疫渗滤法检测无菌水、E. coli DH5α、Lm的结果如图5所示。检测无菌水时,硝酸纤维素膜上无明显颜色变化(图5A);检测浓度约10 8CFU/mL E. coli DH5α时,硝酸纤维素膜上点样处周围零散分布红色斑点(图5B);检测浓度约10 9CFU/mL E. coli DH5α时,硝酸纤维素膜上点样处出现较浅的红色圆圈,靠圆圈边缘零散分布几个红色斑点(图5C);这可能是由于菌液扩散引起的。当Lm浓度达到10 7CFU/mL时(图5D),点样处即出现明显的红色圆圈,且圈内有大量红色斑点;该现象与杨小姣 [20]的报道一致。
抗体是免疫学分析的核心试剂,基于免疫胶体金探针检测Lm的免疫学方法多采用多克隆抗体和单克隆抗体 [6-7]。随着分子生物学技术的发展而兴起的基因工程抗体备受研究者关注,基因工程抗体可不经动物免疫过程直接筛选获得,具有成本低、耗时短、易于修饰、可体外利用原核或真核细胞表达等特点 [21-23]。本研究以Paoli等 [14]报道的scFv氨基酸序列为基础,优化并合成scFv基因,经E. coli表达系统制备scFv,获得的scFv特异性强、灵敏度高、且成本低,可为基于免疫学原理的分析技术建立提供优良试剂。
制备高质量的胶体金探针是检测Lm的前提,其中pH值和标记scFv的用量是两个重要的影响因素 [24]。因此,本研究对这两个因素都进行了优化。同时,胶体金探针制备后须进行活性鉴定,以确保胶体金探针的可用性。研究结果表明将制备的胶体金探针用于免疫渗滤法时,对Lm的检测限约为10 7CFU/mL。但是将该探针置于4 ℃保存28 d后,探针丧失活性,这可能是由于scFv相对完整抗体分子的分子质量小、结构简单、稳定性较差 [11]等原因造成的,因此后续需要研究如何提高胶体金探针的稳定性,增强胶体金探针的易用性。
免疫胶体金技术主要包括胶体金免疫层析和胶体金免疫渗滤法。但研究者多采用免疫层析技术检测Lm,鲜见免疫渗滤法的报道。崔焕忠 [7]、Shim [25]等利用单克隆抗体构建免疫层析法检测Lm的检测限均达到10 5CFU/mL;Ueda等 [26]采用商业化免疫层析试剂盒检测Lm的检测限为10 6CFU/mL;熊国华 [27]利用多克隆抗体构建免疫层析法检测Lm的敏感性为10 6CFU/mL。免疫渗滤法操作过程相对简单,但本研究的检测灵敏度仍有提升的空间。
参考文献:
[1] MURPHY M, CORORAN D, BUCKLEY F, et al. Development and application of multiple-locus variable number of tandem repeat analysis (MLVA) to subtype a collection of Listeria monocytogenes[J]. International Journal of Food Microbiology, 2007, 115(2): 187-194. DOI:10.1016/j.ijfoodmicro.2006.10.022.
[2] RIVOAL K, FABLET A, COURTILLON C, et al. Detection of Listeria spp. in liquid egg products and in the egg breaking plants environment and tracking of Listeria monocytogenes by PFGE[J]. International Journal of Food Microbiology, 2013, 166(1): 109-116. DOI:10.1016/j.ijfoodmicro.2013.06.014.
[3] JADHAV S, BHAVE M, PALOMBO E. Methods used for the detection and subtyping of Listeria monocytogenes[J]. Journal of Microbiological Methods, 2012, 88(3): 327-341. DOI:10.1016/ j.mimet.2012.01.002.
[4] 张淑红, 吴清平, 张菊梅, 等. 显色培养基在几种食源性致病菌快速检测中的应用[J]. 微生物学通报, 2006, 33(6): 108-111. DOI:10.3969/ j.issn.0253-2654.2006.06.022.
[5] MIKŠ-KRAJNIK M, LIM H, ZHENG Q, et al. Loop-mediated isothermal amplification (LAMP) coupled with bioluminescence for the detection of Listeria monocytogenes at low levels on food contact surfaces[J]. Food Control, 2016, 60: 237-240. DOI:10.1016/ j.foodcont.2015.07.035.
[6] K A R O O N U T H A I S I R I N, C H A R L E R M R O J R, TEERAPORNPUNTAKIT J, et al. Bead array for Listeria monocytogenes detection using specif i c monoclonal antibodies[J]. Food Control, 2015, 47: 462-471. DOI:10.1016/j.foodcont.2014.07.049.
[7] 崔焕忠, 张辉, 王兴龙. 胶体金试纸快速检测食品中单增李斯特菌[J].食品科学, 2010, 31(4): 239-242.
[8] 郭婷, 张宇昊, 马良. 纳米抗体的特性及其应用研究进展[J]. 食品科学, 2013, 34(3): 294-297.
[9] 陈荫楠, 陈华, 石贤爱, 等. 抗呋喃唑酮单克隆抗体的制备及其应用[J].食品科学, 2016, 37(3): 157-163. DOI:10.7506/spkx1002-6630-201603029.
[10] BIRD R, HARDMAN K, JACOBSON J. Single-chain antigenblinding proteins[J]. Science, 1998, 242: 423.
[11] LIU A, YE Y, CHEN W, et al. Expression of VH-linker-VL orientationdependent single-chain Fv antibody fragment derived from hybridoma 2E6 against af l atoxin B 1in Escherichia coli[J]. Journal of Industrial Microbiology and Biotechnology, 2015, 42(2): 255-262. DOI:10.1007/ s10295-014-1570-9.
[12] 何扩, 张秀媛, 杜欣军, 等. 基因工程抗体在食品安全检测中应用进展研究[J]. 中国粮油学报, 2014, 29(8): 124-128.
[13] 刘细霞, 孙远明, 董洁娴, 等. 抗克伦特罗核糖体展示单链抗体库的构建及鉴定[J]. 食品科学, 2011, 32(15): 200-204.
[14] PAOLI G, CHEN C, BREWSTER J. Single-chain Fv antibody with specificity for Listeria monocytogenes[J]. Journal of Immunological Methods, 2004, 289(1): 147-155. DOI:10.1016/j.jim.2004.04.001.
[15] 刘颖沙, 李建科, 张琳, 等. 胶体金制备技术的改进与优化[J]. 食品与发酵工业, 2015, 41(11): 110-114. DOI:10.13995/j.cnki.11-1802/ ts.201511020.
[16] 李成文. 现代免疫化学技术[M]. 上海: 上海科学技术出版社, 1992: 165-181.
[17] 谌志强, 段惠莉, 王新为, 等. 大肠埃希菌O157:H7的胶体金免疫渗滤法检测[J]. 中国公共卫生, 2005, 21(6): 705-706. DOI:10.3321/ j.issn:1001-0580.2005.06.030.
[18] 贺北方, 王效宇. 基于灰色聚类决策的水质评价方法[J]. 郑州大学学报(工学版), 2002, 23(1): 10-13. DOI:10.3969/ j.issn.1671-6833.2002.01.003.
[19] 李涛, 程立庆, 陈兵. 斑点金免疫渗滤法联合检测糖尿病自身抗体的研究[J]. 免疫学杂志, 2014, 30(1): 70-74. DOI:10.13431/j.cnki. immunol.j.20140016.
[20] 杨小姣. 胶体金免疫层析快速检测氯霉素技术研究[D]. 杨凌: 西北农林科技大学, 2007.
[21] VAUGHAN T, WILLIAMS K, PRITCHARD J, et al. Human antibodies with sub-nanomolar affinities isolated from a large nonimmunized phage display library[J]. Nature Biotechnology, 1996, 14: 309-314. DOI:10.1038/nbt0396-309.
[22] WANG S, ZHANG J, ZHANG Z, et al. Construction of single chain variable fragment (scFv) and biscFv-alkaline phosphatase fusion protein for detection of Bacillus anthracis[J]. Analytical Chemistry, 2006, 78(4): 997-1004. DOI:10.1021/ac0512352.
[23] WINTER G, GRIFFITHS A, HAWKINS R, et al. Making antibodies by phage display technology[J]. Annual Review of Immunology, 1994, 12: 433-455. DOI:10.1146/annurev.iy.12.040194.002245.
[24] YE Y, ZHOU Y, MO Z, et al. Rapid detection of aflatoxin B 1on membrane by dot-immunogold fi ltration assay[J]. Talanta, 2010, 81(3): 792-798. DOI:1016/j.talanta.2010.01.017.
[25] SHIM W, CHOI J, KIM J, et al. Production of monoclonal antibody against Listeria monocytogenes and its application to immunochromatography strip test[J]. Journal of Microbiology and Biotechnology, 2007, 17(7): 1152-1161.
[26] UEDA S, IWASE M, KUWABARA Y. Evaluation of immunochromatography for the rapid and specific identification of Listeria monocytogenes from food[J]. Biocontrol Science, 2013, 18(3): 157-161. DOI:10.4265/bio.18.157.
[27] 熊国华. 单增李斯特菌及溶血素O与葡萄球菌三种肠毒素免疫胶体金检测技术研究[D]. 沈阳: 沈阳农业大学, 2007. DOI:10.7666/ d.y1099064.
Preparation and Activity Determination of Colloidal Gold Probe Based on Anti-Listeria monocytogenes Single Chain Fv Antibody Fragment
LIU Aiping, YE Zixiong, MA Yu, ZHANG Zhouli, XIONG Qing, LI Wenli, SUN Haiqin, LI Cheng
*
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
Abstract:In this study, an anti-Listeria monocytogenes (Lm) single chain Fv antibody fragment was expressed in Escherichia coli. After purif i cation, the antibody fragment was used to prepare a colloidal gold probe with colloidal gold as a tracer and the preparation process was optimized. The activity of the probe was determined by using an immunof i ltration assay. The results showed that the colloidal gold probe exhibited high specificity. Positive samples could be directly identif i ed by color development using the probe. The detection limit (LOD) for Lm was approximately 10 7CFU/mL and the whole process of immunof i ltration assay took approximately 10 min. The method developed is simple, rapid and accurate, and it could be applied for Lm detection in food samples.
Key words:Listeria monocytogenes; single chain Fv antibody fragment; colloidal gold; immunof i ltration assay
DOI:10.7506/spkx1002-6630-201704049
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)04-0301-05
引文格式:
刘爱平, 叶子熊, 马榆, 等. 基于抗单增李斯特菌单链抗体的胶体金探针制备及其活性鉴定[J]. 食品科学, 2017, 38(4): 301-305. DOI:10.7506/spkx1002-6630-201704049. http://www.spkx.net.cn
LIU Aiping, YE Zixiong, MA Yu, et al. Preparation and activity determination of colloidal gold probe based on anti-Listeria monocytogenes single chain Fv antibody fragment[J]. Food Science, 2017, 38(4): 301-305. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704049. http://www.spkx.net.cn
收稿日期:2016-06-20
基金项目:四川省烹饪科学重点实验室一般项目(PZKX2015Z05);四川省级大学生创新创业训练计划项目(201610626077)
作者简介:刘爱平(1986—),男,讲师,博士,研究方向为食品微生物与免疫学检测。E-mail:aipliu@outlook.com
*通信作者:李诚(1964—),男,教授,硕士,研究方向为畜产品加工与质量安全控制。E-mail:lichenglcp@163.com