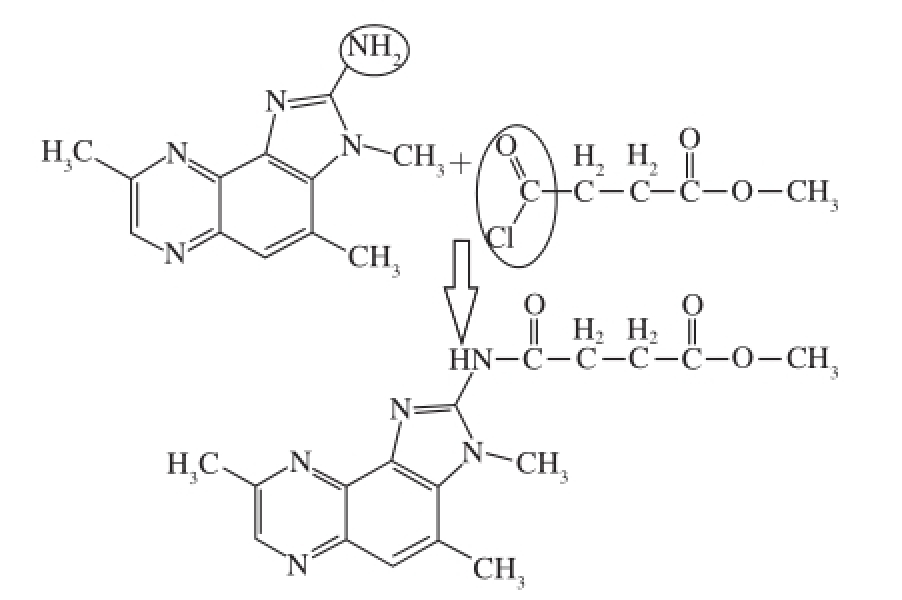
图1 PA的合成
Fig.1 Synthesis process of hapten
王 静,马宁宁,宋 洋 *
(天津师范大学生命科学学院,天津市动植物抗性重点实验室,天津 300387)
摘 要:为建立适用于一类杂环胺的酶联免疫吸附检测方法(enzyme-linked immunosorbent assay,ELISA),利用改良的碳化二亚胺法将在2-氨基-3,4,8-三甲基咪唑[4,5-f]-喹喔啉(2-amino-3,4,8-trimethyl-3H-imidazo[4,5-f] quinoxaline,4,8-DiMeIQx)的2-氨基处连接丁二酸单甲酯酰氯制备的半抗原偶联蛋白获得人工抗原。该方法利用适当pH值的缓冲体系,将酯的水解和蛋白偶合一步完成,与传统方法相比,有效地节省了反应时间和成本,且对人工抗原的紫外扫描验证和多克隆抗体效价检测结果都直接和间接地表明偶合是成功的。最终免疫获得4,8-DiMeIQx结构类似物的多克隆抗体,该抗体的最高效价为1∶450 000,且经直接竞争ELISA检测,该抗体对目标物4,8-DiMeIQx的灵敏度(IC 50)为24.0 μg/L,最低检测限(IC 15)为1.8 μg/L,对其结构类似物7,8-DiMeIQx、8-MeIQx、2-氨基-3-甲基咪唑[4,5-f]-喹喔啉(IQx)、2-氨基-3,4,7,8-四甲基咪唑[4,5-f]-喹喔啉(TriMeIQx)的灵敏度分别为35.0、30.0、28.0、40.0 μg/L,而其他与目标物结构相差较大的杂环胺,像2-氨基-1-甲基-6-苯基咪唑[4,5-b]吡啶(PhIP)、2-氨基-3-甲基咪唑[4,5-f]喹啉(IQ)和2-氨基-3,4-二氨基咪唑[4,5-f]喹啉(2-amino-3,4-dimethyl-imidazo[4,5-f]quinoline,MeIQ),它们几乎不与抗体结合(CR<0.01%)。由此可见,可以利用该抗体建立高效快速的杂环胺ELISA检测方法用以定量或定性检测肉类加工食品中的一类杂环胺。
关键词:杂环胺;半抗原;人工抗原;多克隆抗体;酶联免疫吸附检测方法
一些流行病学的研究已经证实,杂环胺可能是人类致癌物 [1]。而在普遍使用高温烹饪的即食食品和加工食品中,会生成大量的杂环胺。根据食物热处理温度的不同,杂环胺可进一步分为氨基咪唑氮杂芳烃(aminoimidazo azaarenes,AIAs)和氨基咔啉 [2]。国际癌症研究机构(International Agency for Research on Cancer,IARC)将一些AIAs视为可能的人类致癌物,如2-氨基-3,4-二氨基咪唑[4,5-f]喹啉(2-amino-3,4-dimethyl-imidazo[4,5-f]quinoline,MeIQ)、2-氨基-3,4,8-三甲基咪唑[4,5-f]-喹喔啉(2-amino-3,4,8-trimethyl-3H-imidazo[4,5-f]quinoxaline,4,8-DiMeIQx)、2-氨基-3-甲基咪唑[4,5-f]-喹喔啉(2-amino-3-methyl-3H-imidazo[4,5-f] quinoxaline,IQx)、2-氨基-3,7,8-三甲基咪唑[4,5-f]-喹喔啉(2-amino-3,7,8-trimethyl-imidazo[4,5-f]quinoline,7,8-DiMeIQx)和2-氨基-3-甲基咪唑[4,5-f]喹啉(2-amino-3-methyl-imidazo[4,5-f]quinoline,IQ) [3]。
国内外关于杂环胺的定量和定性方面的研究很多。近年来,常用的杂环胺检测方法是高效液相色谱法 [4-6],或者是一些检测效果更好的仪器串联技术如串联式固相萃取-电喷雾串联质谱检测技术 [7-9]。而且只要是那些利用同步荧光法,再结合化学计量学的分析方法,比如气相色谱分析、质谱分析和超高效液相色谱分析 [10-12],都可以高效地定量烤肉样品中的杂环胺。目前,为了消除基质效应(脂肪、蛋白质、糖、色素等)所运用的样品前处理方法有液液萃取 [13-14]、超临界流体萃取 [15]、固相萃取 [16-17]、柱层析 [18-19]、固相微萃取 [20]以及液液萃取-固相萃取串联萃取法。这些检测方法虽然灵敏度好、准确度高,但还存在很多问题,如前处理复杂、仪器成本高、自动化程度低,因此,需要熟练的技术型人才,且步骤多耗时,不适合运用于大量样本的监测。
酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)是基于免疫学原理的一种简便、快速的新型小分子残留检测方法。虽然,ELISA法的准确性略低于传统仪器法,但是通过ELISA法的初步筛选可以大大减少样本的数量,从而减少后续仪器分析的工作量。在20世纪90年代早期,Vanderlaan等 [21-22]就建立了一种ELISA方法用于检测样品中IQ、MeIQ、4,8-DiMeIQx、2-氨基-1-甲基-6-苯基咪唑[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP)的含量,但是由于杂环胺之间的交叉反应以及干扰物质的存在使得高效地量化样品中各杂环胺的难度很大,尤其是复杂的样品。因此,这些年来关于杂环胺免疫学检测方法的研究几乎没有。主要的原因是:首先,合成半抗原的原料昂贵;其次,尽管杂环胺的热稳定性高,但其复杂的结构使得在反应过程中产生更多的副产物,不利于获得较纯的半抗原。最重要的是,由于在复杂样品基质中杂环胺的含量很低,因此,制备一种高灵敏性和特异性地抗体对于建立杂环胺ELISA检测方法是至关重要的。
本实验为了建立适用于一类杂环胺的ELISA检测方法,通过在4,8-DiMeIQx的2-氨基处连接4个碳的间隔臂制备半抗原,然后使用改进的碳化二亚胺法,同时进行两步反应,即间隔臂末端的酯水解反应和其反应产物与蛋白偶联反应,这样有效地减少了反应步骤和副产物的生成。这种新的制备人工抗原的方法简单高效地获得了高特异性的多克隆抗体,为建立快速检测肉类加工产品中杂环胺含量的ELISA方法提供参考依据。
1.1 材料与试剂
4,8-DiMeIQx、IQx、7,8-DiMeIQx、MeIQ、IQ、2-氨基-3,8-二甲基咪唑[4,5-f]-喹喔啉(2-amino-3,8-dimethyl-imidazo[4,5-f]quinoxaline,8-MeIQx)、2-氨基-3,4,7,8-四甲基咪唑[4,5-f]-喹喔啉(2-amino-3,4,7,8-tetramethyl-imidazo[4,5-f]quinoxaline,TriMeIQx)、PhIP加拿大TRC公司;丁二酸单甲酯酰氯(methyl 4-chloro-4-oxobutyrate,MCO)、卵清蛋白(ovabulmin,OVA)、N,N-二甲基甲酰胺(dimethylformamide,DMF)、弗氏完全佐剂和不完全佐剂、3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethyl-benzidine,TMB)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(1-ethyl-3-[3-dimethylamino propyl]carbodiim-ide hydrochloride,EDC)、辣根过氧化物酶(horse radish peroxidase,HRP) 美国Sigma-Aldrich公司;羊抗兔酶标二抗 中美生物技术有限公司;牛血清白蛋白(bovine albumin,BSA) 德国Merck公司;蛋白A亲和层析柱美国GE公司。
1.2 仪器与设备
旋蒸仪 中国予华仪器公司;AV-300MHZ核磁共振仪 德国Bruker公司;LCQ Advantage液相色谱-质谱联用仪 美国Thermo Finnegan公司;Labsystems全波长酶标仪 美国雷勃公司;ÄKTA™蛋白纯化仪 美国GE公司;RH-KT加热磁力搅拌器 美国IKA公司;低温恒温培养箱 上海Eyela公司;Lambda 35紫外分光光度仪美国Perkin Elmer公司;96 孔酶标板 丹麦Nunc公司。
1.3 方法
1.3.1 常用的缓冲溶液
0.0 1 m o l/L的磷酸盐缓冲液(p H 7.4,phosphate buffered saline,PBS);PBST缓冲液(1 L PBS+0.5 g吐温-20);130 mmol/L的NaHCO 3溶液(pH 8.1)。
1.3.2 半抗原及人工抗原的合成
1.3.2.1 PA的合成
用1 0 0 m L的无水二氯甲烷溶解2 0.0 m g的4,8-DiMeIQx(0.088 mmol),水浴降温至0 ℃,再在不断搅拌的溶液中缓慢滴加含有 11 μL MCO(1.223 g/mL)的30 mL的无水二氯甲烷,反应混合物在0 ℃搅拌反应3 h后转至室温过夜反应,并由薄层色谱(thin layer chromatography,TLC)监测。以上反应均在N 2环境下进行,反应终止后,用20 mL饱和碳酸氢钠溶液冲洗3 次去除氢离子,有机相经无水Na 2SO 4干燥,过滤,旋蒸仪(45 ℃)减压旋干滤液。残渣进一步经硅胶柱纯化,且洗脱条件以及洗脱液的选择(二氯甲烷-无水甲醇(60∶1,V/V))由TLC结果确定,最后获得产物(PA)为深红色粉末状,产率为60%。图1为PA的合成过程。

图1 PA的合成
Fig.1 Synthesis process of hapten
1.3.2.2 酯的水解
称取10.0 mg PA(0.03 mmol)溶解于700 μL无水DMF中,再加入4.0 mL无水甲醇和2.0 mL去离子水搅拌混合。然后向溶液中逐滴加入60 μL氢氧化钠溶液(0.5 mol/L),室温搅拌2 h,然后加入20.0 mL去离子水,静置10 min,用1.0 mol/L的稀盐酸溶液将反应溶液调成微酸,然后用10 mL乙酸乙酯萃取3 次,有机相再经10 mL去离子水冲洗3 次后通过无水Na 2SO 4干燥,减压旋干获得产物PB,TLC(石油醚-乙酸乙酯(10∶1,V/V)+ 1%醋酸)监测反应,PB(Rf=0.40)产率15%。质谱检测产物PB,结果显示:在负离子模式图中,基峰的质荷比为339.10,而相对强度为80%的峰的质荷比为325.20,与产物PB(C 16H 17N 5O 3)的理论分子质量一致。
1.3.2.3 酯的胺解作用
参照Davis等 [23]使用的碳化二亚胺法,利用产物PA间隔臂的末端酯的胺解作用偶联载体蛋白制备人工抗原。A液:称取0.19 μmol的BSA(或OVA、HRP)溶解在2 mL的碳酸氢钠溶液(130 mmol/L,pH 8.1)中;B液:称取3.75 μmol PA和7.5 μmol EDC溶于0.1 mL的DMF中。将B液缓慢加入A液中(0 ℃以下),室温搅拌4~6 h后,加入3.75 μmol EDC,4 ℃反应过夜。最后,反应溶液在4 ℃用PBS透析3 d,加入0.1%的叠氮化钠或等体积的甘油,-20 ℃贮存。其中,PA-BSA和PA-KLH作为免疫原,PA-OVA作为包被原,且经紫外扫描初步确定偶联是否成功。
1.3.3 多克隆抗体的制备
免疫动物选择日本大白兔(月龄3 个月,体质量1.5 kg,天津生物医学工程研究所养殖场)经背部皮下多点注射免疫原,免疫方法与过程参考Wang Suo等 [24]的研究。选取2 只符合条件的兔子,每次每只兔子的免疫剂量为1 mg(免疫原含量),隔两周免疫1次,从第2次免疫开始,每次免疫1 周后,从耳背动脉采血,测定抗血清效价,直至效价达到较高水平时处死兔子,取全血。血液先室温条件下凝固15 min,然后3 500 r/min离心10 min,取上清即抗血清,加0.1%的叠氮化钠,4 ℃贮存。用Protein A-Sepharose 4B纯化抗血清,洗脱液经PBS透析72 h,加0.1%叠氮化钠贮存在4 ℃备用。
1.3.4 抗体特异性
利用直接ELISA法,以标品的质量浓度(μg/L)为横坐标,以抑制率为纵坐标绘制抑制曲线。抑制率计算如式(1)所示:
式中:A 0为标品质量浓度为零时的吸光度;A x为标品质量浓度为x时的吸光度;A 空白为空白孔的吸光度。
Kurtz等 [25]认为抗体的效价和其特异性直接相关,但经实验验证并非如此。事实上,可以通过比较它与其他结构类似物的交叉反应来判断其特异性。交叉反应率(cross reactivity,CR)越小,说明该抗体对目标物的特异性越高,而如果该抗体与其他该类结构类似物也有较高的CR,那么该抗体就可用于这类目标物的检测。CR计算如式(2)所示:
式中:IC 50为标品的抑制率为50%时所对应的标品质量浓度。
2.1 半抗原的制备
目标物4,8-DiMeIQx与小分子物质丁二酸单甲酯酰氯发生取代反应,脱去一分子HCl,生成粗产物PA,反应过程如图1所示。反应经TLC(展开剂:二氯甲烷-无水甲醇(60∶1,V/V))监测,当反应过夜后,发现原料4,8-DiMeIQx点(Rf=0)和丁二酸单甲酯酰氯(Rf =0.20)几乎消失,且出现了新的点(Rf =0.37),初步断定反应完成,最后经硅胶柱纯化后获得产物PA,通过质谱及核磁检测,可以证明PA就是实验的理论产物。该方法只有一步取代反应,操作简单,无副产物,且产率高。产物PA的TLC结果:TLC(二氯甲烷-无水甲醇(60∶1,V/V),Rf=0.37;质谱结果显示:在正离子模式图中,基峰的质荷比为342.36,与产物PA(C 17H 19N 5O 3)的理论分子质量一致。核磁结果: 1H NMR(400 MHz, CDCl 3):δ 10.30(1H, s, NH),δ 8.68(1H, s, N-CH-C),δ 7.81(1H, d, phH),δ 3.61(3H, s, COOCH 3),δ 3.47(1H, s, N-CH 3),δ 2.54~2.49(4H, m, CH 2),δ 2.42(1H, s, CH 3),δ 1.92(1H, s, CH 3)。
2.2 酯的水解及蛋白偶联
一般情况下,半抗原的末端羧基和载体蛋白的氨基反应生成人工抗原。因此,产物PA需要经过一步脂水解反应,从而暴露其羧基端。但是,酯水解反应结果不太理想。一方面,在水解过程中,由于PA的酰胺键很容易断开,所以一些反应条件,如pH值、反应时间和温度必须进行优化;另一方面,反应产物经TLC、质谱鉴定,发现有很多副产物生成,目标产物则合成转化率低(只有15%)。而优化水解条件和净化产物都需消耗太多的原料。

图2 PA、BSA和PA-BSA的紫外扫描图
Fig.2 Ultraviolet (UV) absorption spectra of PA, BSA and PA-BSA

图3 PA、OVA和PA-OVA的紫外扫描图
Fig.3 UV Absorption spectra of PA, OVA and PA-OVA
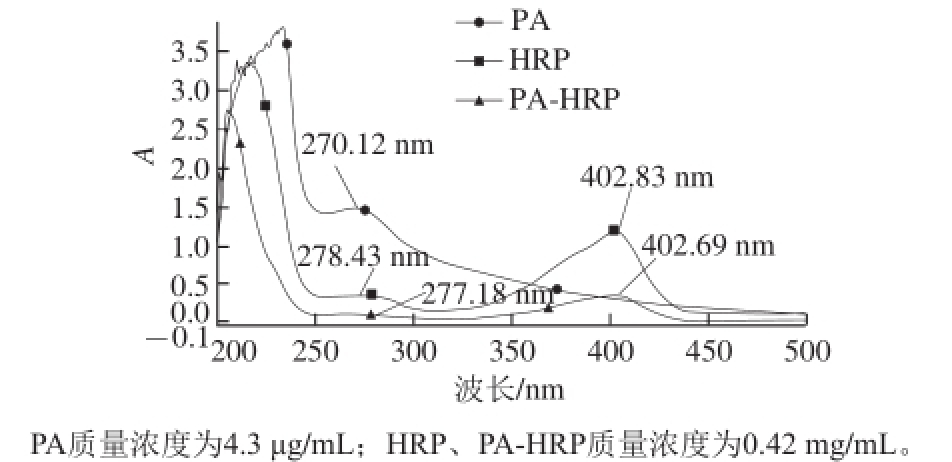
图4 PA、HRP和PA-HRP的紫外扫描图
Fig.4 UV Absorption spectra of PA, HRP and PA-HRP
因此,最后使用改进的EDC法,在弱碱条件下,通过酯的胺解作用使酯水解反应与蛋白偶联反应同时进行,有效地减少原料的损耗和副产物的生成。从图2~4可以看出,半抗原PA在波长270.12 nm有一个较高的紫外吸收峰,如果半抗原和载体蛋白偶联成功,则人工抗原在280 nm处的紫外吸收峰会在半抗原影响下,向左侧偏移,而实际确实如此,虽然偏移较小,这可能是因为偶联比较小,而在此后获得高效价的抗体也充分证明人工抗原的成功合成。
2.3 抗体的效价

图5 在免疫期间抗体效价的变化
Fig.5 Change in antiserum titer during immunization
用间接ELISA法测定抗体的效价,包被量为1 μg/well,酶标二抗稀释5 000 倍。用酶标仪读取A 450 nm值,选择吸光度约为1.0时的抗体稀释倍数作为多克隆抗体的效价。由图5可以看出,随着免疫次数的增加,抗体效价也逐渐升高,且该免疫原产生了高效价的抗体,但因为兔子间的生理差异,兔1和兔2的效价略有不同,其最高的抗体效价分别为1∶450 000和1∶440 000。而且从ELISA结果可以看出,所有抗体的稀释倍数与其吸光度呈负相关,该结果与理论一致。
2.4 直接竞争ELISA法的建立
采用直接ELISA法优化酶标抗原的最适质量浓度,将酶标抗原进行一系列的梯度稀释,选择吸光度在0.7~1.2之间的酶标抗原稀释倍数,最后得出最佳酶标抗原稀释倍数为180 000。以上述酶标抗原优化抗体包被量,如图6所示,PA-BSA 1的抗体(兔1)和PA-BSA 2的抗体(兔2)与酶标抗原PA-HRP都有较好的亲和性,但当包被抗体PA-BSA 2,且包被量为0.5 μg/well时,IC 50值最低,因此,选择抗体PA-BSA 2进行进一步研究。

图6 抗体包被量的优化
Fig.6 Optimization of coating antibody concentration
不同的化学条件包括离子浓度、pH值和有机溶剂含量也需进行优化。一方面,杂环胺耐酸碱,但需考虑其对抗体及酶活性的影响;另一方面,随着离子浓度的增大,抗体和目标物的亲和性逐渐下降,说明离子浓度较高时,不利于抗原抗体的结合反应,所以最终选择pH值为7.4,离子浓度为10 mmol/L的PBS。当甲醇含量大于5%时,检测灵敏度明显降低,所以标品溶液的甲醇含量要低于5%。根据以上优化的反应条件,建立直接竞争ELISA法,得出目标物4,8-DiMeIQx的抑制曲线如图7所示,且目标物的灵敏度(IC 50)和检测限(IC 15)分别是24.0 μg/L和1.8 μg/L。

图7 4,8-DiMeIQx的抑制曲线
Fig.7 Inhibitory curve of 4,8-DiMeIQx
2.5 抗体特异性
通过优化的直接ELISA法研究了7 种杂环胺的抗体结合反应即交叉反应。结果显示(表1):对于那些结构与目标物非常接近的杂环胺与抗体有较高亲和性,如7,8-DiMeIQx、8-MeIQx、IQx和TriMeIQx与抗体的CR分别为68.6%、80%、85.7%和60%。而其他含有与目标物杂环结构不同的杂环胺,像PhIP、IQ和MeIQ,它们几乎不与抗体结合(CR<0.01%)。由此说明,目标物的空间结构很大地影响了抗原与抗体的反应;该抗体可以高特异性地识别目标物及与其结构相似的一些杂环胺,为建立这些杂环胺的免疫学检测方法提供了可能。
表1 抗体与4,8-DiMeIQx及其他结构类似物的交叉反应
Table1 Cross-reactivity of antiserum against 4,8-DiMeIQx with other analogues
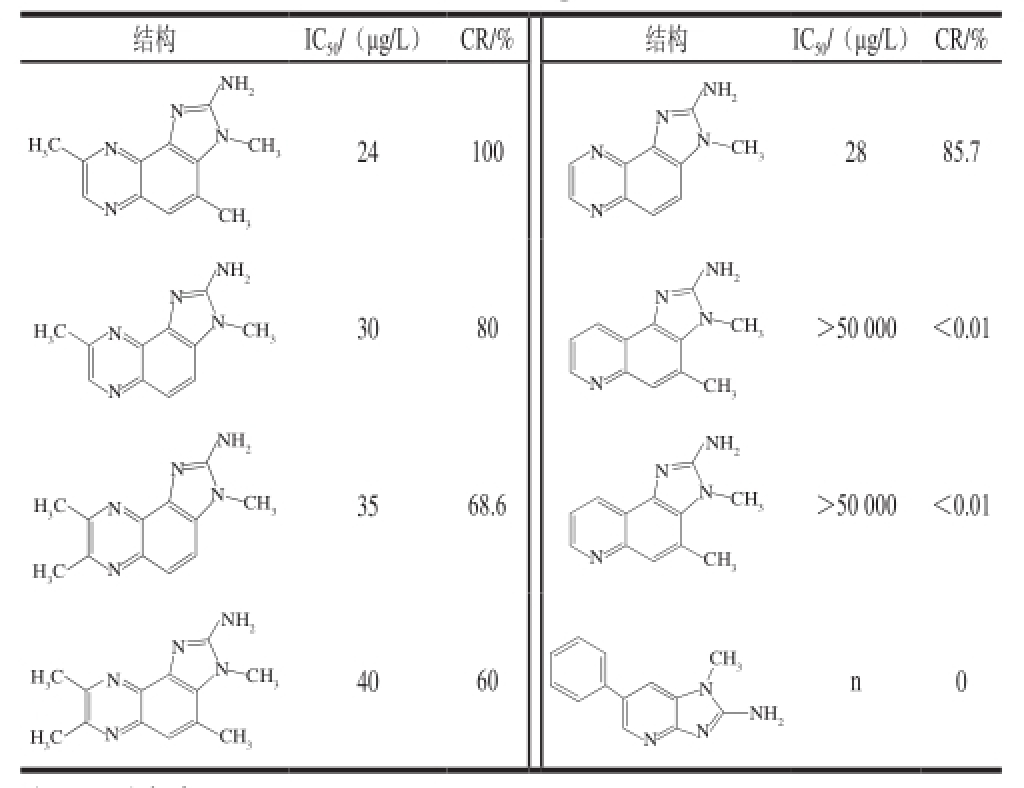
注:n.无穷大。
?
本研究首先利用MCO延长了4,8-DiMeIQx的间隔臂生成产物PA,然后通过酯水解反应暴露出PA的末端羧基得到产物PB,但由于产物PA中酰胺键的存在,使得该反应副产物较多,且PB产率低,考虑到优化反应条件及提高产率所消耗的时间和成本,最后决定利用酯的胺解作用,通过改进的EDC法将产物PA直接偶联载体蛋白制备人工抗原,并获得了高效价的多克隆抗体。然后,经过优化反应条件建立了4,8-DiMeIQx的直接竞争ELISA法,得到目标物的检测限(IC 15)和灵敏度(IC 50)分别是1.8 μg/L和24.0 μg/L,证明了抗体的灵密度高;而交叉反应结果则表明,虽然该抗体对目标物4,8-DiMeIQx的特异性较低,但是可以有效地识别一类结构相似的杂环胺,且这些杂环胺经IARC认定为可能的人类致癌物,所以需要为其建立有效、灵敏的免疫学检测方法用以监测肉类加工食品。
利用该多克隆抗体,再结合其他实验室的研究成果,可以建立新的杂环胺免疫检测方法,如ELISA法、SPR法等,从而能快速高效地检测加工食品中一类杂环胺的含量。更重要的是,与传统分析方法相比,对于环境污染的研究和监测,这些相对简单、灵敏和高特异性的免疫学分析方法可以发挥更重要的作用。
参考文献:
[1] RAHMAN U U, SHAHZAD T, SAHAR A, et al. Recapitulating the competence of novel & rapid monitoring tools for microbial documentation in food systems[J]. LWT-Food Science and Technology, 2015, 67: 62-69. DOI:10.1016/j.lwt.2015.11.041.
[2] JÄGERSTAD M, SKOG K, ARVIDSSON P, et al. Chemistry, formation and occurrence of genotoxic heterocyclic amines identif i ed in model systems and cooked foods[J]. European Food Research and Technology, 1998, 207(6): 419-427. DOI:10.1007/s002170050355.
[3] DURLING L. The effect on chromosomal stability of some dietary constituents[D]. Sweden: Uppsala University, 2008.
[4] URSZULA B, BEATA J. Analysis of azaarenes in pan fried meat and its gravy by liquid chromatography with fluorescence detection[J]. Food Chemistry, 2008, 109(1): 235-242. DOI:10.1016/ j.foodchem.2007.12.038.
[5] BARCELO-BARRACHINA E, MOYANO E, PUIGNON L, et al. Evaluation of different liquid chromatography-electrospray mass spectrometry systems for the analysis of heterocyclic amines[J]. Journal of Chromatography A, 2004, 1023: 67-78. DOI:10.1016/ j.chroma.2003.10.030.
[6] YAO Yao, PENG Zengqi, SHAO Bin, et al. Effects of the antioxidant capacities of 20 spices commonly consumed on the formation of heterocyclic amines in braised sauce beef[J]. China Agriculture Science, 2012, 45(20): 4252-4259. DOI:10.3864/ j.issn.0578-1752.2012.20.015.
[7] BARCELO-BARRACHINA E, MOYANO E, GALCERAN M T, et al. Ultra-performance liquid chromatography-tandem mass spectrometry for the analysis of heterocyclic amines in food[J]. Journal of Chromatography A, 2006, 1125(2): 195-203. DOI:10.1201/b16670-8.
[8] KATAOKA H, ISHIZAKI A, NONAKA Y, et al. Developments and applications of capillary microextraction techniques: a review[J]. Analytica Chimica Acta, 2009, 655(1/2): 8-29. DOI:10.1016/ j.aca.2009.09.032.
[9] KATAOKA H, SAITO K. Recent advances in column switching sample preparation in bioanalysis[J]. Bioanalysis, 2012, 4(7): 809-832. DOI:10.4155/bio.12.28.
[10] KHAN M R, BUSQUETS R, SANTOS F J, et al. New method for the analysis of heterocyclic amines in meat extracts using pressurised liquid extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2008, 1194(2): 155-160. DOI:10.1016/j.chroma.2008.04.058.
[11] SAHAR A, PORTANGUEN S, KONDJOYAN A, et al. Potential of synchronous fluorescence spectroscopy coupled with chemometrics to determine the heterocyclic aromatic amines in grilled meat[J]. European Food Research and Technology, 2010, 231(5): 803-812. DOI:10.1007/s00217-010-1323-6.
[12] FERNANDO D A, MOHAMMED Z, GREGORIO C, et al. Determination of heterocyclic amines in urine samples by capillary liquid chromatography with evaporated light-scattering detection[J]. Analytical Biochemistry, 2010, 397(1): 223-231. DOI:10.1007/ s00216-009-3370-z.
[13] KOBAYASHI M, HANAOKA T, TSUGANE S. Validity of a self-administered food frequency questionnaire in the assessment of heterocyclic amine intake using 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) levels in hair[J]. Mutation Research, 2007, 630(1/2): 14-19. DOI:10.1016/ j.mrgentox.2007.02.003.
[14] MARTÍN-CALERO A, AYALA J H, GONZÁLEZ V, et al. Determination of less polar heterocyclic amines in meat extracts: Fast sample preparation method using solid-phase microextraction prior to high-performance liquid chromatography-fluorescence quantification[J]. Analvtica Chimica Acta, 2007, 582(2): 259-266. DOI:10.1016/j.jchromb.2003.09.028.
[15] FERNANDO D A, MOHAMMED Z, GREGORIO C, et al. Simultaneous determination of six non-polar heterocyclic amines in meat samples by supercritical fl uid extraction-capillary electrophoresis under fl uorimetric detection[J]. Electrophoresis, 2010, 31(13): 2165-2173. DOI:10.1002/elps.201000080.
[16] BESSETTE E E, YASA I, DUNBAR D, et al. Biomonitoring of carcinogenic heterocyclic aromatic amines in hair: a validation study[J]. Chemical Research in Toxicology, 2009, 22(8): 1454-1463. DOI:10.1021/tx900155f.
[17] GU D, NEUMAN Z L, MODIANO J F, et al. Biomonitoring the cooked meat carcinogen 2-amino-1-methyl-6-phenylimidazo[4,5-b] pyridine in canine fur[J]. Journal of Agricultural and Food Chemistry, 2012, 60(36): 9371-9375. DOI:10.1021/jf302969h.
[18] GROSS G A. Simple methods for quantifying mutagenic heterocyclic aromatic amines in food products[J]. Carcinogenesis, 1990, 11: 1597-1603. DOI:10.1093/carcin/11.9.1597.
[19] OHGAKI H, TAKAYAMA S, SUGIMURA T. Carcinogenicities of heterocyclic amines in cooked food[J]. Mutation Research, 1991, 259: 399-410. DOI:10.1016/0165-1218(91)90130-e.
[20] KATAOKA H, INOUE T, SAITO K, et al. Analysis of heterocyclic amines in hair by on-line in-tube solid-phase microextraction coupled with liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2013, 786: 54-60. DOI:10.1016/ j.aca.2013.05.007.
[21] VANDERLAAN M, HWANG M, KNIZE M G, et al. Monoclonal antibody based immunoassays for cooking-induced meat mutagens[J]. Progress in Clinical and Biological Research, 1990, 340E: 189-198. DOI:10.1093/carcin/bgh350.
[22] VANDERLAAN M, ALEXANDER J, THOMAS C, et al. Immunochemical detection of rodent hepatic and urinary metabolites of cooking-induced food mutagens[J]. Carcinogenesis, 1991, 12(2): 349-354. DOI:10.1093/carcin/12.2.349.
[23] DAVIS M T, PRESTON J F. A simple modified carbodiimide method for conjugation of small-molecular-weight compounds to immunoglobulin G with minimal protein crosslinking[J]. Analytical Biochemistry, 1981, 116(2): 402-407. DOI:10.1016/0003-2697(81)90380-8.
[24] WANG Suo, ALLAN R D, SKERRITT J H, et al. Development of a class-specific competitive ELISA for the benzoylphenylurea insecticides[J]. Journal of Agricultural and Food Chemistry, 1998, 46(8): 3330-3338. DOI:10.1021/jf9800920.
[25] KURTZ D A, SKERRITT J H, STANKER L. New frontiers in agrochemical immunoassay[M]. AOAC International, 1995: 9.
Preparation of Artif i cial Antigen and Polyclonal Antibody for the Detection of Heterocyclic Amines
WANG Jing, MA Ningning, SONG Yang
*
(Tianjin Key Laboratory of Animal and Plant Resistance, College of Life Sciences, Tianjin Normal University, Tianjin 300387, China)
Abstract:With the aim of developing a generic enzyme-linked immunosorbent assay (ELISA) for the detection of heterocyclic amines, a new approach was used to prepare hapten, in which, methyl 4-chloro-4-oxobutyrate (MCO) was attached to the 2-amino group of 2-amino-3,4,8-trimethyl-3H-imidazo[4,5-f]quinoxaline (4,8-DiMeIQx). The antigen was obtained by a modif i ed carbodiimide method. In pH buffer system at the appropriate pH, the hydrolysis of ester and the coupling step were completed simultaneously. Compared with the traditional method, the new method shortened the reaction time and cut down the cost effectively. The results of UV identif i cation and polyclonal antibody titer indicated that the coupling was successfully achieved. And the immunogens produced polyclonal antibody for 4,8-DiMeIQx with a high titer of 1:450 000. High-affinity antibody against 4,8-DiMeIQx was optimized and a direct competitive ELISA assay was developed. It was shown that the analyte concentration giving 50% inhibition of color development (IC 50) was 24.0 μg/L and that giving 15% inhibition of color development (IC 15) was 1.8 μg/L for 4,8-DiMeIQx, and IC 50was 35.0 μg/L for 7,8-DiMeIQx, 30.0 μg/L for 8-MeIQx, 28.0 μg/L for IQx, and 40.0 μg/L for TriMeIQx, respectively, while almost no cross-reactivity (CR < 0.01%) with other heterocyclic amines having a structure different from that of 4,8-DiMeIQx, such as PhIP, IQ and MeIQ, was observed. The developed ELISA method was suitable for the rapid quantitative and qualitative determination of heterocyclic amines in processed meat products.
Key words:heterocyclic aromatic amines; hapten; antigen; polyclonal antibody; enzyme-linked immunosorbent assay (ELISA)
DOI:10.7506/spkx1002-6630-201704008
中图分类号:R155
文献标志码:A
文章编号:1002-6630(2017)04-0045-06
收稿日期:2016-03-29
基金项目:“十二五”国家科技支撑计划项目(2014BAD04B03);国家自然科学基金青年科学基金项目(31301487);天津市科技计划项目(142CDGNC00098)
作者简介:王静(1992—),女,硕士研究生,研究方向为食品安全与检测。E-mail:1576901938@qq.com
*通信作者:宋洋(1983—),女,讲师,博士,研究方向为食品安全与检测。E-mail:skysongy@mail.tjnu.edu.cn
引文格式:
王静, 马宁宁, 宋洋. 杂环胺人工抗原的合成以及多克隆抗体的制备[J]. 食品科学, 2017, 38(4): 45-50. DOI:10.7506/ spkx1002-6630-201704008. http://www.spkx.net.cn
WANG Jing, MA Ningning, SONG Yang. Preparation of artificial antigen and polyclonal antibody for the detection of heterocyclic amines[J]. Food Science, 2017, 38(4): 45-50. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201704008. http://www.spkx.net.cn